莲雾Syzygium samarangense,原产马来西亚、印度尼西亚和印度,为桃金娘科蒲桃属热带常绿乔木果树。17世纪我国台湾最早引种,是著名的热带水果[1]。我国广东、海南、福建、广西、云南和四川等省区均有栽培。莲雾性喜高温、高湿气候,种植过程中易发生炭疽病、果腐病、藻斑病、果蝇、金龟子及蚧壳虫等病虫害,多用化学农药进行防治[2]。在防治过程中,种植者往往会选用一些混配农药,或多种农药混合施用。由于莲雾皮可食,若农药残留超标则存在较大的质量安全风险。因此,建立可同时测定莲雾中常见农药残留量的分析方法非常必要。
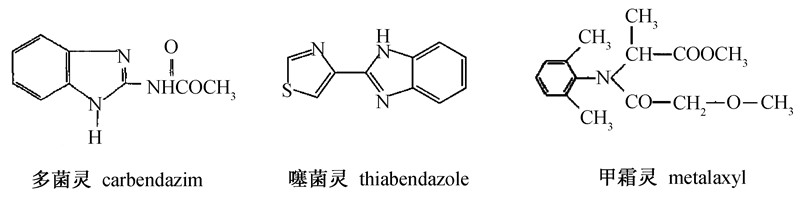
多菌灵,化学名称为N-(2-苯并咪唑基)-氨基甲酸甲酯,是一种广谱性杀菌剂,对多种作物的病害有防治效果[3, 4];噻菌灵,化学名称为2-(4-噻唑基)-1H-苯并咪唑,属苯咪唑类杀菌剂,能防治多种作物的真菌病害,亦可用于防治水果和蔬菜采后的某些病害[5, 6];甲霜灵,化学名称为D,L-N-(2,6-二甲基苯基)-N-(2-甲氧基乙酰),是特效杀菌剂,可有效防治多种作物霜霉病,瓜果蔬菜类的疫霉病、谷子白发病[7, 8]。多菌灵、噻菌灵及甲霜灵的结构式[9, 10, 11]见Scheme 1。目前关于多菌灵、噻菌灵和甲霜灵的检测方法主要有液相色谱法[3, 7, 12]、气相色谱法[5, 13]、液相色谱-串联质谱法[4, 8, 14]以及气相色谱-串联质谱法[6, 15],但所测基质与莲雾存在很大差异,其前处理方法并不适于莲雾中农药残留的提取。张群等[16]运用气相色谱-串联质谱法测定了莲雾中灭蚁灵和哒螨灵的残留,但其前处理采用了毒性较高的甲苯,且操作相对繁琐。目前,针对于莲雾中多菌灵、噻菌灵和甲霜灵同时测定的检测方法未见报道。近几年,农药残留分析的样品前处理趋于简单化和环境友好,本研究采用乙腈提取样品,定容后直接用高效液相色谱-串联质谱(UPLC-MS/MS)分析,简化了前处理步骤,操作简单,提取效率高,且试剂消耗少,在5 min内即可完成莲雾中多菌灵、噻菌灵和甲霜灵残留的定性与定量检测。
|
Scheme 1 |
Waters ACQUITY UPLC/Quattro Premier XE超高效液相色谱-串联质谱仪(美国Waters公司);EB-280-12电子顶载天平(日本岛津公司);QL-901旋涡混合器(江苏海门其林医用仪器厂);0.22 μm有机系滤膜(天津美瑞泰克公司)。
多菌灵(carbendazim)、噻菌灵(thiabendazole)和甲霜灵(metalaxyl)标准品,纯度≥99%,农业部环境质量监督检验测试中心(天津);乙腈和甲醇,HPLC级,美国Fisher公司;C18色谱柱,美国Waters公司;乙酸铵,分析纯,广州试剂公司;Milli-Q超纯水,美国Millipore公司。
1.2 检测条件 1.2.1 色谱条件Waters ACQUITY_UPLCTM BEH C18色谱柱(100 mm×2.1mm,1.7 μm);柱温35 ℃;进样量5 μL;流动相及梯度洗脱条件见表 1。
|
|
表 1 梯度洗脱条件 Table 1 Gradient elution parameters |
离子源:电喷雾电离(ESI+);毛细管电压3.0 kV;离子源温度110 ℃;脱溶剂气温度350 ℃;脱溶剂气流量900 L/h;锥孔气流量50 L/h;碰撞气流量0.21 mL/min;3种农药的质谱采集参数见表 2。
|
|
表 2 3种农药质谱采集参数 Table 2 Mass spectrum acquisition parameters of 3 pesticides |
参考文献[17, 18]的方法。将莲雾鲜果于食品料理机中搅碎,混匀;准确称取25.00 g样品于烧杯中,加入50.0 mL乙腈,高速匀浆2 min,静置30 s;过滤至装有7~10 g氯化钠的具塞量筒中,剧烈振摇2 min,静置30 min;准确吸取0.50 mL上层乙腈溶液,加入0.5 mL的V(甲醇)∶V(水)=1∶1溶液,过0.22 μm滤膜后,按1.2节条件测定。
1.4 标准溶液配制与标准曲线绘制分别准确吸取多菌灵、噻菌灵和甲霜灵标准品(精确至0.01 mL),以甲醇溶解配制成100 μg/mL的单标储备液,于-18 ℃冷冻避光保存;使用时准确移取适量单标储备液,用甲醇将其分别稀释成10.00和1.00 μg/mL的混合标准储备液,于-18 ℃冷冻避光保存,备用。
取空白样品基质提取液逐级稀释混合标准储备液,配制成0.01、0.02、0.05、0.1、0.2和0.5 μg/mL的基质标准工作液。同时,用V(甲醇)∶V(水)=1∶1溶液逐级稀释混合标准储备液,配制成0.01、0.02、0.05、0.1、0.2和0.5 μg/mL的试剂标准工作液。按1.2节条件测定。分别以多菌灵、噻菌灵和甲霜灵质量浓度(x)为横坐标,对应色谱峰面积(y)为纵坐标,绘制标准曲线。
1.5 添加回收试验称取不含上述3种农药的空白样品25.00 g,分别以0.04、0.4和2 mg/kg 3个添加水平进行添加回收试验,每个水平重复5次。按1.3节的方法提取和1.2节的条件测定,计算添加回收率和相对标准偏差。
2 结果与讨论 2.1 样品提取溶剂的选择本研究考察了丙酮、甲醇、乙腈和乙酸乙酯4种溶剂的提取效果。结果表明:以丙酮和甲醇作为提取溶剂时,其提取范围较广,质谱测定的基质影响较大;乙酸乙酯在水中的溶解度很小,而这3种农药的极性均较强,很难转移到有机相中,回收率不理想;以乙腈作为提取溶剂,基质干扰较小,且回收率、灵敏度、精密度均满足残留分析的要求。因此本方法最终选择乙腈作为提取溶剂。
2.2 液相色谱条件选择本研究使用C18色谱柱进行分离,并对流动相进行了筛选:分别以乙腈-超纯水、甲醇-超纯水、乙腈-1 mmol/L的乙酸铵和甲醇-1 mmol/L的乙酸铵作为流动相;为了降低杂质干扰,采用梯度洗脱法对标准溶液进行进样分析。结果发现:以甲醇-1 mmol/L的乙酸铵为流动相进行梯度洗脱时,响应值最高。因此选用甲醇-1 mmol/L的乙酸铵作为流动相,详见表 1。
2.3 质谱条件优化分别配制1 μg/mL的多菌灵、噻菌灵和甲霜灵标准溶液,在电喷雾离子正离子模式下,采用全扫描和子离子扫描方式进行分析,分别得到母离子和子离子,然后优化各自锥孔电压和碰撞能量。选择特征离子峰进行二级质谱分析,以响应值最大的碎片离子(子离子)为定量离子,次级响应离子为定性离子。经反复测试和优化,得到3种农药的质谱条件(表 2)。对3种农药的定量离子对及定性离子对进行质谱扫描分析(图 1)。从图 1可以看出:各农药化合物的峰形尖锐、确证性强、灵敏度高。运行过程中采用柱后阀切换模式进样质谱,有助于降低对离子源的污染。
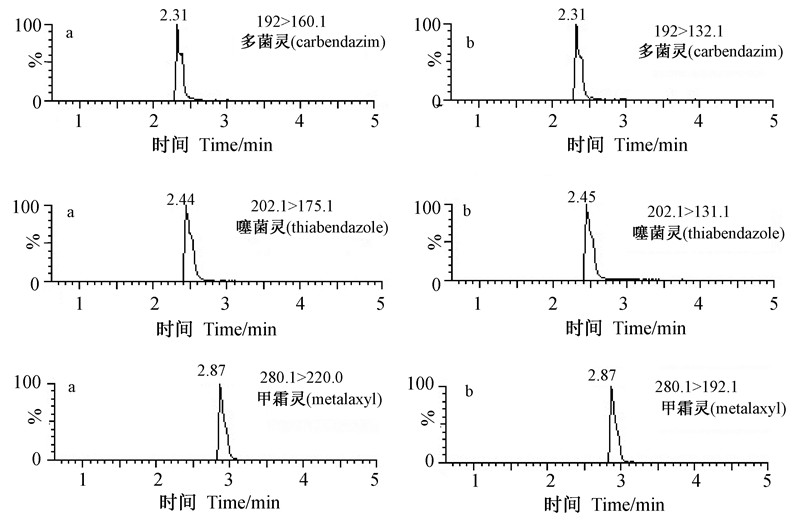 | 图 1 3种农药的定量(a)与定性(b)离子图 Fig. 1 The mass fragmentation ions for quantitation(a) and identification(b) of the 3 pesticides |
结果(表 3)显示:在0.01~0.5 μg/mL范围内,3种农药标准溶液的质量浓度与峰面积间呈良好的线性关系。
|
|
表 3 3种农药的线性方程及其决定系数 Table 3 Linear equations and determination coefficient for the tested pesticides |
分别以3倍信噪比和10倍信噪比确定作为被测物质的检出限和定量限,莲雾中3种农药的检出限均为0.001 mg/kg,定量限均为0.003 mg/kg。根据实际添加回收试验,确定多菌灵、噻菌灵和甲霜灵的定量限均为0.04 mg/kg,平均添加回收率分别为107%、75%和80%,相对标准偏差分别为6.1%、4.6%和3.8%(n=5)(表 4)。
|
|
表 4 3种农药的添加平均回收率和相对标准偏差(n=5) Table 4 Average recovery and RSDs for the tested pesticides(n=5) |
结果(表 4)表明:在0.04、0.4和2 mg/kg 3个添加水平下,3种农药的平均回收率在75%~107%之间,相对标准偏差(RSD)在2.0%~8.9%之间,均满足农药残留分析的要求[19]。对相同浓度的标准溶液进行稳定性测试,同日内每间隔2 h的时间段10次重复进样,多菌灵、噻菌灵和甲霜灵峰面积的相对标准偏差分别为4.2%、2.3%和1.8%,表明本方法的重复性良好。
2.5 基质效应在相同的色谱条件下,对基质标准工作液和试剂标准工作液进行分析,制作拟合曲线方程,根据公式(1)用斜率比(ME)来评价基质效应[20]。若ME值大于100%,说明基质增强了待测物的离子响应强度,为基质增强效应;反之,若ME值小于100%则为基质减弱效应[21]。

式中:B为基质标准工作液曲线斜率,A为试剂标准工作液曲线斜率。
从表 5可以看出:多菌灵、噻菌灵ME值均大于100%,说明存在基质增强效应;而甲霜灵的ME值小于100%,表明存在基质减弱效应。从ME值的大小来看,虽然基质效应不是十分明显,但为了提高定量的准确性,本试验仍采用基质标准工作液对样品进行定量分析。
|
|
表 5 基质效应 Table 5 Matrix effects |
运用本研究建立的方法对海口市售的10个莲雾样品进行测定,均未检出多菌灵、噻菌灵和甲霜灵。今后还会继续加强对莲雾样品中多菌灵、噻菌灵和甲霜灵残留情况的监测。
3 结论本研究建立了莲雾中多菌灵、噻菌灵和甲霜灵残留的UPLC-MS/MS快速检测分析方法。样品无需经过复杂的前处理,提取后即可进样测定。该方法操作简单、高效快捷、灵敏度高、准确性强,在实际检测中具有较强的可行性和实用性,是莲雾中多菌灵、噻菌灵和甲霜灵残留检测比较理想的方法。
| [1] | 肖邦森, 谢江辉, 孙光明, 等. 莲雾优质高效栽培技术[M]. 北京: 中国农业出版社, 2001. Xiao Bangsen, Xie Jianghui, Sun Guangming, et al. Wax Apple Quality and Efficient Cultivation Techniques[M]. Beijing: China Agriculture Press, 2001. (in Chinese) |
| [2] | 黄雪芬. 台湾黑珍珠莲雾引种表现及其栽培技术[J]. 东南园艺, 2014(6): 92-94. Huang Xuefen. Introduction performance of Taiwan 'Black Pearl' wax apple and its Corresponding ultivation techniques[J]. Southeast Hortic, 2014(6): 92-94. (in Chinese) |
| [3] | 高洁, 胡德禹, 黄荣茂. HPLC法检测黄瓜及土壤中多菌灵的残留量[J]. 山地农业生物学报, 2011, 30(2): 161-164. Gao Jie, Hu Deyu, Huang Rongmao. Determination of carbendazim residue in cucumber and soil using HPLC method [J]. J Mountain Agric Biol, 2011, 30(2): 161-164. (in Chinese) |
| [4] | 杨楠, 张琦, 权伍英, 等. QuEChERS前处理方法结合液相色谱-串联质谱技术检测蔬菜中的多菌灵[J]. 中国卫生检验杂志, 2011, 21(5): 1096-1097. Yang Nan, Zhang Qi, Quan Wuying, et al. Determination of carbendazim in vegetables by QuEChERS-liquid chromatography/tandem mass spectrometry [J]. Chin J Health Labor Technol, 2011, 21(5): 1096-1097. (in Chinese) |
| [5] | 赵其阳, 焦必宁, 王成秋, 等. 气相色谱法同时测定柑桔中抑霉唑、噻菌灵和嘧霉胺残留[J]. 现代科学仪器, 2007(1): 77-79. Zhao Qiyang, Jiao Bining, Wang Chengqiu, et al. Simultaneous determination of imazalil, thiabendazole and pyrimethanil residues in citrus fruits by gas chromatography [J]. Modern Sci Instru, 2007(1): 77-79. (in Chinese) |
| [6] | 张群, 刘春华, 吴南村, 等. 气相色谱-串联质谱法同时测定龙眼中的噻菌灵、多效唑、己唑醇[J]. 农药, 2014, 53(6): 423-425. Zhang Qun, Liu Chunhua, Wu Nancun, et al. Determination of thiabendazole, paclobutrazol and hexaconazole pesticide residues in Longan using GC-MS/MS [J]. Agrochemicals, 2014, 53(6): 423-425. (in Chinese) |
| [7] | 郑雪虹, 潘永波, 吕岱竹, 等. 高效液相色谱法对西瓜和香蕉中甲霜灵残留的测定[J]. 热带农业科学, 2013, 33(9): 50-54. Zheng Xuehong, Pan Yongbo, Lv Daizhu, et al. Determination of metalaxyl in water melons and bananas by HPLC [J]. Chin J Trop Agric, 2013, 33(9): 50-54. (in Chinese) |
| [8] | 乐渊, 尹桂豪, 刘春华, 等. 超高效液相色谱-串联质谱法测定香草兰中多菌灵和甲霜灵残留[J]. 广东农业科学, 2012, 39(19): 98-101. Le Yuan, Yin Guihao, Liu Chunhua, et al. Determination of carbendazim and metalaxyl in vanilla by ultra performance liquid chromatography-tandem mass spectrometry [J]. Guangdong Agric Sci, 2012, 39(19): 98-101. (in Chinese) |
| [9] | GB 10501—2000, 多菌灵原药[S].北京:中国标准出版社,2004. GB 10501—2000, Carbendazim technica [S]. Beijing:China Standard Press,2004.(in Chinese) |
| [10] | 付新梅, 张丽静, 封顺, 等. 高效液相色谱法同时测定甜瓜样品中的抑霉唑和噻菌灵. 分析化学, 2004, 32(3): 329-331. Fu Xinmei, Zhang Lijing, Feng Shun, et al. Simultaneous determination of imazalil and thiabendzole in muskmelons by high performance liquid chromatography. Chin J Anal Chem, 2004, 32(3): 329-331.(in Chinese) |
| [11] | HG 2206—1991,甲霜灵原药[S].北京:化学工业出版社,2015. HG 2206—1991,metalaxyl technica[S]. Beijing:Chemical Industry Press,2015.(in Chinese) |
| [12] | 刘杰, 杨春亮, 查玉兵, 等. 高效液相色谱法-荧光检测器同时检测龙眼中多菌灵和噻菌灵残留[J]. 广东农业科学, 2010, 37(3): 150-152. Liu Jie, Yang Chunliang, Zha Yubing, et al. Simultaneous determination of carbendazim and thiabendazole residues in longan by HPLC with fluorescence detector [J]. Guangdong Agric Sci, 2010, 37(3): 150-152. (in Chinese) |
| [13] | Navickiene S, Ribeiro M L. Rapid method for the determination of thiabendazole and imazalil residues in orange by capillary column gas chromatography[J]. J High Resolut Chromatogr, 1999, 22(5): 303-304. |
| [14] | 胡梅, 王骏, 张卉, 等. 超高效液相色谱-串联质谱测定蒜苔中多菌灵和噻菌灵的残留量[J]. 山东农业科学, 2010(4): 89-91. Hu Mei, Wang Jun, Zhang Hui, et al. Determination of carbendazim and thiabendazole residues in garlic sprouts by UPLC-MS/MS [J]. Shandong Agric Sci, 2010(4): 89-91. (in Chinese) |
| [15] | 陈红平, 刘新, 汪庆华, 等. 气相色谱-串联质谱检测水果、蔬菜中抗蚜威、甲霜灵和克螨特残留量[J]. 质谱学报, 2010, 31(4): 220-223. Chen Hongping, Liu Xin, Wang Qinghua, et al. Determination of pirimicarb, metalaxyl and propargite residues in fruit and vegetable by GC-MS/MS [J]. J Chin Mass Spectrom Soc, 2010, 31(4): 220-223. (in Chinese) |
| [16] | 张群, 吴南村, 刘春华, 等. 气相色谱-串联质谱法测定莲雾中的灭蚁灵和哒螨灵残留[J]. 农药学学报, 2014, 16(3): 362-366. Zhang Qun, Wu Nancun, Liu Chunhua, et al. Determination of mirex and pyridaben residues in wax-apple by gas chromatography-tandem mass spectrometry [J]. Chin J Pestic Sci, 2014, 16(3): 362-366. (in Chinese) |
| [17] | 郑姝宁, 李凌云, 林桓, 等. 超快速液相色谱-串联质谱法快速筛查蔬菜中176 种农药的残留量[J]. 色谱, 2013, 31(1): 71-78. Zheng Shuning, Li Lingyun, Lin Huan, et al. Rapid screening of 176 pesticide residues in vegetables by ultra fast liquid chromatography-tandem mass spectrometry [J]. Chin J Chromatogr, 2013, 31(1): 71-78. (in Chinese) |
| [18] | 刘春华, 乐渊, 阳辛凤, 等. 超高效液相色谱-串联质谱法快速测定生咖啡豆中多菌灵等农药残留[J]. 广东农业科学, 2012, 39(24): 108-110. Liu Chunhua, Le Yuan, Yang Xinfeng, et al. Ultra performance liquid chromatography tandem mass spectrometric for determination of 6 pesticides in raw coffee beans [J]. Guangdong Agric Sci, 2012, 39(24): 108-110. (in Chinese) |
| [19] | NY/T 788—2004, 农药残留试验准则[S]. 北京:中国农业出版社,2004. NY/T 788—2004, Guideline on pesticide residue trials [S]. Beijing:China Agriculture Press,2004.(in Chinese) |
| [20] | Egea Gonzállez F J, Hernández Torres M E, Almansa López E, et al. Matrix-effects of vegetable commodities in electron-capture detection applied to pesticide multiresidue analysis [J]. J Chromatogr A, 2002, 966(1-2): 155-165. |
| [21] | 张月, 吕岱竹, 韩丙军, 等. 超高效液相色谱-串联质谱法测定咖啡鲜果中草铵膦及其代谢产物残留[J]. 农药学学报, 2014, 16(6): 734-739. Zhang Yue, Lv Daizhu, Han Bingjun, et al. Determining residues of glufosinate-ammonium and its metabolites in coffee cherries by ultra performance liquid chromatography-tandem mass spectrometry [J]. Chin J Pestic Sci, 2014, 16(6): 734-739. (in Chinese) |
 2015, Vol. 17
2015, Vol. 17


