环丙唑醇(cyproconazole),化学名称2-(4-氯苯基)-3-环丙基-1-(1,2,4-三唑-1-基)丁-2-醇,是一种手性三唑类杀菌剂,具有2个手性碳原子,存在两对对映体(结构式见图式1)。可用于防治由白粉菌属、喙孢属和壳针孢属菌等对禾谷类作物引起的病害。三唑类杀菌剂一般具有杀菌和植物调节的作用,研究表明,这两种活性往往表现在不同的异构体上,如:多效唑的杀菌活性是其(2R,3R)-体大于(2S,3S)-体,而植物生长调节活性则是(2S,3S)-体大于(2R,3R)-体[1, 2];己唑醇、戊唑醇对花生褐斑病菌、番茄早疫病菌、油菜菌核病菌等5种病菌的抗菌活性均为(-)-体优于(+)-体;而(+)-粉唑醇的抗菌活性则优于(-)-粉唑醇[3]。另有研究表明:环丙唑醇的4个异构体在不同土壤中的降解速率不同[4];己唑醇的右旋体在家兔多个组织中被优先降解[5];(+)-(S)-戊唑醇在血浆中比(-)-(R)-戊唑醇降解快[6]。由此可见,三唑类手性农药对映体不仅具有不同的生物活性,而且在代谢降解方面也有所差异。因此建立高效、快速的三唑类手性农药分离方法,获取其单一对映体,对手性农药生物活性和环境行为研究具有重要意义。
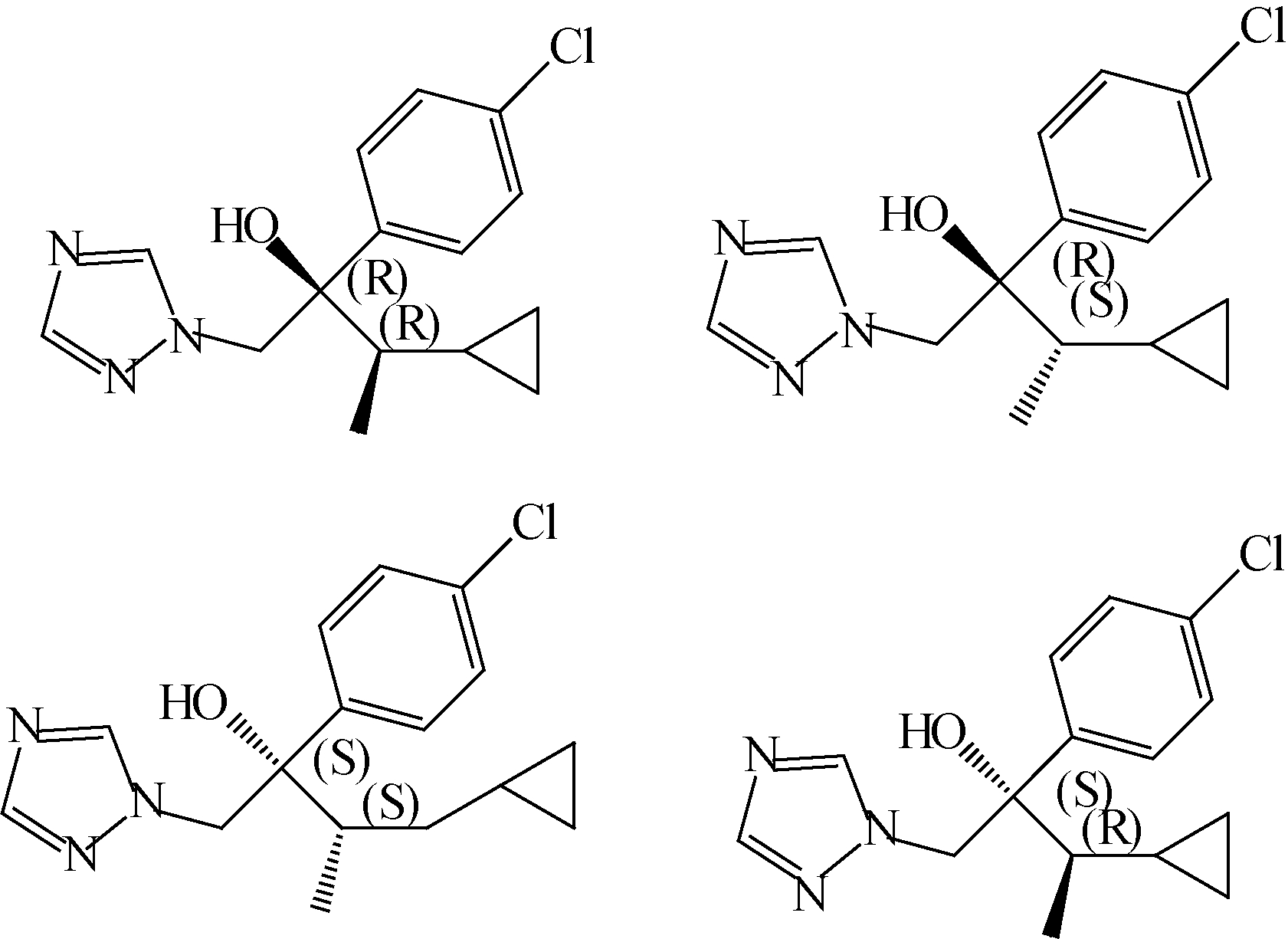 | 图式1 环丙唑醇异构体的化学结构 Scheme 1 Chemical structure of cyproconazole isomers |
关于手性农药的拆分方法已有很多报道,其中高效液相色谱(HPLC)手性固定相(CSP)法因其操作简便,应用范围广且可以用于制备分离而成为目前研究和应用最多的一种对映体分离方法[7]。已报道的有关环丙唑醇对映体拆分方法主要有毛细管电泳法[8, 9],以及采用多糖类Chiralpak AD柱[10]、Lux Amylose-2柱[11]和其他手性柱进行HPLC分离的方法。纤维素、淀粉等多糖类手性固定相具有通用性强、柱容量高、柱性能稳定等优点,被证明是应用最广泛的一类固定相。最初多糖类手性固定相大都被用在正相模式下,以正己烷/异丙醇混合物作流动相,在该模式下氢键、π-π和偶极相互作用被认为是最有效的手性识别作用;相对于正相模式下对映体的拆分,在反相模式下采用多糖类手性固定相进行对映体拆分的报道较少[12, 13]。本文利用Lux Cellulose-1[纤维素-三(3,5-二甲基苯基氨基甲酸酯)]手性色谱柱在高效液相色谱反相条件(RP-HPLC)下,进行了环丙唑醇对映体的分离研究,考察了色谱柱粒径、流动相组成和柱温等对拆分的影响,并采用在线旋光检测器研究了对映体的洗脱顺序。
1 材料与方法 1.1 仪器与试剂Agilent 1200高效液相色谱仪(配备G1311A泵、G1322A脱气机、G1316B控温装置、G1329A自动进样装置和G1315C-DAD检测器)及CHIRALYSER-MP在线旋光检测器(德国IBZ MESSTECHNIK公司,由北京赛普瑞生科技开发有限公司提供)。色谱柱:Lux Cellulose-1[纤维素-三(3,5-二甲基苯基氨基甲酸酯)],规格250 mm×4.6 mm,粒径5 μm和150 mm×2.0 mm,粒径3 μm),由广州菲罗门公司提供。甲醇、乙腈等试剂均为色谱纯(美国Fisher公司)。环丙唑醇(cyproconazole)标准品纯度为98.5%(德国Dr. Ehrenstorfer公司)。
1.2 色谱条件及色谱参数、热力学参数的计算 1.2.1 流动相组成对环丙唑醇对映体拆分的影响在柱温20 ℃、流速分别为1.0 mL/min(5 μm色谱柱)及0.3 mL/min(3 μm色谱柱)、进样量20 μL、检测波长220 nm、标准工作液质量浓度100 mg/L条件下,分别考察以不同体积比的甲醇-水或乙腈-水为流动相时对环丙唑醇对映体拆分的影响。
计算的色谱参数主要有:容量因子k′=(tn-t0)/t0;分离因子α=kn+1′/kn′;分离度Rs=2(tn+1-tn)/ (wn+1+wn);其中t0为死时间,tn+1及tn分别为两相邻洗脱峰的保留时间,wn+1及wn分别为两相邻洗脱峰之基线峰宽。
1.2.2 温度对环丙唑醇对映体拆分的影响及热力学研究分别以甲醇-水(3 μm色谱柱以V(甲醇)∶V(水)=75∶25,5 μm色谱柱以V(甲醇)∶V(水)=80∶20)或V(乙腈) ∶V(水)=60∶40为流动相,考察不同柱温(5~40 ℃)条件下对环丙唑醇对映体拆分的影响。为了揭示手性识别过程中分子间作用力随温度变化的情况,本研究将色谱参数用于推导相关热力学参数[14, 15, 16, 17]。
lnk′=-ΔH°/RT+ΔS°/R +lnΦ
lnα=-ΔΔG°/RT=-ΔΔH°/RT+ΔΔS°/R
其中:k′为某一对映异构体的保留因子,R为气体常数,T为绝对温度,Φ为相比,ΔH°、ΔS°分别代表该异构体在固定相与流动相分配的摩尔焓变和熵变。ΔΔG°、ΔΔH°和ΔΔS°分别代表两相邻异构体在两相间分配的自由能变、焓变和熵变之差。若对映体与固定相之间的相互作用在所研究的温度范围内不发生变化,则以lnα和lnk′对1/T作图(van′t Hoff equation)应为直线,根据直线斜率或截距可求得手性拆分过程对应的热力学参数。
2 结果与讨论 2.1 流动相组成对环丙唑醇对映体拆分的影响在反相条件下,分别考察了不同粒径的色谱柱及不同比例的甲醇-水和乙腈-水对环丙唑醇对映体拆分的影响。
从表1可以看出:在粒径为3 μm的色谱柱上,当以甲醇-水为流动相时,随着流动相中甲醇含量的升高,容量因子k′逐渐减小;分离因子α逐渐升高;分离度的变化较为复杂,表现为Rs12和Rs23逐渐下降,而Rs34呈现先下降后升高的趋势。在以乙腈-水为流动相时,随着乙腈含量的增加,k′逐渐减小;α12和α34逐渐升高,α23逐渐下降;Rs12和Rs23逐渐下降,Rs34先下降后升高。总体来说,随着流动相中水的比例增加,对映体保留增强,有利于提高分离效果,但受保留时间和柱压的限制,最终选择甲醇-水的最佳体积比为75∶25(典型谱图见图1A),乙腈-水的最佳体积比为60∶40。
|
|
表 1 流动相组成对环丙唑醇对映体拆分的影响 Table 1 Effect of the mobile phase composition on the enantiomeric separation of cyproconazole |
在粒径为5 μm的色谱柱上,以甲醇-水为流动相时,随着流动相中甲醇含量的升高,容量因子k′逐渐减小;分离因子α12和α34逐渐升高,α23逐渐下降;分离度Rs12先下降后升高,Rs23呈现下降趋势、Rs34先下降后趋于稳定。而以乙腈-水为流动相时,随着乙腈含量的增加,k′逐渐减小;α12、α34逐渐升高,α23逐渐下降; Rs均逐渐下降。随着流动相中水的比例增加,对映体保留增强,有利于提高分离效果,但受保留时间和柱压的限制,综合考虑,最终选择甲醇-水的最佳体积比为80∶20,乙腈-水的最佳体积比为60∶40(典型谱图见图1B)。
 | A,C: 3 μm色谱柱(column with particle size of 3 μm),20 ℃,V(甲醇)∶ V(水)[V(methanol)∶V(water)]=75∶25,流速(flow rate) 0.3 mL/min;B,D: 5 μm色谱柱(column with particle size of 5 μm),20 ℃,V(乙腈)∶ V(水)[V(acetonitrile) ∶ V(water)=60∶ 40,流速(flow rate) 1.0 mL/min。 图 1 环丙唑醇对映体在LuxCellulose-1反相条件下的典型拆分紫外(A,B)和旋光色谱图(C,D) Fig. 1 The typical UV(A,B) and OR(C,D) chromatograms of enantioseparation of cyproconazole on Lux Cellulose-1 by RP-HPLC |
由于多糖类手性固定相结构复杂,目前有关其手性拆分机理并非完全清楚。但通常认为纤维素-三(3,5-二甲基苯基氨基甲酸酯)手性固定相的手性识别能力主要依赖于极性的氨基甲酸酯基与3,5-二甲基苯基围绕着主链形成的手性螺旋空腔[14]。在环丙唑醇分子中含有苯环和羟基,羟基与氨基甲酸酯之间的氢键作用、苯环间的π-π 作用、偶极-偶极作用以及环丙唑醇手性碳上取代基空间取向的排斥作用等,可能是导致环丙唑醇对映体很好分离的原因。另外,随着流动相中水含量的增加,对映体保留时间增加,即溶质分子保留时间随着流动相极性的增加而增加,这正是反相色谱的特征[18],这种现象说明流动相极性的改变对溶质分子的保留时间有直接影响。同时,对映体的α值随着水含量的变化改变不大,这说明分离因子受流动相中水含量的影响较小。
总体而言,在流动相和温度相同的条件下,对映体在粒径5 μm色谱柱上的分离效果比在粒径3 μm色谱柱上的分离效果好。但使用5 μm色谱柱时,流动相因流速较高而用量更大,而且对映体在其上所需分离的时间更长。综合考虑,在满足环丙唑醇对映体可以达到完全分离的情况下,可以优先使用3 μm色谱柱。
2.2 对映体的洗脱顺序手性化合物的光学活性差异主要是表现在两个方面:一是对线性偏振光偏振平面的旋转;另一是对左右旋圆偏振光的吸收差异。利用光学活性的差异,分别对应两种手性检测器:旋光检测器(ORD)和圆二色检测器(CD)[19]。本研究采用在线旋光检测器以旋光信号的正负研究了环丙唑醇对映体的洗脱顺序(见图1C,1D)。结果发现,在相同的流动相条件下,不同温度、不同粒径的色谱柱对对映体的洗脱顺序没有影响。但当以甲醇-水为流动相时,对映体洗脱顺序为(+/-/+/-),以乙腈-水为流动相时,对映体洗脱顺序则变为(+/+/-/-),据此推测峰2和峰3、峰1和峰4分别是两对对映异构体,但还需要进一步的研究确认。产生这种现象的原因尚不清楚,一般认为是流动相成分的改变导致了手性空腔的立体环境发生变化所致[20]。目前还未见环丙唑醇4个对映体绝对构型的相关报道,因此绝对构型与旋光特性的对应关系有待进一步研究。
2.3 温度对环丙唑醇手性对映体拆分的影响及其热力学探讨不同柱温(5~40 ℃)对环丙唑醇对映体手性分离影响结果见表2。从表中可以看出:随着柱温的降低,容量因子k′增大,分离因子α也逐渐增大。这一点与传统HPLC作用机理类似,即柱温降低,溶质在固定相和流动相之间传质速度变慢,对映体保留时间延长,容量因子k′增大,分离因子α同时也增大。
|
|
表 2 柱温对环丙唑醇对映体拆分的影响 Table 2 Effect of column temperature on the enantiomeric separation of cyproconazole |
在3 μm色谱柱上以V(甲醇)∶V(水)=75∶25作为流动相时,温度降低,Rs12和Rs23均增大,而Rs34则呈现出先升高后下降的趋势,并在20 ℃达到最大值,环丙唑醇的最佳拆分温度为5 ℃。在以V(乙腈)∶V(水)=60∶40为流动相时,随着温度的升高,相邻对映体之间的分离度均有所下降,最佳拆分温度为30 ℃。
在5 μm的色谱柱上,以V(甲醇)∶V(水)=80∶20作为流动相时,温度对环丙唑醇对映体拆分的影响较为复杂。在考察的温度范围内,随着温度的升高,Rs12呈现波浪式升高、Rs23呈波浪式下降、Rs34呈现出先升高后下降的趋势,最佳拆分温度为20 ℃。在以V(乙腈)∶V(水)=60∶40为流动相时,随着温度的升高,相邻对映体之间的分离度均有所下降,最佳拆分温度为40 ℃。
通过考察温度对手性分离的影响,可以计算出手性分离过程中相应的热力学参数,从而对手性分离过程有更加深入的了解。测定不同温度下的容量因子k′和手性分离因子α,以ln k′和lnα分别对1/T作图,各自可以得到一条直线,斜率分别为ΔH°/R和ΔΔH°/R,截距为ΔS°/R +lnΦ和ΔΔS°/R,从而可以求得对映体与手性固定相相互作用的ΔH°及其差值ΔΔH°,熵变ΔS°由及其差值ΔΔS°。其中ΔH°可衡量溶质从流动相转移到固定相时的热效应,ΔS°可表示溶质吸附过程自由度的变化情况[16]。ΔΔH°是表征对映体与手性固定相作用强度之差,而ΔΔS°则可表征为两对映体与手性固定相作用过程中构象匹配性的差别。在试验温度范围内,环丙唑醇对映体在Lux Cellulose-1手性色谱柱上拆分对应的van′t Hoff方程的线性关系较好(R2>0.92,见表3),说明根据van′ Hoff求得的热力学参数在此温度范围内为定值,固定相的构型未发生明显变化,对映体的保留机制及选择作用不变。在该温度范围内,在粒径为3 μm和5 μm的色谱柱上,分别以甲醇-水和乙腈-水作为流动相时,ΔH°和ΔS°均为负值,表明环丙唑醇对映体在固定相上的吸附是一个放热过程,此过程中对映体分子发生构象变化,使得分子总体变得有序。在以乙腈-水作为流动相时,环丙唑醇对映体的ΔΔH°和ΔΔS°均为负值,说明对映体的手性拆分过程受焓驱动,后出峰异构体较前出峰异构体与固定相间存在更强的作用,且与固定相形成的可逆过渡态络合物分子总体上更加有序,温度升高时分离因子下降,因此温度的降低有利于对映体的分离;在以甲醇-水为流动相时,峰1与峰2异构体之间分离情况的热力学函数ΔΔH°为负,ΔΔS°为正,说明此对映体在分离过程中既受焓驱动又受熵驱动,反映峰2与峰3以及峰3与峰4异构体分离的ΔΔH°和ΔΔS°均为负值,说明环丙唑醇峰2与峰3异构体之间,以及峰3与峰4异构体之间的手性分离受焓驱动,因此温度的降低有利于对映体的分离。
|
|
表 3 环丙唑醇对映体拆分的热力学参数 Table 3 Thermodynamic parameters of enantiomeric separation of cyproconazole |
采用反相高效液相色谱手性固定相法,以乙腈-水或甲醇-水为流动相,在Lux Cellulose-1手性色谱柱上可以实现环丙唑醇对映体的直接拆分,其中,以乙腈-水为流动相比以甲醇-水为流动相具有更好的拆分效果;柱温降低有利于对映体的拆分。柱温及固定相中填充物的粒径对对映体洗脱顺序无影响,但当流动相由乙腈-水变为甲醇-水时,对映体的洗脱顺序由(+/+/-/-)变为(+/-/+/-)。最佳拆分条件为:流动相为V(乙腈)∶V(水)=60∶40,柱温20 ℃,流速0.3 mL/min(3 μm色谱柱)和流速1.0 mL/min(5 μm色谱柱),在满足对映体完全分离的情况下,建议优先使用3 μm色谱柱。
热力学机理研究结果表明:在5~40 ℃试验温度范围内,van′t Hoff 方程的线性关系良好( R2>0.92);以乙腈-水作为流动相时,环丙唑醇对映体的拆分过程受焓驱动;而以甲醇-水为流动相时,峰1与峰2的分离既受焓驱动又受熵驱动,峰2与峰3以及峰3与峰4的分离受焓驱动。
| [1] | Burden R S, Carter G A, Clark T, et al. Comparative activity of the enantiomers of triadimenol and paclobutrazol as inhibitors of fungal growth and plant sterol and gibberellin biosynthesis [J]. Pestic Sci, 1987, 21(4): 253-267. |
| [2] | Sugavanam B. Diastereoisomers and enantiomers of paclobutrazol: Their preparation and biological activity[J]. Pestic Sci, 1984, 15(3): 296-302. |
| [3] | 杨丽萍, 李树正, 李煜昶, 等. 三种三唑类杀菌剂对映体生物活性的研究[J]. 农药学学报, 2002, 4(2): 67-70. Yang Liping, Li Shuzheng, Li Yuchang, et al. Bioactivity investigation of triazole fungicide enantiomers [J]. Chin J Pestic Sci, 2002, 4(2): 67-70. (in Chinese) |
| [4] | Buerge I J, Poiger T, Müller M D, et al. Influence of pH on the stereoselective degradation of the fungicides epoxiconazole and cyproconazole in soils[J]. Environ Sci Technol, 2006, 40(17): 5443-5450. |
| [5] | Wang Xinquan, Qiu Jing, Wang Ping, et al. Stereoselective kinetic study of hexaconazole enantiomers in the rabbit [J]. Chirality, 2005, 17(4): 186-192. |
| [6] | Zhu Wentao, Qiu Jing, Dang Zhiheng, et al. Stereoselective degradation kinetics of tebuconazole in rabbits [J]. Chirality, 2007, 19(2): 141-147. |
| [7] | 赵扬. 液相色谱手性固定相在农药拆分中的应用研究[D]. 北京: 中国农业大学, 2006. Zhao Yang. Application in enantiomeric separation of pesticides using chiral stationary phases by liquid chromatography[D]. Beijing: China Agricultural University, 2006. (in Chinese) |
| [8] | Wu Y S, Lee H K, Li S F. High-performance chiral separation of fourteen triazole fungicides by sulfated β-cyclodextrin-mediated capillary electrophoresis[J]. J Chromatogr A, 2001, 912(1): 171-129. |
| [9] | Wan Ibrahim W A, Warno S A, Aboul-Enein H Y, et al. Simultaneous enantioseparation of cyproconazole, bromuconazole, and diniconazole enantiomers by CD-modified MEKC[J]. Electrophoresis, 2009, 30(11): 1976-1982. |
| [10] | Toribio L, Del Nozal M J, Bernal J L, et al. Chiral separation of some triazole pesticides by supercritical fluid chromatography[J]. J Chromatogr A, 2004, 1046(1-2): 249-253. |
| [11] | Yang Wengweng, Qiu Jing, Chen Tianjin, et al. Direct enantioseparation of nitrogen-heterocyclic pesticides on amylose-tris-(5-chloro-2-methylphenylcarbamate) by reversed-phase high-performance liquid chromatography[J]. Chirality, 2012, 24(12): 1031-1036. |
| [12] | Perrin C, Matthijs N, Maftouh D, et al. screening approach for chiral separation of pharmaceuticals: Part II. Reversed-phase liquid chromatography[J]. J Chromatogr A, 2002, 966(1-2): 119-134. |
| [13] | Yashima E. Polysaccharide-based chiral stationary phases for high-performance liquid chromatographic enantioseparation[J]. J Chromatogr A, 2001, 906(1-2): 105-125. |
| [14] | 王新全, 王雪松, 王祥云, 等. 三唑醇对映体的反相高效液相色谱拆分热力学研究[J]. 农药学学报, 2011, 13(1): 53-58. Wang Xinquan, Wang Xuesong, Wang Xiangyun, et al. Thermodynamic property of the enantiomeric separation for triadimenol by reverse-phase high-performance liquid chromatography[J]. Chin J Pestic Sci, 2011, 13(1): 53-58. (in Chinese) |
| [15] | 周瑛, 张世浩, 刘维屏, 等. 敌草胺对映体的高效液相色谱分离及手性拆分热力学研究[J]. 农药学学报, 2006, 8(3): 260-264. Zhou Ying, Zhang Shihao, Liu Weiping, et al. Enantioresolution and study of thermodynamical property of napropamide by high performance liquid chromatography[J]. Chin J Pestic Sci, 2006, 8(3): 260-264. (in Chinese) |
| [16] | 翁文, 姚碧霞, 陈秀琴, 等, 液相色谱手性拆分机理的热力学方法研究[J]. 化学进展, 2006, 18(7-8): 1056-1065. Wong Wen, Yao Bixia, Chen Xiuqin, et al. Thermodynamic studies on mechanism of chiral resolution by liquid chromatography[J]. Progr Chem, 2006, 18(7-8): 1056-1065. (in Chinese) |
| [17] | Weng Wen, Wang Qinhua, Yao Bixia, et al. Enantioseparation of amino acid derivatives on an immobilized network polymer derived from L-tartaric acid[J]. J Chromatogr A, 2004, 1042(1-2): 81-87. |
| [18] | 金丽霞. 手性三唑类杀菌剂和芳氧苯氧丙酸类除草剂高效液相色谱对映体分离[D]. 杭州: 浙江工业大学, 2011. Jin Lixia. Enantiomeric separations of chiral triazole fungicides and aryloxyphenoxypropanoic acid herbicides by HPLC[D]. Hangzhou: Zhejiang University of Technology, 2011. (in Chinese) |
| [19] | 陈胜文, 刘维屏, 张大同. 手性检测器及手性对映体圆二色光谱标识[J]. 环境化学, 2006, 25(3): 331-335. Chen Shengwen, Liu Weiping, Zhang Datong. Chiral detectors and characterization with circular dichroism of chiral pesticides[J]. Environ Chem, 2006, 25(3): 331-335. (in Chinese) |
| [20] | Wang Tao, Wenslow R M. Effects of alcohol mobile-phase modifiers on the structure and chiral selectivity of amylose tris(3, 5-dimethylphenylcarbamate) chiral stationary phase[J]. J Chromatogr A, 2003, 1015(1-2): 99-110. |
 2015, Vol. 17
2015, Vol. 17


