氟取代性信息素类似物的合成设计途径一般包括两个方面[10]:1)选择性地合成不同位置和不同取代数量的含氟化合物,通过活性筛选挑选出具有良好生物活性的引诱剂;2)根据一些合理假说中化合物的作用模式和构效关系,设计出具有良好生物活性的含氟化合物。
根据氟原子或基团的修饰位点分为以下3类。
1.1 烷基链修饰烷基链修饰是指昆虫性信息素分子末端烷基链上的氢原子被一个或多个氟原子取代,使得分子具有极性-非极性的二元特性。
1993年Wu等[9]报道了黄地老虎Agrotis segetum性信息素的主要成分(Z)-5-乙酸癸烯基酯的几种含氟衍生物的合成(图式1)及其生物活性。结果表明:在相同时间和试验条件下,该化合物在滤纸上的挥发量与化合物中氟原子取代的数目成正相关,即:化合物7,7,8,8,9,9,10,10,10-九氟取代物>7,7,8,8-四氟取代物>10,10,10-三氟取代物;昆虫单细胞记录(SSR)数据和田间引诱试验表明:化合物7,7,8,8,9,9,10,10,10-九氟取代的性信息素衍生物基本无生物活性;10,10,10-三氟取代类似物和7,7,8,8-四氟取代类似物的生物活性虽然较天然性信息素有所下降,但均表现出明显的引诱活性,并且前者的活性高于后者。Bengtsson等[11]对葡萄卷叶蛾Eupoecilia ambiguella的性信息素组分(Z)-9-十二烯-1-醇乙酸酯末端烷基链氟取代物进行了研究,合成了该组分的类似物——(Z)-9-11,11-二氟十二烯-1-醇乙酸酯、(Z)-9-12,12,12-三氟十二烯-1-醇乙酸酯和(Z)-9-11,11,12,12,12-五氟十二烯-1-醇乙酸酯(图式2)。风洞试验和田间引诱试验结果表明:五氟取代物本身基本无活性,但对天然组分有增效作用,田间条件下可增加(Z)-9-十二烯-1-醇乙酸酯的引诱活性;三氟取代物活性较弱,挥发性大于天然组分;二氟取代物挥发性相对较弱,生物活性远远高于三氟和五氟取代物,与母体(Z)-9-十二烯-1-醇乙酸酯相当。
 | 图 1 (Z)-5-乙酸癸烯基酯及其含氟类似物 Fig. 1 (Z)-5-decenyl acetate and three fluorinated analogues |
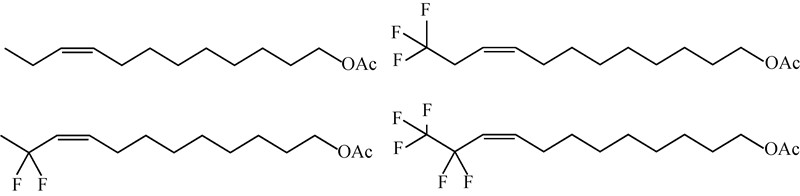 | 图 2 (Z)-9-十二烯醇乙酸酯及其含氟类似物 Fig. 2 (Z)-9-dodecenyl and three fluorinated analogues |
疏水端的氟取代在不同程度上降低了天然性信息素的生物活性,氟代物的生物活性与末端烷基链上氟取代的数量成反比,尤其是全氟取代使化合物基本丧失了引诱活性。说明末端烷基链的疏水性在性信息素分子与受体蛋白的结合中起着重要作用,氟取代后的性信息素分子与受体亲和力的减弱,可能是造成氟取代物电生理活性降低的重要原因[12]。
1.2 双键修饰 1.2.1 双键α位氟取代双键α位氟取代是指以一个或多个氟原子替换性信息素中双键或三键靠近极性基团端的α位氢原子。
当在梨小食心虫Grapholitha molesta性信息素主要成分(Z)-8-十二碳烯-1-醇-乙酸酯的双键α位引入两个氟原子时,发现不仅化合物的挥发性降低,而且活性也大为降低,但值得注意的是,当其与天然性信息素混合使用时,却对天然性信息素有增效作用。欧洲玉米螟Ostrinia nubilalis的性信息素组分之一——(Z)-11-十四烯-1-醇-乙酸酯,其10位上的二氟取代物(Z)-11-10,10-二氟十四烯-1-醇乙酸酯挥发性虽然与母体差别很小,但其已基本丧失生物活性。松异舟蛾Thaumetopoea pityocampa 性信息素主要组分之一——(Z)-13-十六碳烯-11-炔-1-醇乙酸酯,其三键靠近极性基团端的α位二氟取代物(Z)-10,10-二氟-13-十六碳烯-11-1-炔-1-醇乙酸酯在田间试验中不仅没有表现出引诱活性,而且在与天然性信息素混用时,还能抑制天然组分的生物活性(图式3)[13]。
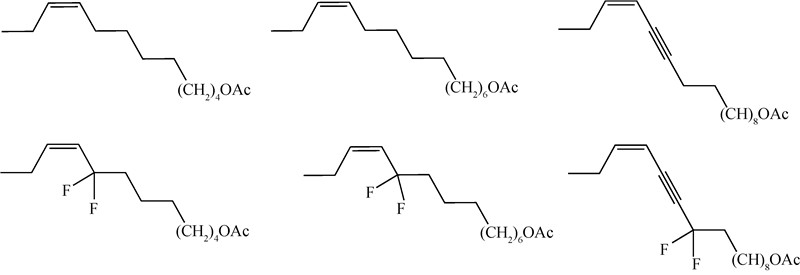 | 图 3 (Z)-8-十二碳烯-1-醇乙酸酯、(Z)-11-十四碳烯-1-醇乙酸酯、(Z)-13-十六碳烯-11-炔-1-醇乙酸酯及其含氟类似物 Fig. 3 (Z)-8-dodecylene-1-ol acetate, (Z)-11-tetradecen-1-ol acetate,(Z)-13-hexadecen-11-yn-1-ol acetate corresponding fluorinated analogues |
1978年Schlosser[14] 研究了苹果蠹蛾Cydia pomonella性信息素的主要成分十二碳烯醇含氟类似物(8E,10Z)-10-氟-8,10-十二碳二烯-1-醇的生物活性,发现其与天然性信息素的触角电位(EAG)响应值相似,生物活性也与母体相似。此后,Tellier等[15]合成了(8E,10E)-8,9-二氟-8,10-十二碳二烯-1-醇、(8E,10E)-10,11-二氟-8,10-十二碳二烯-1-醇和(8E,10E)-8,9,10,11-四氟-8,10-十二碳二烯-1-醇(图式4)。生物活性研究发现:8,9位取代的二氟化合物,其EAG响应值较弱;9,10位取代的二氟化合物暴露在外界条件下时更加稳定,而EAG响应值也与天然性信息素相似;8,9,10,11位取代的四氟化合物则完全丧失了生物活性。Camps等[16]在家蚕Bombyx mori、海灰翅夜蛾Spodoptera mauritia、苏丹棉铃虫Diparopsis castinea、苹果小卷蛾Laspeyresia pomonella和松异舟蛾T. pityocampa 5种昆虫的性信息素组分之一的双键位置进行单氟原子的取代研究(图式5),发现其EAG响应值均与相应的天然组分基本相同,但将松异舟蛾的氟取代物与天然组分以质量比超过3∶1的比例混用时,会强烈抑制天然组分的引诱活性。
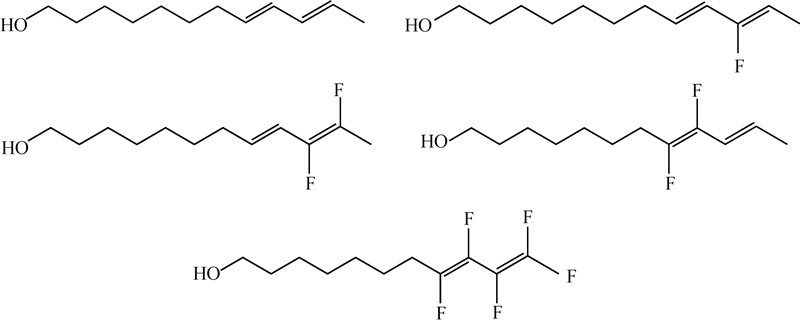 | 图 4 (E8,E10)-十二碳二烯-1-醇及其含氟类似物 Fig. 4 Codlemone and four fluorinated analogues |
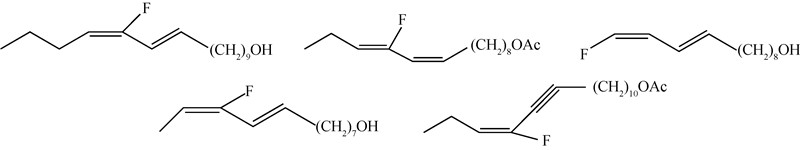 | 图 5 家蚕、海灰翅夜蛾、苏丹棉铃虫、苹果小卷蛾、松异舟蛾性信息素含氟类似物 Fig. 5 Fluorinated analogues of Bombyx mori, Spodopteralittoralis, Diparopsis castanea,Laspeyresia pomonella and Thaumetopoea pityocampa sex-pheromone |
两种方式的氟取代均能使天然性信息素表现出增效、抑制、引诱等多样、复杂的生物活性。但就对雄虫引诱活性而言,双键或三键靠近极性基团端的α位的氟取代物均表现出活性的下降甚至丧失。造成天然组分活性降低的原因可能是氟原子的引入影响了碳链构象的灵活性和双键的反应活性,C—F键强烈的永久性偶极距也可能干扰信息素分子与相应受体的结合[15, 17, 18]。Warthen等[19]对欧洲玉米螟O.nubilalis性信息素及其氟取代类似物的结构活性关系的研究也发现:为获得最佳受体配合和最佳引诱作用,分子双键上质子的静电势值必须在特定的范围内。这说明双键在维持性信息素的生物活性中有着不可忽视的作用。
1.3 极性基团修饰极性基团的修饰是指对昆虫性信息素上醛、酮、醇和酸等极性基团进行氟原子或含氟基团的取代。包括极性基团上氢原子取代和整个极性基团的取代。
化合物(Z)-11-十六碳烯醛和(Z)-9-十四碳烯醛(质量比15∶1)是烟蚜夜蛾Heliothis virescens性信息素的主要组分,Prestwich等[20]分别合成了这两种组分的酰基氟化类似物,但发现两种化合物在空气和无水有机溶剂(1 mg/mL)中的稳定性均下降,实际应用意义不大。Dickens等[21]研究了棉铃象甲Anthonomus grandis性信息素 (Z)-3,3-二甲基环己烷-Δ1-α-乙醛和(E)-3,3-二甲基环己烷-Δ1-α-乙醛的极性基团单氟取代物——(Z)-3,3-二甲基环己烷-Δ1-α-乙酰氟和(E)-3,3-二甲基环己烷-Δ1-α-乙酰氟(图式6),但发现两种酰基氟衍生物的EAG响应值也远远低于相应的天然性信息素。
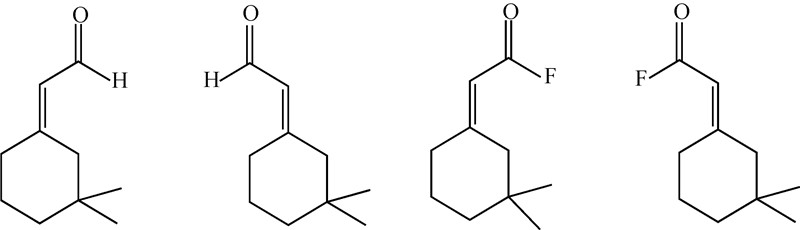 | 图 6 (Z)-3,3-二甲基环己烷-Δ1-α-乙醛、(E)-3,3-二甲基环己烷-Δ1-α-乙醛及其含氟类似物 Fig. 6 (Z)-3,3-dimethylcyclohexane-Δ1-α-acetaldehyde, (E)-3,3-dimethylcyclohexane-Δ1-α-acetaldehyde and their corresponding fluorinated analogues |
Riba等[22]用三氟甲基酮基团取代欧洲玉米螟O. nubilalis性信息素中主要成分——(Z)-十四碳烯-1-醇乙酸酯的极性基团,合成了其三氟甲基酮类似物(图式7)。该类似物的EAG响应值仅为母体(Z)-11-十四碳烯-1-醇乙酸酯的34.7%,生物活性大大降低。触角酯酶活性研究发现,该类似物对触角酯酶的抑制活性随着其浓度升高呈现直线上升趋势,IC50=70 nmol/L。将其与天然性信息素混合使用时,会降低天然信息素的EAG响应值;风洞试验中,当三氟甲基酮类似物与天然性信息素按质量比大于1∶10混用时,会使雄性欧洲玉米螟飞行距离和时间显著增加(从184.8 cm、4.4 s增加到598.2 cm、14.9 s),说明该类似物对天然性信息素组分有拮抗作用。(Z)-11-十六碳烯-1-醇乙酸酯是甘蓝夜蛾Mamestra brassicae性信息素主要组分之一,Renou等[23]合成了该组分的三氟甲基酮类似物——(Z)-11-十六碳烯三氟甲基酮(图式8),虽然该类似物在结构上与天然组分接近,但其生物活性不仅大为降低,而且当其与天然性信息素组分混用时,还能抑制天然性信息素的活性。
 | 图 7 (Z)-11-十四碳烯-1-醇乙酸酯及其三氟甲基酮类似物 Fig. 7 (Z)-11-tetradecen-1-ol acetate and trifluoromethyl ketone analogue |
 | 图 8 (Z)-11-十六碳烯-1-醇乙酸酯及其三氟甲基酮类似物 Fig. 8 (Z)-11-hexadecene-l-ol acetate and trifluoromethyl ketone analogue |
除欧洲玉米螟O.nubilalis和甘蓝夜蛾M. brassicae外,鳞翅目昆虫如海灰翅蛾S. mauritia[24, 25, 26]、茎叶蛾Sesamia calamistis[27, 28, 29]、玉米螟Pyrausta nubilalis[22,30]、多音天蚕蛾Antheraea polyphemus[31, 32]、梨豹蠹蛾Zeuzera pyrina[33] 和苹果蠹蛾C. pomonella[34]中性信息素的三氟甲基酮类似物均被证明能够降低性信息素的EAG响应值,从而抑制性信息素的引诱活性。
对天然性信息素分子中极性基团的修饰主要表现出对天然组分的拮抗作用。此前,人们已经发现,三氟甲基酮化合物对丝氨酸酯酶和蛋白酶有强烈的抑制作用,如乙酰胆碱酯酶和胰凝乳蛋白酶等[35, 36]。而酯酶和蛋白酶在昆虫生物通讯系统中起着至关重要的作用,性信息素的钝化和代谢都离不开雄性昆虫触角中酶的作用,如酯酶、脱氢酶、醛脱氢酶等。将三氟甲基酮基团引入性信息素分子中取代极性基团,依然能够不可逆地抑制昆虫嗅觉组织中相关酶的活性[37, 38, 39, 40],使天然性信息素不能被正常代谢,雄性昆虫触角不能持续接受挥发的性信息素,最终导致雌雄虫之间交配受阻。三氟甲基酮化合物的这种特殊属性使得三氟甲基酮类性信息素类似物也受到越来越多的关注[41, 42, 43, 44, 45]。
2 应用前景天然性信息素存在稳定性不高、易产生抗性和生产成本高等问题,而氟化性信息素类似物则具有活性多样、稳定高等特点,其在害虫预测预报和防治等方面均有良好的应用前景。
2.1 害虫预测预报害虫预测预报是害虫综合治理的必要前提,只有准确和及时地预测预报出害虫的危害,才能正确地拟定综合防治计划和措施,经济有效地控制害虫发生的数量。用于害虫监测的引诱剂必须满足高活性、释放率适当等条件,而引诱剂的化学结构不一定要与天然性信息素严格一致。一般而言,天然性信息素在田间条件下并不稳定,在空气中可迅速氧化,致使生物活性明显降低[10];而一些氟取代的化合物,一方面拥有与天然组分类似的生物活性,另一方面在田间条件下的稳定性高于天然性信息素,这些化合物可替代天然性信息素在害虫预测预报中广泛应用。如,苹果蠹蛾C. pomonella性信息素组分之一十二碳烯醇的9,10位二氟取代物活性与母体相似,但在环境中的稳定性更好[15]。
2.2 害虫防治采用昆虫性信息素防治害虫的技术主要有两种:大量诱捕法和干扰交配法(即迷向法)。前者的防治原理是减少雄蛾的群体数量,降低交配几率,减少田间有效卵量;而后者则是干扰害虫正常交配活动,使田间种群交配率大幅下降,种群繁殖受到抑制而达到防治目的。
昆虫性信息素经过不同的氟取代修饰可产生多种活性效果,在害虫防治中有着巨大的潜能。一些性信息素的氟衍生物本身没有或有较低的生物活性,但与天然性信息素以一定比例混用时却能够提高性信息素的引诱活性[11],可作为增效剂添加到天然组分中使用;一些与天然组分有类似的活性,田间条件下的稳定性更好的氟化衍生物有替代天然性信息素的潜力[46],可作为引诱剂使用;三氟甲基酮取代的信息素类似物对天然性信息素有拮抗作用,可对雄虫起到迷向作用,干扰雌虫和雄虫的交配,减少后代数目。
3 结语与展望与传统杀虫剂相比,昆虫性信息素的优势在于对环境更加友好(无毒,低量高效,专一),在天然性信息素分子中引入氟原子,能够通过改变天然性信息素的化学、生物和物理性质而产生新的活性效果。大量的试验结果表明,氟原子取代的性信息素衍生物对母体性信息素表现出引诱、增效、激活、拮抗等多样的生物活性。因此,氟化性信息素在害虫的综合防治方面具有良好的应用前景,尤其是当性信息素的使用存在降解速度快、稳定性差和成本高等问题时。尽管氟代的性信息素对母体的增效和拮抗作用使得它们的应用前景更加广阔,但并没有明确的作用机制能解释这些作用结果。受体细胞水平上的气味分子之间相互的增效和拮抗作用机制除了能够帮助我们更好地了解氟化性信息素的作用模式,还能为合理设计更有效、稳定的活性化合物奠定基础。另外,由于嗅觉感受器上的差异,即使昆虫同属一个目,对于引入相同或相似模式氟原子化合物的反应也不同,因此氟化性信息素的生物活性具有随机性。其生物活性与氟原子取代的个数、位置以及与昆虫种类的关系也有待进一步的研究。因此,需要更多关于氟取代性信息素的结构与活性关系的研究结果来进一步证明氟化性信息素类似物的有效性。
| [1] | Butenandt A, Beckmann R, Stamm D, et al. Uber den sexual-lockstoff des seidenspinners bombyx mori-reindarstellung und konstitution[J]. Z Fur Naturfors Part B:Chemie Bioche Biopghy Biol Und Verwa Gebi, 1959, 14(4): 283-284. |
| [2] | Wright R H. Finding metarchons for pest control[J]. Nature, 1965, 207(4992): 103-104. |
| [3] | Beroza M. Nonpersistent inhibitor of the gypsy moth sex attractant in extracts of the insect[J]. J Econ Entomol, 1967, 60(3): 875-876. |
| [4] | Roelofs W L, Comeau A, Selle R. Sex pheromone of the oriental fruit moth[J]. Nature, 1969, 224(5220): 723. |
| [5] | Roelofs W L, Comeau A. Sex pheromone perception: Synergists and inhibitors for the red-banded leaf roller attractant[J]. J Insect Physiol, 1971, 17(3): 435-448. |
| [6] | Mitchell E R, Jacobson M, Baumhover A H. Heliothis spp.: Disruption of pheromonal communication with (Z)-9-tetra-decen-1-ol formate[J]. Environ Entomol, 1975, 4: 577-579. |
| [7] | 阚炜, 张钟宁, 杨新玲, 等. [反]-β-法尼烯与氟取代物分子结构叠合差异分析[J]. 昆虫学报, 2002, 45(6): 844-846. Kan Wei, Zhang Zhongning, Yang Xinling, et al. A preliminary analysis of structural differences between [E]-β-farnesene and its fluorine-containing derivatives[J]. Acta Entomologica Sinica, 2002, 45(6): 844-846. (in Chinese) |
| [8] | 阚炜, 张钟宁, 杨新玲, 等. 棉铃虫性信息素与其单氟取代物分子叠合及生物活性研究[J]. 科学通报, 2005, 50(20): 2203-2207. Kan Wei, Zhang Zhongning, Yang Xinling, et al. An analysis of structure fitting and bioactivity between sex pheromone of cotton bollworm, Helicoverpa armigera (Hübner) and its fluorinated analogs[J]. Chin Sci Bull, 2005, 50(22): 2587-2591. |
| [9] | Wu Wenqi, Bengtsson M, Hansson B S, et al. Electro-physiological and behavioral responses of turnip moth males, Agrotis segetum to fluorinated pheromone analogs[J]. J Chem Ecol, 1993, 19(1): 143-157. |
| [10] | Renou M, Guerrero A. Insect parapheromones in olfaction research and semiochemical-based pest control strategies[J]. Annu Rev Entomol, 2000, 45: 605-630. |
| [11] | Bengtsson M, Rauscher S, Arn H, et al. Fluorine-substituted pheromone components affect the behavior of the grape berry moth[J]. Experientia, 1990, 46(11-12): 1211-1213. |
| [12] | Prestwich G D, Sun Weichuan, Mayer M S, et al. Perfluorinated moth pheromones[J]. J Chem Ecol, 1990, 16(6): 1761-1778. |
| [13] | Pesenti C, Viani F. The influence of fluorinated molecules (semiochemicals and enzyme substrate analogues) on the insect communication system[J]. Chembiochem, 2004, 5(5): 590-613. |
| [14] | Schlosser M. Introduction of fluorine into organic molecules: why and how[J]. Tetrahedron, 1978, 34(1): 3-17. |
| [15] | Tellier F, Sauvêtre R, Normant J F. Synthèse de fluoro-codlemones[J]. J Organomet Chem, 1989, 364(1-2): 17-28. |
| [16] | Camps F, Coll J, Fabriàs G, et al. Fluorinated analogs of insect sex pheromones[J]. Experientia, 1984, 40(9): 933-934. |
| [17] | Fujiwara M, Ichikawa J, Okauchi T, et al. Vinylic C-F bond activation with low-valent zirconocene: the generation and cross-coupling reactions of 1-fluorovinylzirconocene[J]. Tetrah Lett, 1999, 40(40): 7261-7265. |
| [18] | Hunter L. The C—F bond as a conformational tool in organic and biological chemistry[J]. Beilstein J Org Chem, 2010, 6(38), doi:10.3762/bjoc.6.38. |
| [19] | Warthen J D, Klun J A, Schwarz M, et al. Structure-activity relationship observations for European corn borer moth pheromone and fluoro analogs via computer molecular modeling[J]. J Chem Ecol, 1995, 21(12): 1921-1930. |
| [20] | Prestwich G D, Carvalho J F, Ding Y S, et al. Acyl fluorides as reactive mimics of aldehyde pheromones: hyperactivation and aphrodisiac in Heliothis virescens[J]. Experientia, 1986, 42(8): 964-966. |
| [21] | Dickens J C, Prestwich G D, Sun Weichuan. Behavioral and neurosensory responses of the boll weevil, Anthonomus grandis Boh. (Coleoptera: Curculionidae), to fluorinated analogs of aldehyde components of its pheromone[J]. J Chem Ecol, 1991, 17(6): 1007-1020. |
| [22] | Riba M, Sans A, Solé J, et al. Antagonism of pheromone response of Ostrinia nubilalis males and implications on behavior in the laboratory and in the field[J]. J Agric Food Chem, 2005, 53(4): 1158-1165. |
| [23] | Renou M, Berthier A, Guerrero A. Disruption of responses to pheromone by (Z)-11-hexadecenyl trifluoromethyl ketone, an analogue of the pheromone, in the cabbage armyworm Mamestra brassicae[J]. Pest Manag Sci, 2002, 58(8): 839-844. |
| [24] | Abdel-Aal Y A I, Hammock B D. Apparent multiple catalytic sites involved in the ester hydrolysis of juvenile hormones by the hemolymph and by an affinity-purified esterase from Manduca sexta Johannson (Lepidoptera: Sphingidae)[J]. Arch Biochem Biophys, 1985, 243(1): 206-219. |
| [25] | Roe R M, Linderman R J, Lonikar M, et al. Rational design and synthesis of polarized ketones as inhibitors of juvenile hormone esterase: importance of juvenile hormone mimicry[J]. J Agric Food Chem, 1990, 38(5): 1274-1278. |
| [26] | Olmstead M M, Musker W K, Hammock B D. Structure of the hydrate form of a β-thiotrifluoromethyl ketone, a potent esterase inhibitor[J]. Acta Cryst C, 1987, 43(9): 1726-1728. |
| [27] | Bau J, Martínez D, Renou M, et al. Pheromone-triggered orientation flight of male moths can be disrupted by trifluoromethyl ketones[J]. Chem Senses, 1999, 24(5): 473-480. |
| [28] | Renou M, Lucas P, Malo E, et al. Effects of trifluoromethyl ketones and related compounds on the EAG and behavioural responses to pheromones in male moths[J]. Chem Senses, 1997, 22(4): 407-416. |
| [29] | Riba M, Sans A, Bau P, et al. Pheromone response inhibitors of the corn stalk borer Sesamia nonagrioides. Biological evaluation and toxicology[J]. J Chem Ecol, 2001, 27(9): 1879-1897. |
| [30] | Klun J A, Schwarz M, Uebel E G. European corn borer: pheromonal catabolism and behavioral response to sex pheromone[J]. J Chem Ecol, 1991, 17(2): 317-334. |
| [31] | Pophof B. Inhibitors of sensillar esterase reversibly block the responses of moth pheromone receptor cells[J]. J Compa Phys A, 1998, 183(2): 153-164. |
| [32] | Pophof B, Gebauer T, Ziegelberger G. Decyl-thio-trifluoropropanone, a competitive inhibitor of moth pheromone receptors[J]. J Compa Phys A, 2000, 186(3): 315-323. |
| [33] | Muåoz L, Bosch M P, Batllori L, et al. Synthesis of allylic trifluoromethyl ketones and their activity as inhibitors of the sex pheromone of the leopard moth, Zeuzera pyrina L. (Lepidoptera: Cossidae)[J]. Pest Manag Sci, 2011, 67(8): 956-964. |
| [34] | Sans A, Gago R, Mingot A, et al. Electrophilic derivatives antagonise pheromone attraction in Cydia pomonella[J]. Pest Manag Sci, 2013, 69(11): 1280-1290. |
| [35] | Roe R M, Anspaugh D D, Venkatesh K, et al. A novel geminal diol as a highly specific and stable in vivo inhibitor of insect juvenile hormone esterase[J]. Arch Insect Biochem Phys, 1997, 36(3): 165-179. |
| [36] | Rosell G, Herrero S, Guerrero A. New trifluoromethyl ketones as potent inhibitors of esterases: 19F NMR spectroscopy of transition state analog complexes and structure-activity relationships[J]. Biochem Bioph Res Co, 1996, 226(1): 287-292. |
| [37] | Durán I, Parrilla A, Feixas J, et al. Inhibition of antennal esterases of the Egyptian armyworm Spodoptera littoralis by trifluoromethyl ketones[J]. Bioorg Med Chem Lett, 1993, 3(12): 2593-2598. |
| [38] | Vogt R G, Riddiford L M, Prestwich G D. Kinetic properties of a sex pheromone-degrading enzyme: the sensillar esterase of Antheraea polyphemus[J]. Proc Natl Acad Sci USA, 1985, 82(24): 8827-8831. |
| [39] | Parrilla A, Guerrero A. Trifluoromethyl ketones as inhibitors of the processionary moth sex pheromone[J]. Chem Senses, 1994, 19(1): 1-10. |
| [40] | Prestwich G D, Streinz L. Haloacetate analogs of pheromones: Effects on catabolism and electrophysiology in Plutella xylostella[J]. J Chem Ecol, 1988, 14(3): 1003-1021. |
| [41] | Ding Y S, Prestwich G D. Chemical studies of proteins that degrade pheromones[J]. J Chem Ecol, 1988, 14(11): 2033-2046. |
| [42] | Plettner E. Insect pheromone olfaction: new targets for the design of species-selective pest control agents[J]. Curr Med Chem, 2002, 9(10): 1075-1085. |
| [43] | Coracini M, Bengtsson M, Cichon L, et al. Codling moth males do not discriminate between pheromone and a pheromone/antagonist blend during upwind flight[J]. Naturwissenschaften, 2003, 90(9): 419-423. |
| [44] | Rayo J, Muåoz L, Rosell G, et al. Reactivity versus steric effects in fluorinated ketones as esterase inhibitors: a quantum mechanical and molecular dynamics study[J]. J Mol Model, 2010, 16(11): 1753-1764. |
| [45] | Luis C P P, Guerrero A, Malo E A. Inhibition of electrophysiological response to the pheromone of the fall armyworm, Spodoptera frugiperda[J]. J Pestic Sci, 2010, 35(1): 23-26. |
| [46] | Klun J A, Schwarz M, Wakabayashi N, et al. Moth responses to selectively fluorinated sex pheromone analogs[J]. J Chem Ecol, 1994, 20(10): 2705-2719. |
 2015, Vol. 17
2015, Vol. 17


