2. 西南大学 农药研究所, 重庆 400716
2. Institute of Pesticide, Southwest University, Chongqing 400716, China
朱砂叶螨Tetranychus cinnabarinus是一种重要的杂食性害螨,广泛分布于世界温带地区及温室,严重危害豇豆、茄子和辣椒等100余种作物[1, 2, 3]。由于化学杀螨剂的长期不合理使用,致使环境污染和害螨抗性问题日益严重[4, 5]。因此,寻找新型靶标、研制和开发新型高效的杀螨剂势在必行。
东莨菪内酯(scopoletin)是一种香豆素类化合物,其化学名称为7-羟基-6-甲氧基香豆素,结构式见Scheme 1,存在于多个科的11万余种植物中[6, 7]。
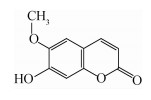 | Scheme 1 |
东莨菪内酯具有良好的抗肿瘤、降血压血脂和解痉等多种药理活性,同时还具有良好的杀虫、抗菌和化感作用等农用生物活性[8, 9, 10, 11, 12]。研究表明,东莨菪内酯对朱砂叶螨Ca2+-ATP酶具有显著的抑制作用,Ca2+-ATP酶可能是其主要作用靶标之一[13, 14]。此外,东莨菪内酯对害螨还具有触杀、内吸、杀卵和抑制产卵等多种作用方式,并且对环境安全友好,具有很好的开发潜力[15, 16];但与化学农药相比,其作用相对缓慢,添加增效助剂可能是一种简便有效的解决途径[17]。本研究探讨了Ca2+与东莨菪内酯联用对朱砂叶螨的杀螨毒力,以及对螨体Ca2+-ATP酶活性的影响,以期为东莨菪内酯的进一步开发利用提供参考。 1 材料与方法 1.1 供试材料
朱砂叶螨Tetranychus cinnabarinus采自重庆市北碚区田间豇豆苗,于智能人工气候室内(26 ℃±1 ℃、RH 60%~80%、光周期14L∶10D)用蛭石盆栽豇豆苗饲养13年,获得未接触任何农药的敏感品系试虫。95%东莨菪内酯(scopoletin)原药,为本实验室从7月份采集的黄花蒿茎叶中分离纯化所得[13];氯化钙购自成都市科龙化工试剂厂;Ca2+-ATP 酶试剂盒(南京建成生物科技有限公司)。 1.2 毒力测定
取适量东莨菪内酯原药,用5%的丙酮溶解,再用0.1%的吐温-80水溶液稀释成2.5、1.25、0.625、0.31和0.16 mg/mL,分别加入供试CaCl2,并使其浓度达 0.1 mmol/L。采用玻片浸渍法[18],分别于处理后12、24、36和48 h测定其对朱砂叶螨的触杀毒力;以在0.1%的吐温-80水溶液中加入5%的丙酮为对照。按公式(1)计算校正死亡率。
| 校正死亡率/%=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)×100 | (1) |
将供试药液及对照溶液均匀喷洒于豇豆苗上,喂饲朱砂叶螨24 h,挑取存活雌成螨测定Ca2+-ATP酶活性,每处理200头。用预冷的重蒸水冲洗朱砂叶螨,吸干水分后分别置于预冷的组织匀浆器中,加入2.0 mL 0.05 mol/L、 pH 7.0的Tris-HCl缓冲液进行冰浴匀浆。先用移液枪吸取缓冲液1.0 mL于冰水浴中充分匀浆,将匀浆液全部转入1.5 mL塑料离心管中,再用另外1.0 mL缓冲液分3次冲洗匀浆器,将冲洗液转入离心管,混匀,于0~4 ℃、4 000 r/min条件下离心15 min,上清液即为酶提取液。
Ca2+-ATP 酶活性测定参照Ca2+-ATP 酶试剂盒的方法,测定 636 nm波长处吸光度值,以蒸馏水调零,重复3次。以每小时每毫克组织蛋白中的ATP酶分解ATP产生1 μmol无机磷的量为1个ATP酶活性单位。以对照组的酶活力为100%,计算处理组的相对酶活力。 1.4 离体酶液制备及Ca2+-ATP酶活性测定
采用未经药液处理的新鲜试螨,按1.3节方法制备酶液。取20 μL供试药液加入200 μL粗酶液中,置于37 ℃、100 r/min的恒温箱内保温20 min后,按1.3节的方法测定Ca2+-ATP酶的活性。 1.5 钙离子对离体Ca2+-ATP酶活性的影响测定
酶液制备同1.4节。取20 μL氯化钙水溶液加入200 μL粗酶液中,混合后Ca2+的终浓度分别为0.1、1和10 mmol/L,以蒸馏水为对照。混匀后将上述溶液置于37 ℃、100 r/min的恒温箱内保温20 min后,按1.3节的方法测定Ca2+-ATP酶的活性。 1.6 酶源蛋白质含量的测定
参照Bradford [19]的方法,采用考马斯亮蓝G-250法测定酶源蛋白质含量。 1.7 数据处理
采用SPSS V. 17.0软件进行统计分析,采用Duncan氏新复极差法进行方差分析,处理组和对照组间的差异由独立样本t检验(Independent-Samples t Test)分析。 2 结果与分析 2.1 Ca2+对东莨菪内酯杀螨活性的影响
由表 1可以看出:含Ca2+的东莨菪内酯对朱砂叶螨的LC50值明显小于东莨菪内酯单用时的LC50值,其中两者联用24和48 h的LC50值分别比东莨菪内酯单用时降低了20%和45%,表明Ca2+对东莨菪内酯的杀螨活性有增效作用。
|
|
表 1 不同浓度的东莨菪内酯以及含0.1 mmol/L Ca2+的东莨菪内酯对朱砂叶螨雌成螨的毒力 Table 1 Acaricidal toxicity of scopoletin alone or combined with 0.1 mmol/L Ca2+ against T.cinnabarinus female adults at different concentrations |
结果(图 1)表明:活体条件下,东莨菪内酯单用时,螨体内的Ca2+-ATP酶活性均显著低于对照组,并且其活性随东莨菪内酯浓度的增大而递减,酶活性为对照组的55.3%~93.3%。0.1 mmol/L的Ca2+和东莨菪内酯联用对螨体内Ca2+-ATP 酶活性也均表现为抑制作用,且随东莨菪内酯浓度的增加,其抑制作用增强,酶活性为对照组的50.6%~80.7%,且显著低于东莨菪内酯单用。
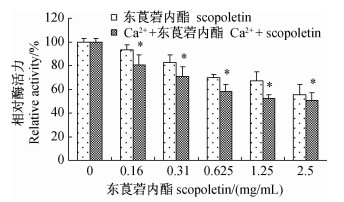 |
*表示差异显著(P<0.05)。Ca2+浓度为0.1 mmol/L。 *Represents significant difference(P<0.05). The concentration of Ca2+ is 0.1 mmol/L. 图 1 活体条件下不同药剂处理对朱砂叶螨Ca2+-ATP酶活性的影响 Fig. 1 Effect of different treatments of scopoletin and Ca2+ on Ca2+-ATPase activity of T.cinnabarinus in vivo |
由图 2可知:离体条件下,东莨菪内酯单用或与Ca2+联用对螨体内Ca2+-ATP 酶活性均表现为抑制作用。在质量浓度0.16 mg/mL下,东莨菪内酯单用比联用时酶活性高,分别为对照组的90%和50%,两者达显著差异(P<0.05);当东莨菪内酯质量浓度为0.31 mg/mL时,两者对酶的抑制作用相似且酶活性均达到最小值,约为对照的24%;随东莨菪内酯浓度继续增大,两者对酶的抑制作用趋于平稳,处理间差异显著(P<0.05)。
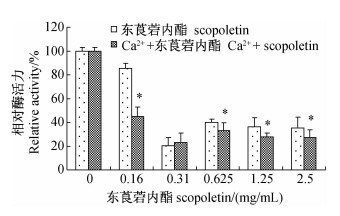 |
*表示差异显著(P<0.05)。Ca2+浓度为0.1 mmol/L。 * Represents significant difference(P<0.05). The concentration of Ca2+ is 0.1 mmol/L. 图 2 离体条件下不同药剂处理对朱砂叶螨Ca2+-ATP酶活性的影响 Fig. 2 Effect of different treatments of scopoletin and Ca2+ on Ca2+-ATPase activity of T.cinnabarinus in vitro |
不同浓度的Ca2+单独作用下,对离体Ca2+-ATP酶活性的影响不同。与对照组相比,Ca2+浓度为0.1和1 mmol/L时,对Ca2+-ATP酶的活性没有显著影响;当Ca2+浓度为10 mmol/L时,酶活性显著升高,达到对照的240%,表现为激活作用(图 3)。
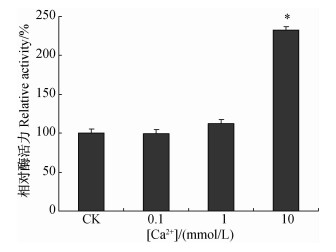 |
*表示差异显著(P<0.05)。 *Represents significant difference(P<0.05). 图 3 离体条件下不同浓度Ca2+对朱砂叶螨Ca2+-ATP酶活性的影响 Fig. 3 Effect of different concentrations of Ca2+on Ca2+-ATPase activity of T.cinnabarinus in vivo |
东莨菪内酯是一种植物源天然活性化合物,广泛存在于植物体内,具有杀虫、杀螨、抑菌等多种农用生物活性,并且具有作用方式和作用靶标多样性的特点,具有很好的开发利用价值[8, 9, 10, 11, 12]。本研究表明,添加适当浓度的氯化钙能显著提高东莨菪内酯对朱砂叶螨的触杀活性,增强其杀螨效果。同时,钙作为一种中微量元素,其合理使用还可以达到平衡施肥、促进植株健康生长的效果[20, 21]。
本研究结果表明,无论在活体还是离体条件下,Ca2+与东莨菪内酯联用均能显著增强对Ca2+-ATP酶的抑制作用;但与活体条件下相比,离体条件下药剂对酶活性的抑制作用更显著,这可能是由于离体条件下酶失去了生物膜系统的保护所致。Ca2+对东莨菪内酯具有显著的增效效应,其原因可能是由于Ca2+是一种金属阳离子,而昆虫体表带有一定的负电荷,因而更有利于药液吸附在体表,从而增加螨体接触药液的量[22];也可能是由于两者联用影响了螨体内的正常生理代谢,从而更有利于东莨菪内酯药效的发挥[23, 24]。另外,Ca2+-ATP酶是由Ca2+激活的ATP酶,通过水解ATP将Ca2+转运到细胞外,形成Ca2+浓度梯度[25]。通常细胞质中游离Ca2+浓度很低,为10-7~10-8mol/L,而细胞间液中Ca2+浓度较高,约5×10-3 mol/L,所以,胞外的Ca2+即使仅很少量涌入胞内,都会引起胞质游离Ca2+浓度显著变化,导致一系列生理反应发生[26, 27]。因此推测Ca2+对东莨菪内酯杀螨活性的增强作用,还有可能与螨体细胞内外Ca2+平衡遭到破坏有关。此外,Ca2+对东莨菪内酯杀螨活性的增强与对Ca2+-ATP酶活性抑制作用的影响趋势相一致,也从侧面验证了Ca2+-ATP酶是东莨菪内酯杀螨活性的重要作用靶标之一。但仅靠测定Ca2+-ATP酶活性的变化还难以全面阐述Ca2+对东莨菪内酯的增效作用机理,还需深入研究其准确的作用机理。
| [1] | Hazan A, Gerson U, Tahori A S. Spider mite webbing I. The production of webbing under various environmental conditions[J]. Acarologia, 1974, 16: 68-84. |
| [2] | Mansour F, Ravid U, Putievsky E. Studies of the effects of essential oils isolated from 14 species of Labiatae on the carmine spider mite, Tetranychus cinnabarinus[J]. Phytoparasitica, 1986, 14(2): 137-142. |
| [3] | Çakmak Ï, Ba pinar H, Madanlar N. Control of the carmine spider mite Tetranychus cinnabarinus Boisduval by the predatory mite Phytoseiulus persimilis (Athias-Henriot) in protected strawberries in Aydın, Turkey[J]. Turk J Agric For, 2005, 29: 259-265. |
| [4] | He Lin, Xue Chuanhua, Wang Jinjun, et al. Resistance selection and biochemical mechanism of resistance to two Acaricides in Tetranychus cinnabarinus (Boiduval)[J]. Pesticide Biochem Phys, 2009, 93(1): 47-52. |
| [5] | Jia Fulin, Chen Yijuan, Chen Jia, et al. Biological activity of extracts from 8 species of plants against Tetranychus cinnabarinus[J]. Chinese Agric Sci Bullet, 2011, 27(24): 286-291. |
| [6] | Rollinger J M, Hornick A, Langer T, et al. Acetylcholinesterase inhibitory activity of scopolin and scopoletin discovered by virtual screening of natural products[J]. J Med Chem, 2004, 47(25): 6248-6254. |
| [7] | Hornick A, Lieb A, Vo N P, et al. The coumarin scopoletin potentiates acetylcholine release from synaptosomes, amplifies hippocampal long-term potentiation and ameliorates anticholinergic- and age-impaired memory[J]. Neuroscience, 2011, 197: 280-292. |
| [8] | Happi E N, Tcho A T, Sirri J C, et al. Tirucallane triterpenoids from the stem bark of Araliopsis synopsis[J]. Phytochem Lett, 2012, 5(3): 423-426. |
| [9] | Manuele M G, Ferraro G, Barreiro A M L, et al. Comparative immunomodulatory effect of scopoletin on tumoral and normal lymphocytes[J]. Life Sci, 2006, 79(21): 2043-2048. |
| [10] | Leszczynski B, Tjallingii W F, Dixon A F G, et al. Effect of methoxyphenols on grain aphid feeding behaviour[J]. Entomol Experit Applic, 1995, 76(2): 157-162. |
| [11] | Taguchi G, Fujikawa S, Yazawa T, et al. Scopoletin uptake from culture medium and accumulation in the vacuoles after conversion to scopolin in 2,4-D-treated tobacco cells[J]. Plant Sci, 2000, 151(2): 153-161. |
| [12] | 侯秋莉, 杨振国, 丁伟, 等. 东茛菪内酯的生物活性研究进展[J]. 天然产物研究与开发, 2013, 25(10): 1461-1467. Hou Qiuli, Yang Zhenguo, Ding Wei,et al. Advances in studies on biological activities of scopoletin[J]. Natl Prod Res Develop, 2013, 25(10): 1461-1467. (in Chinese) |
| [13] | 张永强. 黄花蒿杀螨物质活性追踪及杀螨作用机理研究[D]. 重庆: 西南大学, 2008. Zhang Yongqiang. Study on acaricidal action mechanism andbio-duided isolation of bioactive substance from Artemisia annua L.[D]. Chongqing: Southwest University, 2008. (in Chinese) |
| [14] | Zhang Yongqiang, Ding Wei, Zhao Zhimo, et al. Studies on acaricidal bioactivities of Artemisia annua L. extracts against Tetranychus cinnabarinus Bois. (Acari: Tetranychidae)[J]. Agric Sci China, 2008, 7(5): 577-584. |
| [15] | 秦培元, 丁伟, 张永强, 等. 东莨菪内酯的纯度与其杀螨活性的相关性[J]. 农药, 2012, 51(2): 144-147. Qin Peiyuan, Ding Wei, Zhang Yongqiang,et al. The correlation research that scopoletin purity and acaricidal activity[J]. Agrochemicals, 2012, 51(2): 144-147. (in Chinese) |
| [16] | 雍小菊, 张永强, 丁伟. 东莨菪内酯对朱砂叶螨的驱避和产卵抑制活性[J]. 应用昆虫学报, 2012, 49(2): 422-427. Yong Xiaoju, Zhang Yongqiang, Ding Wei. Repellent and oviposition deterrent properties of scopoletin to Tetranychus cinnabarinus[J]. Chin J Appl Entomol, 2012, 49(2): 422-427. (in Chinese) |
| [17] | 张国生, 汪灿明, 郑瑞琴. 浅谈农药增效剂现状及应用前景[J]. 浙江化工, 2000, 31(4): 18. Zhang Guosheng, Wang Canming, Zheng Ruiqin. The application prospects and situation of pesticides synergic adjuvants[J]. Zhejiang Chem Indust, 2000, 31(4): 18. (in Chinese) |
| [18] | Anonymous. Plant production and protection 21, recommended methods for measurement of resistance to pesticide[Z]. Israel: FAO, 1980: 49-54. |
| [19] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities protein of utilizing the principle of protein-dye binding[J]. Analyt Biochem, 1976, 72(1-2): 248-254. |
| [20] | Ehret D L, Remann R E, Harvey B L, et al. Salinity-induced calcium deficiencies in wheat and barley[J]. Plant Soil, 1990, 128(2): 143-151. |
| [21] | Epstein E. How calcium enhances plant salt tolerance[J]. Science, 1998, 40(5371): 1906-1907. |
| [22] | 陈召亮, 韩志任, 马超, 等. 六种阳离子助剂对阿维菌素的增效作用[J]. 昆虫学报, 2007, 50(8): 801- 806. Chen Zhaoliang, Han Zhiren, Ma Chao, et al. Synergism of six cationic adjuvants to avermectin[J]. Acta Entomol Sinica, 2007, 50(8): 801-806. (in Chinese) |
| [23] | 高聪芬, 张兴, 冯俊涛. 杀虫剂增效作用研究进展[J]. 西北农业大学学报, 1996, 24(1): 88-92. Gao Congfen, Zhang Xing, Feng Juntao. A review on the synergism of insecticide[J]. Acta Univ Agric Boreali-occidentalis, 1996, 24(1): 88-92. (in Chinese) |
| [24] | 王肖娟, 谢慧琴. 杀虫剂增效作用及其作用机理研究进展[J]. 安徽农业科学, 2007, 35(13): 3902-3904. Wang Xiaojuan, Xie Huiqin. Research progress on the synergism of insecticide and its action mechanism[J]. J Anhui Agric Sci, 2007, 35(13): 3902-3904. (in Chinese) |
| [25] | Penniston J T, Enyedi A. Modulation of the plasma membrane Ca2+ pump[J]. J Membr Biol, 1998, 165(2): 101-109. |
| [26] | Brini M, Carafoli E. Calcium pumps in health and disease[J]. Physiol Rev, 2009, 89(4): 1341-1378. |
| [27] | Axelsen K B, Palmgren M G. Evolution of substrate specificities in the P-Type ATPase superfamily[J]. J Mol Evolut, 1998, 46(1): 84-101. |
 2015, Vol. 17
2015, Vol. 17


