2. 中国农业大学 理学院, 北京 100193;
3. 山东省泰安市农业科学院, 山东 泰安 271000
2. College of Science, China Agricultural University, Beijing 100193, China;
3. Tai'an Academy of Agricultural Sciences of Shandong Province, Tai'an 271000, Shandong Province, China
农药水乳剂(emulsion in water,EW)以水为分散介质,与乳油和微乳剂相比,大大减少了有机溶剂和乳化剂的用量,已成为当前农药主要的环保剂型之一[1,2]。水乳剂通常是在添加乳化剂和输入能量的条件下,将含农药的有机溶剂溶液(油相)以小液滴形式分散在互不相溶的水中(水相)形成的水包油(O/W)型乳状液。在实际加工中,既可以将水相加入油相中混匀(反相乳化法)[3],也可以将油相加入水相中混匀(直接乳化法)[4],而且乳化剂既可以添加在油相[5],也可以添加在水相[6]。然而,在配方组成相同的情况下,不同加工方法对水乳剂的形成与稳定性影响较大,也因此成为研究者关注的焦点[7]。齐武[8]研究了直接乳化法、反相乳化法和D相乳化法等加工方法对高效氯氟氰菊酯水乳剂液滴粒径的影响,结果表明:直接乳化法制备的水乳剂液滴粒径较大,反相乳化法和D相乳化法制备的液滴粒径相对较小,且D相乳化法制备的液滴粒径分布较窄。刘迎等[9]在研究不同乳化方法对30%毒死蜱·噻嗪酮水乳剂稳定性的影响时发现,乳化剂添加在油相时制备的水乳剂的粒径小于乳化剂添加在水相中制备的水乳剂。
Turbiscan Lab分散稳定性分析仪采用多重光散射技术,可对乳状液、悬浮液和泡沫等分散体系的稳定性进行评价和预测,具有不稀释试样(非破坏性)、在线实时监测、缩短产品研制周期等优点,已被广泛应用于食品、石油和化妆品等领域[10,11]。近年来,该项技术开始逐步应用于农药制剂加工中,与配方开发相结合,获得了理想的效果[12,13]。本研究组在加工30%异丙甲草胺水乳剂时发现:在配方组成相同的情况下,不同加工方法制备的水乳剂稳定性差别很大[14]。笔者通过Turbiscan Lab分散稳定性分析仪短期扫描图谱分析,以及测定所制备水乳剂液滴平均粒径和Zeta电位,研究了4种不同加工方法制备的异丙甲草胺水乳剂的稳定性,分析了影响水乳剂形成和稳定性的原因,以期为农药水乳剂稳定性的提高和配方开发提供一定的理论依据。
1 材料与方法 1.1 主要仪器与试剂85-1A型磁力搅拌器(巩义市予华仪器有限责任公司);Sartorius电子天平(德国赛多利斯,精度0.1 mg);BT -9300H型激光粒度仪(丹东市百特仪器有限公司);JS94H型微电泳仪(上海中晨数字技术设备有限公司);Turbiscan Lab分散稳定性分析仪(法国Formulation公司);DHG-9031A型电热恒温干燥箱(上海精宏实验设备有限公司)。
98.2%异丙甲草胺(metolachlor)原药,浅棕色油状液体,山东侨昌化学有限公司;乳化剂:SCP[三苯乙烯基苯酚聚氧乙烯醚磷酸酯三乙醇胺盐,结构式见Scheme 1,25.0 ℃±0.5 ℃时,cmc=0.08 g/L,γcmc=43.52 mN/m,威来惠南(中国)有限公司提供。水为去离子水。
|
Scheme 1. SCP |
室温(25 ℃)下,采用A、B、C和D 4种加工方法制备异丙甲草胺水乳剂,其中异丙甲草胺的质量分数为30%,乳化剂SCP为6%,其余用去离子水补足至100%。具体操作过程如下:
方法A:将异丙甲草胺原药与乳化剂SCP混合均匀,形成油相;在500 r/min磁力搅拌下,以2 mL/min 的速率将水相(去离子水)逐滴加入至油相中,再在1 500 r/min下继续搅拌30 min,即得试样A。
方法B:将去离子水与SCP混合均匀,形成水相;在500 r/min磁力搅拌下,以2 mL/min的速率将水相逐滴加入至油相(异丙甲草胺原药)中,再在1 500 r/min下继续搅拌30 min,即得试样B。
方法C:将去离子水与SCP混合均匀,形成水相;在500 r/min磁力搅拌下,以2 mL/min的速率将油相(异丙甲草胺原药)逐滴加入至水相中,再在1 500 r/min下继续搅拌30 min,即得试样C。
方法D:将异丙甲草胺原药与SCP混合均匀,形成油相;在500 r/min磁力搅拌下,以 2 mL/min 的速率将油相逐滴加入至水相(去离子水)中,再在1 500 r/min下继续搅拌30 min,即得试样D。
水乳剂制备完成后,利用Turbiscan Lab分散稳定性分析仪对试样进行扫描(8 h),同时测定各试样中液滴的平均粒径和Zeta电位。
1.3 Turbiscan Lab分散稳定性分散仪测定将新制备的水乳剂试样(约20 mL)置于测试瓶中,设定在25 ℃下每5 min 扫描一次,共扫描8 h。利用随机软件分析背散射光强度随时间的变化情况,获得液滴粒径大小的变化情况。
1.4 粒度测定在室温条件下,取新制备的水乳剂试样0.5 mL,加入到激光粒度仪的测量池中,搅拌均匀后测定平均粒径。重复测量3次,取其平均值。
1.5 Zeta电位测定在室温条件下,取新制备的水乳剂试样0.1 mL,加入到10 mL去离子水中,稀释混匀,在微电泳仪上测定Zeta电位。重复测量3次,取其平均值。
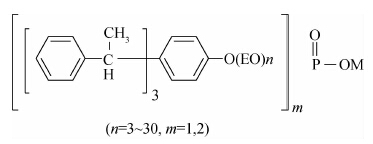
2 结果与分析 2.1 不同加工方法制备的水乳剂的Turbiscan Lab分散稳定性分散仪扫描结果Turbiscan Lab分散稳定性分散仪扫描结果(图 1)显示:在扫描时间(8 h)内,采用方法A制备的水乳剂试样各高度的背散射光强度随时间延长所降低的幅度较小;采用方法B制备的试样顶部及中下部的背散射光强度随时间延长均呈较大幅度下降;而采用方法C和D制备的试样顶部及中下部的背散射光强度随时间延长呈更加明显的下降趋势,但底部的背散射光强度随时间推移逐渐增强。说明采用方法C和D制备的水乳剂液滴粒径随时间延长而明显增加,且由于液滴向底部沉降而导致中部液滴浓度减少,于试样底部出现了沉淀,因而说明该水乳剂的稳定性较差。
 | 图 1 不同加工方法制备的异丙甲草胺水乳剂试样背散射光增量变化图谱 Fig. 1 The delta BS variation for pesticide emulsions prepared with different processing methods |
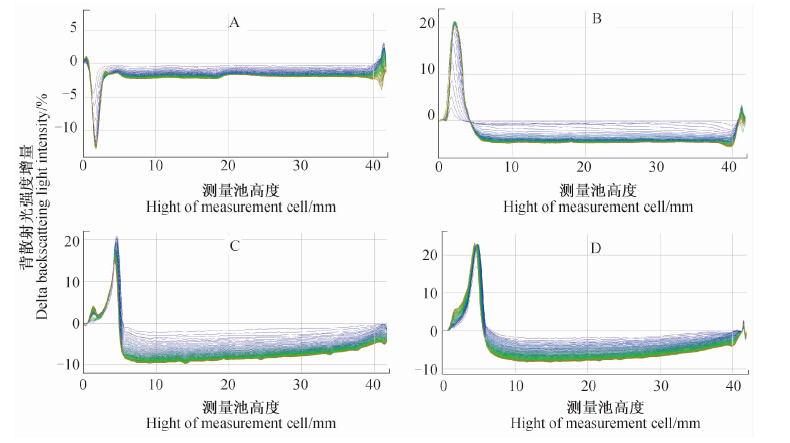
鉴于中部背散射光强度的变化能够反映试样中液滴粒径的变化情况,又进一步分析了试样瓶中部(10~30 mm)背散射光强度增量随时间变化的平均值,结果见图 2。
 | 图 2 不同加工方法(A~D)制备的异丙甲草胺水乳剂试样中部(10~30 mm)背散射光强度增量随时间的平均变化曲线 Fig. 2Curve of the mean delta BS variation in the middle part (height range 10-30 mm) of the pesticide emulsionsprepared with different processing methods (A-D) with the time |
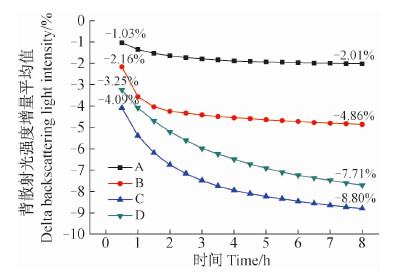
图 2显示,用方法A制备的水乳剂试样中部背散射光强度增量(Delta BS)随时间变化的平均值从-1.03%减少到-2.01%,用方法B制备的试样中部Delta BS平均值从-2.16%减少到-4.86%,而方法C和D制备的试样中部Delta BS平均值分别从-4.09%减少到-8.80%和从-3.25%减少到-7.71%。根据Turbiscan Lab分散稳定性分析仪测定原理,背散射光强度降低,则液滴粒径增大,液滴浓度减小,且背散射光强度降低越明显,液滴粒径增大和液滴浓度减小的幅度越明显[15]。
2.2 不同加工方法制备的水乳剂液滴平均粒径和Zeta电位结果(图 3和图 4)表明:不同加工方法制备的水乳剂液滴的平均粒径和Zeta电位不同,其中方法A制备的水乳剂液滴平均粒径最小,Zeta电位绝对值最大,其次是方法B和D,而方法C制备的水乳剂液滴的平均粒径最大,Zeta电位绝对值最小。Li等[16]在研究甲苯/乳化剂Tween-60/水形成的乳状液时也发现了相同的规律,将Tween-60分别加入甲苯或水中时,所形成的乳状液的平均粒径和稳定性不同,其中将Tween-60加入甲苯时所形成的乳状液的液滴平均粒径较小,且乳状液较稳定。
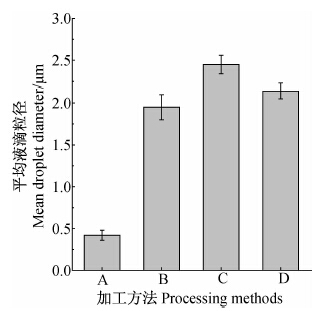 | 图 3 不同加工方法制备的异丙甲草胺水乳剂试样中液滴的平均粒径 Fig. 3The mean droplets diameters prepared with different processing methods |
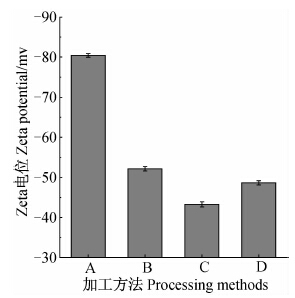 | 图 4 不同加工方法制备的异丙甲草胺水乳剂试样中液滴的Zeta电位 Fig. 4The Zeta potentials prepared with different processing methods |
图 5是不同加工方法制备的异丙甲草胺水乳剂试样在加速试验后的外观图。从图中可以看出,方法A制备的水乳剂外观均一;方法B制备的水乳剂存在轻微的浓度梯度,底部(约占试样体积的30%)浓度要高于中上部;而方法C和D制备的水乳剂分层严重,上部析水,底部有少许沉淀,相比之下,方法C制备的水乳剂稳定性最差。这与稳定性分析仪短期扫描图谱、平均粒径和Zeta电位测定结果一致。
 | 图 5 加速试验后不同加工方法制备的异丙甲草胺水乳剂试样的外观图 Fig. 5The appearance of the pesticide emulsions sample prepared with different processing methods after accelerated test |
综合Turbiscan Lab分散稳定性分析仪对新制备水乳剂的短期扫描结果、水乳剂液滴的平均粒径和Zeta电位测定结果、以及加速试验后水乳剂试样的外观图可以发现:由方法A制备的水乳剂的短期扫描图谱中背散射光强度随时间变化不大,液滴平均粒径最小,Zeta电位绝对值最大,外观均一,稳定性最好;方法B制备的水乳剂稳定性次之;方法C和D制备的水乳剂的短期扫描图谱发生了明显变化,顶部及中下部背散射光强度显著下降,液滴平均粒径均较大,Zeta电位绝对值较小,加速试验后外观不均一,上层析水,下层产生少量沉淀,其中方法C制备的水乳剂稳定性最差。表明采用不同加工方法制备同一配方的水乳剂时,液滴粒径大小和稳定性存在较大差异,其中以乳化剂添加在油相中的反相乳化法(方法A)制备的水乳剂稳定性最好。
水乳剂通常为O/W型乳状液,属于热力学不稳定体系,在加工和贮存过程中容易出现奥氏熟化、分层、析油等不稳定现象[17],而油水相添加顺序和乳化剂添加位置是影响乳状液形成与稳定的关键因素[18,19]。本研究中采用的4种加工方法均属于低能乳化法,可以分为两类:一类是按照油相、水相的添加顺序分为水相加入油相(反相乳化法)和油相加入水相(直接乳化法);另一类是按乳化剂添加位置分为乳化剂加入油相中和乳化剂加入水相中。
针对不同加工方法对水乳剂稳定性的影响可以作如下解释:
1)油水相添加顺序的影响。反相乳化法是将水相缓慢加入油相,最初形成W/O型乳状液,随着水相继续增加,体系转变成O/W型乳状液,相转变过程为油连续相(W/O微乳液)—层状液晶相—凝胶相(O/D乳液)—O/W乳液,在液晶相形成时油/水界面张力达到最小值,层状液晶增溶了大量的油和水,当层状液晶相向凝胶相转变时,增溶的油从液晶相中逐渐分离出来,由于凝胶相的高黏度和低界面张力阻碍了油滴的聚结,且随着水含量的增加可以诱导表面活性剂自发曲率发生变化,导致自发乳化的发生,从而形成颗粒十分细小、又很稳定的O/W型乳状液[20,21,22]。
2)乳化剂添加位置的影响。乳化剂分子能够在水相中快速形成胶束,而在油相中的胶束化能力较弱,从而加速了乳化剂分子在乳化发生之前从油相向油/水界面的扩散[9];相反,由于乳化剂分子在水相中去胶束化难度大,减缓了乳化剂分子由水相向油/水界面的扩散。此外,较大的分子扩散曲率也有助于乳化剂分子从油相中扩散到油/水界面[23,24]。乳化剂分子的迅速扩散将使其快速吸附在新形成的油/水界面上,从而降低在乳化过程中发生絮凝或聚结的可能性。因此,乳化剂添加在油相中制备的水乳剂更稳定。
本研究中涉及到油水相添加顺序和乳化剂添加位置两方面的因素,表明水乳剂中液滴大小和稳定性是由两方面综合效应共同决定的。其中加工方法A是乳化剂添加在油相中的反相乳化法,所制得的水乳剂液滴粒径最小,稳定性最好;方法B是乳化剂添加在水相中的反相乳化法,水乳剂稳定性次之;然后是方法D(乳化剂添加在油相中的直接乳化法)制备的水乳剂;而方法C是乳化剂添加在水相中的直接乳化法,制备的水乳剂稳定性最差。
Turbiscan Lab分散稳定性分析仪在其他行业的应用相对成熟,能够利用多个技术参数准确预测和评价分散体系特别是乳状液的稳定性。在水乳剂配方开发中,评价乳状液稳定性的传统方法需要肉眼观察、长期放置等,较为宏观粗放,导致产品研制周期长,成功率不高,本研究中发现,Turbiscan Lab分散稳定性分析仪短期扫描结果与加速试验结果一致,且通过该仪器可以进一步定量表征液滴粒径的变化,可以为水乳剂稳定性机理研究、不稳定因素分析以及快速准确筛选配方提供有效的手段。
| [1] | Mulqueen P. Recent advances in agrochemical formulation[J].Adv in Colloid and Interface Sci,2003,106(1-3):83-107. |
| [2] | 华乃震. 安全和环保型的农药水乳剂[J].现代农药,2003,2(5):27-31.Hua Naizhen. Pesticides EW formulation for safety and environmental protection[J]. Modern Agro,2003,2(5):27-31.(in Chinese) |
| [3] | 穆瑞珍,姚荣华,张丽清,等. 20%甲氰菊酯水乳剂的研制[J].农药,2011,50(10):724-725.Mu Ruizhen,Yao Ronghua,Zhang Liqing,et al. Study on fenpropathrin 20% emulsion in water [J]. Agrochemicals,2011,50(10):724-725.(in Chinese) |
| [4] | 倪素美,林桂榕,陈映. 480 g/L毒死蜱水乳剂的配方研究[J].世界农药,2009,31(3):43-45.Ni Sumei,Lin Guirong,Chen Ying. Study on the prescription of 480 g/L chlorpyrfos EW [J]. World Pestic,2009,31(3):43-45(in Chinese) |
| [5] | 许良忠,石营,高树坤. 25%甲氰·螺螨酯水乳剂的研制[J].青岛科技大学学报:自然科学版,2011,32(1):34-37. Xu Liangzhong,Shi Ying,Gao Shukun. Preparation of 25% fenpropathrin·spiropathrin emulsion in water [J]. Qingdao Univ Sci Technol:Nat Sci Ed,2011,32(1):34-37.(in Chinese) |
| [6] | 王志亭. 30%毒死蜱水乳剂的研制[J].河北化工,2007,30(3):24-25.Wang Zhiting.The research of 30% chlorpyrifos emulsion in water [J]. Hebei Chemist,2007,30(3):24-25.(in Chinese) |
| [7] | 张登科,魏方林,朱国念,等. 我国农药水乳剂的发展现状及稳定机理研究[J].现代农药,2007,6(5):1-4.Zhang Dengke,Wei Fanglin,Zhu Guonian,et al. Development status of pesticide emulsion oil in water in our country and research of stability mechanism [J]. Modern Agrochem,2007,6(5):1-4.(in Chinese) |
| [8] | 齐武. 拟除虫菊酯类农药水乳剂的研制与开发[D].南京:南京林业大学,2005.Qi Wu.The research and development on pyrethroids emulsion,oil in water [D].Nanjing:Nanjing Forestry University,2005.(in Chinese) |
| [9] | 刘迎,魏方林,王阳阳,等. 不同乳化方法对30%毒死蜱·噻嗪酮水乳剂稳定性的影响[J].农药,2011,50(10):726-729.Liu Ying,Wei Fanglin,Wang Yangyang,et al. Stability of chlorpyrifos-buprofezin 30% EW prepared in different emulsifying processes [J]. Agrochemicals,2011,50(10):726-729.(in Chinese) |
| [10] | Celia C,Trapasso E,Cosco D,et al. Turbiscan Lab® Expert analysis of the stability of ethosomes and ultradeformable liposomes containing a bilayerfluidizing agent[J]. Colloids Surf B,2009,72(1):155-160. |
| [11] | Kang Wanli,Xu Bin,Wang Yongjian,et al. Stability mechanism of W/O crude oil emulsion stabilized by polymer and surfactant[J]. Colloids Surf A,2011,384(1-3):555-560. |
| [12] | 郭勇飞,尹明明,陈福良. 光散射技术在4.5%高效氯氰菊酯水乳剂物理稳定性研究中的应用[J].农药学学报,2010,12(1):79-84.Guo Yongfei,Yin Mingming,Chen Fuliang. Application of light scattering technology for studying the physical stability of beta-cypermethrin 45 EW [J]. Chin J Pestic Sci,2010,12(1):79-84.(in Chinese) |
| [13] | Liu Ying,Wei Fanglin,Wang Yangyang,et al. Studies on the formation of bifenthrin oil-in-water nano-emulsions prepared with mixed surfactants[J]. Colloids Surf A,2011,389(1-3):90-96. |
| [14] | 冯建国,张小军,范腾飞,等. 体系pH值、乳化温度和电解质离子对异丙甲草胺水乳剂稳定性的影响[J].高等学校化学学报,2012,33(11):2521-2525.Feng Jianguo,Zhang Xiaojun,Fan Tengfei,et al. Effects of pH value,emulsification temperature and electrolytical ions on the stability of metolachlor emulsion in water [J]. Chem J Chinese Univ,2012,33(11):2521-2525.(in Chinese) |
| [15] | Buron H,Mengual O,Meunier G,et al. Optical characterization of concentrated dispersions:applications to laboratory analyses and on-line process monitoring and control[J]. Polym Int, 2004,53(9):1205-1209. |
| [16] | 李啸风,陈志荣,刘迪霞,等. 乳化剂初始位置对乳状液稳定性的影响[J].物理化学学报,2000,16(11):964-967.Li Xiaofeng,Chen Zhirong,Liu Dixia,et al. Effect of initial emulsifier locations on emulsion stability [J]. Acta Physico-Chimica Sinica,2000,16(11):964-967. |
| [17] | 李姝静,郭勇飞,李彦飞,等. 农药水乳剂稳定性机制研究进展[J].现代农药,2012,11(4):6-10.Li Shujing,Guo Yongfei,Li Yanfei,et al. Research progress on stability mechanism of pesticide emulsion in water [J]. Modern Agrochem,2012,11(4):6-10.(in Chinese) |
| [18] | 梅贞. 无机盐调控相转变温度法制备O/W纳米乳液研究[D].济南:山东大学,2011.Mei Zhen. Inorganic salts-tuned phase inversion temperature method for preparation of O/W nano-emulsions [D].Ji'nan:Shandong University,2011.(in Chinese) |
| [19] | Ševíková P,Kašpárková V,Vltavská P,et al. On the preparation and characterization of nanoemulsions produced by phase inversion emulsification[J]. Colloids Surf A,2012,410:130-135. |
| [20] | Liu Weirong,Sun Dejun,Li Caifu,et al. Formation and stability of paraffin oil-in-water nano-emulsions prepared by the emulsion inversion point method[J]. J Colloid Interface Sci,2006,303(2):557-563. |
| [21] | Sagitani H. Making homogeneous and fine droplet O/W emulsions using nonionic surfactants[J]. J Am Oil Chem Soc,1981,58(6):738-743. |
| [22] | Fernandez P,André V,Rieger J,et al. Nano-emulsion formation by emulsion phase inversion[J]. Colloids Surf A,2004,251(1-3):53-58. |
| [23] | Ostertag F,Weiss J,McClements D J. Low-energy formation of edible nanoemulsions:factors influencing droplet size produced by emulsion phase inversion[J]. J Colloid Interface Sci,2012,388(1):95-102. |
| [24] | Solè I,Maestro A,Pey C M,et al. Nano-emulsions preparation by low energy methods in an ionic surfactant system[J]. Colloids Surf A,2006,288(1-3):138-143. |
 2015, Vol. 17
2015, Vol. 17


