2. 成都特普科技发展有限公司, 成都 611731
2. Chengdu Tepu Technology Development Co., Ltd, Chengdu 611731, China
番茄立枯病的病原菌为立枯丝核菌Rhizoctonia solani,是一种危害严重的真菌,可侵染水稻、棉花、瓜果等多种农作物[1, 2, 3, 4]。目前防治这类病害的方法主要是加强苗期管理和使用化学药剂,但长期使用化学药剂会导致病原菌抗药性增加、农药残留和环境污染等问题。生物农药具有抗性风险低、环境相容性好等优点,因而研究开发可防治立枯病的生物农药尤为必要。枯草芽孢杆菌Bacillus subtilis是一类被广泛应用的生防细菌,可有效防治番茄立枯病[5, 6]。枯草芽孢杆菌主要通过营养和空间位点竞争、分泌抗菌或脂肽类物质、溶菌作用和诱导抗性等机制发挥生防功能[7, 8, 9]。本实验室前期分离到的枯草芽孢杆菌B99-2对番茄立枯病、水稻纹枯病、番茄叶霉病、黄连白绢病及韭菜根腐病等有较好的防治效果[10],生物防治应用潜力较大,有望开发为防治番茄立枯病的商业化微生物制剂。
尽可能长时期保持制剂中微生物的活性,在生物农药剂型加工中尤为重要,也是目前制约生物农药发展的关键因素。当前国内登记生产的枯草芽孢杆菌农药制剂主要是可湿性粉剂,存在粉尘易污染环境、长时间贮存不能保持药效等问题,微囊技术则可以较好地解决上述问题[11, 12, 13, 14]。目前国内外相关研究主要集中在肠道微生物的微囊化方面,虽然针对生防菌的微囊化也有少量研究[15],但尚未见将其应用于田间病害防治。本研究以麦芽糊精为壁材,以枯草芽孢杆菌发酵液(以下简称发酵液)为芯材,采用喷雾干燥法制备了枯草芽孢杆菌微囊剂(CJ),通过壁材与芯材配比的单因素试验和喷雾干燥条件筛选的正交试验,确定了该微囊剂的最佳制备工艺,并进行了田间药效试验,以期为产业化生产枯草芽孢杆菌微囊制剂提供科学依据。
1 材料与方法 1.1 试验材料供试菌株:枯草芽孢杆菌B99-2菌株,由华东理工大学农业与生物农药研究室分离和保存。壁材:麦芽糊精(西王食品股份有限公司生产,葡萄糖当量值DE=17.5);载体:水合沉淀法白炭黑(上海西盟化工有限公司)。田间试验对照药剂:50%福美双(thiram)可湿性粉剂(WP,四川国光农化股份有限公司)。
1.2 主要仪器设备DS-1500型喷雾干燥机(上海矩源自动化科技有限公司);恒温培养箱及电热恒温鼓风干燥箱(上海精宏实验设备有限公司);pH计(德国赛多利斯股份公司);三目生物显微镜(上海光学仪器厂);JSM-6360LV扫描电子显微镜(日本电子株式会社)。
1.3 菌种培养与菌体存活率测定将枯草芽孢杆菌B99-2接种于细菌基础培养基(LB)中,于30 ℃、200 r/min摇床培养12 h后,按5%接种量转接于发酵培养基(淀粉24 g,蛋白粉 30 g,CaCO3 4.8 g,K2HPO4 2 g,KH2PO4 0.6 g,糖蜜15 g,水1 L,pH 7.0)中,在30 ℃、200 r/min条件下培养,待发酵液芽孢率(将发酵液置于结晶紫染色后光学显微镜下镜检,视野内芽孢含量与总菌含量的比值为芽孢率)大于90%时停止发酵。
制剂的菌含量采用常规稀释涂布平板法测定,根据式(1)计算喷雾干燥后菌体的存活率[16]。
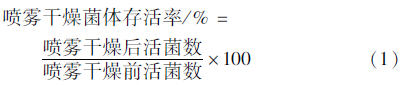
麦芽糊精的糊化:将麦芽糊精与水按体积比 2:1混合搅拌均匀,加热至60 ℃,持续2 min至糊化为金黄色,冷却备用。
喷雾干燥流程:将已糊化的麦芽糊精与一定比例的菌株发酵液混合,混合液置于磁力搅拌器中以500 r/min持续搅拌混合均匀,经蠕动泵均匀进样到喷雾干燥机,喷雾干燥后收集产物。喷雾干燥控制因素:进风温度、进样流量及喷雾压力。
1.5 喷雾干燥筛选试验 1.5.1 壁材和芯材比例筛选发酵液菌含量为 6×108 cfu/mL,喷雾干燥条件:进风温度165 ℃,进样流量650 mL/h,喷雾压力0.20 MPa。以麦芽糊精为壁材,以枯草芽孢杆菌发酵液为芯材,通过麦芽糊精与发酵液不同比例的单因素试验,确定壁材与芯材的最佳配比。以m(白炭黑):V(发酵液)=1:5 的混合液于相同条件下喷雾干燥制备的枯草芽孢杆菌可湿性粉剂为对照。试验重复3次,计算制剂菌含量和菌体存活率。
1.5.2 喷雾干燥条件正交试验发酵液菌含量为6×108 cfu/mL,壁材和芯材比为1.5.1节试验确定的最佳配比 ,对进风温度、进样流量及喷雾压力3个因素进行L9(33)正交试验(见表 1),以制剂菌含量和菌体存活率为评价指标,确定最佳喷雾干燥条件。
|
|
表 1 正交试验设计表 Table 1 Orthogonal experiment design |
取喷雾干燥正交试验最优条件制备的枯草芽孢杆菌微囊剂和对照可湿性粉剂,按照GB/T 19136—2003方法[17]进行(54±2) ℃、14 d热贮稳定性试验,每隔3 d计数1次,测定其菌含量变化情况;同时将该最优条件制备的微囊剂和对照组可湿性粉剂置于恒温箱,于(25±2) ℃条件下常温贮存360 d,每隔30 d计数,测定其菌含量变化情况。
1.5.4 扫描电子显微镜观察取喷雾干燥正交试验最优条件制备的微囊剂,通过扫描电子显微镜观察其表面结构。
1.5.5 制剂的质量指标测定参照文献方法[18, 19, 20]分别对枯草芽孢杆菌微囊剂的pH值、水分和细度进行测定。
1.6 制剂对番茄立枯病的田间防治试验试验在新疆生产建设兵团农十二师五一农场温室中进行。药剂用清水稀释,根据室内温室盆栽试验和预试验确定施药剂量,共设3个处理组和1个对照组(见表 2),每组重复4次,共16个小区,每小区约150株番茄,小区随机排列。于番茄苗期发病初期对茎叶进行喷雾施药,每隔7 d施药1次,共施药3次。整个试验期间温度维持在(24±3) ℃,相对湿度维持在60%±5%,无大风和冰雹等恶劣天气。
|
|
表 2 田间试验施药剂量 Table 2 Field experiment treatment |
于末次施药后7 d调查病株数,分别按式(2)和式(3)计算发病率和防效。

采用SPSS 19.0软件进行单一变量方差分析,并进行Duncan’s新复极差分析。
2 结果与分析 2.1 壁材与芯材最佳配比由表 3可见:白炭黑可湿性粉剂(A1)的菌体存活率显著低于麦芽糊精微囊剂(A2)的菌体存活率(P<0.05),表明在喷雾干燥过程中,微胶囊对枯草芽孢杆菌有显著的保护作用;菌体存活率随麦芽糊精浓度增加而升高,当m(麦芽糊精):V(发酵液)=1:1时,菌体存活率最高,为91.17%。对配方A2~A6所得微囊剂的菌体存活率进行方差 分析,结果显示:A5和A6的菌体存活率显著高于A1、A2和A3(P<0.05),但A5和A6之间无显著差异(P>0.05)。综上所述:喷雾干燥制备枯草芽孢杆菌微囊剂时,随壁材麦芽糊精比例的增加,菌体存活率提高,壁材与芯材的最佳配比为m(麦芽糊精):V(发酵液)=1:1。
|
|
表 3 壁材与芯材比例的筛选 Table 3 Optimum ratio of wall material and core material |
正交试验结果见表 4,极差和方差分析结果见表 5。极差分析可确定最佳试验方案,根据方差分析的P值可确定各因素对试验结果是否有显著影响。由表 4可见:当进风温度为125 ℃、进样流量750 mL/h、喷雾压力为0.20 MPa(B9)时,菌体存活率最高,为95.78%。极差和方差分析结果显示:影响喷雾干燥菌体存活率的因素依次为进风温度>喷雾压力>进样流量,其中,进风温度对菌体存活率有极显著性影响(P<0.001),进样流量和喷雾压力则对菌体存活率无显著影响(P>0.05)。综上所述,影响菌体存活率的主要因素是喷雾干燥时的进风温度,菌体存活率随进风温度的升高而降低,确定喷雾干燥制备枯草芽孢杆菌微囊的最优条件为:进风温度125 ℃,进样流量750 mL/h,喷雾压力0.20 MPa。
|
|
表 4 喷雾干燥优化试验结果 Table 4 Optimum conditions of spray drying |
|
|
表 5 正交试验的极差分析和方差分析 Table 5 Analysis of range and variance of orthogonal experiment |
所选定最优条件下制备的枯草芽孢杆菌微囊剂及对照可湿性粉剂的热贮加速和常温贮存试验结果见图 1。加速试验结果显示,14 d时微囊剂的菌体存活率为93.42%,显著高于对照可湿性粉剂的菌体存活率(57.55%);常温贮存试验结果显示,360 d时微囊剂的菌体存活率为91.36%,也显著高于对照可湿性粉剂(70.76%)。表明微囊剂的贮存稳定性显著高于可湿性粉剂。
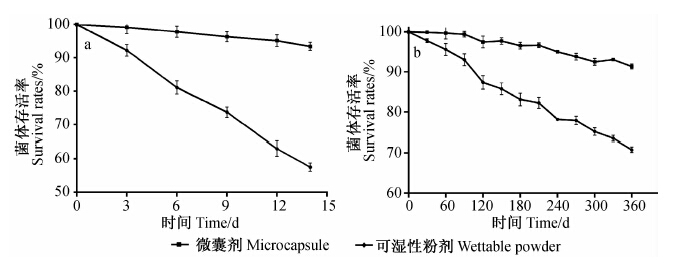 | 图 1 制剂的热贮(a)及常温贮存(b)稳定性 Fig. 1 Storage stability of microcapsules at high(a)and room temperature(b) |
扫描电子显微镜(图 2)观察发现:该微囊粒径在3~10 μm之间,近似球状,表面呈皱缩现象,整个视野中未见裸露的枯草芽孢杆菌菌体,表明菌体全部包裹在微胶囊内。喷雾干燥雾化不均匀可导致微囊粒径不均一,喷雾干燥过程中水分的快速蒸发则会导致微囊表面皱缩[21]。
 | 图 2 优选配方和制备工艺下枯草芽孢杆菌微囊的4 000倍扫描电镜图像 Fig. 2SEM image (4 000 times) of microcapsules under optimum process condition |
最优条件下所制备枯草芽孢杆菌微囊剂的性能指标测定结果显示:其菌含量为5.49×108 cfu/g,水分含量为4.47%,325目(孔径<45 μm)细度通过率为99%,热贮分解率6.57%,pH 6.80,制剂各项指标均符合国家相关标准[17, 18, 19]。
2.6 田间试验防治效果田间药效试验结果(表 6)显示:300 g/hm2剂量微囊剂处理组对番茄立枯病的防治效果最好,其与112.5 g/hm2福美双可湿性粉剂之间无显著差异(P>0.05),均能有效控制番茄立枯病的发生。因此,在番茄立枯病发病前期,采用有效成分为5×108 cfu/g的枯草芽孢杆菌微囊剂,在300 g/hm2(单位面积芽孢量为1.5×107 cfu/m2)用量下可有效控制番茄立枯病的发展及为害。
|
|
表 6 药剂对番茄立枯病的田间防治效果 Table 6 Efficacy of B.subtilis microcapsules compared to thiram wettable powder against R.solani damping-off of tomato under field conditions |
目前防治立枯病的微生物农药剂型主要是可湿性粉剂[5]和水分散粒剂[22],尚未见使用微囊剂制剂对番茄立枯病进行防治的报道。枯草芽孢杆菌的微囊化可有效保护菌体免受外界环境影响,延长制剂有效成分的保存期;此外,喷雾干燥将气味分子微囊化,有效解决了细菌制剂制备过程中的异味问题。
壁材在微囊化过程中起着决定性作用[23]。微囊剂制备中常用的壁材有阿拉伯胶、麦芽糊精及变性淀粉等[24]。通过预试验发现,麦芽糊精和阿拉伯胶都可用作枯草芽孢杆菌微囊剂的壁材。阿拉伯胶虽然有较好的乳化性和成膜性,但价格比较昂贵,不适宜工业化生产。Gharsallaoui等[25]研究发现,当麦芽糊精的葡萄糖当量值(DE)为18.5时,可以取代阿拉伯胶,从而降低生产成本。Raja等[26]的研究显示,麦芽糊精的DE值为10~20时,比较适合作为微囊的壁材。因此本研究采用DE值为17.5的麦芽糊精作为壁材。研究发现,菌体的存活率随麦芽糊精比例的增加而升高,这与Chávez等[27]用麦芽糊精作壁材低温喷雾干燥制备乳酸杆菌微囊剂的试验结果一致。但当麦芽糊精与发酵液比例大于11:10时,物料的粘度较大,不适宜喷雾干燥,所以不再继续增加麦芽糊精的比例。
喷雾干燥最主要的操作变量是进风温度[28]。通过正交试验得知,进风温度对菌体存活率影响最显著,菌体存活率随进风温度的升高而降低。Zakarian等[29]和Su等[30]的研究也表明,菌体活性随温度的升高而降低。
常温条件下,微生物农药的保质期应大于1年[31, 32],因此需尽量保持微生物有效成分的活性从而延长制剂的货架期。Muoz等[33]的研究表明,29 ℃下贮存4周后,微囊化的木霉分生孢子的存活率为60%,而未经处理的分生孢子全部死亡。本研究中通过常温贮存和热贮加速试验发现,枯草芽孢杆菌B99-2的微囊化可以有效保持菌体的活性,从而显著延长制剂的货架期。
本研究所制备枯草芽孢杆菌B99-2微囊剂在较低剂量[300 g/hm2(单位面积芽孢量为1.5×107 cfu/m2)]下对番茄立枯病表现出了较好的防效(72.76%),具有很好的应用潜力。段丽峰等[5]研究发现,剂量为2 g/m2时,3×108 cfu/g哈茨木霉可湿性粉剂对番茄立枯病的防效达76.41%;Sicuia等[34]的研究显示,当剂量为6.3×109 cfu/m2时,枯草芽孢杆菌98a海藻酸钠颗粒剂对番茄立枯病的防效为50%,本研究结果与文献报道类似。
综上所述,本研究通过正交试验确定了制备枯草芽孢杆菌微囊剂的最佳工艺为:壁材与芯材配比为 m(麦芽糊精):V(发酵液)=1:1,进风温度125 ℃,进样流量750 mL/h,喷雾压力0.20 MPa。该微囊制剂的贮存稳定性显著高于对照可湿性粉剂,各项指标均达到国家相关标准要求。所制备枯草芽孢杆菌微囊剂对番茄立枯病的防治效果稳定,对环境无污染,具有较好的产业化生产前景。
| [1] | 董海,王疏,刘晓舟,等. 7种杀菌剂对水稻立枯病的防治效果 [J]. 农药,2011,50(5): 380-381.Dong Hai,Wang Shu,Liu Xiaozhou,et al. Control efficiency of 7 fungicides to rice seedling blight [J]. Agrochemicals,2011,50(5): 380-381. (in Chinese) |
| [2] | 邓振山,张宝成,孙志宏,等. 新疆北疆棉田立枯丝核菌不同菌丝融合群致病力的研究 [J]. 植物保护,2006,32(4): 36-39.Deng Zhenshan,Zhang Baocheng,Sun Zhihong,et al. Study on the anastomotic group of Rhizoctonia solani isolated from cotton fields and their pathogenicity in Northern Xinjiang[J]. Plant Prot,2006,32(4): 36-39. (in Chinese) |
| [3] | 申屠旭萍,石一珺,俞晓平. 枸骨内生菌No.2的鉴定及其对黄瓜立枯病的生防作用[J]. 农药学学报,2010,12(2): 173-177.Shentu Xuping,Shi Yijun,Yu Xiaoping. Identification of an endophytic isolate from Llex cornuta and its antagonism against Rhizoctonia solani[J]. Chin J Pestic Sci,2010,12(2): 173-177.(in Chinese) |
| [4] | 伍恩宇,夏海波,于金凤. 茄科蔬菜立枯丝核菌的融合群鉴定[J]. 植物病理学报,2008,38(4): 429-432.Wu Enyu,Xia Haibo,Yu Jinfeng. Anastomosis group identification of Rhizoctonia solani isolated from solanaceae vegetable crops[J]. Acta Phytophy Sinica,2008,38(4): 429-432.(in Chinese) |
| [5] | 段丽峰,刘国辉,魏凌恺,等. 哈茨木霉菌3亿CFU/g可湿性粉剂对番茄立枯病和猝倒病防治效果 [J]. 农药科学与管理,2013,34(9): 60-62.Duan Lifeng,Liu Guohui,Wei Lingkai,et al. The control effect of 3×108CFU/g Trichodema harzianum WP for tomato rhizoctonia rot and damping off [J]. Pestic Sci Admin,2013,34(9): 60-62. (in Chinese) |
| [6] | 李栎,肖曼,高新征,等. 哈茨木霉TL-1促进植物生长及病害防治效果初报 [J]. 广东农业科学,2013,39(22): 91-94.Li Li,Xiao Man,Gao Xinzheng,et al. Primary study on growth-promoting and biological control effects of Trichoderma harzianum TL-1 [J]. Guangdong Agric Sci,2013,39(22): 91-94. (in Chinese) |
| [7] | Dunlap C A,Schisler D A,Price N P,et al. Cyclic lipopeptide profile of three Bacillus subtilis strains; antagonists of Fusarium head blight [J]. J Microbiol,2011,49(4): 603-609. |
| [8] | Niu Dongdong,Liu Hongxia,Jiang Chunhao,et al. The plant growth-promoting rhizobacterium Bacillus cereus AR156 induces systemic resistance in Arabidopsis thaliana by simultaneously activating salicylate- and jasmonate/ethylene-dependent signaling pathways [J]. Mol Plant Microbe Int,2011,24(5): 533-542. |
| [9] | León M,Yaryura P M,Montecchia M S,et al. Antifungal activity of selected indigenous Pseudomonas and Bacillus from the soybean rhizosphere [J/OL]. Int J Microbiol,2009(2009),Article ID: 572049,9 pages. |
| [10] | 王剑,王楠,高观朋,等. 200亿芽孢/g枯草芽孢杆菌可湿性粉剂的研制[J]. 农药,2010,49(7): 486-489.Wang Jian,Wang Nan,Gao Guanpeng,et al. Research on wetting powder of Bacillus subtilis with each gram 20 billion spores[J]. Agrochemicals,2010,49(7): 486-489. (in Chinese) |
| [11] | Anal A K,Stevens W F. Chitosan-alginate multilayer beads for controlled release of ampicillin [J]. Int J Pharm,2005,290(1-2): 45-54. |
| [12] | 李北兴,张大侠,张灿光,等. 微囊化技术研究进展及其在农药领域的应用[J]. 农药学学报,2014,16(5): 483-496.Li Beixing,Zhang Daxia,Zhang Canguang,et al. Research advances and application prospects of microencapsulation techniques in pesticide[J]. Chin J Pestic Sci,2014,16(5): 483-496.(in Chinese) |
| [13] | Anal A K,Singh H. Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery [J]. Trends Food Sci Technol,2007,18(5): 240-251. |
| [14] | Uludag H,De Vos P,Tresco P A. Technology of mammalian cell encapsulation [J]. Adv Drug Deliv Rev,2000,42(1-2): 29-64. |
| [15] | Muñoz-Celaya A L,Ortiz-García M,Vernon-Carter E J,et al. Spray-drying microencapsulation of Trichoderma harzianum conidias in carbohydrate polymers matrices [J]. Carbohyd Polym,2012,88(4): 1141-1148. |
| [16] | Yánez-Mendizábal V,Viñas I,Usall J,et al. Formulation development of the biocontrol agent Bacillus subtilis strain CPA-8 by spray-drying [J]. J Appl Microbiol,2012,112(5): 954-965. |
| [17] | GB/T 19136—2003,农药热贮稳定性测定方法[S]. 北京: 中国标准出版社,2003.GB/T 19136—2003,Testing method for the storage stability at elevated temperature of pesticides[S]. Beijing: China Standards Press,2003. (in Chinese) |
| [18] | GB/T 1601—1993,农药pH值的测定方法[S]. 北京: 中国标准出版社,1993.GB/T 1601—1993,Determination method of pH value for pesticides[S]. Beijing: China Standards Press,1993. (in Chinese) |
| [19] | GB/T 1600—2001,农药水分测定方法[S]. 北京: 中国标准出版社,2001.GB/T 1600—2001,Testing method of water in pesticides [S]. Beijing: China Standards Press,2001.(in Chinese) |
| [20] | GB/T 16150—1995,农药粉剂、可湿性粉剂细度测定方法[S]. 北京: 中国标准出版社,1995.GB/T 16150—1995,Seive test for dustable and wettable powders of pesticides [S]. Beijing: China Standards Press,1995. (in Chinese) |
| [21] | Saénz C,Tapia S,Chávez J,et al. Microencapsulation by spray drying of bioactive compounds from cactus pear (Opuntia ficus-indica)[J]. Food Chem,2009,114(2): 616-622. |
| [22] | 黄大野,姚经武,朱志刚,等. 枯草芽孢杆菌水分散粒剂防治黄瓜立枯病效果及对黄瓜的促生作用 [J]. 湖北农业科学,2014,53(18): 4327-4328.Huang Daye,Yao Jingwu,Zhu Zhigang,et al. Controlling effect of Bacillus subtilis water dispersible granule on cucumber rhizoctonia rot and its growth-promoting effect on cucumber[J]. Hubei Agric Sci,2014,53(18): 4327-4328.(in Chinese) |
| [23] | Jen A C,Wake M C,Mikos A G. Review: hydrogels for cell immobilization [J]. Biotechnol Bioeng,1996,50(4): 357-364. |
| [24] | Gouin S. Microencapsulation: industrial appraisal of existing technologies and trends [J]. Trends Food Sci Technol,2004,15(7-8): 330-347. |
| [25] | Gharsallaoui A,Roudaut G,Chambin O,et al. Applications of spray-drying in microencapsulation of food ingredients: an overview [J]. Food Res Int,2007,40(9): 1107-1121. |
| [26] | Raja K C M,Sankarikutty B,Sreekumar M,et al. Material characterization studies of maltodextrin samples for the use of wall material[J]. Starch-Strke,1989,41(8): 298-303. |
| [27] | Chávez B E,Ledeboer A M. Drying of probiotics: optimization of formulation and process to enhance storage survival [J]. Dry Technol: An Int J,2007,25(7-8): 1193-1201. |
| [28] | Liu Zhiqiang,Zhou Jianhong,Zeng Yunlong,et al. The enhancement and encapsulation of Agaricus bisporus flavor [J]. J Food Eng,2004,65(3): 391-396. |
| [29] | Zakarian J A,King C J. Volatiles loss in the nozzle zone during spray drying of emulsions [J]. Ind Eng Chem Process Des Dev,1982,21(1): 107-113. |
| [30] | Su Lieh Chi,Lin Chin Wen,Chen Mingju. Development of an Oriental-style dairy product coagulated by microcapsules containing probiotics and filtrates from fermented rice[J]. Int J Dairy Technol,2007,60(1): 49-54. |
| [31] | Abadias M,Trixidó N,Usall J,et al. Solute stresses affect growth patterns,endogenous water potentials and accumulation of sugars and sugar alcohols in cells of the biocontrol yeast Candida sake [J]. J Appl Microbiol,2000,89(6): 1009-1017. |
| [32] | Pedreschi F,Aguilera J M. Viability of dry Trichoderma harzianum spores under storage [J]. Bioprocess Eng,1997,17(3): 177-183. |
| [33] | Muñoz-Celaya A L,Ortiz-García M,Vernonr-Carter E J,et al. Spray-drying microencapsulation of Trichoderma harzianum conidias in carbohydrate polymers matrices[J]. Carbohydr Polym,2012,88(4): 1141-1148. |
| [34] | Sicuia O A,Constantinescu F,Dinu S. Bacterial biocontrol strains that reduce Rhizoctonia damping-off in tomato seedlings[J]. Sci Papers-Series B,Horticult,2012(56): 175-180. |
 2015, Vol. 17
2015, Vol. 17


