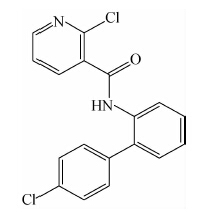
啶酰菌胺(boscalid)是一种新烟酰胺类广谱杀菌剂(结构式见Scheme 1),主要用于果树、蔬菜等白粉病、灰霉病及各种腐烂病、褐腐病和根腐病等的防治[1, 2, 3],可通过抑制线粒体电子传递链上琥珀酸辅酶Q还原酶,阻碍三羧酸循环,干扰细胞的分裂和生长,从而起到杀菌作用[4]。联合国粮农组织的研究报告表明,啶酰菌胺对胎儿、婴儿以及儿童具有潜在的风险[5]。
|
Scheme 1 |
目前,国内外对啶酰菌胺检测方法的研究报道较少,多采用液相色谱或液相色谱-质谱法,前处理步骤复杂,基质干扰较严重,不适合大批量样品的快速测定。简化前处理步骤,提高检测速度是目前啶酰菌胺检测所面临的主要问题。唐俊等[6]采用振荡提取-弗罗里硅土固相萃取柱净化法,测定了黄瓜中的啶酰菌胺;张玉婷等[7]采用振荡提取-弗罗里硅土层析柱净化法,测定了葡萄样品中的啶酰菌胺;陈莉等[8]采用液液萃取、固相萃取相结合的前处理方法,测定了草莓样品中的啶酰菌胺。这些方法均存在溶剂用量大、操作复杂、耗时长等不足。近年来,Lagunas-Allué等[9]比较了不同提取方法对葡萄中啶酰菌胺等杀菌剂的提取效果,结果表明,与微波萃取和固液萃取相比,QuEChERS方法操作最为简单,且回收率明显优于固液萃取,获得了较好的净化效果和回收率。
啶酰菌胺作为广谱性杀菌剂,在番茄、黄瓜、葡萄、大葱和油菜[10, 11, 12, 13, 14, 15]等蔬果上已有应用,但关于其在草莓上的残留及消解规律还未见研究报道。Angioni等[16]研究了啶酰菌胺在葡萄酒酿制工艺中的消解动态,发现葡萄残渣中啶酰菌胺的残留浓度较高,而葡萄酒中却几乎无啶酰菌胺残留。本研究在QuEChERS样品前处理方法基础上优化了提取溶剂及分散固相萃取净化材料,建立了草莓和土壤中啶酰菌胺的分散固相萃取-气相色谱-质谱(GC-MS)快速测定方法;通过两年两地的田间残留试验,研究了喷施方式下啶酰菌胺在草莓和土壤中的消解半衰期和最终残留量,以期确定啶酰菌胺在草莓上的安全间隔期,为其安全使用提供科学依据。
1 材料与方法 1.1 仪器与试剂Agilent 6890气相色谱仪、Agilent 5975 质谱仪及Analysis工作软件(美国Agilent公司);HP-5 MS 石英毛细管柱(30 m×0.25 mm,0.25 μm)、十万分之一天平(瑞士Mettler Toledo公司);涡旋混匀器(海门市其林贝尔仪器有限公司);高速冷冻离心机(美国Thermo公司)。
99.5%啶酰菌胺(boscalid)标准品(购自德国Dr.E公司);甲醇、乙腈(色谱纯,Fisher科技公司);96%乙酸(色谱纯,迪马公司)、氯化钠、无水硫酸镁(分析纯,北京化学试剂公司);N-丙基乙二胺吸附剂(PSA)和十八烷基键合硅胶吸附剂(C18)(天津博纳艾杰尔公司);MilliQ超纯水;50%啶酰菌胺水分散粒剂(江阴苏利化学股份有限公司)。
1.2 田间试验设计供试草莓品种为“红颜”(北京试验点)和“丰香”(山东试验点)。
分别于2013年4月24日至6月10日和2014年4月20日至6月9日在北京和山东进行消解动态及最终残留试验。按农药残留试验准则[17]的要求分别设空白对照区、低剂量处理区、高剂量处理区和消解动态处理区。每小区面积为15 m2,每处理重复3次,随机排列,处理间设保护带。
1.2.1 消解动态试验于草莓果实生长到成熟个体一半大小时喷雾施药1次,施药剂量为推荐高剂量的1.5倍(有效成分含量506.3 g/hm2)。处理间设保护隔离区,另设清水空白对照。分别于施药后2 h及1、3、5、7、10、14、21、28和45 d随机采样,每小区内设10个以上采样点,采集生长正常、无病害、成熟的草莓果实,每小区采集草莓样本40~60个(不少于500 g);同时用土壤取样器随机采集深度为0~10 cm的土壤约1 kg。
1.2.2 最终残留试验设两个施药剂量:低剂量采用推荐高剂量(有效成分含量337.5 g/hm2),高剂量采用推荐高剂量的1.5倍(有效成分含量506.3 g/hm2),各设3次施药和4次施药两个处理,施药间隔期为5 d,分别于距最后一次施药3、5、7 d时随机取样。每小区内设10个以上采样点,采集生长正常、无病害、成熟的草莓果实,每小区每次采集草莓样本不少于1 kg;同时用土壤取样器随机采集深度为0~15 cm的土壤约1 kg。
1.3 样品前处理草莓:准确称取5 g粉碎混匀的草莓样品(精确至0.01 g)于50 mL离心管中,准确加入10 mL含体积分数为1%乙酸的乙腈溶液、2.0 g无水硫酸镁及1.0 g氯化钠,均质提取2 min,于6 000 r/min下离心5 min。经离心后,取上清液各2 mL置于10 mL 离心管中,分别加入100 mg C18和50 mg PSA吸附剂进行分散固相萃取净化,均质2 min,于6 000 r/min 下离心5 min,上清液过0.22 μm滤膜,待测。
土壤:准确称取5 g土壤样品(精确至0.01 g)于50 mL离心管中,提取和净化步骤同草莓样品。
1.4 检测条件色谱条件:HP-5 MS石英毛细管柱(30 m×0.25 mm,0.25 μm);色谱柱温度:初始温度为70 ℃,保持2 min,以25 ℃/min程序升温至150 ℃,以15 ℃/min程序升温至200 ℃,再以10 ℃/min 程序升温至280 ℃,保持10 min;进样口温度250 ℃;色谱-质谱接口温度280 ℃;载气为氦气,纯度≥99.999%,恒流模式1 mL/min;进样体积1 μL。
质谱条件:离子源温度230 ℃;四级杆温度150 ℃;选择离子监测方式(SIM),监测离子为140、112、167和342。 1.5 标准溶液的配制及基质标准曲线绘制准确称取0.01 g(精确至0.000 01 g)啶酰菌胺标准品,用乙腈溶解并定容至100.00 mL,配制成100 mg/L 的啶酰菌胺标准储备液,于4 ℃下避光储存。移取该标准储备液1 mL至10 mL容量瓶中,用乙腈定容,配成10 mg/L标准工作液,即用即配。
用空白草莓和土壤样品的1%乙酸-乙腈提取液作为稀释液,分别将标准工作液逐级稀释成2、1、0.5、0.1、0.05、0.01和0.001 mg/L的基质匹配标准溶液,按1.4节的条件进行检测。以进样质量浓度为横坐标,监测离子峰面积为纵坐标作标准曲线。
1.6 数据处理采用Analysis 5975C数据处理软件,按公式(1)计算样品中啶酰菌胺含量。

其中,wB表示啶酰菌胺的质量分数,mg/kg;Ai表示样品溶液中啶酰菌胺的峰面积;cs表示标准溶液中啶酰菌胺的质量浓度,mg/L;V表示样品溶液最终体积,mL;As表示标准溶液中啶酰菌胺的峰面积;m表示最终样品溶液所代表的样品质量,g。
以距施药的采样间隔时间为横坐标、啶酰菌胺的残留浓度为纵坐标,啶酰菌胺的消解反应动力学方程采用一级动力学方程(2)进行拟合,得到消解速率常数k值后,通过公式(3)计算消解半衰期t1/2:

式中:c0为啶酰菌胺的初始质量浓度,ct为t时刻啶酰菌胺的残留质量浓度。
2 结果与分析 2.1 方法的线性范围、准确度及精密度本研究基于QuEChERS前处理方法[17, 18, 19, 20]进行优化:在提取过程中,通过在乙腈中加入1%乙酸来提高草莓和土壤中啶酰菌胺的提取率;通过添加C18分散固相萃取吸附剂及PSA分散固相萃取吸附剂去除土壤样品中的杂质。外标法定量分析结果表明,在0.001~2 mg/L 范围内,啶酰菌胺的峰面积(y)与其质量浓度(x)呈良好的线性关系,草莓基质匹配标准品回归方程为y=25x-441,r=0.999 3;土壤基质匹配标准样品的回归方程为y=2.286x-244.5,相关系数r=0.999 3。
在0.05、0.3和3 mg/kg添加水平下,啶酰菌胺在草莓中的平均回收率分别为93%、91%和121%,相对标准偏差(RSD)分别为9.9%、8.2%和5.8%(n=5);在0.1、0.3和3 mg/kg添加水平下,啶酰菌胺在土壤中的平均回收率分别为91%、94%和100%,RSD分别为5.4%、6.5%和6.0%(n=5);草莓和土壤中啶酰菌胺的定量限(LOQ)分别为0.05和0.1 mg/kg,均符合农药残留试验规范的要求[21]。
该方法与文献报道的弗罗里硅土层析[7]、二氯甲烷液-液萃取[8]及弗罗里硅土固相萃取[6]等前处理方法相比,操作步骤简单、有机溶剂用量少、灵敏度高,适用于大批量样品中啶酰菌胺的快速测定。其典型色谱图见图 1。
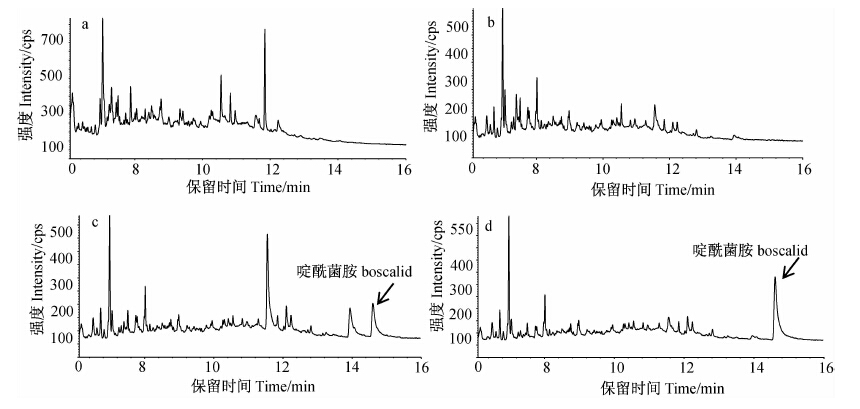 | a.草莓空白样品;b.土壤空白样品;c.草莓添加(0.05 mg/kg)样品; d.土壤添加(0.1 mg/kg)样品。a. Blank strawberry sample; b. Blank soil sample; c. Spiking strawberry sample (0.05 mg/kg); d. Spiking soil sample (0.1 mg/kg). 图 1样品中啶酰菌胺的气相色谱-质谱总离子流图 Fig. 1 GC-MS total ion chromatography of boscalid |
北京和山东试验点草莓中啶酰菌胺的原始沉积量,2013年分别为1.91和0.77 mg/kg,2014年分别为0.72和1.04 mg/kg。啶酰菌胺在草莓中的残留量与施药后间隔时间成指数关系,消解动态符合准一级动力学或一级动力学方程(图 2)。消解动力学方程:2013年北京试验点为ct=1.418 2e-0.106t,R2=0.642,半衰期t1/2=6.5 d;山东试验点为ct=0.488 8e-0.059t,R2=0.673,t1/2=11.8 d。2014年北京试验点为ct=1.147 6 e-0.111t,R2=0.688,t1/2=6.2 d;山东试验点为ct=0.674 5e-0.062t,R2=0.710,t1/2=11.3 d。
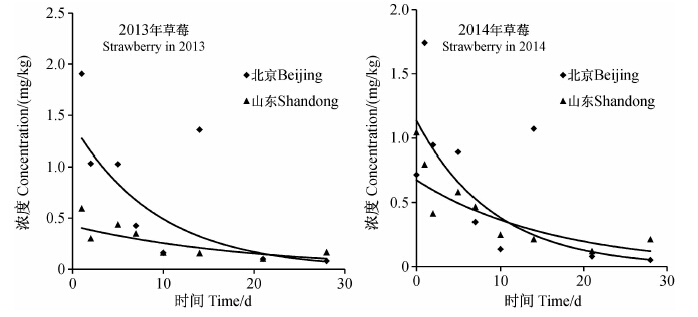 | 图 2啶酰菌胺在草莓中的消解动态 Fig. 2 Dynamic curve of boscalid residues in strawberry |
北京和山东试验点土壤中啶酰菌胺的原始沉积量,2013年分别为0.10和0.31 mg/kg,2014年分别为0.14和0.16 mg/kg。10 d后,北京和山东土壤中啶酰菌胺的残留量均低于定量限,如图 3所示,山东和北京试验点土壤中的残留量与施药间隔时间均未拟合出指数曲线,因此未得出其消解半衰期。
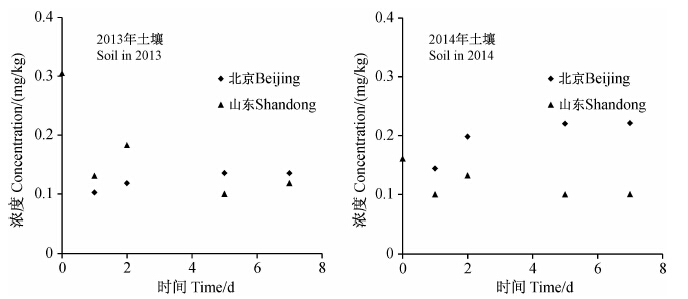 | 图 3啶酰菌胺在土壤中的消解动态 Fig. 3 Dynamic curve of boscalid residues in soil |
从表 1可看出:50%啶酰菌胺水分散粒剂在有效成分337.5和506.3 g/hm2剂量下分别施药3~4次,施药间隔为5 d的情况下,在2013—2014年两年两地田间试验中,啶酰菌胺在山东试验点草莓中的残留量均低于LOQ,在北京试验点草莓中的最终残留量为0.70~2.84 mg/kg,均低于我国的最大允许残留限量(MRL值3.0 mg/kg)[22]。北京试验点土壤中啶酰菌胺的最终残留量均低于0.38 mg/kg,山东试验点土壤中的残留量均低于LOQ,表明其对大田环境较为安全,不会对后茬作物产生危害。采收间隔期为3、5和7 d时,草莓中啶酰菌胺的残留中值(STMR)分别为0.495、0.650和0.375 mg/kg,与2009年农药残留联合专家会议(JMPR)报告的结果相近[23]。该报告指出,在GAP条件下,啶酰菌胺在草莓中的残留最大值(HR)和残留中值(STMR)分别为1.87和0.555 mg/kg。
|
|
表 1 2013—2014年草莓和土壤中啶酰菌胺的最终残留量 Table 1 Final residue of boscalid in strawberry and soil in 2013 and 2014 |
目前,食品法典委员会(CAC)、欧盟、英国、加拿大、韩国以及日本均规定了草莓中啶酰菌胺的MRL值,分别为3.0、10.0、3.0、4.5、5和15 mg/kg。根据本研究结果,在草莓种植中,采用50%啶酰菌胺水分散粒剂以 推荐高剂量(337.5 g/hm2)分别施药3次,采收间隔期为3 d时即可保证草莓中啶酰菌胺的残留是安全的。
3 结论与讨论啶酰菌胺在草莓中消解速率较快,消解半衰期为6.2~11.8 d。当50%啶酰菌胺水分散粒剂以337.5 g/hm2推荐高剂量在草莓果实生长至一半大小时开始施药,共3次,施药间隔5 d时,推荐安全间隔期为3 d。
张玉婷等[8]通过研究发现,啶酰菌胺在葡萄上消解较快,消解半衰期为9.9~12 d;郑尊涛等[10]研究发现,啶酰菌胺在番茄上的消解半衰期为7.6~11.7 d;啶酰菌胺在黄瓜上的消解速率最快,半衰期为1.3 d[11]。可以看出啶酰菌胺在不同作物上的消解半衰期有所不同[8, 10, 11]。而同一种作物由于品种不同也可能影响农药在其中的消解速率。本研究发现,在“红颜”草莓上啶酰菌胺的半衰期为6.2~6.5 d,而在“丰香”草莓上为11.3~11.8 d。“红颜”草莓平均果重为30~60 g,最大可达100 g,果实较大,而“丰香”草莓平均果重在16 g,果实较小。钱玉琴等[24]及夏会龙等[25]报道,茶树生长稀释在农药消解中的作用可达50%左右;马妍等[26]也推断出植物的生长稀释作用能够促进农药在作物中的消解。但由于本研究中不同品种草莓种植在不同区域,影响因素较多,生长稀释与啶酰菌胺的消解速率是否呈正相关还有待进一步研究。此外,品种的差异也可能影响到初始沉积量和最终残留量。在消解试验中,北京试验点“红颜”草莓中啶酰菌胺的原始沉积量约为山东“丰香”草莓的3倍,除与温度、风速、降雨等气候条件有关外,也可能与“丰香”草莓叶片大而厚、果实较小,而“红颜”草莓植株较高且果实较大,果实着药量较多有关,这也可能是导致最终残留试验中啶酰菌胺在北京“红颜”草莓的残留浓度高于山东“丰香”草莓的原因之一。
| [1] | Wedge D E, Smith B J, Quebedeaux J P, et al. Fungicide management strategies for control of strawberry fruit rot diseases in Louisiana and Mississippi[J]. Crop Protect, 2007, 26(9): 1449-1458. |
| [2] | 夏源源,孟昭礼,李健强,等.高效液相色谱法测定邻烯丙基苯酚在草莓果实中的消解动态和残留[J].分析化学, 2007, 35(1):79-82.Xia Yuanyuan, Meng Zhaoli, Li Jianqiang,et al. Studies on degradation and final residue of the bionic fungicide o-allylphenol in strawberry fruit by high performance liquid chromatography[J]. Chin J Analytic Chem, 2007, 35(1): 79-82. (in Chinese) |
| [3] | Ma Huixia, Chen Yu, Wang Jianxin, et al. Activity of carbendazim, dimethachlon, iprodione, procymidone and boscalid against Sclerotinia stem rot in Jiangsu province of China[J]. Phytoparasitica, 2009, 37(5): 421-429. |
| [4] | Stierl R, Hanke W, Lorenz G, et al. Nicobifen (BAS 510 F): Biological characteristics and redistribution[J]. Phytopathol, 2002, 92(6): S79. |
| [5] | 啶酰菌胺—FAO[DB/OL]. [2014-11-02]. |
| [6] | 唐俊,汤锋,操海群,等.啶酰菌胺在黄瓜和土壤中残留分析方法研究[J].安徽农业大学学报, 2008, 35(4): 550-554.Tang Jun, Tang Feng, Cao Haiqun,et al. Analytical method of boscalid residue in cucumber and soil[J]. J Anhui Agric Univ, 2008, 35(4): 550-554.(in Chinese) |
| [7] | 张玉婷,郭永泽,刘磊,等.啶酰菌胺在葡萄及土壤中的残留动态[J]. 农药, 2011, 50(1): 51-52.Zhang Yuting, Guo Yongze, Liu Lei,et al. The residues dynamics of boscalid in grape and soil[J]. Agrochemicals, 2011, 50(1): 51-52.(in Chinese) |
| [8] | 陈莉, 贾春虹, 贺敏, 等. 草莓和土壤中啶酰菌胺残留量的高效液相色谱分析[J]. 农药, 2009, 48(5): 360-361.Chen Li, Jia Chunhong, He Min,et al. Residue analysis method of boscalid in strawberry and soil with HPLC[J]. Agrochemicals, 2009, 48(5): 360-361.(in Chinese) |
| [9] | Lagunas-Allué L, Sanz-Asensio L, Martínez-Soria M T. Comparison of four extraction methods for the determination of fungicide residues in grapes through gas chromatography-mass spectrometry[J]. J Chromatogr A, 2012, 1270: 62-71. |
| [10] | 郑尊涛, 孙建鹏, 简秋, 等. 啶酰菌胺在番茄和土壤中的残留及消解动态[J]. 农药, 2012, 51(9): 672-674.Zheng Zuntao, Sun Jianpeng, Jian Qiu,et al. The residues and dissipation of boscalid in tomato and soil[J]. Agrochemicals, 2012, 51(9): 672-674. (in Chinese) |
| [11] | 乔金龙, 毛晨蕾, 王珏, 等. 啶酰菌胺在黄瓜植株上的吸收与消解[J]. 农药, 2013, 52(5): 360-362.Qiao Jinlong, Mao Chenlei, Wang Jue,et al. Uptake and degradation of boscalid in cucumber plants[J]. Agrochemicals, 2013, 52(5): 360-362. (in Chinese) |
| [12] | 郭庆龙,崔淑华,段浩,等.高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留[J]. 食品科学, 2012, 33(10): 255-259.Guo Qinglong, Cui Shuhua, Duan Hao,et al. Determination of boscalid and fenhexamid residues in fruits and vegetables by HPLC-MS/MS[J]. Food Sci, 2012, 33(10): 255-259. (in Chinese) |
| [13] | Bardinelli T R, Ypema H L, Barnes J S, et al. Nicobifen (BAS 510 F): a new fungicide for use on vegetables, field crops and turfgrass[J]. Phytopathol, 2002, 92(6): S6. |
| [14] | Matheron M E, Porchas M. Activity of boscalid, fenhexamid, fluazinam, fludioxonil, and vinclozolin on growth of Sclerotinia minor and S. sclerotiorum and development of lettuce drop[J]. Plant Dis, 2004, 88(6): 665-668. |
| [15] | Chen M F, Huang J W, Chien H P. Residue analysis of fungicide boscalid in cucumbers following applications of boscalid 50% water dispersible granule[J]. J Food Drug Anal, 2007, 15(2): 174-177. |
| [16] | Angioni A, Dedola F, Garau V L, et al. Fate of iprovalicarb, indoxacarb, and boscalid residues in grapes and wine by GC-ITMS analysis[J]. J Agric Food Chem, 2011, 59(12): 6806-6812. |
| [17] | Anastassiades M, Lehotay S J, Stajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412-431. |
| [18] | Lagunas-Allué L, Sanz-Asensio J, Martínez-Soria M T. Response surface optimization for determination of pesticide residues in grapes using MSPD and GC-MS: assessment of global uncertainty[J]. Analytic Bioanalytic Chem, 2010, 398(3): 1509-1523. |
| [19] | Fang Guozhen, Min Guang, He Jinxing, et al. Multiwalled carbon nanotubes as matrix solid-phase dispersion extraction absorbents to determine 31 pesticides in agriculture samples by gas chromatography-mass spectrometry[J]. J Agric Food Chem, 2009, 57(8): 3040-3045. |
| [20] | Pérez-Serradilla J A, Mata-Granados J M, de Castro M D L. Low-level determination of organochlorine pesticides in wines by automatic preconcentration and GC-MS-MS detection[J]. Chromatographia, 2010, 71(9-10): 899-905. |
| [21] | NY /T 788—2004, 农药残留试验准则[S]. 北京: 中国农业出版社, 2004.NY /T 788—2004, Guideline on pesticide residue trials[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [22] | GB 2763—2014, 食品安全国家标准:食品中最大残留量[S]. 北京: 中国农业出版社, 2014.GB 2763—2014, National food safety standard:maximum residue limits for pesticides in food[S]. Beijing: China Agriculture Press, 2014. (in Chinese) |
| [23] | FAO. Boscalid[DB/OL]. [2014-09-16]. |
| [24] | 钱玉琴, 陈巧, 董秀云, 等. 农药残留降解技术研究现状与展望[J]. 质量技术监督研究, 2010(6): 64-69.Qian Yuqing, Chen Qiao, Dong Xiuyun,et al. The current status and the prospect of the degradation of pesticide residues[J]. Qual Technic Supervis Res, 2010(6): 64-69. (in Chinese) |
| [25] | 夏会龙, 王运浩, 万海滨, 等. 茶树生长稀释在农药降解中的定量[J]. 茶叶科学, 1992, 12(1): 1-6.Xia Huilong, Wang Yunhao, Wan Haibin,et al. Quantum of growth dilution by tea shoots in the degradation of pesticides on tea plant[J]. J Tea Sci, 1992, 12(1): 1-6.(in Chinese) |
| [26] | 马妍, 李薇, 仇少萍, 等. 番茄中己唑醇残留降解动态研究[J]. 长江蔬菜:学术版, 2009(10): 68-71.Ma Yan, Li Wei, Qiu Shaoping,et al. Study on residues and degradation dynamics of hexaconazole in tomato[J]. J Changjiang Veget, 2009(10): 68-71. (in Chinese) |
 2015, Vol. 17
2015, Vol. 17


