草甘膦(glyphosate,GLY),一种内吸传导型广谱非选择性除草剂,广泛应用于农田、果园、道路、林业等一年生和多年生杂草防除[1, 2],是目前世界上应用最广、生产量最大的除草剂[3, 4]。草甘膦及其主要代谢物氨甲基膦酸(aminomethylphosphonic acid,AMPA)具有与其他有机磷农药相似的毒理学特性,即其在促进农业生产的同时,对不同生物及生态环境也存在潜在的巨大风险[5, 6, 7]。
土壤是生态环境的一个重要组成部分,同时也是除草剂一个最重要的归属场所。除草剂进入土壤后一方面影响土壤的生物环境,改变其性质和结构;同时也会发生迁移,转移到植物或其他环境介质中,造成植物中药物残留或环境次级污染[5, 6, 7]。因此,除草剂在土壤中的残留行为是其环境评价的主要内容。
草甘膦及其主要代谢物氨甲基膦酸均为强极性两性化合物(结构式见图式1),可溶于水,难溶于一般有机溶剂,具有难挥发、缺少发色团和荧光团等特点,色谱分离及检测都存在困难,分析测定难度较大[8, 9]。早期常采用三氟乙酸酐和七氟丁醇等对目标物进行衍生化处理,提高其挥发性后采用气相色谱或气相色谱-质谱联用仪进行分析[10, 11, 12],但其前处理繁琐,且稳定性较差,不利于样品批量快速处理。利用9-芴甲基氯甲酸酯柱前衍生或邻苯二醛柱后衍生、荧光检测器检测则是其液相色谱分析的代表性方法[13, 14]。但柱前衍生法所用衍生试剂副产物干扰较大,色谱分离及定量效果较差;而柱后衍生则需要色谱仪器辅助系统,同时对色谱条件的要求较为苛刻,同样制约了该方法的应用。根据两种目标物的离子特性,也有利用离子色谱法[15]和毛细管电泳法[16]进行测定的分析方法,但限于仪器的普及率及方法的灵敏度,其应用也受到限制。关于土壤中草甘膦残留量的测定,资料报道的方法也仅局限于以上气相色谱法[17, 18]、液相色谱法[19]和离子色谱法[20]。高效液相色谱-串联质谱法(HPLC-MS/MS)具有更高的选择性和灵敏度,采用该方法测定农产品和食品中草甘膦的残留已有报道[21, 22],但尚未见采用该方法测定土壤中草甘膦及其代谢物残留的报道。本研究通过对提取溶剂、固相萃取净化方法、质谱及色谱参数的优化,采用柱前衍生法建立了土壤中草甘膦及其主要代谢物氨甲基膦酸的HPLC-MS/MS分析方法。
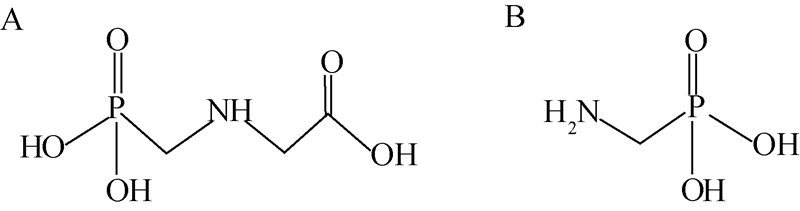 | 图式1 草甘膦 (A)与氨甲基膦酸 (B)的化学结构式 Scheme.1 Molecular structures of glyphosate (A) and AMPA (B) |
高效液相色谱仪(日本岛津公司);API4000 Q-TRAP质谱仪(美国AB SCIEX公司);V8漩涡混匀器(美国安胜公司);SHA-C恒温振荡器(常州国华仪器有限公司);Allegra 64R高速冷冻离心机(美国BECKMAN公司);Milli-Q 超纯水系统(美国Millipore公司)。
草甘膦(glyphosate)和氨甲基膦酸(AMPA)标准品(纯度99.9%,美国Sigma-aldrich公司);C18、MAX和CAX固相萃取柱(500 mg/6 mL)(美国Waters公司Oasis系列);9-芴基甲基三氯甲烷(FMOC-Cl,Aladdin公司);试验用水均为超纯水系统制备;其余试剂均为市售分析纯。
1.2 土壤样品及制备供试土壤为采自陕西石泉、杨凌和子州的黄褐土、娄土和黄绵土。采集0~20 cm耕层土壤,风干后过筛,筛孔径0.850 mm,其基本理化性质见表 1。
1.3 标准溶液配制标准储备液:分别称取草甘膦和氨甲基膦酸标准品各50 mg于50 mL聚四氟乙烯容量瓶中,加适量水和0.1 mL盐酸溶解,用水定容,分别得1.0 g/L的标准储备液,于5 ℃以下保存。
|
|
表 1 供试土壤理化性质 Tab. 1 Physical and chemical properties of the tested soils |
混合标准工作液:分别取草甘膦和氨甲基膦酸标准储备液各1 mL至100 mL聚四氟乙烯容量瓶中,用水稀释并定容至刻度,得质量浓度均为10 μg/mL 的混合标准工作液。
标准系列工作溶液:取以上混合标准工作溶液适量,用水逐步稀释,得草甘膦和氨甲基膦酸质量浓度均为1.6、8.0、40、100和200 μg/L的标准系列工作液,临用新配。
1.4 土壤样品预处理 1.4.1 提取称取土壤样品5.0 g于50 mL塑料离心管中,加入20 mL 0.6 mol/L的氢氧化钾溶液,漩涡混匀,超声提取30 min,再振荡提取30 min,于5 000 r/min离心5 min,移出上清液,用0.6~6 mol/L 的盐酸或0.4~4 mol/L的氢氧化钠调节溶液pH值至中性,用水定容至25 mL,备用。
1.4.2 净化将C18小柱依次用3 mL乙腈、3 mL水和1 mL样品提取液活化和平衡,弃去淋出液,待液面到达柱吸附层表面时,加入1.5 mL样品提取液,收集本次淋出液,待用。
1.4.3 衍生化处理吸取标准系列工作溶液及样品净化溶液各1 mL,加入200 μL 5%硼酸盐缓冲液,混匀;再分别加入200 μL 1.0 g/L的FMOC-Cl丙酮溶液,混匀;室温下进行衍生化反应4 h。反应液过0.45 μm滤膜,待HPLC-MS/MS测定。
1.5 仪器检测条件 1.5.1 高效液相色谱条件Shim-pack XR-ODS色谱柱(75 mm×3.0 mm,2.2 μm);柱温35 ℃;流动相:A相为5 mmol/L的乙酸铵溶液,B相为乙腈;梯度洗脱程序:0~9 min,B相从体积分数5%升至100%,保持2 min,11~12 min回至初始比例并保持5 min;流速0.3 mL/min;进样量10 μL。
1.5.2 质谱条件电喷雾离子源(ESI),负离子多反应监测(MRM)模式;电喷雾电压(IS):4 500 V;气帘气(CUR)压力:138 kPa(20 Psi);雾化气(GS1)压力:345 kPa(50 Psi);辅助气(GS2)压力:345 kPa(50 Psi);离子源温度(TEM):500 ℃。草甘膦母离子为m/z 389.9,子离子为m/z 167.9/149.9,其中389.9>167.9为定量离子对;去簇电压(DP):-60 V/-60 V;碰撞能量(CE):-17 V/-33 V。氨甲基膦酸母离子为m/z 331.9,子离子为m/z 109.9/135.9,其中331.9>109.9为定量离子对;去簇电压(DP):-60 V/-60 V;碰撞能量(CE):-10 V/-20 V。碰撞室入口电压(EP):-10 V;碰撞室出口电压(CXP):-15 V。
2 结果与分析 2.1 质谱条件优化在流动注射状态下,用10 μg/mL的混合标准溶液的衍生液分别在正离子和负离子模式下进行全扫描。结果表明:两个化合物的衍生物均在负离子模式下具有更好的响应值,这与衍生液在偏碱性条件下(用硼酸缓冲液调节)目标物负离子易于形成机制相吻合;进一步对其[M-H]-母离子进行子离子扫描,并对电喷雾电压、去簇电压、碰撞能量等参数进行优化。最终,两个目标物均选择丰度较高、干扰较小的两对离子进行MRM监测,其中以丰度最高的离子作为定量离子。结合液相色谱条件,最后修正完成质谱分析的所有参数(见1.5.2节)。
2.2 色谱条件优化本研究参照我国SN/T 1923—2007[21]中规定,采用正离子模式对200 μg/L的混合标准工作液衍生液进行测定。结果发现:在酸性流动相条件下,两种目标物色谱分离效果欠佳,峰形拖尾;后改用不加酸的流动相以正离子模式[21]和负离子模式(1.5.2节条件)测定,发现其色谱分离效果明显改善,峰形对称,而且负离子模式显示出更高的仪器响应值。故本研究最终确立非酸流动相体系及负离子监测模式(图 1A)。参照1.5.1节的梯度洗脱程序,进一步考察乙腈+乙酸铵(20、10、5 mmol/L)、乙腈+水、乙腈+0.03%氨水和甲醇+5 mmol/L乙酸铵6种流动相组合的色谱行为。结果(图 1B和1C)发现:乙腈+水和乙腈+0.03%氨水两种体系色谱保留特性较差,不宜采用;乙腈+乙酸铵体系具有较好的色谱分离效果,且随乙酸铵浓度的增加,仪器响应值降低,其中以5 mmol/L乙酸铵体系响应值为最大;甲醇+5 mmol/L 乙酸铵体系则具有最大的色谱保留值,其两种物质仪器响应值跟乙腈+5 mmol/L乙酸铵体系接近。综合考虑目标物质信号强度、色谱分离度以及分析时间,本试验最终选择乙腈+5 mmol/L的乙酸铵体系作为流动相。
 | 图 1 不同色谱及质谱条件总离子图 Fig. 1 Total ion chromatograms of glyphosate and AMPA with different mobile phases |
由于土壤中的有机质和黏性矿物质成分均具有较强的吸附性,草甘膦入土后很容易与铁、铝等金属离子结合生成不溶于水的化合物或被土壤有机质所吸附[23],因而提取土壤中残留的草甘膦较为困难。鉴于草甘膦及其代谢物水溶性强及其具有两性化合物的特性,资料中已有用水[20]、碱[19, 24]和酸[17]等不同溶液提取的方法;另外,两种目标物中均含磷酸结构,其在土壤中的特性应与土壤中的速效磷类似,土壤中速效磷提取方法也可以尝试[25]。本研究借鉴这些方法,选用3种不同类型的土壤样品,采用空白样品中添加标准品(5.0 g样品中加入1 mL 1.0 μg/mL的标准混合溶液,混匀,静置吸附24 h)的方法,分别用0.6 mol/L 的氢氧化钾、0.5 mol/L 的碳酸氢钠(pH 8.5)、0.5 mol/L的碳酸氢钠(pH 13)、水、0.5%的磷酸水溶液等5种溶剂参照1.4.1节步骤提取,提取液不做净化处理直接进行衍生测定,比较各提取剂的回收率及重现性。结果(表 2)表明:两种目标物以0.6 mol/L的氢氧化钾为提取剂时提取效果最优,回收率为 96%~99%,RSD为7.6%~9.4%;其次为pH 8.5、0.5 mol/L的碳酸氢钠和pH 13、0.5 mol/L 的碳酸氢钠(用4 mol/L的氢氧化钠调节pH值),回收率为65%~83%,RSD为3.1%~9.0%;水和0.5%磷酸水溶液两种提取方法回收率和重现性均较差。
本试验中两种目标物虽为两性化合物,但其通常情况下均表现为酸性,故用碱性溶液提取应具有较好的提取效果;另外,0.5 mol/L的碳酸氢钠提取法所表现出的较好的回收率以及最佳的稳定性,也说明草甘膦及其代谢物与土壤速效磷特性的一致性。
综合考虑方法回收率以及稳定性,本试验最终选择以0.6 mol/L的氢氧化钾为提取剂。
2.3.2 净化方法优化草甘膦及氨甲基膦酸均含有磷酸基(以及羧基)酸性基团和氨基碱性基团,根据其不同基团离子属性,前处理样品净化可选择阴离子交换法[26]或阳离子交换法[21];另外,利用C18固相萃取柱对极性物质的不保留特性也可进行样品的净化处理[22]。本试验选用娄土空白样品按1.4.1节处理,得提取液后加入混合标准溶液(使提取液中两种目标物的质量浓度均为 0.040 μg/mL),采用以下4种方法进行处理,考察方法适用性。
|
|
表 2 不同提取溶剂方法平均回收率及相对标准偏差(n=3) Tab. 2 The fortified recoveries and relative standard deviations (n=3) of different extraction solvents |
MAX-SPE净化[26]:MAX 小柱依次用3 mL甲醇、2 mL 水和2 mL 2%氨水活化平衡;加入1.0 mL提取液后用2 mL 2%氨水淋洗;再依次用2 mL 甲醇和2 mL 2%的盐酸-甲醇洗脱;收集洗脱液,氮吹至干;用1 mL水溶解,待用。
CAX-SPE净化[21]:CAX小柱经10 mL水活化,加入1.0 mL提取液,用0.7 mL洗脱液(160 mL水+2.7 mL盐酸+40 mL 甲醇)淋洗两次,再用11 mL 洗脱液(同前)洗脱并收集洗脱液,于45 ℃下旋转蒸发至近干,加入1 mL 5%硼酸盐缓冲液溶解残渣,待用。
C18-SPE净化:按1.4.2节进行。样品提取液不做净化处理,直接吸取提取液进行下一步试验。另取4份空白样品提取液按以上方法处理后配制基质标准溶液。
不同处理样品进一步进行衍生测定,按基质效应/%=(基质标准峰面积-溶剂标准峰面积)/溶剂标准峰面积×100计算各方法基质效应,以基质标准外标法计算各处理回收率。结果表明:采用C18-SPE净化及样品提取液不做净化处理均具有较好的试验结果,两种目标物基质效应在-0.4%~3.0%之间,回收率在100%~103%之间;MAX-SPE以及CAX-SPE两种净化方式效果较差,基质效应在-78.0%~-27.0%之间,回收率在26%~52%之间(表 3)。这说明在选择性很强的质谱MRM扫描模式下,土壤样品具有较低的背景干扰,样品不做净化处理或简单C18柱快速过滤即可满足分析要求。MAX-SPE和CAX-SPE两种净化方式(离子交换固相萃取法)效果较差,可能由于目标物均存在多级电离特征,其样品溶液离子特性、萃取柱吸附活性和洗脱强度难以准确控制,致使试验回收率偏低;同时,操作过程中溶剂体系及条件多变,净化后样品引入酸性物质过多,从而可能影响衍生反应条件而使试验结果偏离。因此,从样品净化效果、试验的可操作性以及保护色谱柱角度出发,本试验最终选择C18-SPE净化法进行样品处理,溶剂标准溶液外标法定量。
|
|
表 3 不同净化方法基质效应和回收率 Tab. 3 The matrix effects and recoveries of different purification methods |
取1.3节中标准系列工作溶液,按1.4.3节衍生化处理并进行仪器测定,绘制方法标准曲线;利用空白样品中添加8.0 μg/kg 试验样品,按色谱峰S/N≥3计算方法检出限、S/N≥10计算方法定量限。结果表明:草甘膦及氨甲基膦酸在1.6~200 μg/L范围内线性关系良好,草甘膦线性方程为y=6.86×103x+2.08×104 (r=0.999 8);检出限和定量限分别为0.80和2.6 μg/kg;氨甲基膦酸线性方程为y=7.35×103x+1.1×104 (r=0.999 9),检出限和定量限分别为0.94和3.0 μg/kg。两种目标物线性关系良好,方法灵敏度高。
2.4.2 方法回收率和精密度选择不同土壤类型的3个空白样品,采用优化条件,进行不同水平的添加回收试验,每个水平3次重复。结果表明:草甘膦平均回收率为84%~104%,相对标准偏差(RSD)为4.8%~7.5%;氨甲基膦酸平均回收率为89%~104%,RSD为2.8%~6.5%(表 4)。方法的准确度及精密度均满足农药残留分析要求[27]。
|
|
表 4 不同添加水平回收率及相对标准偏差(n=3) Tab. 4 Recoveries and RSDsof 2 target compounds spiked in three levels (n=3) |
随机从本中心样品室选取来源于不同区域的18个土壤样品,应用本方法进行测定。结果表明:所检土壤中草甘膦和氨甲基膦酸的存在较为普遍,其中草甘膦最高含量为42.75 μg/kg,检出率38.9%;氨甲基膦酸最高含量为85.83 μg/kg,检出率61.1%;氨甲基膦酸检出率及含量均比其代谢母体草甘膦高(表 5)。这说明,在目前草甘膦大量使用的情况下,土壤中草甘膦残留状况较为突出,且残留期长,降解缓慢,值得进一步研究。
|
|
表 5 实际土壤样品测定结果 Tab. 5 The determination results of real soil sample |
采用0.6 mol/L的氢氧化钾溶液提取和C18固相萃取柱快速净化、FMOC-Cl柱前衍生的方法进行样品前处理,通过高效液相色谱-串联质谱法进行含量测定,实现了土壤样品中草甘膦及其代谢物氨甲基膦酸的同时、快速分析。与文献方法[17, 18, 19, 20]比较,本方法前处理过程简单,仪器干扰小,方法灵敏度、准确度和精密度好。应用本方法对部分土壤样品进行检测,发现所检土壤中草甘膦和氨甲基膦酸检出率均较高。
草甘膦为农业生产中应用最广的除草剂,随着抗草甘膦转基因作物的迅速发展,其施用更为普遍,但其危害及残留问题也备受关注。草甘膦在作物及土壤环境中代谢及降解的产物主要为氨甲基膦酸[28],根据农药残留联席会议(JMPR)农药残留风险评估意见,国际食品法典委员会(CAC)2005年发布大豆等产品中农药残留限量标准并定义草甘膦残留包括草甘膦及主要代谢物氨甲基膦酸[29],我国GB 2763—2014食品中农药最大残留量标准中也采纳了该残留定义,并先后制定16类食品中草甘膦的残留限量标准[30],在我国GB5749—2006生活饮用水卫生标准中也同样规定了草甘膦的限量要求[31]。近年来,随着一种新型草甘膦代谢机制被发现[32],又有两种新的草甘膦代谢物——N-乙酰草甘膦和N-乙酰氨甲基膦酸被提出,2013年,CAC标准重新修订了动、植物产品以及膳食风险评估中草甘膦残留物定义[33]。由于检测标准更新的滞后以及各国标准的不同步,这些新的残留物定义尚未被各国及时采纳和执行。本研究借鉴我国目前现行相关产品中草甘膦残留检测指标,对土壤中草甘膦及氨甲基膦酸残留检测方法及含量分布进行研究,可评估分析土壤环境中草甘膦的残留分布现状及造成产品二次污染的风险状况,为土壤环境质量评价及相关产品中草甘膦残留控制提供技术和理论依据;但有关土壤中是否存在草甘膦新的代谢物N-乙酰草甘膦和N-乙酰氨甲基膦酸及其检测方法,还有待进一步研究和探索。
##CanKaoWenXian##| [1] | Safarpour H, Asiaie R. Determination of glyphosate as cross-contaminant in a commercial herbicide by capillary electrophoresis-electrospray ionization-mass spectrometry [J].Electrophoresis, 2005, 26(7-8): 1562-1566. |
| [2] | Goodwin L, Startin J R, Goodall D M, et al. Tandem mass spectrometric analysis of glyphosate, glufosinate, aminomethy-lphosphonic acid and methylphosphinicopropionic acid [J].Rapid Commun Mass Spectrom, 2003, 17(9): 963-969. |
| [3] | 王慧, 闫晓红, 徐杰, 等. 我国抗草甘膦基因的发掘现状[J]. 农业生物技术学报, 2014, 22(1): 109-118.Wang Hui, Yan Xiaohong, Xu Jie,et al. Current status of excavation glyphosate-resistant gene in china [J].J Agric Biotechnol, 2014, 22(1): 109-118. (in Chinese) |
| [4] | 梁诚. 草甘膦生产现状与市场分析 [J]. 精细化工原料及中间体, 2011(8): 13-15.Liang Cheng. Production status and market analysis of glyphosate[J].Fine Chemical Industrial Raw Materials & Intermediates, 2011(8): 13-15. (in Chinese) |
| [5] | 卢信, 赵炳梓, 张佳宝, 等. 除草剂草甘膦的性质及环境行为综述 [J]. 土壤通报, 2005, 36(5): 785-790.Lu Xin, Zhao Bingzi, Zhang Jiabao,et al. Property and environmental behavior of herbicide glyphosate [J].Chin J Soil Sci, 2005, 36(5): 785-790. (in Chinese) |
| [6] | 周垂帆, 李莹, 张晓勇, 等. 草甘膦毒性研究进展 [J]. 生态环境学报, 2013, 22(10): 1737-1743.Zhou Chuifan, Li Ying, Zhang Xiaoyong,et al. Research advance in ecotoxicity of glyphosate [J].Ecol Environ Sci, 2013, 22(10): 1737-1743. (in Chinese) |
| [7] | 张伟, 王进军, 高立明, 等. 草甘膦在水-土壤系统中的环境行为及研究进展 [J]. 农药, 2006, 45(10): 649-654.Zhang Wei, Wang Jinjun, Gao Liming,et al. The review of glyphosate environment fate in the water-soil system [J].Agrochemicals, 2006, 45(10): 649-654. (in Chinese) |
| [8] | Coutinho C F B, Coutinho L F M, Mazo L H, et al. Direct determination of glyphosate using hydrophilic interaction chromatography with coulometric detection at copper microelectrode [J].Analytica Chimica Acta, 2007, 592(1): 30-35. |
| [9] | Martins-Júnior H A, Lebre D T, Wang A Y, et al. An alternative and fast method for determination of glyphosate and aminomethylphosphonic acid (AMPA) residues in soybean using liquid chromatography coupled with tandem mass spectrometry [J].Rapid Commun Mass Spectrom, 2009, 23(7): 1029-1034. |
| [10] | Kataoka H, Ryu S, Sakiyama N, et al. Simple and rapid determination of the herbicides glyphosate and glufosinate in river water, soil and carrot samples by gas chromatography with flame photometric detection [J].J Chromatogr A, 1996, 726 (1-2): 253-258. |
| [11] | NY/T 1096—2006, 食品中草甘膦残留量的测定 [S]. 北京: 中国农业出版社, 2006.NY/T 1096—2006, Determination of glyphosate residues in food [S]. Beijing: China Agriculture Press, 2006. (in Chinese) |
| [12] | GB/T 23750—2009, 植物性产品中草甘膦残留量的测定 气相色谱-质谱法 [S]. 北京: 中国标准出版社, 2009.GB/T 23750—2009, Determination of glyphosate residues in plant products-GC-MS method [S]. Beijing: China Standards Press, 2009. (in Chinese) |
| [13] | Nedelkoska T V, Low G K C. High-performance liquid chromatographic determination of glyphosate in water and plant material after pre-column derivatisation with 9-fluorenylmethyl chloroformate [J].Analytica Chimica Acta, 2004, 511(1): 145-153. |
| [14] | GB/T 5750.9—2006, 生活饮用水标准检验方法 农药指标 [S]. 北京: 中国标准出版社, 2007.GB/T5750.9—2006, Standard examination methods for drinking water-Pesticides parameters [S]. Beijing: China Standards Press, 2007. (in Chinese) |
| [15] | Marques M N, Passos E A, Silva M T, et al. Determination of glyphosate in water samples by IC [J].J Chromatogr Sci, 2009, 47(9): 822-824. |
| [16] | Corbera M, Hidalgo M, Salvadó V, et al. Determination of glyphosate and aminomethylphosphonic acid in natural water using the capillary electrophoresis combined with enrichment step [J].Analytica Chimica Acta, 2005, 540(1): 3-7. |
| [17] | Roy D N, 陆贻通. 土壤中草甘膦及其代谢物残留测定方法的改进 [J]. 农药译丛, 1990, 12(3): 47-49.Roy D N, Lu Yitong. Improvement of determination method of glyphosate and its metabolite residues in soil[J].Pesticide Trans, 1990, 12(3): 47-49. (in Chinese) |
| [18] | 胡继业, 赵殿英, 宁君, 等. 气相色谱-氮磷检测器测定草甘膦在土壤和苹果中的残留量 [J]. 农药学学报, 2007, 9(3): 285-290.Hu Jiye, Zhao Dianying, Ning Jun,et al. Determination of glyphosate residues in soil and apple by capillary gas chromatography with nitrogen-phosphorus detection [J].Chin J Pestic Sci, 2007, 9(3): 285-290. (in Chinese) |
| [19] | 司友斌, 桑忠营, 程凤侠. 对甲基苯磺酰氯衍生化液相色谱法测定土壤中草甘膦 [J]. 安徽农业大学学报, 2009, 36(1): 136-139.Si Youbin, Sang Zhongying, Cheng Fengxia. Determination of glyphosate in soil by high performance liquid chromatography after derivatization with p-toluenesulphonyl chloride [J].J Anhui Agric Univ, 2009, 36(1): 136-139. (in Chinese) |
| [20] | 张培志, 吴军, 张培敏, 等. 土壤中草甘膦的离子色谱法测定 [J]. 分析测试学报, 2003, 22(4): 89-90.Zhang Peizhi, Wu Jun, Zhang Peimin,et al. Determination of glyphosate in soil by ion chromatography [J].J Instrumental Anal, 2003, 22(4): 89-90. (in Chinese) |
| [21] | SN/T 1923—2007, 进出口食品中草甘膦残留量的检测方法 液相色谱-质谱/质谱法 [S]. 北京: 中国标准出版社, 2007.SN/T 1923—2007, Determination of glyphosate residues in food for import and export-HPLC-MS/MS method [S]. Beijing: China Standards Press, 2007. (in Chinese) |
| [22] | 曹赵云, 牟仁祥, 陈铭学. 液相色谱-串联质谱法测定稻米中的草甘膦和氨甲基膦酸残留 [J]. 色谱, 2010, 28(8): 743-748.Cao Zhaoyun, Mou Renxiang, Chen Mingxue. Determination of glyphosate and aminomethylphosphonic acid in rice using liquidchromatography-tandem mass spectrometry [J].Chin J Chromatogr, 2010, 28(8): 743-748. (in Chinese) |
| [23] | Hensley D L. 由不同土壤和金属盐引起的草甘膦的钝化 [J]. 热带作物译丛, 1980(4): 10-12.Hensley D L. Passivation of glyphosate caused by different soil and metal salt[J].Tropical Crops Trans, 1980(4): 10-12. (in Chinese) |
| [24] | 汪立高, 杨仁斌, 魏凤. 土壤中残留草甘膦检测方法及其消解动态研究 [J]. 湖南农业科学, 2011(23): 85-88.Wang Ligao, Yang Renbin, Wei Feng. Detection method and degradation dynamics of isopropylamine salt of glyphosate in soil[J].Hunan Agric Sci, 2011(23): 85-88. (in Chinese) |
| [25] | 史瑞和. 土壤农化分析[M].2版. 北京: 中国农业出版社, 1990: 73.Shi Ruihe. SoilAgro-Chemistrical Analysis[M].2nd ed. Beijing: China Agriculture Press, 1990: 73. (in Chinese) |
| [26] | 周爽, 徐敦明, 林立毅, 等. 反反相色谱-串联质谱法直接测定植物源性食品中草甘膦及其代谢物残留 [J]. 分析测试学报, 2013, 32(2): 199-204.Zhou Shuang, Xu Dunming, Lin Liyi,et al. Determination of glyphosate and aminomethylphosphonic acid in plant-derived foodstuff by aqueous normal phase (ANP) chromatography-tandem mass spectrometric method [J].J Instrumental Anal, 2013, 32(2): 199-204. (in Chinese) |
| [27] | NY/T 788—2004, 农药残留试验准则[S]. 北京: 中国农业出版社, 2004.NY/T 788—2004, Guideline on pesticide residue trials [S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [28] | 苏少全. 草甘膦述评 [J]. 农药, 2005, 44(4): 145-149.Su Shaoquan. Glyphosate review[J].Chin J Pestic, 2005, 44(4): 145-149. (in Chinese) |
| [29] | Agriculture and Consumer Protection. Residue and analytical aspects [DB/OL]. (2005-03-24) [2014-01-20]. http://www.fao.org/docrep/009/a0209e/a0209e0d.htm#Top0fpage |
| [30] | GB 2763—2014, 食品安全国家标准 食品中农药最大残留限量 [S]. 北京: 中国标准出版社, 2014.GB 2763—2014, National food safety standard-Maximum residue limits for pesticides in food [S]. Beijing: China Standards Press, 2014. (in Chinese) |
| [31] | GB 5749—2006, 生活饮用水卫生标准 [S]. 北京: 中国标准出版社, 2006.GB 5749—2006, Standards for drinking water quality [S]. Beijing: China Standards Press, 2006. (in Chinese) |
| [32] | Green J M, Hazel C B, Forney D R, et al. New multiple-herbicide crop resistance and formulation technology to augment the utility of glyphosate [J].Pest Manag Sci, 2008, 64(4): 332-339. |
| [33] | CODEX alimentarius [DB/OL]. (2013-07-01)[2015-01-20]. http://www.codexalimentarius.net/pestres/data/pesticides/details.html?id=158 |
 2015, Vol. 17
2015, Vol. 17


