2. 杭州职业技术学院 临江学院, 杭州 310018
2. Linjiang College, Hangzhou Vocational & Technical College, Hangzhou 310018, China
三唑类杀菌剂是目前广泛使用的一类杀菌剂和植物生长调节剂[1, 2]。该类化合物分子中均含有1个或 2个手性中心,即存在2个或4个对映异构体。大量研究表明,三唑类手性杀菌剂在生物活性、毒性、分布、生物选择性及农药降解等方面均与其对映体结构密切相关[3, 4, 5, 6, 7]。目前虽然已有部分三唑类杀菌剂实现了以光学纯单体形式出售,但大部分仍以外消旋体形式销售和使用。这意味着在保证药效的前提下势必将增大农药的使用量,增加潜在的环境风险。因此对三唑类手性杀菌剂的对映体进行分离研究是十分必要的。
近年来,随着手性固定相的出现,高效液相色谱(HPLC)已成为三唑类杀菌剂对映体分离的主要方法[8, 9, 10]。而与HPLC相比,超临界流体色谱(supercritical fluid chromatography,SFC)具有分析时间短、柱平衡快、流动相体系简单等优点[11]。目前采用SFC对三唑类杀菌剂进行对映体分离研究的相关报道较少。Toribio等[12, 13, 14]采用SFC在Chiralpak AD柱上对三唑酮、三唑醇、烯唑醇、己唑醇和丙环唑等8种三唑类杀菌剂进行了手性拆分,结果表明,大多数杀菌剂能在13 min内实现对映体分离,显示出了SFC快速高效的特点。在上述8种杀菌剂中,除三唑醇和丙环唑外,其余化合物均只含有1个手性中心。目前关于含有2个手性中心的三唑类杀菌剂(如苄氯三唑醇、联苯三唑醇、NFDA1 醚唑等)的对映体分离研究还鲜见报道[9]。
本研究考察了6种含有2个手性中心的三唑类杀菌剂(苄氯三唑醇、联苯三唑醇、叶菌唑、乙环唑、糠菌唑和 NFDA1 醚唑)在SFC中的对映体分离情况,通过在流动相中添加不同种类及浓度的醇类改性剂(甲醇、乙醇和异丙醇),探索流动相组成对手性拆分效果的影响。同时在Chiralcel OD-H柱上考察了系统背压的高低对对映体分离的影响。
1 材料与方法 1.1 药剂和试剂苄氯三唑醇、联苯三唑醇、叶菌唑、乙环唑、糠菌唑和 NFDA1 醚唑,均购于Sigma-Aldrich公司(St. Louis,USA),均为纯度在98.0%以上的原药(外消旋混合物),其化学结构见图式1。将供试原药用色谱纯乙醇溶解,制备成质量浓度为500 mg/L的药液供试。流动相所用的甲醇、乙醇和异丙醇均为色谱纯,其中乙醇和异丙醇购于天津四友精细化学品有限公司,甲醇购于上海陆都化学试剂厂。干冰级二氧化碳(CO2)购于杭州今工特种气体有限公司。
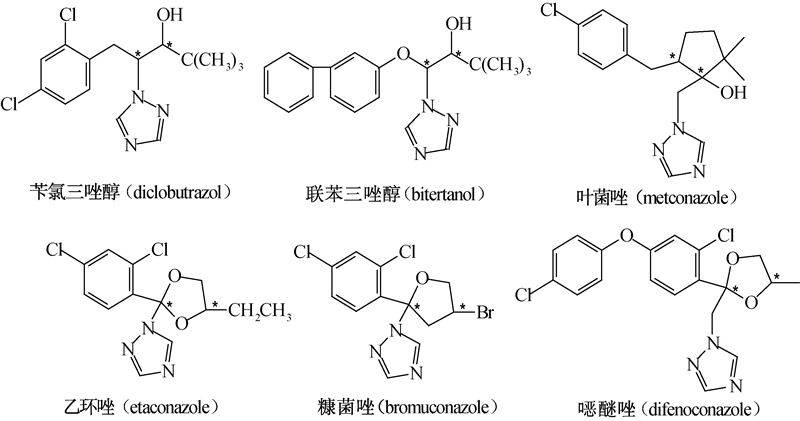 | 图式1 6种三唑类手性杀菌剂的化学结构式(*所示为手性中心) Scheme.1 The chemical structures of six triazole fungicides(* denoted chiral center) |
超临界流体色谱仪:Thar SD-ASFC-2 色谱系统(Thar Technologies,Pittsburgh,PA,USA),配有Gilson UV/VIS-151紫外检测器(Middleton,WI,USA)和Rheodyne 7410手动进样阀。
手性色谱柱:Chiralcel OD-H(250 mm×4.6 mm,5μm),填料为纤维素-三(3,5-二甲基苯基氨基甲酸酯)涂敷5μm硅胶的手性固定相及Chiralpak IB(250 mm×4.6 mm,5μm),填料为纤维素-三(3,5-二甲基苯基氨基甲酸酯)共价键合5μm硅胶的手性固定相,均购于日本大赛璐化学工业公司(Daicel Chemical Industries,LTD);Sino-Chiral OJ(250 mm×4.6 mm,5μm),填料为纤维素-三-(4-甲基苯甲酸酯)涂敷5μm硅胶的手性固定相,购于分水(北京)科技有限公司。
1.3 试验方法在Chiralcel OD-H手性柱上,以超临界CO2为主流动相,其中添加不同种类(甲醇、乙醇、异丙醇)和不同体积分数(0~15%)的极性改性剂,根据色谱分离情况选择优化的改性剂条件。
采用Chiralcel OD-H手性柱,在添加优化的改性剂条件下,分别在不同系统背压(13~17 MPa)下对6种三唑类杀菌剂对映体进行拆分。
比较6种三唑类杀菌剂在3种不同手性柱上的分离情况,并探讨手性固定相不同结构和基团对对映体分离的影响。
1.4 色谱条件和色谱参数计算流动相主体为超临界CO2,添加甲醇、乙醇或异丙醇为改性剂,流动相流速为2 mL/min。SFC系统温度34 ℃,系统背压15 MPa(考察系统背压对分离效果的影响试验除外),紫外检测波长230 nm。
第i个峰的容量因子:ki=(ti-t0)/t0,其中t0为色谱柱死时间,ti为第i个峰的保留时间。ki值越大,说明固定相对此组分的容量越大,出柱越慢,保留时间越长。
分离度Rs=1.18×(ti-t0)/(wi+wi+1),其中t0为色谱柱死时间,ti为第i个峰的保留时间,wi为第i个峰的半峰宽。Rs值越大,说明相邻两组分分离越好;当Rs≥1.5时,说明分离程度可达到99.7%,可视为两种相邻组分达到完全分离(或基线分离)[15]。
2 结果与讨论 2.1 醇类改性剂对手性分离的影响由于CO2为非极性物质,而三唑类杀菌剂的分子极性较强,与流动相的相互作用力不强。在Chiralcel OD-H手性柱上,在不添加改性剂仅以超临界CO2为流动相条件下(其他色谱条件为温度34 ℃,系统背压15 MPa,流动相流速2 mL/min),6种供试杀菌剂在60 min内均不能被洗脱;而添加改性剂后,6种杀菌剂的保留时间均明显降低,所有供试药剂在40 min内均得到了洗脱。由图 1结果可以看出:随着改性剂体积分数的增加,6种杀菌剂的第一个峰和第二个峰的容量因子k1和k2均减小,而且改性剂体积分数越低,容量因子减小越明显。由于供试药剂均含有两个手性中心,各有4个对映异构体,其与手性固定相和流动相的作用较为复杂,因此改性剂体积分数的改变对分离度的影响没有统一规律。但总体来说,对于同一种改性剂,存在一个最佳添加量。如苄氯三唑醇在Chiralcel OD-H手性柱上以体积分数为1%的乙醇为改性剂时,其4个峰之间的分离度分别为RS12=0.72、RS23=2.48和RS34=5.82;当乙醇体积分数为3%时,苄氯三唑醇实现了基线分离,RS12、RS23、RS34分别为1.55、3.97和3.88;而当乙醇体积分数为5%时,仅出了2个峰。
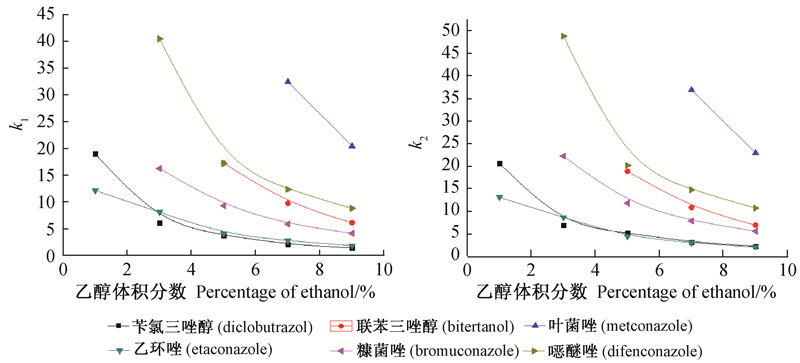 | 注(Note):T=34 ℃,P=15 MPa,u=2 mL/min,Chiralcel OD-H。图 1 乙醇体积分数对容量因子的影响 Fig. 1 Effect of ethanol percentage on the capacity factor |
研究表明,三唑类杀菌剂手性中心上取代基的极性大小对对映体分离效果影响较大[16]。本研究结果(表 1)表明:在甲醇、乙醇和异丙醇3种改性剂条件下,乙环唑和 NFDA1 醚唑均未能在Chiralcel OD-H柱上获得基线分离,这可能是由于乙环唑和 NFDA1 醚唑的一个手性中心上同时连接了2个碳氧单键,极性差异较小,从而增加了分离难度;联苯三唑醇含有两个苯环结构,在3种改性剂条件下均能实现基线分离,这是因为多糖类手性固定相对芳环有较高的亲和力,增加了供试药剂在固定相上的吸附-脱附次数,有利于对映体的分离。类似地,含有2个苯环结构的 NFDA1 醚唑的分离效果也明显好于只含有1个苯环结构的乙环唑。
一般改性剂极性越大,对供试药剂的洗脱能力越强,导致对映体在固定相上的保留时间缩短,分离效果变差;改性剂空间位阻增大时,其对供试药剂在手性固定相上的吸附点的竞争减弱,即流动相的洗脱能力降低。本研究中的三种醇类改性剂的极性大小顺序为异丙醇<乙醇<甲醇,而分子体积大小顺序为异丙醇>乙醇>甲醇。可能是由于以上两方面因素的共同作用,糠菌唑只能在以甲醇为改性剂、苄氯三唑醇只能在以乙醇为改性剂的条件下才能获得基线分离。
|
|
表 1 改性剂对6种三唑类杀菌剂对映体分离的影响 Tab. 1 Effect of modifier on the enantiomeric separation of six triazole fungicides |
表 2为4种三唑类杀菌剂在不同系统背压下的分离数据。由此可见,随着系统背压的升高,杀菌剂对映体分离的容量因子(k)逐渐减小,即洗脱速率越来越快,但容量因子减小的程度不大。Pear 等[17]研究发现,在35 ℃下,当系统背压从10 MPa升高到20 MPa时,超临界CO2的密度可从717.19 kg/m3升高到866.11 kg/m3。本研究中也可能是由于系统背压升高,导致流动相的密度增大,致使其溶剂化能力加强,最终导致其对三唑类杀菌剂的洗脱速率加快[18]。由分离度(Rs)数据可以看出,苄氯三唑醇和联苯三唑醇仅在系统背压为15 MPa 时实现了基线分离。系统背压的改变可能会引起对映体出峰顺序的改变,因此分离度的变化比较复杂。但是大致可以推断在系统背压为15 MPa左右时,手性分离的分离效果最佳,压力过高或者过低,均不利于分离。
2.3 手性色谱柱种类对手性分离的影响本研究结果表明:乙环唑和 NFDA1 醚唑在3种手性柱中均未能实现基线分离。相对而言,Chiralcel OD-H柱对6种杀菌剂的手性拆分效果优于Chiralpak IB柱和Sino-Chiral OJ柱。在Chiralcel OD-H柱上,除乙环唑和 NFDA1 醚唑外,其余4种杀菌剂均实现了基线分离;而Sino-Chiral OJ柱只能拆分联苯三唑醇和糠菌唑;Chiralpak IB柱则可以拆分联苯三唑醇、叶菌唑和糠菌唑。
手性化合物在手性固定相上的拆分机理尚不十分明确。对映体与手性固定相间存在着偶极-偶极、氢键-氢键、π-π作用或非手性作用(空间位阻作用)等不同方式的作用力,彼此会有差异,也正是这种差异造成对映体之间保留时间不同,从而实现手性拆分。本研究结果表明,供试手性杀菌剂在Chiralcel OD-H柱上的拆分效果较好,而Sino-Chiral OJ柱在拆分速率上体现出优势。与Sino-Chiral OJ柱相比,Chiralcel OD-H手性固定相在结构上多一个—NH基团,而供试6种杀菌剂中均含有—OH或者醚键,这些官能团可以与固定相中的—NH产生氢键作用,由此认为氢键可能是造成拆分效果差异的主要原因[19, 20];此外,供试杀菌剂在Chiralpak IB柱上的分离效果最差,这可能是因为IB柱是共价键合型CSP,键合型的CSP在制备过程中由于间隔臂的介入以及键合位置的多样性,在一定程度上破坏了多糖衍生物的有序分子结构,进而影响了手性物质与IB柱的手性空腔的匹配程度[21]。
|
|
表 2 三唑类杀菌剂在不同系统背压下的分离结果 Tab. 2 Effect of pressure on the enantiomeric separation of triazole fungicides |
综合比较6种三唑类杀菌剂在各种条件下的对映体分离结果,选取分离时间较短,分离度较大的色谱条件为优化分离条件。6种杀菌剂的优化条件见表 3,在此条件下的对映体拆分色谱图见图 2。
|
|
表 3 6种三唑类杀菌剂对映体分离的优化条件及分离效果 Tab. 3 The optimal separation conditions and enantiomeric separation of six triazole fungicides |
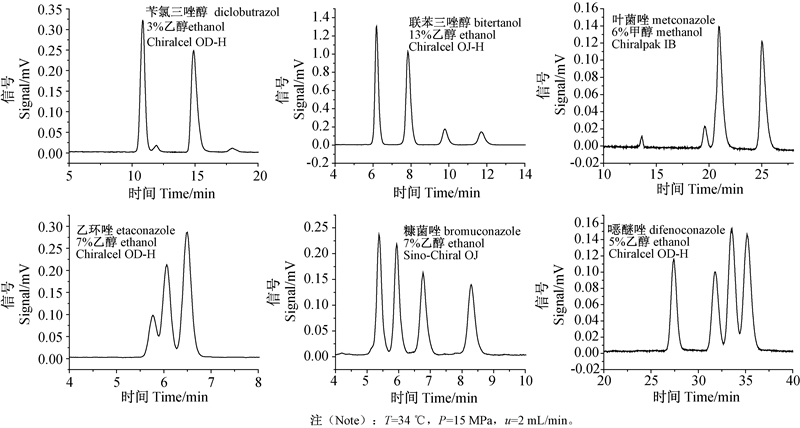 | 图 2 6种三唑类杀菌剂在优化条件下的色谱拆分图 Fig. 2 SFC chromatograms of six triazole fungicides under the optimal separation conditions |
本研究结果表明:在Chiralcel OD-H柱上,单独以超临界CO2为流动相时,6种三唑类杀菌剂的保留时间均大于60 min,而添加了醇类改性剂后其在40 min内都得到了洗脱,且随着改性剂浓度增加,手性拆分的容量因子逐渐减小。在试验系统背压范围内,随着系统背压的升高,杀菌剂对映体的保留时间逐渐减小,而根据分离度的数据显示在系统背压为15 MPa左右时,供试药剂手性分离的分离效果最佳。Chiralcel OD-H柱对6种供试三唑类杀菌剂的手性拆分效果优于Sino-Chiral OJ柱和Chiralpak IB柱,但对映体分离时间要长10~20 min。在柱温为34 ℃、系统背压为15 MPa、流动相流速为2 mL/min的条件下,苄氯三唑醇、联苯三唑醇、叶菌唑和糠菌唑在20 min内均实现了基线分离,色谱柱和改性剂的优化条件分别为:Chiralcel OD-H柱、体积分数为3%的乙醇;Sino-Chiral OJ柱、体积分数为13%的乙醇;Chiralpak IB柱、体积分数为6%的甲醇;Sino-Chiral OJ柱、体积分数为7%的乙醇。该研究可为一些手性三唑类杀菌剂及其类似物的对映体纯度测定和单一对映体的制备提供参考。
| [1] | Frohberger P E. Bekämpfung von pilzkrankheiten im Getreidebau durch Saatgubehandlung [J]. Mitt Biol BundAnst Land-Forstwirtsch, Berlin-Dahlem, Heft, 1973, 151: 61-74. |
| [2] | 毕彦博, 潘红艳, 张晓庆, 等. 三唑类杀菌剂调节植物逆境生长研究进展 [J]. 中国农学通报, 2012, 28(30): 213-217.Bi Yanbo, Pan Hongyan, Zhang Xiaoqing,et al. The advances on triazole fungicides regulating plant growth against environmental stresses [J]. Chin Agric Sci Bull, 2012, 28(30): 213-217. (in Chinese) |
| [3] | 杨丽萍, 李树正, 李煜昶, 等. 三种三唑类杀菌剂对映体生物活性的研究 [J]. 农药学学报, 2002, 4(2): 67-70.Yang Liping, Li Shuzheng, Li Yuchang, et al. Bioactivity investigation of triazole fungicide enantiomers [J]. Chin J Pestic Sci, 2002, 4(2): 67-70. (in Chinese) |
| [4] | 李朝阳, 张艳川, 李巧玲, 等. 三唑农药的手性拆分及对映体的转化 [J]. 分析化学研究简报, 2010, 38(2): 237-240.Li Zhaoyang, Zhang Yanchuan, Li Qiaoling, et al. Chiral separation and enantiomerization of triazole pesticides [J]. Chin J Analytic Chem, 2010, 38(2): 237-240. (in Chinese) |
| [5] | 鹿文红, 王继红, 张春荣, 等. 三唑醇及其对映异构体在3种不同类型土壤中的降解动态 [J]. 农药学学报, 2014, 16(5): 570-579.Lu Wenhong, Wang Jihong, Zhang Chunrong, et al. Degradation dynamics of triadimenol and its enantiomers in three different types of soil [J]. Chin J Pestic Sci, 2014, 16(5): 570-579. (in Chinese) |
| [6] | Zhang Qing, Hua Xiude, Shi Haiyan, et al. Enantioselective bioactivity, acute toxicity and dissipation in vegetables of the chiral triazole fungicide flutriafol [J]. J Hazard Mater, 2015, 284(2): 65-72. |
| [7] | Buerge I J, Poiger T, Muller M D, et al. Influence of pH on the stereoselective degradation of the fungicides epoxiconazole and cyproconazole in soils [J]. Environ Sci Technol, 2006, 40(17): 5443-5450. |
| [8] | 王鹏, 江树人, 姜伟, 等. HPLC法拆分粉唑醇对映体 [J]. 应用化学, 2005, 22(4): 445-447.Wang Peng, Jiang Shuren, Jiang Wei, et al. Enantiomeric separation of flutriafol by HPLC [J]. Chin J Appl Chem, 2005, 22(4): 445-447. (in Chinese) |
| [9] | Zhou Ying, Li Ling, Lin Kunde, et al. Enantiomer separation of triazole fungicides by high-performance liquid chromatography [J]. Chirality, 2009, 21(4): 421-427. |
| [10] | 曹巧, 董丰收, 刘新刚, 等. 戊唑醇对映体在直链淀粉衍生物手性固定相上的拆分 [J]. 农药, 2008, 47(3): 182-183.Cao Qiao, Dong Fengshou, Liu Xingang,et al. Enantiomeric separation of tebuconazole on amylose chiral stationary phase [J]. Agrochemicals, 2008, 47(3): 182-183. (in Chinese) |
| [11] | Taylor L T. Supercritical fluid chromatography for the 21st century [J]. J Supercrit Fluid, 2009, 47(3): 566-573. |
| [12] | Del Nozal M J, Toribio L, Bernal J L, et al. Separation of triadimefon and triadimenol enantiomers and diastereoisomers by supercritical fluid chromatography [J]. J Chromatogr A, 2003, 986(1): 135-141. |
| [13] | Toribio L, Del Nozal M J, Bernal J L, et al. Chiral separation of some triazole pesticides by supercritical fluid chromatography [J]. J Chromatogr A, 2004, 1046(1-2): 249-253. |
| [14] | Toribio L, Del Nozal M J, Bernal J L, et al. Enantiomeric separation of several antimycotic azole drugs using supercritical fluid chromatography [J]. J Chromatogr A, 2007, 1144(2): 255-261. |
| [15] | 朱明华, 胡坪. 仪器分析 [M]. 4版. 北京: 高等教育出版社, 2008: 10-18.Zhu Minghua, Hu Ping. Instrumental Analysis[M]. 4th ed. Beijing: Higher Education Press, 2008: 10-18. (in Chinese) |
| [16] | Qian-Cutrone J F, Hartz R, Ahuja V T, et al. Chiral separation of potent corticotropin-releasing factor-1 receptor antagonists by supercritical fluid chromatography [J]. J Pharm Biomed Anal, 2011, 54(3): 602-606. |
| [17] | PeAKčDar D, DoleAKčDek V. Thermodynamic properties of coenzyme Q10 in supercritical carbon dioxide [J]. J Supercrit Fluid, 2004, 40(2): 200-207. |
| [18] | Wang Chunlei, Zhang Yingru. Effects of column back pressure on supercritical fluid chromatography separations of enantiomers using binary mobile phases on 10 chiral stationary phases [J]. J Chromatogr A, 2013, 1281: 127-134. |
| [19] | Okamoto Y, Yashima E. Polysaccharide derivatives for chromatographic separation of enantiomers [J]. Angew Chem Int Ed, 1998, 37(8): 1020-1043. |
| [20] | 黄小龙, 张炽坚, 孙远明, 等. 高效液相色谱法拆分异丙草胺对映体 [J]. 武汉大学学报:理学版, 2014, 60(1), 62-64.Huang Xiaolong, Zhang Zhijian, Sun Yuanming, et al. Chiral resolution of propisochlor enantiomers by high performance liquid chromatography [J]. J Wuhan Univ :Nat Sci Ed, 2014, 60(1): 62-64. (in Chinese) |
| [21] | Yang Xue, Ma Binbin, Zheng Xiaqiong, et al. Chiral separation of ten arylphenoxypropionate herbicides on four chiral columns by supercritical fluid chromatography [J]. Anal Methods, 2014, 6(13): 4769-4774. |
 2015, Vol. 17
2015, Vol. 17


