灰霉病是一种世界性病害,对经济作物会造成严重损失。灰葡萄孢Botrytis cinerea可侵染番茄、黄瓜和葡萄等250多种植物,引起植物灰霉病[1]。目前,化学防治是控制该病最有效的手段之一。由于具有繁殖快、变异快和适合度高等特点,灰葡萄孢已经对苯并咪唑类的多菌灵、二甲酰亚胺类的腐霉利、异菌脲和苯胺基嘧啶类的嘧霉胺等常用化学杀菌剂普遍产生了抗性[2, 3]。因此,生产上迫切需要利用现有杀菌剂筛选具有增效作用的组合,进行桶混施药或开发新型高效复配杀菌剂,以克服或延缓抗药性。啶酰菌胺是德国巴斯夫公司开发的琥珀酸脱氢酶抑制剂,对灰霉病具有良好的防治效果,其作用机理是通过与植物病原菌细胞内的线粒体作用,与呼吸链电子传递体系中复合体Ⅱ结合,进而阻碍呼吸能量代谢,抑制ATP的合成,使菌体死亡[4]。唑胺菌酯是沈阳化工研究院自主研发的新型甲氧基丙烯酸酯类杀菌剂,对多种病害兼具保护和治疗活性[5],其作用机理是通过与病原菌线粒体电子传递链中复合物Ⅲ相结合,阻断电子传递,破坏能量的合成,从而抑制真菌生长或杀死病菌[6]。药剂的合理混配使用不但可以提高防效,扩大防治谱,还可延缓病菌抗药性的产生,降低用药成本。目前还未见啶酰菌胺与唑胺菌酯混配对灰葡萄孢毒力增效作用及其增效机制的研究报道。本研究通过测定啶酰菌胺与唑胺菌酯以不同比例混配后对灰葡萄孢多抗菌株DZ3的毒力,确定两者的最佳增效配比,并通过测定最佳配比对其他不同菌株的毒力及田间防效而加以验证;通过研究最佳配比对灰葡萄孢分生孢子呼吸代谢、细胞膜通透性和菌丝膜脂质过氧化的影响,初步探讨其增效机制,为番茄灰霉病的抗性治理及防治灰霉病杀菌剂的合理混配提供依据。 1 材料与方法 1.1 供试材料 1.1.1 菌株
供试灰葡萄孢菌株DZ3、DX4和SJZ5(对多菌灵、乙霉威和嘧霉胺高抗)、HD2(对多菌灵和乙霉威高抗,对嘧霉胺敏感)、LF8(对多菌灵和嘧霉胺高抗,对乙霉威敏感)、HS6(对多菌灵高抗,对乙霉威和嘧霉胺敏感),均从设施番茄上分离纯化获得,于4 ℃冰箱保存。 1.1.2 培养基
PDA培养基:马铃薯 200 g,葡萄糖20 g,琼脂12 g,蒸馏水定容至1 L;PD培养液:马铃薯 200 g,葡萄糖20 g,蒸馏水定容至1 L。 1.1.3 植物材料
室内试验:供试黄瓜品种为新泰密刺(新泰市祥云种业有限公司),在温室蛭石中培育黄瓜苗,待子叶充分展开时,供室内毒力测定。
田间试验:供试番茄品种为东圣(陕西东圣种业有限责任公司),在32穴育苗盘中培育番茄苗,待长至5~6片真叶时定植。 1.1.4 主要药剂及仪器
87%唑胺菌酯(pyrametostrobin)原药(沈阳化工研究院)、96%啶酰菌胺(boscalid)原药(巴斯夫欧洲公司)。50%啶酰菌胺水分散粒剂(巴斯夫欧洲公司);20%唑胺菌酯悬浮剂(沈阳化工研究院);400 g/L 嘧霉胺悬浮剂[拜耳作物科学(中国)有限公司]。
HI-2300型电导仪(常州诺基仪器有限公司);T6新世纪紫外可见分光光度计(北京普析通用仪器有限公司);JPB-607型便携式溶解氧测定仪(上海精密科学仪器有限公司)。QWJ型无油空气压缩机(上海曲辰机电技术有限公司);WS-16P型“卫士”牌背负式手动喷雾器(山东卫士植保机械有限公司)。 1.2 试验方法 1.2.1 啶酰菌胺与唑胺菌酯混配对灰葡萄孢菌丝生长的抑制作用及联合毒力
采用菌丝生长速率法[7]。称取一定量的啶酰菌胺和唑胺菌酯原药用丙酮溶解,分别配制成质量浓度为1×104 μg/mL的母液后,按不同质量比(9∶1、7∶1、5∶1、3∶1、1∶1、1∶3、1∶5、1∶7、1∶9)混合,得到不同配比的混合液。再用无菌水将各单剂及混剂稀释成质量浓度为100、50、10、5和1 μg/mL的药液,分别与PDA培养基按体积比1∶9 的比例混合,制成含药量分别为10、5、1、0.5和0.1 μg/mL的PDA平板。在无菌条件下,用打孔器在预培养3 d的DZ3菌落边缘打取直径为 5 mm 的菌饼,倒置转接到含药培养基上,每处理 3次重复,设溶剂对照和空白对照。将培养皿倒置,于25 ℃黑暗条件下培养3 d,用十字交叉法测量菌落直径,根据(1)式计算各处理的抑制率(IR),利用DPS v7.05软件计算啶酰菌胺、唑胺菌酯及其混合物对灰葡萄孢的有效抑制中浓度(EC50)及相关系数。采用Wadley 法[8]评价联合毒力,根据式(2)和式(3)计算增效系数(SR)。SR>1.5为增效作用;SR=0.5~1.5为相加作用;SR < 0.5 为拮抗作用。
| IR/%=[(dCK-5)-(dCT-5)]/(dCK-5)×100 | (1) |
| EC50(th)=(a+b) /[a /EC50 (A) +b /EC50 (B)] | (2) |
| SR=EC50(th) /EC50(ob) | (3) |
式(1)中,d表示菌落直径,CK和CT,分别表示对照和处理。式(2)和(3)中,A、B 分别代表两种药剂,a、b分别代表两种药剂的配比,EC50(ob) 为实际观察EC50值,EC50(th) 为理论EC50值。 1.2.2 增效组合对不同菌株的联合毒力测定
采用黄瓜子叶喷雾法[9]。按1.2.1节的方法将啶酰菌胺、唑胺菌酯及其混合物(质量比1∶3)分别配制成10、5、1、0.5、0.1和 0 μg/mL的药液。采用空气压缩机驱动的喉头喷雾器(压力0.1 MPa)分别将各药剂均匀喷洒于黄瓜子叶正面至流失(每浓度喷施15株),待药液晾干后,将子叶剪下,正面朝上,置于铺有湿滤纸的直径15 cm的培养皿中,采用空气压缩机驱动的喉头喷雾器将浓度为每mL含5×105个孢子的不同菌株分生孢子悬浮液(1%酵母浸膏、2.5%葡萄糖和10%胡萝卜汁)均匀喷接于黄瓜子叶正面,皿内相对湿度保持在90%以上,置于培养箱中于 23 ℃、全光照条件下培养3 d后,调查病情,根据式(4)和式(5)计算病情指数(ID)和相对防治效果(RC)。其中病情分级根据病斑面积占整个子叶面积的百分率划分,其分级标准如下:0级,未发病;1级,小于10%;3级,11%~25%;5级,26%~50%;7级,51%~75%;9级,76%以上。该试验重复1次,根据两次试验结果,计算混剂及其单剂的EC50平均值及增效系数。 (4)
| ID/%=∑[(Pi×Di)/(P×DM)]×100 | (4) |
| RC/%=[(ID(CK)-ID(CT))/ID(CK)]×100 | (5) |
式(4)中,Pi表示各级发病数,Di表示各级代表值,P表示调查总子叶数或总果数,DM表示最高级代表值。式(5)中ID表示病情指数,CK表示对照,CT表示处理。 1.2.3 增效组合对番茄灰霉病的田间防效
田间试验在河北省徐水县高林村镇白塔铺村进行。试验大棚外覆盖草苫保温,白天卷起。当棚内温度过低时,采用炉火升温。前茬为黄瓜,番茄种植15年以上,灰霉病历年发生。
2013年试验:番茄于1月18日定植,每公顷定植 45 000 株,试验共设7个处理(有效成分):50%啶酰菌胺水分散粒剂与20%唑胺菌酯悬浮剂混合物(质量比1∶3)200、250和300 g/hm2;50%啶酰菌胺水分散粒剂360 g/hm2;20%唑胺菌酯悬浮剂225 g/hm2;400 g/L嘧霉胺悬浮剂560 g/hm2;清水对照。试验小区采用随机区组排列,每处理4次重复,小区面积13 m2。用手动喷雾器分别于3月1日、3月10日和3月17日施药3次,每次用水量 900 L/hm2。
2014年试验:种植模式及试验处理与2013年一致。番茄于1月8日定植,分别于3月5日、3月13日和3月20日施药3次。
施药前灰霉病零星发生,基数视为零,末次用药后7 d调查发病情况[10]。每小区随机5点取样,每点调查2株,每株调查全部叶片和果实的发病情况。根据式(4)~(6)计算病果率(RD)、病情指数及防效。
| RD /%=(ND/n) ×100 | (6) |
式(6)中,ND表示病果数,n表示调查总果数。 1.2.4 增效组合对灰葡萄孢分生孢子呼吸代谢的影响
分生孢子悬浮液中溶氧量的测定[11]:将DZ3菌株在 PDA培养基上预培养约10 d,待产生分生孢子后用无菌水洗脱,制备浓度为每mL含5×105个孢子的分生孢子悬浮液。在100 mL三角瓶中依次加入36 mL质量浓度为0.1 mol/L的磷酸盐缓冲溶液 (PBS,pH 7.2)、4 mL 1%的葡萄糖溶液和10 mL分生孢子悬浮液,搅拌5 min后在密封状态下测定悬浮液中的溶氧量。用注射器分别加入啶酰菌胺、唑胺菌酯及其混合物(质量比1∶3),使其终浓度为50、10、5和1 μg/mL,摇匀,静置5 min后,于密封状态下测定悬浮液中的溶氧量。由菌体悬浮液中溶氧量的变化求出灰葡萄孢的呼吸速率(RR),单位为[μmol O2/(g·min)]。根据式(7)和(8)求出药剂对灰葡萄孢的呼吸抑制率(RI)。
| RR/(μmol O2/(g·min))=(Q0-Q1)/t | (7) |
| RI/%=(R0-R1)/R0×100 | (8) |
式(7)中,Q0、Q1 分别为处理前后溶液中的含氧量,t表示处理时间;式(8)中,R0、R1 分别为药剂加入前、后灰葡萄孢分生孢子的呼吸速率。 1.2.5 增效组合对灰葡萄孢细胞膜通透性的影响
采用电导率法测定[12]。按1.2.1节的方法将啶酰菌胺、唑胺菌酯及其混合物(质量比1∶3)分别配制成50、10、5和1 μg/mL的药液。用布氏漏斗将在PD培养液中培养4 d的DZ3菌丝抽干,用重蒸水洗 3次;分别称取2 g菌丝加至100 mL上述不同浓度药液中,在室温下,分别于0、5、15、30、60、90、180和360 min时测定其电导率。煮沸(死处理)后再次测定电导率。以重蒸水为对照。重复3次。根据式(9)计算各个时间点的相对电导率(RC)。
| RC/%=(Ct一C0)/C死处理×100 | (9) |
式(9)中,Ct为某一时刻的电导率值;C0为最初时刻(0 min)的电导率值;C死处理为煮沸后的电导率值。 1.2.6 增效组合对灰葡萄孢菌丝膜脂质过氧化的影响
采用2-硫代巴比妥酸(TBA)法[13]测定丙二醛(MDA)的含量。将在PD培养液中摇培4 d的DZ3菌丝过滤,用0.05 mol/L、pH 7.2的PBS缓冲液冲洗3次,转移至12个盛有30 mL PBS缓冲液的三角瓶中(每瓶中的菌丝重约1.5 g),分别加入啶酰菌胺、唑胺菌酯及其混合物(质量比1∶3),使其终浓度为5 μg/mL,预处理0、6、12、24 h后过滤得到菌丝。称取1 g菌丝(湿重),加入液氮,于冰浴下研磨,同时加入4 mL 0.05 mol/L、pH 7.2的PBS缓冲液,于10 000 r/min、4 ℃条件下离心10 min,取上清液2 mL 加入质量分数为10%的三氯乙酸(TCA) (含0.67% TBA)反应液,混匀后于100 ℃水浴中放置15 min,冰浴迅速冷却终止反应,于10 000 r/min、4 ℃下离心10 min,取上清液测定其在450、532和600 nm处的吸光度值。以PBS缓冲液为对照,按体积比5∶2的比例加入反应液。根据式(10)计算MDA浓度(c)(μmol/L)。
| c/(μmol/L)=6.45(OD532 - OD600)-0.56OD450 | (10) |
式(10)中,OD532、OD600和OD450分别表示532、600和450 nm处的吸光度值。 1.2.7 统计分析方法
采用DPS v7.05软件进行统计分析,用Fisher’s LSD法进行差异显著性分析。 2 结果与分析 2.1 啶酰菌胺与唑胺菌酯混配对灰葡萄孢的联合毒力
从表 1可知:啶酰菌胺与唑胺菌酯不同配比混合物均对灰葡萄孢的菌丝生长表现出很强的抑制作用。9种混合物对DZ3菌丝生长的抑制作用均强于各单剂,表现出增效作用,其中质量比为1∶3 的混合物增效作用最明显,增效系数(SR)为4.76。
|
|
表 1 啶酰菌胺和唑胺菌酯混配对灰葡萄孢菌丝生长的抑制作用 Table 1 Inhibitory action of boscalid-pyrametostrobin mixtures against mycelial growth of B.cinerea |
结果(表 2)显示:啶酰菌胺与唑胺菌酯质量比为1∶3的处理对5个供试菌株均具有很高的毒力,平均EC50值在0.433~0.679之间,增效系数在1.55~2.40之间,均表现出良好的增效作用。
|
|
表 2 啶酰菌胺与唑胺菌酯混合物(质量比1∶3)对5株灰葡萄孢的联合毒力 Table 2 Joint toxicity of a boscalid and pyrametostrobin mixture (1∶3, m/m) against 5 isolates of B.cinerea |
田间试验结果(表 3)表明:50%啶酰菌胺水分散粒剂与20%唑胺菌酯悬浮剂以有效成分质量1∶3的比例进行混配后,对番茄灰霉病表现出良好的防治效果,且均显著高于对照药剂嘧霉胺;两者混配后,除有效成分300 g/hm2处理外,均与各单剂防治效果相当。
|
|
表 3 不同药剂对番茄灰霉病的防治效果 Table 3 Efficacy of different fungicides in controlling tomato gray mould |
从表 4可以看出:啶酰菌胺、唑胺菌酯及其混合物(质量比1∶3)均对灰葡萄孢呼吸代谢表现出不同程度的抑制作用,且随着药剂浓度的升高而增强。在相同浓度下,两者混配后施用对灰葡萄孢呼吸代谢的抑制作用与其单剂啶酰菌胺相当,但显著高于其单剂唑胺菌酯。
|
|
表 4 啶酰菌胺与唑胺菌酯混合物(质量比1∶3)对灰葡萄孢分生孢子呼吸代谢的影响 Table 4 Effect of boscalid-pyrametostrobin mixture (1∶3, m/m) on conidial respiration of B. cinerea |
由图 1可知:供试灰葡萄孢菌株DZ3的相对电导率,随处理时间的推移而升高。质量浓度为50、10和5 μg/mL的各处理在前5 min内,菌株DZ3的相对电导率增长幅度最大,随着处理时间的延长,相对电导率的增长幅度有所降低,但均高于其单剂和对照,说明两者混配后施用增强了灰葡萄孢细胞膜的通透性;当处理浓度为1 μg/mL时,在前 5 min内两者混配与各单剂及对照的相对电导率相当,处理15 min时增幅最大,且显著高于各单剂及对照。
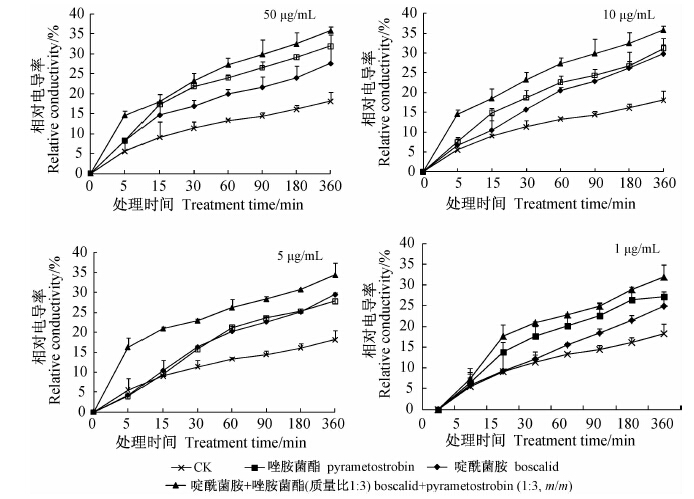 | 图 1 不同浓度啶酰菌胺与唑胺菌酯(质量比1∶3)混合物对灰葡萄孢菌丝相对电导率的影响 Fig. 1 Effect of boscalid-pyrametostrobin mixtures(1∶3, m/m) on relative conductivity of the mycelia of B.cinerea at different concentrations |
MDA是膜脂过氧化的产物,其含量可反映膜脂过氧化的程度,是反映膜系统受伤害的重要指标之一[14],当细胞膜破损时会释放到细胞外的培养液中[15]。本研究中,经啶酰菌胺、唑胺菌酯及其混合物(质量比1∶3)处理后,随药剂作用时间的延长,MDA含量均呈现出在菌丝中逐渐降低,而在PBS缓冲液中逐渐升高的变化趋势,且两者混配后均显著高于其单剂处理 (图 2),表明两者混配后施用加速了灰葡萄孢菌丝膜脂质过氧化,加剧了膜损伤程度。
 | 图 2 啶酰菌胺与唑胺菌酯(质量比1∶3)混合物对灰葡萄孢菌丝膜质过氧化的影响 Fig. 2 Effect of boscalid-pyrametostrobin mixture(1∶3, m/m) on lipid peroxidation of B.cinerea mycelia |
药剂混用协同效应的机理一般可分为被动的跨膜扩散、载体介导的靶标运输、活化作用、解毒作用、与靶标位点的亲合力、规避靶标位点和靶标位点的补偿等[16]。啶酰菌胺和唑胺菌酯的作用机理是分别通过与线粒体呼吸链中的复合物Ⅱ和Ⅲ结合,阻断电子传递,破坏能量的合成,从而抑制病菌生长或杀死病菌。线粒体呼吸链包含4种蛋白复合体Ⅰ~IV,由于线粒体中需要经呼吸链氧化和电子传递的主要是NADH,而FADH2较少,可将呼吸链分为主、次呼吸链[17]。主呼吸链从NADH开始,由复合体Ⅰ、Ⅲ和Ⅳ构成,次呼吸链从FADH2开始,由复合体Ⅱ、Ⅲ、Ⅳ构成。除了以上常规途径之外,还存在能够将电子从NADH直接传送给分子氧的候补通道,该途径中的电子传递只通过复合体Ⅰ,而不经过复合体Ⅲ和Ⅳ。本研究发现:在相同浓度下,啶酰菌胺与唑胺菌酯(质量比1∶3)混配后对灰葡萄孢呼吸速率的抑制作用显著高于唑胺菌酯,但与啶酰菌胺相当。虽然啶酰菌胺与唑胺菌酯作用于病原菌呼吸链中电子传递的不同位点,但由于病原菌线粒体电子传递链比较复杂,两者混用对灰葡萄孢呼吸的抑制未表现增效作用。其是怎样影响线粒体呼吸作用的还有待于进一步研究。
当真菌细胞膜受损时,可使膜的构造发生变化,进而影响膜的结构及功能,导致细胞膜通透性改变[18]。本研究中,啶酰菌胺与唑胺菌酯(质量比1∶3)混配药剂,不但增强了其对灰葡萄孢细胞膜的损伤程度,而且显著增加了灰葡萄孢细胞膜的通透性。由此推断其增效作用机理可能是,由于混配后增强了对细胞膜的破坏作用,导致灰葡萄孢无法维持正常的生理功能,同时其又提高了细胞膜的通透性,加快了药剂跨膜扩散的速度,易与靶标结合,从而显现出增效作用。啶酰菌胺与唑胺菌酯均为能量合成抑制剂,两者混配后是通过什么途径影响了灰葡萄孢细胞膜的通透性,还有待进一步研究。
啶酰菌胺与甲氧基丙烯酸酯类杀菌剂嘧菌酯、醚菌酯混配后对灰葡萄孢也表现出良好的毒力增效作用[19];同时,啶酰菌胺与嘧菌酯和醚菌酯之间存在负交互抗性关系[20]。啶酰菌胺与唑胺菌酯之间是否存在负交互抗性还有待进一步研究。 4 结论
啶酰菌胺与唑胺菌酯按质量比1∶3混配后对灰葡萄孢的毒力具有增效作用,在田间对番茄灰霉病具有良好的防治效果,可用于灰霉病的防治。啶酰菌胺与唑胺菌酯混配后增强了其对灰葡萄孢细胞膜的损害程度,从而使药剂易与靶标相结合可能是其增效的机理之一。
| [1] | Elad Y, Williamson B, Tudzynski P, et al. Botrytis spp. and diseases they cause in agricultural systems-an introduction[M]//Elad Y, Williamson B, Tudzynski P, et al. Botrytis: Biology, Pathology and Control. Netherlands: Springer, 2007: 1-8. |
| [2] | Zhang Chuanqing, Hu Jiali, Wei Fengling, et al. Evolution of resistance to different classes of fungicides in Botrytis cinerea from greenhouse vegetables in eastern China[J].Phytoparasitica, 2009, 37(4): 351-359. |
| [3] | Sun Haiyan, Wang Hancheng, Chen Yu, et al. Multiple resistance of Botrytis cinerea from vegetable crops to carbendazim, diethofencarb, procymidone, and pyrimethanil in China[J].Plant Dis, 2010, 94(5): 551-556. |
| [4] | 亦冰. 新颖杀菌剂——啶酰菌胺[J]. 世界农药, 2006, 28(5): 51-53. Yi Bing. Anovel fungicides-boscalid[J].Word Pestic, 2006, 28(5): 51-53. (in Chinese) |
| [5] | 曹秀凤, 刘君丽, 李志念, 等. 新杀菌剂唑胺菌酯的作用特性[J]. 农药, 2010, 49(5): 323-325. Cao Xiufeng, Liu Junli, Li Zhinian, et al. The Characteristics of the new fungicide pyrametostrobin[J]. Agrochemicals, 2010, 49(5): 323-325.(in Chinese) |
| [6] | 思彬彬, 杨卓. 甲氧基丙烯酸酯类杀菌剂作用机理研究进展[J]. 世界农药, 2007, 29(6): 5-9. Si Binbin, Yang Zhuo. Studies on mechanism and resistance to strobilurin fungicides[J].World Pestic, 2007, 29(26): 5-9. (in Chinese) |
| [7] | 孙广宇, 宗兆峰. 植物病理学实验技术[M]. 北京: 中国农业出版社, 2002: 139-146. Sun Guangyu, Zong Zhaofeng. Laboratory Manual of Plant Pathology[M]. Beijing: China Agriculture Press, 2002: 139-146. (in Chinese) |
| [8] | 韩丽娟, 顾中言, 王强. 农药复配与复配农药[M]. 南京: 江苏科学技术出版社, 1994: 44-45. Han Lijuan, Gu Zhongyan, Wang Qiang. Pesticide Mixtures and Mixtures of Pesticides[M]. Nanjing: Jiangsu Science and Technology Press, 1994: 44-45. (in Chinese) |
| [9] | 陈治芳, 韩秀英, 王文桥, 等. 一种测定杀菌剂对灰霉病菌(Botrytis cinerea)毒力方法的改进[J]. 中国农学通报, 2011, 27(5): 346-350. Chen Zhifang, Han Xiuying, Wang Wenqiao, et al. Improvement of a fungitoxicity test of fungicide to Botrytis cinerea[J].Chin Agric Scie Bull, 2011, 27(5): 346-350. (in Chinese) |
| [10] | GB/T 17980.28—2000, 农药田间药效试验准则(一): 杀菌剂防治蔬菜灰霉病[S]. 北京: 中国标准出版社, 2000. GB/T17980.28—2000, Pesticide-Guidelines for the field efficacy trials (1): Fungicides against grey mould of vegetables[S]. Beijing: China Standards Press, 2000. (in Chinese) |
| [11] | 宋风平, 王树桐, 胡同乐, 等. 芒果苷对马铃薯晚疫病菌的抑菌作用机制初探[J]. 农药学学报, 2009, 11(2): 213-218. Song Fengping, Wang Shutong, Hu Tongle, et al. Preliminary studies on the mode of action of mangiferin against Phytophthora infestans[J].Chin J Pestic Sci, 2009, 11(2): 213-218. (in Chinese) |
| [12] | 夏晓明, 王开运, 范昆, 等. 抗戊唑醇禾谷丝核菌的渗透压敏感性及相对渗率变化研究[J]. 农药学学报, 2005, 7(2): 126-130. Xia Xiaoming, Wang Kaiyun, Fan kun, et al. Changes of relative leakage and osmolarity sensitivity to tebuconazole-resistant strains of Rhizoctonia cerealis[J].Chin J Pestic Sci, 2005, 7(2): 126-130. (in Chinese) |
| [13] | 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 260-261. Li Hesheng. Testing Principle and Technique of Plant Physiology and Chemistry[M]. Beijing: Higher Education Press, 2000: 206-261. (in Chinese) |
| [14] | 张义贤, 张丽萍. 重金属对大麦幼苗膜脂过氧化及脯氨酸和可溶性糖含量的影响[J]. 农业环境科学学报, 2006, 25(4): 857-860. Zhang Yixian, Zhang Liping.Effects of heavy metals on membrane lipid peroxidation, proline and soluble sugar in roots of Hordeum vulgare[J].J Agro-Environ Sci, 2006, 25(4): 857-860. (in Chinese) |
| [15] | Choi G J, Lee H J, Cho K Y. Lipid peroxidation and membrane disruption by vinclozolin in dicarboximide-susceptible and -resistant isolates of Botrytis cinerea[J].Pestic Biochem Physiol, 1996, 55(1): 29-39. |
| [16] | De Waard M A. Fungicide synergism and antagonism[M]//Fungicides for Crop Protection BCPC Monograph No. 31. UK: Surrey, BCPC, 1985: 9-95. |
| [17] | Graham L A, Phillips J D, Trumpower B L. Deletion of subunit 9 of the Saccharomyces cerevisiae cytochrome bc1 complex specifically impairs electron transfer at the ubiquinol oxidase site (center P) in the bc1 complex[J].FEBS Lett, 1992, 313(3): 251-254. |
| [18] | 李得宙, 张笑宇, 刘正垣, 等. 菌核菌粗毒素对向日葵种子及幼苗的毒害作用[J]. 北京农学院学报, 2008, 23(4): 21-24. Li Dezhou, Zhang Xiaoyu, Liu Zhengyuan, et al. Poisoning effects of crude toxin by Sclerotinia sclerotiorum on seed and seedling of sunflower[J].J Beijing Univ Agric, 2008, 23(4): 21-24. (in Chinese) |
| [19] | 赵建江, 张小风, 马志强, 等. 啶酰菌胺与嘧菌酯混配对灰葡萄孢的增效作用[M]//周明国. 中国植物病害化学防治研究(第九卷). 北京: 中国农业科学技术出版社, 2014: 101-105. Zhao Jianjiang, Zhang Xiaofeng, Ma Zhiqiang, et al. Synergistic interaction of mixtures of boscalid with azoxystrobin against Botrytis cinerea[M]//Zhou Mingguo. Studies on Chemical Control of Plant Diseases in China (9th vol.). Beijing: Agricultural Science and Technology Press of China, 2014: 101-105. |
| [20] | Zhang C Q, Yuan S K, Sun H Y, et al. Sensitivity of Botrytis cinerea from vegetable greenhouses to boscalid[J].Plant Pathol, 2007, 56(4): 646-653. |
 2015, Vol. 17
2015, Vol. 17

