2. 甘肃农业大学 草业学院, 兰州 730070
2. Pratacultural College, Gansu Agricultural University, Lanzhou 730070, China
光解是农药降解的重要途径之一,对于光敏感农药,光解更是其生物防治作用减弱和有效利用率降低的重要原因[1, 2, 3]。研究表明,很多农药的光解产物与原药相比生物活性降低,但毒性增加[4, 5, 6]。因此,采取适当措施减缓或阻止光敏感农药的光解作用,是提高该类农药有效利用率和安全性的关键。采取农药化学结构修饰[7]、添加紫外吸收剂或光稳定剂[8, 9]等措施可降低农药的光解率,但其弊端也不容忽视:农药化学结构被修饰后,其生物活性有时会不可避免地降低[10, 11];紫外吸收剂或光稳定剂虽有一定的抗光解作用,但在强光下农药的光解依然严重,同时,紫外吸收剂或光稳定剂还可能对环境有害[12]。因此,亟需寻找一种在保证农药生物活性和安全性的前提下提高农药光稳定性的新方法。而近年来研究较多的微囊技术正是解决这一难题且极具前景的一种方法。
近年来,研究者采用微囊技术已显著提高了除虫菊酯、氨氯吡啶酸(picloram)以及印楝素等农药的光稳定性[13, 14, 15]。目前,氟乐灵的微囊化研究主要集中在制备条件对微囊形态和粒径的影响,多数以合成材料脲醛树脂为壁材[16],而对微囊的缓释性能及光稳定性研究甚少。有报道称,采用蒙脱土吸附的方法能显著提高氟乐灵的光稳定性[17],但该文并未涉及氟乐灵的释放特性。
氟乐灵,化学名称为2,6-二硝基-N,N-二正丙基-4-三氟甲基苯胺,结构式见(Ⅰ), 是一种二硝基苯胺类除草剂,主要用于棉花、大豆等作物田防除禾本科杂草和部分阔叶杂草,在我国应用广泛,但氟乐灵极易光解(光解半衰期9.6 h)[18],且其光解产物多数没有生物活性[17],通常采用增加施用次数和施药量来提高防效,这不仅增加了应用成本也增加了污染环境的风险,因此,提高氟乐灵的光稳定性具有重要意义。
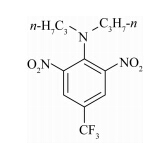
氟乐灵(trifluralin)
Ⅰ
壳聚糖是一种含有氨基和羟基的天然高分子材料,化学性质活泼[19],具有良好的生物相容性和生物可降解性,已广泛用于药物负载[20]。有报道称,壳聚糖能吸收紫外光[2],是包覆光敏感农药的理想载体。本研究以极易光解的氟乐灵为芯材,以天然高分子材料壳聚糖和甲基丙烯酸甲酯为壁材,采用原位聚合法制备了氟乐灵微囊,并对其缓释性能和光稳定性进行了研究,旨在为制备光敏农药微囊、提高其有效利用率提供参考。
1 材料与方法 1.1 仪器与试剂85-2型恒温电磁搅拌器,上海司乐仪器有限公司;RE-2000旋转蒸发器,上海亚荣生化仪器厂;TG20-WS离心机,长沙湘智离心机仪器有限公司;Matersizer Micro激光粒度分析仪,英国马尔文仪器有限公司;CX22光学显微镜,日本奥林巴斯公司;FD-1-50型真空冷冻干燥机,北京博医康实验仪器有限公司;Agilent 1200型高效液相色谱仪,美国安捷伦科技有限公司;Hitachi S4800冷场发射扫描电子显微镜,日本日立公司。
97% 氟乐灵(trifluralin,TF)原药,由中国农业科学院植物保护研究所农药质量与全分析实验室提供;壳聚糖(chitosan,CS,脱乙酰度≥91%),国药集团化学试剂有限公司;98%甲基丙烯酸甲酯(methyl methacrylate,MMA)和98%硝酸铈铵(ceric ammo-nium nitrate,CAN),北京偶合科技有限公司;99%氟乐灵标准品,迈克斯(如东)化工有限公司;甲醇和乙腈,色谱纯试剂;其余试剂均为分析纯。
1.2 氟乐灵微囊的制备采用原位聚合法[21]制备。其原理为:引发剂硝酸铈铵活化壳聚糖产生氮自由基,与甲基丙烯酸甲酯在反应条件下发生亲核加成反应[22],生成的共聚物将氟乐灵包裹形成微囊。在250 mL三口瓶中,加入0.5 g CS溶解于75 mL质量分数为0.43%的乙酸去离子水溶液,加热至50 ℃,通入氮气0.5 h后加入1 g MMA。称取0.3 g 氟乐灵原药溶解于5 mL丙酮中,边搅拌边滴加到反应体系,搅拌10 min 后升温至70 ℃。称取0.18 g CAN溶解于10 mL 硝酸水溶液中,加入反应体系,在70 ℃、400 r/min下搅拌反应24 h。过滤,滤液在8 000 r/min下离心10 min,用蒸馏水冲洗沉淀3次,冷冻干燥48 h,即得氟乐灵微囊干粉。
1.3 氟乐灵微囊的表征 1.3.1 微囊的形态观察光学显微镜观察:取一定量的氟乐灵微囊干粉加入蒸馏水中,超声后制得微囊悬浮液。将其小心滴于载玻片上,盖上盖玻片,调节显微镜观察微囊形态,并拍照。
扫描电子显微镜观察:将微囊悬浮液滴加在硅片上,待水分自然挥发后,置于显微镜下观察拍照。
1.3.2 微囊粒径测定在微囊干粉中加入适量蒸馏水,超声后制得微囊悬浮液。在2 000 r/min搅拌下,将其滴加到去离子水中,用Malvern激光粒度仪测定氟乐灵微囊的粒径大小及其分布。
1.3.3 微囊包封率与载药量测定准确称量0.025 g(精确至0.000 1 g)氟乐灵微囊干粉,用色谱纯甲醇溶解并定容至25 mL,经0.22 μm膜过滤。滤液经Eclipse XDB-C18(250 mm × 4.6 mm(i.d),5 μm)色谱柱分离,在220 nm波长下经高效液相色谱带二极管阵列检测器(HPLC-DAD)检测,流动相V(甲醇)∶V(水)=95∶5,外标法计算微囊中氟乐灵的含量。按公式(1)和(2)计算包封率和载药量。


采用淋溶法[23]测定。将20 g柱层析硅胶填入内径为2 cm的层析柱中并压实,用甲醇充分饱和后,加入0.05 g(精确至0.000 1 g)氟乐灵微囊干粉,上面覆盖一层石英砂。层析柱用锡箔纸包裹防止光照。分别在0.5、1.5、6、12 h及以后每隔12 h加入10 mL甲醇淋洗。接取10 mL淋洗液,经0.22 μm膜过滤,采用HPLC-DAD检测淋洗液中氟乐灵的含量,检测条件同1.3.3节。以氟乐灵原药作为对照。
绘制氟乐灵微囊的累积释放曲线,按公式(3)[24]计算累积释放百分率。
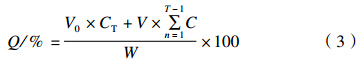
其中,Q:累积释放百分率,%;CT:取样时间点时释放到介质中的药物浓度,mg/mL;V:每次取样时释放介质的体积,mL;V0:释放介质的总体积,mL;W:所添加微囊中药物的质量,mg。
1.5 氟乐灵微囊的光稳定性试验 1.5.1 微囊在土壤表面的光稳定性 1.5.1.1 土壤处理将土壤风干,过2 mm筛,于800 ℃下烧1 h,以除去有机质和微生物等物质,防止其对氟乐灵光解的干扰。
1.5.1.2 添加回收试验标准溶液配制:准确称取0.025 g (精确至0.000 1 g)氟乐灵标准品,用色谱纯甲醇溶解并定容至25 mL,配制成1 000 mg/L的母液,再用甲醇逐级稀释,配制质量浓度分别为500、250、125、25、2.5 mg/L的系列标准溶液。分别移取1 mL 系列标准溶液,经氮气吹干,加入1 mL空白基质提取液,配制成相应的基质匹配标准溶液。
样品前处理:1)提取。称取3 g处理过的土壤于50 mL具塞离心管中,分别加入1 mL质量浓度分别为5、50和125 mg/L的氟乐灵标准溶液,加盖涡旋30 s;加入2 mL蒸馏水和3 mL分析纯乙腈,加盖涡旋3 min;加入0.5 g氯化钠和2 g无水硫酸镁,加盖涡旋3 min;在4 000 r/min下离心5 min,抽取1.5 mL上清液于2 mL离心管中。2)净化。加入50 mg N-丙基乙二胺(PSA)和150 mg无水硫酸镁,加盖涡旋1 min,在4 000 r/min下离心5 min,抽取1 mL上清液,过0.22 μm滤膜,用HPLC-DAD检测氟乐灵含量,计算添加回收率。检测条件见1.3.3节。每个处理重复5次。
1.5.1.3 氟乐灵乳油及其微囊悬浮液的制备48%氟乐灵乳油配方(质量分数,其中乳油组分折百计算):97%氟乐灵原药,49.5%;农乳500#,7%;农乳700#,3%;二甲苯补足100%。
分别称取一定量的氟乐灵乳油和氟乐灵微囊干粉,加入适量蒸馏水,分别超声配制成有效成分为50 mg/L的氟乐灵乳状液和微囊悬浮液。
1.5.1.4 光解试验参考文献方法[25]进行。将9 g处理好的土壤均匀铺展在直径为 9 cm的培养皿中,土层厚度约为1 mm,均匀加入5 mL蒸馏水后于室温下阴干。将3 mL 50 mg/L的氟乐灵微囊悬浮液均匀滴加于土壤表面,使土壤中氟乐灵的质量分数为12.5 mg/kg。将加盖培养皿放置在人工氙灯(波长范围为290~800 nm,光强为12 000 lx)下光照,保持温度为(30±2) ℃。分别于光照0、1、3、7、14、24、38和58 d后取出,用锡箔纸包裹,置于4 ℃下保存,待提取及检测。氟乐灵的提取和净化操作与添加回收试验相同,HPLC检测条件同1.3.3节。
1.5.2 氟乐灵微囊在水中的光稳定性 1.5.2.1 添加回收试验标准溶液配制:按1.5.1.2节的方法,用乙腈将氟乐灵标准品配制成100、50、25、10和1 mg/L 的系列标准溶液。分别移取 1 mL 该溶液,经氮气吹干,加入1 mL蒸馏水,配制成相应的基质匹配标准溶液。
样品前处理:在2 mL蒸馏水中加入2 mL质量浓度为5、50和100 mg/L氟乐灵标准溶液,混匀,加入0.5 g 氯化钠,静置,抽取1 mL上层溶液,过0.22 μm膜,用HPLC-DAD检测,检测条件同1.3.3节。每个处理重复5次。
1.5.2.2 光解试验参考文献方法[25]进行。在100 mL锥形瓶中加入50 mg/L的氟乐灵微囊悬浮液50 mL,在100 r/min下搅拌,以防止微囊沉降,将其置于人工氙灯(波长范围为290~800 nm,照度为12 000 lx)下光照,保持温度为(30±2) ℃。分别于光照0、10、30 min及以后每隔30 min,按1.5.2.1节方法处理样品。用HPLC-DAD检测氟乐灵含量,色谱条件同1.3.3节。以氟乐灵乳油为对照。
1.6 光解试验数据分析采用Origin V8.0分析氟乐灵微囊在土壤表面和水中的光解数据,绘制氟乐灵微囊的光解动态曲线,分别按公式(4)和(5)计算光解速率常数k和光解半衰期t1/2。


式中ct:t时氟乐灵的质量浓度,mg/L;c0:氟乐灵起始质量浓度,mg/L;k:光解速率常数;t:反应时间。
氟乐灵微囊的光保护率(the photo-protection percentage of TF,%PPTF)[26]是指氟乐灵微囊相对于其他剂型光解减弱的百分率,是反映光稳定性提高程度的重要参数,可按公式(6)计算。
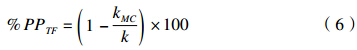
其中,kMC:氟乐灵微囊的光解速率常数;k:除微囊外,氟乐灵其他剂型的光解速率常数。
2 结果与分析 2.1 氟乐灵微囊的形貌及粒径
光学显微镜和扫描电子显微镜观察结果(图 1)显示:所制备的氟乐灵微囊为规则球形颗粒,黄色的氟乐灵包裹在微囊内部。激光粒度仪测定数据表明:氟乐灵微囊粒径在3~10 μm之间,平均粒径为6.5 μm。
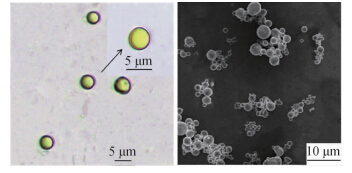 | 图 1 氟乐灵微囊的光学显微镜和扫描电子显微镜图片 Fig. 1 The optical microscope photo and SEM photo of trifluralin-loaded microcapsules |
由公式(1)和(2)计算得知,所制备的氟乐灵微囊的包封率为79%,载药量为45%。
2.3 氟乐灵微囊的释放特性 2.3.1 释放曲线氟乐灵微囊和氟乐灵原药的累积释放曲线见图 2。图中显示,在1.5 h时,氟乐灵原药的累积释放百分率高达94%,而氟乐灵微囊的仅为38%。与原药相比,微囊能够显著降低氟乐灵的释放速率,这是由于微囊外壁降低了芯材的释放速率[27]。氟乐灵微囊的释放过程可分为突释和缓慢稳定释放两个连续的阶段,在这两个阶段氟乐灵的累积释放百分率分别为38%和61%。突释是由附着在微囊外壁及浅层的氟乐灵快速释放造成的,这些突释的氟乐灵有利于发挥速效性;而在第二阶段缓慢释放出的微囊深层的氟乐灵则有利于发挥持效性。微囊的缓释特性能延长氟乐灵的持效期,提高药剂有效利用率。此外有报道称,药物的缓慢释放能降低其向环境扩散的速率,减少其光解[28]。
 | 图 2 氟乐灵微囊和氟乐灵原药的释放曲线 Fig. 2 Release profiles of trifluralin-loaded microcapsules(MC) and technical(TC) |
建立芯材的释放模型是研究微囊释放动力学的一种有效方法。目前,常用的释放模型有以下4种:零级释放动力学模型、一级释放动力学模型、Higuchi模型[29]和Korsmeyer-Peppas模型[30]。这4种模型的方程和释放机理如下:
零级释放动力学模型:Q=a+bt,其释放机理是恒速释放,即微囊中芯材的释放速率与药物浓度无关。一级释放动力学模型:Q=a(1- ebt),其释放机理是一级释放,芯材释放速率与芯材浓度成正比。 Higuchi模型:Q=a+bt1/2,微囊释放的芯材质量与时间的平方根成正比,其微囊释放机理是Fick扩散,当芯材均匀分布在整个微囊中或部分芯材溶解在外壁中时,其释放动力学符合Higuchi方程。 Korsmeyer-Peppas模型:logQ=a+nlogt,n为扩散指数,根据n的数值推断微囊释放机理的类型,当n < 0.45时,芯材的释放以Fick扩散为主;当0.45<n < 0.89时,芯材的释放以通过芯材扩散和外壁溶蚀释放为主;当n >0.89时,芯材以外壁溶蚀释放为主。
将氟乐灵微囊释放数据拟合上述4种模型,结果见图 3。拟合方程和决定系数R2见表 1。 Korsmeyer-Peppas模型的决定系数最接近1,表明该模型拟合效果最好,扩散指数n为0.140 5,小于0.45,因此推断氟乐灵微囊释放以Fick扩散为主。
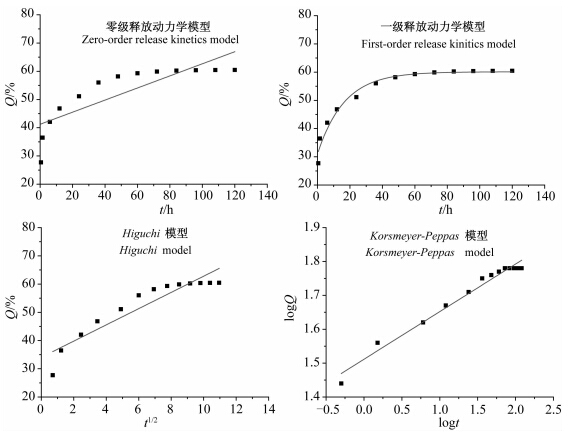 | 图 3 氟乐灵微囊释放的模型拟合图 Fig. 3 Model fitting of cumulative release of trifluralin-loaded microcapsules |
|
|
表 1 氟乐灵微囊释放数据的拟合模型 Table 1 The fitting models of release of trifluralin-loaded microcapsules |
氟乐灵在2.5~500 mg/L(土壤光解)和1~100 mg/L(水中光解)范围内线性良好,相关系数均大于0.996 5;在土壤中的平均添加回收率为87%~107%,相对标准偏差为3.2%~6.2%;在水中的平均添加回收率为80%~113%,相对标准偏差为4.2%~7.6%;在土壤和水中的定量限分别是2.5 mg/L和1 mg/L。该方法的准确度、灵敏度和精密性均符合相关要求。
2.4.2 氟乐灵微囊在土壤和水中的光稳定性农药的光稳定性对其在环境中的残留消解动态和持效期有直接影响。以往农药的光稳定性研究多以有机溶剂为介质,而实际应用中农药多以水为介质喷施,因此本研究以水为介质研究了氟乐灵微囊的光稳定性。目前,氟乐灵的使用以土壤处理为主,因此笔者对氟乐灵微囊在土壤表面的光稳定性也进行了研究,以全面评价其光稳定性。
从图 4和表 2可以看出:在土壤光照1 d和水中光照30 min,氟乐灵微囊的光解速率与氟乐灵乳油的基本相同,这是由微囊表面及已释放到介质中的氟乐灵快速光解造成的;而此后,氟乐灵微囊的光解速率远小于氟乐灵乳油,其光解半衰期(t1/2)也分别由氟乐灵乳油的8 d和98 min延长至15 d和173 min。在土壤和水中,氟乐灵微囊相对于氟乐灵乳油的光保护率分别为48%和44%。氟乐灵微囊光稳定性增强的原因有两点:一是壁材吸收或阻隔了光照(壳聚糖能吸收和分散紫外光[31]),二是微囊的缓释特性使暴露在光照下的氟乐灵的量低于乳油。
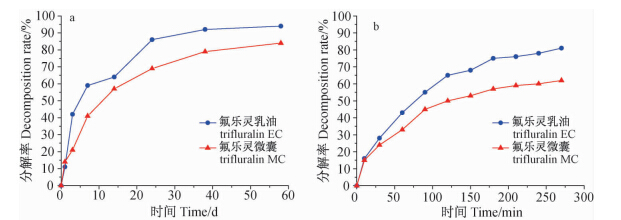 | 图 4 氟乐灵微囊与氟乐灵乳油在土壤(a)和水中(b)的光解动态曲线 Fig. 4 Photolysis of trifluralin-loaded microcapsules(MC) and trifluralin emulsifiable concentrate (EC) in soil(a) and in water(b) |
|
|
表 2 氟乐灵微囊和氟乐灵乳油在土壤和水中的光解动力学方程 Table 2 The photolysis kinetics equations of trifluration-loaded microcapsules(MC) and emulsifiable concentrate(EC) in soil and in water |
本研究以具有生物可降解性的壳聚糖及甲基丙烯酸甲酯为壁材,采用原位聚合法制备了氟乐灵微囊。该微囊呈规则的球形颗粒,粒径主要集中在3~10 μm,平均粒径为6.5 μm。其包封率和载药量较高,分别为79%和45%。采用淋溶法测定了微囊的释放特性,结果表明:该微囊具有良好的缓释性能;微囊的释放符合Korsmeyer-Peppas模型,其释放以Fick扩散为主。与乳油相比,氟乐灵微囊在土壤表面和水中的光稳定性均显著增强,这对提高氟乐灵的有效利用率具有重要意义。本研究采用的壁材壳聚糖来源广泛、成本低、生物相容性好,可用于研发环境友好的新剂型。
| [1] | Tiefenbacher E M, Haen E, Przybilla B, et al. Photodegradation of some quinolones used as antimicrobial therapeutics[J]. J Pharm Sci, 1994, 83(4): 463-467. |
| [2] | Nguyen H M, Hwang I C, Park J W, et al. Photoprotection for deltamethrin using chitosan-coated beeswax solid lipid nanoparticles[J]. Pest Manag Sci, 2012, 68(7): 1062-1068. |
| [3] | Liu Pengyan, Liu Yujie, Liu Qingxue, et al. Photodegradation mechanism of deltamethrin and fenvalerate[J]. J Environ Sci China, 2010, 22(7): 1123-1128. |
| [4] | Tiryaki O, Temur C. The fate of pesticide in the environment[J]. J Biol Environ Sci, 2010, 4(10): 29-38. |
| [5] | Franko M, Sarakha M, Čibej A, et al. Photodegradation of pesticides and application of bioanalytical methods for their detection[J]. Pure Appl Chem, 2005, 77(10): 1727-1736. |
| [6] | Benitez F J, Acero J L, Real F J, et al. Photolysis of model emerging contaminants in ultra-pure water: kinetics, by-products formation and degradation pathways[J]. Water Res, 2013, 47(2): 870-880. |
| [7] | Wissing S A, Müller R H. The development of an improved carrier system for sunscreen formulations based on crystalline lipid nanoparticles[J]. Int J Pharm, 2002, 242(1-2): 373-375. |
| [8] | Sundaram K M S, Curry J. Effect of some UV light absorbers on the photostabilization of azadirachtin, a neem-based biopesticide[J]. Chemosphere, 1996, 32(4): 649-659. |
| [9] | Tan Weihong, Song Zhanqian. Research on effect of four natural ultraviolet light absorbers on photostabilization of azadirachtin-A[J]. Agric Sci China, 2006, 5(11): 855-858. |
| [10] | Margulies L, Rozen H, Cohen E. Photostabilization of a nitromethylene heterocycle insecticide on the surface of montmorillonite[J]. Clays Clay Miner, 1988, 36(2): 159-164. |
| [11] | El-Nahhal Y, Nir S, Margulies L, et al. Reduction of photodegradation and volatilization of herbicides in organo-clay formulations[J]. Appl Clay Sci, 1999, 14(1-3): 105-119. |
| [12] | 卢向阳, 刘伟成, 卢彩鸽, 等. 6种光稳定剂对那他霉素抗光解的影响[J]. 农药, 2011, 50(8): 570-572. Lu Xiangyang, Liu Weicheng, Lu Caige, et al. Effects of six light stabilizers on natamycin anti-photolysis[J]. Agrochemicals, 2011, 50(8): 570-572.(in Chinese) |
| [13] | Fernández-Pérez M, Flores-Céspedes F, Daza-Fernández I, et al. Lignin and lignosulfonate-based formulations to protect pyrethrins against photodegradation and volatilization[J]. Ind Eng Chem Res, 2014, 53(35): 13557-13564. |
| [14] | Wang Xiaojing, Zhao Jing. Encapsulation of the herbicide picloram by using polyelectrolyte biopolymers as layer-by-layer materials[J]. J Agric Food Chem, 2013, 61(16): 3789-3796. |
| [15] | Riyajan S A, Sakdapipanich J T. Encapsulated neem extract containing azadiractin-A within hydrolyzed poly(vinyl acetate) for controlling its release and photodegradation stability[J]. Chem Eng J, 2009, 152(2-3): 591-597. |
| [16] | 董红强, 徐好学, 胡克德, 等. 分散乳化条件对氟乐灵微囊悬浮剂形成状态的影响[J]. 农药, 2010, 49(6): 416-418. Dong Hongqiang, Xu Haoxue, Hu Kede, et al. Effect of dispersion and emulsifying conditions on the appearance of trifluralin microcapsule[J]. Agrochemicals, 2010, 49(6): 416-418.(in Chinese) |
| [17] | Margulies L, Stern T, Rubin B, et al. Photostabilization of trifluralin adsorbed on a clay matrix[J]. J Agric Food Chem, 1992, 40(1): 152-155. |
| [18] | University of Hertfordshire. Pesticide Properties DataBase [DB/OL].(2015-01-14) [2015-05-12]. http://sitem.herts.ac.uk/aeru/ppdb/en/index.htm. |
| [19] | Yi H, Wu Liqun, Bentley W E, et al. Biofabrication with chitosan[J]. Biomacromolecules, 2005, 6(6): 2881-2894. |
| [20] | Yang Yu, Wang Shengpeng, Wang Yitao, et al. Advances in self-assembled chitosan nanomaterials for drug delivery[J]. Biotechnol Adv, 2014, 32(7): 1301-1316. |
| [21] | Ding Xiaochu, Richter D L, Matuana L M, et al. Efficient one-pot synthesis and loading of self-assembled amphiphilic chitosan nanoparticles for low-leaching wood preservation[J]. Carbohydr Polym, 2011, 86(1): 58-64. |
| [22] | 杜秀英, 张维邦, 许家瑞, 等. 壳聚糖接枝甲基丙烯酸甲酯的动力学研究[J]. 中山大学学报: 自然科学版, 1997, 36(2): 87-90. Du Xiuying, Zhang Weibang, Xu Jiarui, et al. Kinetic study on graft copolymerization of MMA onto chitosan[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1997, 36(2): 87-90.(in Chinese) |
| [23] | Johnson R M, Pepperman A B. Leaching of alachlor from alginate-encapsulated controlled-release formulations[J]. Pestic Sci, 1996, 48(2): 157-164. |
| [24] | 孔令娥. 三种不同农药的微囊化及其微囊悬浮体系控释性能研究 [D]. 北京: 中国农业科学院, 2012. Kong Ling'e. The microencapsulation of three different pesticides and research of their controlled release properties [D]. Beijing: Chinese Academy of Agricultural Sciences, 2012.(in Chinese) |
| [25] | GB/T 31270.3—2014, 化学农药环境安全评价试验准则 [S]. 北京: 中国标准出版社, 2014. GB/T 31270.3—2014, Test guidelines on environmental safety assessment for chemical pesticides [S]. Beijing: China Standard Publishing House, 2014.(in Chinese) |
| [26] | Boiero M L, Mandrioli M, Braber N V, et al. Gum arabic microcapsules as protectors of the photoinduced degradation of riboflavin in whole milk[J]. J Dairy Sci, 2014, 97(9): 5328-5336. |
| [27] | Bang S H, Hwang I C, Yu Y M, et al. Influence of chitosan coating on the liposomal surface on physicochemical properties and the release profile of nanocarrier systems[J]. J Microencapsul, 2011, 78(7): 595-604. |
| [28] | Nguyen M H, Hwang I C, Park H J. Enhanced photoprotection for photo-labile compounds using double-layer coated corn oil-nanoemulsions with chitosan and lignosulfonate[J]. J Photochem Photobiol B, 2013, 125: 1301-1316. |
| [29] | Ravi P R, Kotreka U K, Saha R N. Controlled release matrix tablets of zidovudine: effect of formulation variables on the in vitro drug release kinetics[J]. AAPS Pharm Sci Tech, 2008, 9(1): 302-313. |
| [30] | Korsmeyer R W, Gumy R, Doelker E, et al. Mechanisms of solute release from porous hydrophilic polymers[J]. Int J Pharm, 1983, 15(1): 25-35. |
| [31] | Azofeifa D E, Arguedas H J, Vargas W E. Optical properties of chitin and chitosan biopolymers with application to structural color analysis[J]. Opt Mater, 2012, 35(2): 175-183. |
 2015, Vol. 17
2015, Vol. 17


