2. 南开大学 元素有机化学国家重点实验室, 天津 300071
2. State Key Laboratory of Element-Organic Chemistry, Nankai University, Tianjin 300071, China
苯酚类化合物是有机化工和农药制造中常见的反应物和中间体,此类化合物进入环境后残留期较长,生物降解困难,且有较强的生物富集作用,不仅污染环境而且对动植物有一定的毒害作用。氯代酚类属于致癌、致畸和致突变物质,具有较强的神经毒性和器官感应性,已被世界野生动物基金会列为内分泌干扰物质[1]。美国环境保护局和欧盟已将其列入优先污染物名单。
酚类物质极性大,提取困难,并且挥发性强,易在浓缩过程中挥发损失。因此目前对酚类物质残留量的检测多回避了其浓缩问题,如采用在线洗脱方式用流动相直接洗脱测定[2];或利用固相萃取柱富集后,用有机溶剂洗脱后直接测定[3, 4]。在线洗脱存在洗脱溶剂与流动相不兼容、分析复杂基质时干扰大等问题;固相萃取柱富集后直接测定,则洗脱液体积较大,易出现检测限过高等问题。目前对酚类化合物的检测基质多局限于水,对土壤或其他基质的研究很少。为此,本研究使用基质固相分散(MSPD)法提取净化土壤样品中的酚类物质,采用在洗脱液中加入高沸点溶剂的方式固定易挥发的两种酚类化合物,建立了一种高效液相色谱(HPLC)测定土壤样品中酚类污染物含量的方法,以期解决上述问题。
1 材料与方法
1.1 药剂、试剂与仪器2,4-二氯苯酚标准品(2,4-dichlorophenol,以下简称2,4-DCP,纯度95%),购自Alfa Aesar公司; 2-甲基-4-氯苯酚标准品(4-chloro-2-methylphenol,以下简称4-C-2-MP,纯度97%)和无水硫酸钠(分析纯,用前于600 ℃ 烘焙4 h),购自天津市北方天医化学试剂厂。硅胶(0.15~0.25 mm,用前于600 ℃烘焙4 h),购自青岛海洋化工厂分厂。磷酸(优级纯,纯度85%),甲醇(色谱纯),其余试剂均为分析纯,用前经重蒸处理。
Agilent 1100高效液相色谱仪(美国Agilent公司),配G1315A二极管阵列检测器,进样量20 μL;Agilent C18 (250 mm×4.6 mm i.d.) 色谱柱和Agilent C18(12.5 mm×4.6 mm i.d.) 保护柱,粒径均为5 μm。
1.2 供试土壤样品土壤类型分别为壤质土、黄壤和黄棕壤(见表 1),使用前风干后研磨至粒径小于0.85 mm。
|
|
表 1 供试土壤的性质 Table 1 The properties of three kinds of soil |
准确称取0.05 g(精确重0.000 1 g) 2,4-DCP和4-C-2-MP标准品,分别用甲醇溶解并定容至50 mL,配制成1 000 mg/L的标准母液;另再取一份用丙酮配制成1 000 mg/L的标准母液。用V(pH为4的磷酸水溶液)∶V(甲醇)=44∶56的混合溶剂稀释标准母液至质量浓度分别为100、50、10、1和 0.2 mg/L 的混合标准溶液,待HPLC测定。以峰面积为纵坐标,相应的质量浓度为横坐标绘制标准曲线,5次重复。
1.4 样品前处理方法的比较 1.4.1 基质固相分散提取(MPSD)准确称取20.0 g空白土壤样品于研钵中,加入1.0 mL 10 mg/L 的 2,4-DCP和4-C-2-MP的混合标准溶液,混匀;依次加入6.0 g硅胶和2.0 mL蒸馏水,使其失活,研磨均匀;在层析柱下端放入脱脂棉,然后依次填入5.0 g无水硫酸钠、上述样品-硅胶混合物和2.0 g石英砂,用胶棒敲实;用35.0 mL二氯甲烷淋洗层析柱,收集洗脱液;向洗脱液内加入0.50 mL乙二醇,于室温下旋蒸浓缩至近干,用2.0 mL甲醇转移至刻度管内,氮气吹至1.0 mL以下,用二次蒸馏水定容至1.0 mL;超声处理2 min后过0.2 μm滤膜,经HPLC检测。
1.4.2 固-液提取(SLE)准确称取20.0 g空白土壤样品于研钵中,加入1.0 mL 10 mg/L的 2,4-DCP和4-C-2-MP的混合标准溶液,混匀;加入20 mL CH2Cl2,浸泡过夜后振荡30 min,抽滤,再用25 mL 二氯甲烷分3次洗涤土壤样品,抽滤;向滤液中加入约2.0 g无水硫酸钠直至滤液清澈,将滤液转移至250 mL圆底烧瓶中,用20 mL二氯甲烷分3次洗涤抽滤瓶,合并滤液;向滤液中加入0.50 mL乙二醇,于室温下旋蒸浓缩至1 mL左右,用10 mL甲醇分3次将其转移至刻度管内,氮气吹至1.0 mL以下,用二次蒸馏水定容至1.0 mL;超声处理2 min后过0.2 μm滤膜,经HPLC测定。
1.5 色谱条件流动相为V(pH=4的磷酸水溶液)∶V(甲醇)=44∶56,流速为1.0 mL/min;检测波长为228 nm;进样体积为20 μL;柱温20 ℃。
1.6 添加回收试验向3种空白土壤样品中分别添加0.01、0.05、0.5和2.5 mg/kg 4个水平的2,4-DCP和4-C-2-MP的混合标准溶液,每个水平重复5次,计算添加回收率和相对标准偏差(RSD)。
1.7 老化样品测定分别称取3种土壤样品各500 g,加入1 mL用丙酮配制的含1 000 μg/mL酚类化合物的混合标准母液,混匀后置于4 ℃冰箱内密封保存,分别于0、15、30和80 d取样测定回收率和相对标准偏差。
2 结果与讨论 2.1 MSPD提取条件的优化 2.1.1 分散剂类型及用量的选择考察了硅胶、弗罗里硅土、酸性氧化铝、碱性氧化铝、中性氧化铝和硅藻土6种分散剂对回收率和净化效果的影响。结果表明:使用硅藻土、弗罗里硅土、碱性氧化铝和中性氧化铝作为固相分散剂时,酚类化合物的回收率均较低;而采用硅胶和酸性氧化铝时效果较好,以硅胶为最好。因此选择硅胶作为MSPD的分散剂。
分别比较了4.0、6.0、8.0、10.0、12.0和15.0 g硅胶的净化效果(见表 2)。由表 2知:当分散剂用量增至6.0 g时,回收率较好,且杂质干扰少,继续增加硅胶用量回收率并无明显增加,故确定硅胶用量为6.0 g。
|
|
表 2 不同硅胶用量对2,4-DCP和4-C-2-MP平均回收率及相对标准偏差的影响(n=5) Table 2 Average recoveries and RSD of 2,4-DCP and 4-C-2-MP using different amount of silica(n=5) |
尝试了4种不同极性且常见的溶剂:正己烷、二氯甲烷、氯仿和乙酸乙酯的洗脱效果。其中,极性最小的正己烷洗脱强度太小,对4-C-2-MP、2,4-DCP的回收率仅为4.8%和25%,回收率太低,不能满足分析的要求。而使用极性稍大的二氯甲烷、三氯甲烷和乙酸乙酯时,酚类化合物的回收率均很好。但由于2,4-DCP和4-C-2-MP的挥发性很强,因此洗脱液的浓缩困难,而二氯甲烷沸点为40 ℃,常温下即可挥发,浓缩条件温和,酚类化合物损失量最少,色谱分析时溶剂残留量少,对色谱柱损伤最小,因此选择二氯甲烷为洗脱溶剂。在此基础上讨论了不同体积二氯甲烷对目标物回收率的影响,如表 3所示,当洗脱液体积为30.0 mL时,继续增加洗脱剂用量,回收率变化不大,但杂质的洗脱量增加,对目标物的干扰增强,综合考虑节约溶剂与减少杂质干扰两种因素,确定二氯甲烷用量为30.0 mL。
|
|
表 3 采用不同体积二氯甲烷洗脱对2,4-DCP和4-C-2-MP的平均回收率及相对标准偏差的影响(n=5) Table 3 Average recoveries and RSD of 2,4-DCP and 4-C-2-MP using different volume dichloromethane to elute (n=5) |
由于两种酚类化合物极性大,易溶于极性溶剂,因此本研究采用反相高效液相色谱法测定目标物的回收率,并选择易溶于水且沸点相对较高的溶剂。水的沸点虽然相对较高,但与洗脱液二氯甲烷不互溶,不能充分固定易挥发的分析物。结合Kot-Wasik等[5]的结果,考察了甲醇(bp. 65 ℃)、乙醇(bp. 78.3 ℃)、乙腈(bp. 82 ℃)和乙二醇(bp. 189 ℃)4种高沸点溶剂。
结果(表 4)表明:以高沸点的乙二醇为溶剂时,两种酚类化合物的回收率最高,因此选择乙二醇作为溶剂,但其添加量对回收率的影响也较大。当乙二醇添加量增至0.5 mL时,4-C-2-MP和2,4-DCP的回收率分别为99.1%和97.7%,继续增加其用量,浓缩难度相应增加,而目标物的回收率基本不变,故确定乙二醇的添加量为0.5 mL。
|
|
表 4 不同高沸点溶剂对2,4-DCP和4-C-2-MP的平均回收率及相对标准偏差的影响(n=5) Table 4 Average recoveries and RSD of 2,4-DCP and 4-C-2-MP at different high boiling point solvents(n=5) |
由表 5可以看出:MSPD对2,4-DCP和4-C-2-MP的提取回收率均明显高于SLE的,这与Teixeira等[6]的结果一致。
|
|
表 5 MSPD与SLE两种提取方法对2,4-DCP和4-C-2-MP的平均回收率及相对标准偏差的影响(n=5) Table 5 Average recoveries and RSD of 2,4-DCP and 4-C-2-MP by MSPD method and SLE method(n=5) |
在0.02~2.5 mg/kg范围内,两种分析物的质量浓度与峰面积之间呈良好的线性关系,R2=0.999。4-C-2-MP 的检测限(LOD)为2 μg/kg(S/N=3),2,4-DCP的 LOD为3 μg/kg(S/N=3);两者的定量限(LOQ)皆为0.01 mg/kg(S/N>10)。
2.4.2 准确度与精密度结果(见表 6和图 1)表明:在0.01、0.05、0.5和2.5 mg/kg 4个添加水平下,3种类型土壤中两种待测物的平均回收率在90%~118%之间,RSD在0.1%~8.5%之间,符合农药残留分析要求。
|
|
表 6 三种土壤中添加2,4-DCP和4-C-2-MP的平均回收率及相对标准偏差(n=5) Table 6 Average recoveries and RSD of 2,4-DCP and 4-C-2-MP from three types of soil spiked at different levels(n=5) |
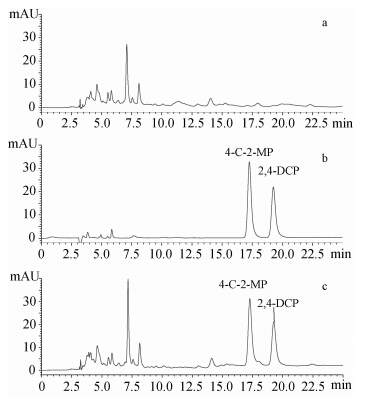 | a.空白土壤样品;b.两种酚类化合物标样(10 mg/L);c. 土壤添加样品(0.5 mg/kg)。 a. blank soil sample;b. 10 mg/L standard solution of two kinds of phenolic compounds;c. spiked soil sample(0.5 mg/kg). 图 1 壤质土空白、添加目标物及2,4-DCP、4-C-2-MP标准溶液色谱图 Fig. 1 HPLC chromatograms of blank,spiked loamy soil samples and standard solution of 2,4-DCP,4-C-2-MP |
上述结果是向样品中添加目标物后在很短的时间内(1 h)提取、测定的,目标物与土壤基质之间作用时间短,而实际样品是在施药一定时间后才进行测定。为了更好地模拟实际土壤样品,对添加了目标物的土壤在样品处理之前先进行老化,使目标物与土壤基质之间充分作用,以验证所建立的MSPD法。结果(见表 7)表明:壤质土和黄棕壤中两种酚类化合物的回收率降低较明显。Bringmann等[7]研究发现,土壤中有机质含量低时,不同土壤中氯代酚的回收率几乎不受有机质含量的影响,但当有机质含量增加至1.6%时,氯代酚的回收率明显降低。本研究中,黄壤中有机质含量最低,为0.9%;壤质土中有机质含量居中,为1.9%;黄棕壤中有机质含量最高,为3.1%。本研究结果与Crespin等研究结果的趋势一致。
|
|
表 7 三种土壤不同老化时间对2,4-DCP和4-C-2-MP的相对平均回收率及相对标准偏差的影响(n=5) Table 7 Relative average recoveries and RSD of 2,4-DCP and 4-C-2-MP at different aged time from three types of soil(n=5) |
本研究建立了基质固相分散(MSPD)提取、高效液相色谱测定土壤中酚类化合物的方法,该法将样品的提取与净化一步完成,操作简单且节约分析时间;通过向洗脱液内加入高沸点溶剂,解决了酚类物质在浓缩过程中易损失的难题;采用离线洗脱测定,避免了洗脱溶剂与流动相不兼容的问题;20 g土壤样品提取和浓缩过程只需要35 mL溶剂,溶剂用量少。本研究从分散剂类型及用量、失活水量、洗脱溶剂及其用量等方面优化了提取方法;为确保酚类化合物的回收率,对高沸点溶剂的类型及其用量进行了优化。
与经典的固液萃取法(SLE)相比,本研究所建立的MSPD方法对2,4-DCP和4-C-2-MP的回收率显著提高,且检测限和定量限较低,具有操作简单、
溶剂用量少、分析时间短、准确度高等优点,适合用于土壤中2,4-DCP和4-C-2-MP残留量的检测。
| [1] | Xing Jionghao, Zhang Yuntao. A QSAR study of halogen phenols toxicity to the tetrahymena pyriformis[J]. Comput Appl Chem, 2007, 24(1): 87-90. |
| [2] | Crespín M A, Gallego M, Valcarcel M. A semiautomatic module for the direct leaching and determination of sixteen phenols in agricultural soils[J]. Anal Chem, 1999, 71(14): 2687-2696. |
| [3] | Moret S, Hidalgo M, Sánchez J M. Development of an ion-pairing liquid chromatography method for the determination of phenoxyacetic herbicides and their main metabolites: application to the analysis of soil samples[J]. Chromatographia, 2006, 63(3-4): 109-115. |
| [4] | Patsias J, Papadakis E N, Mourkidou E P. Analysis of phenoxyalkanoic acid herbicides and their phenolic conversion products in soil by microwave assisted solvent extraction and subsequent analysis of extracts by on-line solid-phase extraction liquid chromatography[J]. J Chromatogr A, 2002, 959(1-2): 153-161. |
| [5] | Kot-Wasik A, Kartanowicz R, Dabrowska D, et al. Determination of chlorophenols and phenoxyacid herbicides in the Gulf of Gdansk, Southern Baltic Sea[J]. Bull Environ Contam Toxicol, 2004, 73(3): 511-518. |
| [6] | Teixeira D M, Patão R F, Coelho A V, et al. Comparison between sample disruption methods and solid-liquid extraction(SLE) to extract phenolic compounds from Ficus carica leaves[J]. J Chromatogr A, 2006, 1103(1): 22-28. |
| [7] | Bringmann G, Messer K, Wohlfarth M, et al. HPLC-CD on-line coupling in combination with HPLC-NMR and HPLC-MS/MS for the determination of the full absolute stereostructure of new metabolites in plant extracts[J]. Anal Chem, 1999, 71(14): 2678-2686. |
 2015, Vol. 17
2015, Vol. 17


