福美双(thiram)属二硫代氨基甲酸酯类保护性广谱杀菌剂,主要用于处理种子和土壤,防治禾谷类黑穗病和多种作物的苗期立枯病,此外还可作为内吸性杀菌剂复配剂的伴药[1];甲霜灵(metalaxyl)属酰胺类内吸性杀菌剂,主要用于茎叶、种子和土壤处理,防治霜霉菌、疫霉菌及腐霉菌引起的病害[2, 3]。在我国,以福美双·甲霜灵复配方式登记的农药品种共有38个,主要登记作物为水稻、黄瓜等,用于防治水稻苗期立枯病、水稻立枯病及黄瓜霜霉病等。有研究表明,福美双对鸟类及哺乳动物具有一定的毒性[4, 5, 6],甲霜灵对人体健康具有潜在的风险[7, 8]。我国规定糙米中甲霜灵的最大残留限量(MRL)值为0.1 mg/kg,规定玉米和麦类中福美双的MRL值分别为0.1和0.3 mg/kg(以二硫化碳CS\-2计),尚未规定水稻(糙米)中福美双的MRL值[9];日本肯定列表规定水稻(糙米)中甲霜灵的MRL值为0.1 mg/kg[10],福美双的MRL值为0.3 mg/kg(以CS2计)[11];欧盟规定水稻中甲霜灵的MRL值为0.05 mg/kg[12],福美双的MRL值为0.05 mg/kg(以CS2计)[13];国际食品法典委员会规定谷物中甲霜灵的MRL值为0.05 mg/kg[14]。
目前,福美双的测定多采用检测二硫代氨基甲酸酯(盐)类农药的方法,即在酸性条件下使福美双分解为CS2,再用光谱法[15]或气相色谱法[16]检测CS2,此方法不能确定单一福美双的含量,缺乏专一性,而且操作繁琐[17];也有学者采用高效液相色谱法[18, 19, 20, 21, 22]或液相色谱-质谱联用法[23, 24, 25],前者灵敏度和选择性较差,有些还需衍生化过程[18],二者的前处理方法多采用液固萃取、液液萃取和固相萃取等,步骤繁琐、耗时较长、有机溶剂用量较大。甲霜灵的测定方法有气相色谱-质谱法[26]、高效液相色谱法[27, 28, 29]和液相色谱-质谱联用法[30, 31],前处理方法也多采用液液萃取、固相萃取等,操作复杂,不利于大批量样品的处理。目前国内外均未见同时测定水稻及土壤中福美双和甲霜灵残留的报道。分散固相萃取法具有快速、简单、高效等优点,已广泛用于农药残留检测[32, 33, 34]。因此,本研究以土壤、水稻植株、稻壳及糙米为研究对象,采用分散固相萃取法净化,建立了分散固相萃取-高效液相色谱-串联质谱同步分析水稻及土壤中福美双和甲霜灵的方法。
1 材料与方法 1.1 仪器
Agilent 1200高效液相色谱仪(美国Agilent公司),API 5000 三重四级杆串联质谱仪(配有ESI源)(美国AB公司),THU35-C型实验砻谷机(苏州佐竹机械有限公司),FW-135中草药粉碎机(天津市泰斯特仪器有限公司),IKA-2高速匀浆机(德国 IKA公司),XS105DU电子天平(0.000 1 g)(瑞士Mettler Toledo公司),高速冷冻离心机(美国Thermo科技公司)。
1.2 试剂99.0%福美双(thiram)标准品和98.7%甲霜灵(metalaxyl)标准品(德国Dr. Ehrenstofer公司);乙腈和甲酸均为色谱纯;水为MilliQ超纯水;N-丙基乙二胺(PSA)、十八烷基键合硅胶(C18)分散固相萃取吸附剂(天津博纳艾杰尔科技公司);石墨化碳黑(GCB)吸附剂(美国SIGMA-ALDRICH公司)。
氯化钠(北京化工厂,用前经120 ℃烘干6 h后)和无水硫酸镁(上海试剂厂,用前在马弗炉550 ℃灼烧4 h)均为分析纯,于干燥器中贮存,备用。
1.3 样品制备土壤样本:随机在稻田试验小区内取点5~10个,采用土钻采集0~15 cm深的土壤1~2 kg,除去碎石、杂草和植物根茎等杂物,室内风干,过10目(2 mm)筛,混匀。
植株样本:在稻田试验小区内随机剪取土表以上的全株(去根的全株)1 kg,切碎,混匀。
稻壳和糙米样本:在稻田试验小区内随机剪取稻穗2 kg,脱粒后,脱壳(如样本较湿,可先摊开晾干再脱粒),分别得到稻壳和糙米。稻壳经粉碎后,混匀;糙米经粉碎后,过20目(0.850 mm)筛,混匀。
所有样品采用四分法留样,于-20 ℃保存,待测。
1.4 样品前处理 1.4.1 提取土壤或糙米样品:准确称取10.0 g试样(精确至0.01 g)于50 mL离心管中,加入10 mL乙腈,涡旋2 min,加入4 g无水硫酸镁和1 g氯化钠,涡旋1 min,于5 000 r/min、4 ℃条件下离心5 min,上清液为提取液,待净化。
水稻植株或稻壳:准确称取5.0 g(稻壳称取1g)试样(精确至0.01 g)于50 mL离心管中,加入10 mL乙腈,涡旋2 min,加入2 g无水硫酸镁和0.5 g氯化钠,涡旋1 min,于5 000 r/min、4 ℃条件下离心5 min,上清液为提取液,待净化。
1.4.2 净化土壤或糙米样品:取1.0 mL上清液于10 mL离心管中,加入50 mg PSA吸附剂,高速涡旋2 min,于5 000 r/min、4 ℃条件下离心5 min,上清液过0.22 μm 有机相滤膜,待测。
水稻植株或稻壳:取1.0 mL上清液于10 mL离心管中,加入50 mg PSA和50 mg C18吸附剂,高速涡旋2 min,于5 000 r/min、4 ℃条件下离心5 min,上清液过0.22 μm 有机相滤膜,待测。
1.5 色谱和质谱条件色谱条件:C18 色谱柱(2.1 mm×150 mm,5 μm);柱温25 ℃;进样体积5 μL;采用等度洗脱,流动相为V(0.2%甲酸水)∶V(乙腈)=50∶50,流速0.2 mL/min。
质谱条件:电喷雾离子源(ESI);正离子模式;喷雾电压(IS+) 5 500 V;离子源温度(TEM) 500 ℃;碰撞气压力(CAD) 48.3 kPa;雾化气(GS1) 275.8 kPa;辅助气(GS2) 344.7 kPa;气帘气(CUR) 241.3 kPa。在多反应监测(MRM)模式下福美双和甲霜灵的质谱参数见表 1。
|
|
表 1 多反应监测模式下福美双和甲霜灵的质谱参数 Table 1 Mass spectrum parameters of thiram and metalaxyl under the multiple reactions monitoring(MRM) mode |
分别称取福美双和甲霜灵标准品10 mg(精确至0.000 1 g),用乙腈溶解并定容至100 mL,制得100 mg/L的标准储备液,于4 ℃下避光储存。根据需要,用乙腈稀释成不同质量浓度的标准工作溶液,即用即配。
将福美双和甲霜灵标准储备液分别用空白土壤、水稻植株、稻壳、糙米提取液稀释成500、200、100、50、20、10、5、2和1μg/L系列基质标准工作溶液,并按优化后的条件进行分析,以福美双、甲霜灵进样浓度(x)为横坐标,定量监测离子对峰面积(y)为纵坐标绘制标准曲线,
1.7 添加回收试验在空白土壤、水稻植株、稻壳和糙米样品中添加不同浓度的福美双和甲霜灵标准溶液,测定日内添加平均回收率和日间添加平均回收率,每个水平重复5次,其中日间添加平均回收率连续测3 d。
1.8 数据处理采用数据处理软件Analyst (version 1.4.2),按公式(1)计算样品中福美双或甲霜灵含量。

其中,wB 表示福美双(或甲霜灵)的质量分数,mg/kg; Ai表示样品溶液中福美双(或甲霜灵)的峰面积;cs表示标准溶液中福美双(或甲霜灵)的质量浓度,mg/L;V 表示样品溶液最终体积,mL;As 表示标准溶液中福美双(或甲霜灵)的峰面积;m 表示最终样品溶液所代表的试样质量,g。
目前GB2763—2014中规定福美双的MRL值以CS2计[9],本研究提供的方法为福美双化合物本身的含量,两者的换算关系见公式(2)。

其中,wB(二硫化碳)表示二硫化碳的质量分数,mg/kg;wB(福美双)表示福美双的质量分数,mg/kg。
2 结果与分析
2.1 质谱条件的选择及优化
采用API 5000 三重四级杆串联质谱仪(ESI源),通过配置的自动针泵进样系统,在多反应监测(MRM)模式下对福美双(相对分子质量为240.44)和甲霜灵(相对分子质量为279.33)的质谱条件进行选择优化。根据两种分析物的性质,采用正离子扫描模式。结果表明:在正离子模式下,当两种分析物进入一级质谱后,很容易产生稳定的[M+H]+分子离子峰,其中福美双还出现了m/z=263.3的[M+Na]+和m/z=279.4的[M+K]+峰,但比较稳定,不易获得碎片离子,因此选择m/z=241.3为福美双的母离子,m/z=280.4为甲霜灵的母离子。
由图 1可知:福美双二级质谱的特征碎片m/z为88.0、120.0和196.1,可能的碎片为C3H6NS+、C3H6NS2+和C4H6NS4+,其中m/z 88.0响应值很高且稳定,因此将241.3/88.0作为定量离子;甲霜灵二级质谱的特征碎片m/z为192.4、220.3等,可能的碎片为C11H14NO2+和C13H18NO2+,其中m/z 192.4响应值很高且稳定,因此,将280.4/192.4作为定量离子。当确定了两种物质的准分子离子峰和特征碎片离子后,对两种物质的质谱参数进行了优化(见表 1)。
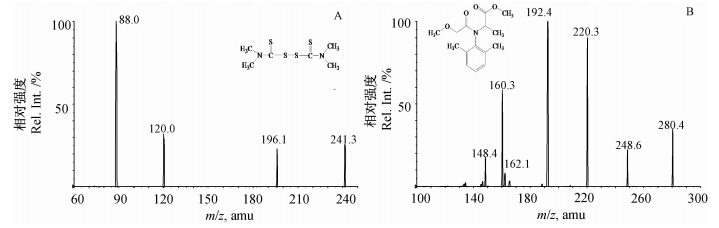 | 图 1 福美双(A)和甲霜灵(B)二级质谱图 Fig. 1 Product ion spectra of thiram(A) and metalaxyl(B) |
本研究考察了甲醇-水和乙腈-水两种流动相体系的色谱分离效果。结果显示:流动相为甲醇-水时柱压力较高,且基线噪声较大,因此选择乙腈-水流动相体系;当乙腈的体积比降低到30%时,福美双和甲霜灵的保留时间延长,峰宽增加,响应值降低;当乙腈比例高于80%时,目标物出峰太早,分离效果较差。此外,在流动相中加入少量甲酸可以提高离子化效率,优化峰形,提高灵敏度。综合考虑,确定V(0.2%甲酸水)∶V(乙腈)=50∶50为流动相,流速为0.2 mL/min。
2.3 净化剂的选择及优化选择比较了GCB、PSA和C18三种净化剂使用方式及用量对样品中目标物净化回收效果的影响。以25 mg的GCB为分散固相萃取吸附剂时,甲霜灵的回收率较低,为54.1%~71.6%;以50 mg的PSA净化水稻植株、稻壳、糙米和土壤提取液时,对水稻植株、稻壳色素去除效果不明显。因此,为了改善植株和稻壳提取液的净化效果,添加一定量的C18净化剂,分别使用25、50、75、100 mg C18和50 mg的PSA共同净化水稻植株、稻壳样品。结果显示,50、75和100 mg的C18去除色素效果均较好,当C18用量为50和75 mg时,两种农药的回收率相差无几,均在70.4%~109.7%之间,而当C18用量为100 mg时,目标物的回收率偏低(62.6%~94.4%)。最终确定以50 mg的PSA为土壤和糙米的净化剂,分别以50 mg的PSA和50 mg的C18为水稻植株和稻壳的净化剂。
2.4 基质效应、线性关系和灵敏度LC-MS/MS分析中基质效应一般认为是由于基质成分和目标物在进行离子化时相互竞争造成的,表现为离子抑制或离子增强效应,影响仪器的灵敏度和重复性[35]。因此,本研究采用基质匹配标准溶液来抵消基质效应的影响。结果(表 2)表明:在1~500 μg/L范围内,福美双和甲霜灵的响应值与其浓度间线性关系良好,相关系数均大于0.991。
采用基质标准曲线斜率和溶剂标准曲线斜率之比(K)来评价基质效应:当K 大于1.1时为基质增强效应,小于0.9为基质减弱效应,而当K 在0.9~1.1之间时,为基质效应不明显[36]。从本研究的斜率比(表 2)可以看出:土壤和糙米对福美双具有基质减弱效应,而植株对甲霜灵具有基质增强效应,其余均无明显基质效应。
根据HPLC-MS/MS信噪比(S/N)=10得到福美双和甲霜灵的定量限(LOQ),结果见表 2,均低于现有国内外残留限量[9, 10, 11, 12, 13, 14],满足检测要求。
|
|
表 2 福美双和甲霜灵的线性范围、线性方程、相关系数、斜率比和定量限 Table 2 Finear ranges,regression equations,correlation coefficients(r),slope of matrix/slope of solvent(K) |
结果(表 3)表明:在0.01~1.5 mg/kg添加水平范围内,土壤、水稻植株、稻壳和糙米样品中福美双和甲霜灵的日内平均回收率为76%~104%,日内相对标准偏差(RSD)为1.2%~13.2%(n=5);日间平均回收率为74%~102%,日间RSD为2.8%~10.4%(n=5)。表明该方法具有较好的准确性和稳定性,满足农药残留分析的要求。典型添加色谱图见图 2。
|
|
表 3 不同基质中福美双和甲霜灵的日内、日间添加回收率及相对标准偏差 Table 3 Intra-day and inter-day average recoveries and relative standard deviation(RSD) for thiram and metalaxyl in different matrices(n=5) |
 |
A1:空白土壤;A2:土壤添加甲霜灵(0.03 mg/kg);A3:土壤添加福美双(0.04 mg/kg);B1:空白糙米;B2:糙米添加甲霜灵(0.03 mg/kg);B3:糙米添加福美双(0.05 mg/kg);C1:空白植株;C2:植株添加甲霜灵(0.02 mg/kg);C3:植株添加福美双(0.01 mg/kg);D1:空白稻壳;D2:稻壳添加甲霜灵(0.03 mg/kg);D3:稻壳添加福美双(0.05 mg/kg)。 A1:blank soil; A2:soil spiked with 0.03 mg/kg metalaxyl; A3:soil spiked with 0.04 mg/kg thiram; B1:blank brown rice; B2:brown rice spiked with 0.03 mg/kg metalaxyl; B3:brown rice spiked with 0.05 mg/kg thiram; C1:blank rice plant; C2:rice plant spiked with 0.02 mg/kg metalaxyl; C3:rice plant spiked with 0.01 mg/kg thiram; D1:blank rice husk; D2:rice husk spiked with 0.03 mg/kg metalaxyl; D3:rice husk spiked with 0.05 mg/kg thiram. 图 2 空白样品及添加回收样品的色谱图 Fig. 2 Chromatograms of blank and spiked samples |
为了验证方法的可靠性和实用性,运用本研究所建立的方法对黑龙江省哈尔滨市、天津蓟县和浙江省诸暨市2012年—2013年两年三地的水稻植株、稻壳、糙米和土壤田间实际样品(90 d最终残留和植株中残留量)进行了测定。结果表明:在土壤、糙米、水稻植株和稻壳样品中,甲霜灵的最终残留量分别为6.65~27.8、6.61~7.56、6.66~9.41和6.58~6.96 μg/kg,而所有最终残留样品中均未检出福美双;在水稻植株动态消解样品中甲霜灵和福美双的残留量分别为6.63~587和2.07~47.5 μg/kg(福美双残留量以CS2计为1.3~29.9 μg/kg)。与两种农药现有的国内外MRL值比较可知,仅0~3 d的植株动态消解样品中甲霜灵的残留量(130~587 μg/kg)超过我国规定的糙米中甲霜灵的MRL值(100 μg/kg)[9, 10, 11, 12, 13, 14]。
3 结论本研究建立了一种同步分析水稻植株、稻壳、糙米和土壤中福美双和甲霜灵残留的HPLC-MS/MS检测方法。该方法简单、快速、灵敏度及准确度高,能够满足水稻及土壤中福美双和甲霜灵残留量的快速检测和确证的要求,可应用于农药登记残留田间试验样品的分析。
| [1] | 李伟华, 胡小宁, 吕雪霞, 等. 比色法快速测定小麦中福美双的残留量[J]. 农药, 2011, 50(3): 213-214. Li Weihua, Hu Xiaoning, Lü Xuexia, et al. Rapid determination of thiram residues in wheat by colorimetry[J]. Agrochemicals, 2011, 50(3): 213-214.(in Chinese) |
| [2] | 郑雪虹, 冯信平, 葛会林, 等. 甲霜灵在西瓜及土壤中的残留消解动态研究[J]. 热带作物学报, 2014, 35(3): 570-575. Zheng Xuehong, Feng Xinping, Ge Huilin, et al. Residual dynamics of metalaxyl in watermelons and soil[J]. Chin J Trop Crops, 2014, 35(3): 570-575.(in Chinese) |
| [3] | Fan Sufang, Zhang Fengzu, Deng Kailin, et al. Spinach or amaranth contains highest residue of metalaxyl, fluazifop-p-butyl, chlorpyrifos, and lambda-cyhalothrin on six leaf vegetables upon open field application[J]. J Agric Food Chem, 2013, 61(9): 2039-2044. |
| [4] | Rasaputra K S, Liyanage R, Lay Jr J O, et al. Effect of thiram on avian growth plate chondrocytes in culture[J]. J Toxicol Sci, 2013, 38(1): 93-101. |
| [5] | Li J, Bi D, Pan S, et al. Effect of diet with thiram on liver antioxidant capacity and tibial dyschondroplasia in broilers[J]. Brit Poultry Sci, 2007, 48(6): 724-728. |
| [6] | Dalvi S, Wilder-Ofiet T, Mares B, et al. Effect of cytochrome P450 inducers on the metabolism and toxicity of thiram in rats[J]. Veterin Human Toxicol, 2002, 44(6): 331-333. |
| [7] | Saab J, Bassil G, Naccoul R A, et al. Salting-out phenomenon and 1-octanol/water partition coefficient of metalaxyl pesticide[J]. Chemosphere, 2011, 82(6): 929-934. |
| [8] | Li Yuanbo, Dong Fengshou, Liu Xin'gang, et al. Enantioselective separation and transformation of metalaxyl and its major metabolite metalaxyl acid in tomato and cucumber[J]. Food Chem, 2013, 141(1): 10-17. |
| [9] | GB 2763—2014, 食品中农药最大残留限量[S]. 北京: 中国标准出版社, 2014. GB 2763—2014, Maximum residue limits for pesticides in food[S]. Beijing: China Standards Press, 2014.(in Chinese) |
| [10] | The Japan Food Chemical Research Foundation. Table of Maximum Residue Limits(MRLs)for Agricultural Chemicals[DB/OL]. [2015-02-07]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=75100. |
| [11] | The Japan Food Chemical Research Foundation. Table of Maximum Residue Limits(MRLs)for Agricultural Chemicals[DB/OL]. [2015-02-07]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=28700. |
| [12] | European Union. EU Pesticides database[DB/OL]. [2015-02-07]. http://ec.europa.eu/sanco_pesticides/public/index.cfm?event=pesticide.residue.CurrentMRL&language=EN. |
| [13] | European Union. EU Pesticides database[DB/OL]. [2015-02-07]. http://ec.europa.eu/sanco_pesticides/public/index.cfm?event=pesticide.residue.CurrentMRL&language=EN. |
| [14] | Codex Alimentarius Commission-International Food Standards. Codex Pesticides Residues in Food Online Database[DB/OL]. [2015-02-07]. http://www.codexalimentarius.net/pestres/data/pesticides/details.html?id=138. |
| [15] | Malik A K, Kaul K N, Lark B S, et al. Simple and sensitive method for determination of tetramethylthiuram disulphide(thiram)[J]. Pestic Sci, 1998, 53(1): 104-106. |
| [16] | 秦曙, 乔雄梧, 王霞, 等. 气相色谱法检测22种基质中的4种二硫代氨基甲酸盐类农药残留[J]. 色谱, 2010, 28(12): 1162-1167. Qin Shu, Qiao Xiongwu, Wang Xia, et al. Determination of 4 dithiocarbamate residues in 22 matrices by gas chromatography[J]. Chin J Chromatogr, 2010, 28(12): 1162-1167.(in Chinese) |
| [17] | 马婧玮, 潘灿平, 张玲, 等. 二硫代氨基甲酸盐类(DTCs) 杀菌剂残留分析方法综述[J]. 农药学学报, 2010, 12(1): 22-30. Ma Jingwei, Pan Canping, Zhang Ling, et al. Research progress on residue analysis of dithiocarbamates(DTCs) fungicide[J]. Chin J Pestic Sci, 2010, 12(1): 22-30.(in Chinese) |
| [18] | 孟凡立, 崔兆丰, 王志坤, 等. 高效液相色谱法检测福美双在蔬菜及土壤中的残留[J]. 东北农业大学学报, 2010, 41(6): 28-31. Meng Fanli, Cui Zhaofeng, Wang Zhikun, et al. Determination of residual thiram in vegetable and soil samples by high performance liquid chromatography[J]. J Northeast Agric Univ, 2010, 41(6): 28-31.(in Chinese) |
| [19] | 田宏哲, 周艳明. 高效液相色谱法对水果中多菌灵与福美双残留的同时测定[J]. 分析测试学报, 2010, 29(1): 93-96. Tian Hongzhe, Zhou Yanming. Simultaneously analysis of residue of carbendazim and thiram in fruits by high performance liquid chromatography[J]. J Instrum Anal, 2010, 29(1): 93-96.(in Chinese) |
| [20] | 饶钦雄, 宣岩芳, 白冰, 等. 高效液相色谱法测定食用菌中福美双残留量[J]. 食用菌学报, 2011, 18(4): 82-84. Rao Qinxiong, Xuan Yanfang, Bai Bing, et al. Development of a HPLC-based method for determining thiram in the fruit bodies of edible fungi[J]. Acta Edulis Fungi, 2011, 18(4): 82-84.(in Chinese) |
| [21] | Gupta B, Rani M, Kumar R. Degradation of thiram in water, soil and plants: A study by high-performance liquid chromatography[J]. Biomed Chromatogr, 2012, 26(1): 69-75. |
| [22] | Bilehal D C, Chetti M B, Sung D D, et al. Reversed-phase UPLC method for the determination of monocrotophos, thiram, carbendazim, carbaryl, and imidacloprid pesticides in mango and pomegranate by QuEChERS method[J]. J Liqu Chromatogr Relat Technol, 2014, 37(12): 1633-1643. |
| [23] | Blasco C, Font G, Picó Y. Determination of dithiocarbamates and metabolites in plants by liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2004, 1028(2): 267-276. |
| [24] | Peruga A, Grimalt S, López F J, et al. Optimisation and validation of a specific analytical method for the determination of thiram residues in fruits and vegetables by LC-MS/MS[J]. Food Chem, 2012, 135(1): 186-192. |
| [25] | Schmidt B, Christensen H B, Petersen A, et al. Method validation and analysis of nine dithiocarbamates in fruits and vegetables by LC-MS/MS[J]. Food Addit Contam: Part A, 2013, 30(7): 1287-1298. |
| [26] | 陈红平, 刘新, 汪庆华, 等. 气相色谱-串联质谱检测水果、蔬菜中抗蚜威、甲霜灵和克螨特残留量[J]. 质谱学报, 2010, 31(4): 220-223. Chen Hongping, Liu Xin, Wang Qinghua, et al. Determination of pirimicarb, metalaxyl and propargite residues in fruit and vegetable by GC-MS/MS[J]. J Chin Mass Spectrom Soc, 2010, 31(4): 220-223.(in Chinese) |
| [27] | 何书海, 李腾崖, 陈菲. 高效液相色谱法对环境样品中甲基托布津与甲霜灵残留的测定[J]. 分析测试学报, 2010, 29(2): 161-164. He Shuhai, Li Tengya, Chen Fei. Residual Determination of thiophanate-methyl and metalaxyl in environment by high performance liquid chromatography[J]. J Instrum Anal, 2010, 29(2): 161-164.(in Chinese) |
| [28] | 殷春杭, 朱国念, 钱允辉, 等. 蔬菜中甲霜灵残留量的HPLC分析[J]. 农药, 2006, 45(10): 686, 688. Yin Chunhang, Zhu Guonian, Qian Yunhui, et al. HPLC determination metalaxyl residues in vegetable[J]. Agrochemicals, 2006, 45(10): 686, 688.(in Chinese) |
| [29] | Liu Xiangyun, Yang Yan, Cui Ying, et al. Dissipation and residue of metalaxyl and cymoxanil in pepper and soil[J]. Environ Monit Assess, 2014, 186(8): 5307-5313. |
| [30] | 徐娟, 陈捷, 林峰, 等. 液相色谱-串联质谱法测定八种食品中甲霜灵[J]. 食品科学, 2010, 31(4): 175-178. Xu Juan, Chen Jie, Lin Feng, et al. Liquid chromatography-tandem mass spectrometric determination of metalaxyl residue in animal-derived and plant-derived foods[J]. Food Sci, 2010, 31(4): 175-178.(in Chinese) |
| [31] | 乐渊, 尹桂豪, 刘春华, 等. 超高效液相色谱-串联质谱法测定香草兰中多菌灵和甲霜灵残留[J]. 广东农业科学, 2012, 39(19): 98-101. Le Yuan, Yin Guihao, Liu Chunhua, et al. Determination of carbendazim and metalaxyl in vanilla by ultra performance liquid chromatography-tandem mass spectrometry[J]. Guangdong Agric Sci, 2012, 39(19): 98-101.(in Chinese) |
| [32] | Wu Qiuhua, Wang Chun, Liu Zhimei, et al. Dispersive solid-phase extraction followed by dispersive liquid-liquid microextraction for the determination of some sulfonylurea herbicides in soil by high-performance liquid chromatography[J]. J Chromatogr A, 2009, 1216(29): 5504-5510. |
| [33] | 刘菲菲, 赵成林, 朱国念. 超高效液相色谱-串联质谱法检测水稻及稻田环境中速灭威的残留[J]. 农药学学报, 2013, 15(4): 445-450. Liu Feifei, Zhao Chenglin, Zhu Guonian. Determination of metolcarb residue in rice and paddy field by ultra high performance liquid chromatography tandem mass spectrometry[J]. Chin J Pestic Sci, 2013, 15(4): 445-450.(in Chinese) |
| [34] | 李慧晨, 尤祥伟, 刘丰茂, 等. 高效液相色谱-串联质谱法检测稻田中吡嘧磺隆和苯噻酰草胺残留[J]. 农药学学报, 2014, 16(6): 728-733. Li Huichen, You Xiangwei, Liu Fengmao, et al. Simultaneous determination of pyrazosulfuron-ethyl and mefenacet residues in rice by high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2014, 16(6): 728-733.(in Chinese) |
| [35] | 闫震, 聂继云, 徐国锋, 等. 超高效液相色谱-串联质谱法对比 4 种净化方式对不同色素含量基质中 19 种农药残留检测的影响[J]. 分析测试学报, 2014, 33(9): 1000-1009. Yan Zhen, Nie Jiyun, Xu Guofeng, et al. Effects of four kinds of purification methods for determination of 19 pesticide residues in substrates of different pigments analyzed by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2014, 33(9): 1000-1009.(in Chinese) |
| [36] | Liu Xin'gang, Xu Jun, Li Yuanbo, et al. Rapid residue analysis of four triazolopyrimidine herbicides in soil, water, and wheat by ultra-performance liquid chromatography coupled to tandem mass spectrometry[J]. Analyt Bioanalyt Chem, 2011, 399(7): 2539-2547. |
 2015, Vol. 17
2015, Vol. 17


