2. 贵州省烟草公司毕节市公司, 贵州毕节 551700
2. Bijie Branch of Guizhou Provincial Tobacco Corporation, Bijie 551700, Guizhou Province, China
植物病毒病是一类重要的农业病害,目前已经发现的植物病毒约有1 000多种[1]。由于病毒对寄主具有绝对依赖性,而植物又缺少像动物一样的免疫系统,这要求植物病毒抑制剂只对病毒起作用而不能伤害宿主细胞,使得植物病毒病的防治和植物病毒抑制剂的开发变得困难[2]。在植物病毒中,烟草花叶病毒(TMV)对经济作物的危害最为严重。烟草花叶病毒病是一种系统侵染性病害,在全世界主要烟草产区均有分布,每年因TMV危害所造成的损失高达1亿多美元[3],在我国烟草产区中该病被列为主要发生病害[4, 5]。
植物是生物活性化合物的天然宝库,其产生的次生代谢产物超过40万种,大多具有不同的杀虫或抗菌活性,其中不乏对病毒病有效的成分[6]。商陆属植物是最早发现的具有抗植物病毒活性的植物之一[7]。自1948年Kassanis等[8]首次从商陆中提取得到一种具有抗病毒活性的糖蛋白以来,国内外研究者对商陆的化学成分做了大量研究,其中对垂序商陆Phytolacca americana L.的研究较多[9]。商陆中富含皂苷和多糖以及商陆酸性杂多糖、商陆苷、商陆皂苷元、商陆酸和美商陆酸等成分,其中研究较为清楚的是商陆皂苷类成分,其具有多种抑菌、抗炎和抗肿瘤活性,并具有增强免疫的作用[10, 11, 12, 13, 14, 15]。近年来,关于垂序商陆的研究取得了不少新进展,尤其是从商陆属植物中发现的核糖体失活蛋白,由于其具有广谱的抗病毒和抗菌活性而受到研究者的广泛关注[16]。对于植物商陆抗TMV活性方面的研究,目前主要集中在粗提物[13]和大分子化合物研究方面[16],对于其中的小分子化合物,如皂苷、萜类成分的研究鲜有报道。为此,本研究通过活性追踪法,对采集于贵州省福泉市的植物垂序商陆中的小分子化学成分进行了抗TMV活性的追踪与分离,从中筛选出了两个具有抗TMV活性的三萜皂苷类化合物,对其结构进行了解析,并初步探讨了其抗TMV活性的作用机制。
1 材料与方法1.1 供试植物及药剂
垂序商陆Phytolacca americana L.采集于贵州省福泉市,供试部位为植物枝叶,自然阴干后粉碎。植物标本由贵阳中医学院付志明副教授鉴定,保存于贵州省烟草科学研究院。
对照药剂:2%宁南霉素水剂(ningnanmycin AS),黑龙江强尔生化技术开发有限公司提供。 1.2 供试病毒
烟草花叶病毒(TMV)U1普通株系,由贵州省烟草科学研究院提供。通过常规的摩擦接种,使其在普通烟K326上繁殖,采用Gooding的方法[17]提纯。
准确量取5 μL提纯的TMV,用0.01 mol/L的磷酸盐缓冲液(PB)稀释100倍,紫外分光光度计法测定其质量浓度为16 mg/mL。于-20℃冰箱中保存,临用前用0.01 mol/L的PB稀释至32 μg/mL。
1.3 供试寄主
心叶烟Nicotiana glutinosa(为TMV枯斑寄主)和普通烟K326(Nicotianata bacum K326),其种子由贵州省烟草科学研究院提供;于无虫温室中漂盘育苗。挑选6~8片叶龄,且大小、质量相似的健康植株供试。
1.4 主要试剂和仪器提取用乙醇为工业级,重蒸处理后使用;萃取及分离试剂均为分析纯,购于西陇化工股份有限公司;柱层析硅胶(200~300目)、硅胶H和薄层层析硅胶(GF254)均为青岛海洋化工厂生产;反相硅胶柱层析RP-18(40~63 μm)为Merck公司产品;凝胶Sephadex LH-20(25~100 μm)为Amersham Biosciences公司产品(Sweden)。
XT-4双目显微熔点测定仪(温度未校正);SEPA-300旋光仪(Horiba生产);EI质谱由HP-5973型质谱仪测定(惠普-安捷伦公司生产);ESI质谱由Waters 2695 HPLC-Thermo Finnigan LCQ Advantage型质谱仪测定(Waters公司生产);FTS-135红外光谱仪(Bio-Rad生产);Shimadzu 210双波长紫外分光光度仪;INOVA-400核磁共振仪(以TMS为内标)。 1.5 活性成分的提取、分离及结构鉴定
1.5.1 活性成分的提取
称取垂序商陆枝叶粗粉4 kg,用乙醇(工业级)按m(原料)∶V(提取剂)=1∶2 的配比加热回流提取3次,每次4 h,过滤,合并3次滤液后减压浓缩得浸膏113.4 g,于4 ℃冰箱中保存备用。
1.5.2 活性成分的分离将乙醇提取物利用蒸馏水悬浊,分别经石油醚、乙酸乙酯和正丁醇萃取,包括水相共得到4个极性部分。利用活体半叶枯斑法[18],对各组分进行抗TMV活性测试,其中乙酸乙酯萃取部分表现出较强的抗TMV活性。将该部分采用正相硅胶柱层析分离,用氯仿-甲醇进行梯度洗脱,得到组分Fr.1~Fr.9,同样采用活体半叶枯斑法进行活性检测,共发现具有抗TMV活性的5段组分,其中CL-2和CL-4为高活性组分。将这5段组分中的每一段用小孔树脂(MCI)除去大部分色素后,分别通过RP-C18反相硅胶柱层析洗脱,流动相为V(甲醇)∶V(水)=1∶1~1∶0。洗脱液通过凝胶柱层析,用甲醇进行回溶,滤去甲醇不溶物,利用半制备高效液相色谱,在流动相为V(甲醇)∶V(水)=34∶66条件下,得到白色针晶状单体化合物1(26 mg),在流动相为V(乙腈)∶V(水)=45∶55条件下 ,得到白色粉末状化合物2(34 mg)。
1.5.3 结构鉴定根据熔点、质谱及核磁共振氢谱及碳谱的检测结果,并结合相关文献解析化合物1和2的结构。> 1.6 生物活性测定
1.6.1 活体钝化TMV作用测定
将化合物1、2及对照药剂2%宁南霉素水剂先用30 μL DMSO溶解,再用含1% Tween-20的dd H2O配制成有效成分质量浓度分别为200、100、50、25、10和5 μg/mL的系列药液,采用半叶枯斑法[18]进行TMV钝化活性检测。具体步骤为:将供试化合物溶液与对照药剂溶液分别与16 μg/mL的病毒汁液按体积比1∶1混合钝化0.5 h后,磨擦接种于右半叶片,将病毒汁液与溶媒按体积比1∶1混合摩擦接种于左半叶片,并以左半叶片为对照组,右半叶为处理组。每个浓度处理3株,重复3次。置光照培养箱培养,3~4 d出斑完全后调查心叶烟枯斑数,按(1)式计算枯斑抑制率。
枯斑抑制率/%=[(对照组枯斑数-处理组枯斑数/对照组枯班数]×100(1)
参考文献方法[19]计算各药液的抑制中浓度(IC50值)。
1.6.2 抑制TMV初侵染和增殖作用测定挑选健康合适的普通烟,在暗室放置12 h后接种TMV病毒,放入28℃±1℃,相对湿度70%的光照智能培养箱中黑暗避光培养,6 h后挑选长势一致的接种病毒叶片和未接种病毒的健康叶片,用直径10 mm打孔器避开主叶脉打取叶圆片,将叶圆片朝上放入盛有不同质量浓度(200、100、50、25、10、5 μg/mL)供试化合物、对照药剂及25 mL/LDMSO溶液的灭菌培养皿中,每皿放置15片,于28 ℃±1 ℃、照度10 000 lx及相对湿度70%的培养箱中培养。48 h后,分别取出叶圆片,用消毒的脱脂棉吸干水,分别加入10 mL 0.01 mol/L的PB,在液氮中研磨。于12 000×g、4 ℃下离心10 min,取上清液作为待测液;另取16 mg/L的TMV溶液分别配制成不同质量浓度的病毒溶液(3.75、1.87、0.93、0.46、0.23 μg/mL)[20]。将上述待测液和不同质量浓度的病毒溶液,利用双抗夹心酶联免疫吸附法(DAS- ELISA)[21]在酶标仪中测定其OD405值,并制作病毒质量浓度与OD405值的标准曲线,得到回归方程。根据TMV病毒标准曲线计算出待测溶液的TMV浓度,并按公式(2)计算TMV抑制率。每个化合物重复3次。
试验设处理组、阳性对照、阴性对照和空白对照。处理组为不同浓度的供试化合物溶液中的叶圆片;阳性对照为在25 mL/L 的DMSO溶液中放置接种病毒的叶圆片;阴性对照为在DMSO溶液中放置未接种TMV的健康烟草叶片;空白对照为含25 mL/L的 DMSO的1%的吐温水溶液。
TMV抑制率/%=[1-(处理组TMV质量浓度/阳性对照的TMV质量浓度)]×100(2)
1.6.3 Western-blot及SDS-PAGE电泳方法参考文献[20]方法测定。取1.6.2节中制作的待测液,利用Western blotting法[19]检测化合物对TMV外壳蛋白积累的影响,比较处理组、阳性对照、阴性对照和空白对照条带的显色情况。
2 结果与分析
2.1 商陆活性成分的分离、纯化及结构鉴定
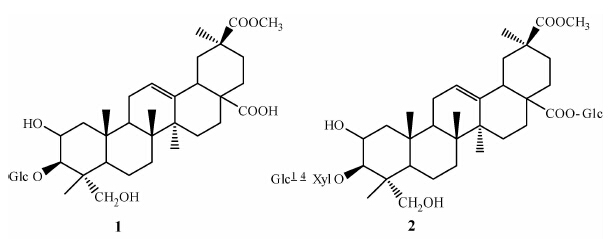
商陆提取物经二次硅胶柱层析和高效液相色谱分离等方法,从CL-2和CL-4两个馏分中分离得到化合物1和2,经熔点、质谱及核磁共振谱测定并结合相关文献[22, 23]解析其结构如Scheme 1所示。
 | Scheme 1 |
化合物1:白色粉末;分子式C31H47O6;m.p. 248~252 ℃,ESI-MS,m/z:516.3422 [M+H]+ ,易溶于甲醇;Liebermann-Burchard反应显紫红色,Molish反应呈阳性。IR,v/cm-1:3 426(OH),1 735(酯键CO),1 696(羧基CO),1 646(CC),2 943、1 460、1 380(CH3,CH2),1 218(酯键 C—O—C)、1 048(苷键C—O)。1H NMR(400MHz,DMSO-d6),δδ: 0.70(3H,s,CH3),0.82(3H,s,CH3),1.05(3H,s,CH3),1.09(3H,s,CH3),1.20(3H,s,CH3),3.63(3H,s,OCH3),4.27(1H,d,J=8.0 Hz,端基H),5.19(1H,m,C12-H)。13C NMR(DMSO-d6,δ): 43.5(C-1),69.2(C-2),80.7(C-3),43.3(C-4),47.4(C-5),16.9(C-6),32.0(C-7),41.4(C-8),48.7(C-9),35.9(C-10),23.0(C-11),122.1(C-12),143.6(C-13),41.6(C-14),27.2(C-15),23.0(C-16),46.2(C-17),42.2(C-18),42.2(C-19),45.0(C-20),29.8(C-21),33.3(C-22),63.5(C-23),14.3(C-24),16.5(C-25),16.9(C-26),25.6(C-27),178.3(C-28),27.8(C-29),176.4(C-30),51.7(C-31),104.2(C-Glc-1),73.8(C-Glc-2),76.6(C-Glc-3),70.0(C-Glc-4),76.9(C-Glc-5),61.1(C-Glc-6)。
该化合物Liebermann-Burchard反应显紫红色和Molish反应显阳性,说明是三萜皂苷类化合物。红外光谱显示有羟基、羧基、双键和苷键。核磁共振氢谱显示有5个甲基、1个甲氧基、1个烯质子和1个糖端基质子。核磁共振碳谱在δ 104.2有一个糖的端碳信号,而核磁共振氢谱中糖的端质子为4.27(1H,d,J=8.0 Hz),证明葡萄糖以β-苷键与苷元相接。将化合物1的核磁共振碳谱与化合物商陆皂苷乙[22]的比较,除了糖的信号不同之外,二者的碳谱化学位移值几乎一致,表明除了糖基不同之外,二者具有相同的苷元,且葡萄糖连在苷元的C3位上。根据以上分析,同时与文献[22]的氢谱数据比较,确定化合物1为3-O-β-D-吡喃葡萄糖-2-羟基商陆酸-30-甲酯(商陆皂苷丁,eseulentoside D)。
化合物2:白色粉末;分子式C48H76O21;m.p. 220~228℃;ESI-MS,m/z:1011.49 [M+Na]+。易溶于甲醇;Molish反应与Liebermann-Burchard反应均为阳性。IR,v/cm-1:3 411(OH),1 738(酯键CO),1 669(CC),2 901、1 492、1 422(CH3,CH2),1 278(酯键 C—O—C)。1H NMR(400 MHz,DMSO-d6),δ: 0.64(3H,s,CH3),0.79(3H,s,CH3),1.02(3H,s,CH3),1.03(3H,s,CH3),1.12(3H,s,CH3),3.58(3H,s,OCH3),4.17(1H,d,J=8.0 Hz,端基H),4.29(1H,d,J=8 Hz,端基H),4.42(1H,d,J=8 Hz,端基H),5.18(1H,m,C12-H)。13C NMR(DMSO-d6,δ): 43.8(C-1),69.9(C-2),80.3(C-3),43.3(C-4),47.5(C-5),16.9(C-6),32.0(C-7),41.4(C-8),48.7(C-9),36.0(C-10),23.1(C-11),122.3(C-12),143.4(C-13),41.4(C-14),27.3(C-15),22.7(C-16),46.3(C17-),42.2(C-18),41.8(C-19),45.5(C-20),29.7(C-21),32.9(C-22),63.3(C-23),14.3(C-24),16.8(C-25),16.7(C-26),25.6(C-27),174.9(C-28),27.8(C-29),176.4(C-30),51.8(C-31),105.1(C-Xyl-1),73.6(C-Xyl-2),74.9(C-Xyl-3),77.9(C-Xyl-4),63.3(C-Xyl-5),101.7(C-Glc-1),72.8(C-Glc-2),76.4(C-Glc-3),70.2(C-Glc-4),76.5(C-Glc-5),61.2(C-Glc-6),94.1(C-Glc-1),72.4(C-Glc-2),76.7(C-Glc-3),69.5(C-Glc-4),77.1(C-Glc-5),60.6(C-Glc-6)。
根据Liebermann-Burchard反应显紫红色和Molish反应显阳性,说明该化合物是三萜皂苷。红外光谱显示有羟基、羧基、双键和苷键。核磁共振氢谱显示有5个甲基、3个糖端质子、1个甲氧基和1个双键质子。与化合物商陆皂苷甲的核磁共振碳谱[23比较发现,化合物2除了比商陆皂苷甲多1个葡萄糖的碳信号外,其余碳信号基本相同,但化合物2的C-28信号明显增强,且向高场移动3.5,说明C-28羧基与葡萄糖缩合成酯苷。根据以上数据,确定化合物2为3-O-(β-D-吡喃葡萄糖-β-D-吡喃木糖)-2-羟基-30-甲酯-28-O-β-D-吡喃葡萄糖商陆苷(商陆皂苷H,eseulentoside H)[23。
2.2 化合物活体钝化TMV作用活性结果(表 1)表明,在不同浓度下,用化合物1和2涂抹烟叶叶片后,对TMV病毒均能产生较好的钝化活性,其活性均高于对照药物宁南霉素。
| 表 1 供试化合物抗TMV钝化活性Table 1 Inhibitory activity against TMV of compounds 1,2 and ningnanmycin |
各供试化合物的毒力测定结果(IC50值)见表 2。其中,化合物1和2的IC50值分别为9.52和10.78 μg/mL,活性明显高于宁南霉素(IC50值为65.8 μg/mL)。
| 表 2 化合物活体钝化TMV作用活性(半叶枯斑法,IC50值)Table 2 Anti-TMV activity of the compound in vivo(semi leaf spot method) |
病毒质量浓度与其利用DAS-ELISA法测定的OD405值之间的标准曲线见图 1。回归方程为y=0.074 1x+0.458 5,相关系数r=0.992。
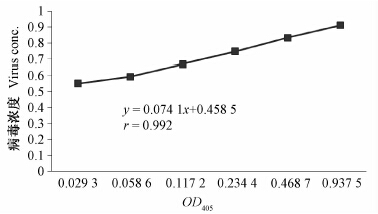 | 图 1 DAS-ELESA测试中病毒浓度与OD405值的标准曲线 Fig. 1 The standard curve of virus concentration and OD405 value in DAS-ELESA test |
离体法测定的两个化合物抗TMV侵染的活性见表 3。结果表明,感染TMV病毒的叶片经过两个化合物药液浸泡后,均表现出较好的抑制病毒初侵染和增殖的作用,且两个化合物在50、25和10 μg/mL下的抑制效果均好于对照宁南霉素。
| 表 3 化合物抗TMV侵染活性(离体叶圆片法)Table 3 Compounds anti-TMV infection activity test in vitro leaf disc method |
为了验证了DAS-ELESA检测结果,进一步采用Western-blot检测了化合物对TMV外壳蛋白积累的影响。由图 2可见:用化合物1和化合物2处理过的样品中外壳蛋白积累明显被抑制,Western-blot检测不到或仅检测到很弱的外壳蛋白(CP)条带表明,表明化合物1(商陆皂苷丁)和化合物2(商陆皂苷H)主要作用于TMV外壳蛋白,进而起到抑制病毒增殖复制的作用。在50 μg/mL下,两种供试药液的抑制作用均强于对照药剂宁南霉素,但随着其质量浓度的降低,化合物1的抑制效果弱于化合物2。
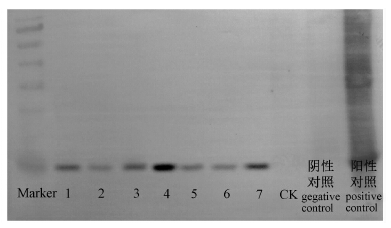 |
1. 商陆皂苷丁25 μg/mL;2. 商陆皂苷丁50 μg/mL;3. 商陆皂苷丁10 μg/mL;4. 宁南霉素50 μg/mL;5. 商陆皂苷H 25 μg/mL;6. 商陆皂苷H 50 μg/mL;7. 商陆皂苷H 10 μg/mL;CK为空白;阴性对照为未接种TMV只浸入DMSO溶液中的叶片;阳性对照为接种TMV并浸入DMSO溶液中的叶片。 1. eseulentoside D 25 μg/mL;2. eseulentoside D 50 μg/mL;3. eseulentoside D 10 μg/mL;4. ningnanmycin 50 μg/mL;5. eseulentoside H 25 μg/mL;6. eseulentoside H 50 μg/mL;7. eseulentoside H 10 μg/mL;CK was blank; negative control was the leaf dipped into DMSO but not inoculated with TMV; positive control was the leaf dipped into DMSO and inoculated with TMV. 图 2 Western-blot检测结果 Fig. 2 Western blot analysis |
在对植物中天然抗病毒成分的研究中,对植物小分子抗TMV的活性研究取得了较为丰硕的成果,先后发现了一些生物碱、甾体和苦木素等小分子化合物具有显著的抗TMV活性,其中很多具有独特的抗病毒机制[24, 25, 26, 27, 28]。如从马蓝中分离的生物碱3-acetony-3-hydroxyoxindole、甾体cinchonaglycoside C和seco-pregnane steroids 具有显著的抗TMV活性,且具有不同的作用机制,其中后两者并不是直接作用于TMV病毒,而是在植物感染TMV以前即激活了植物的系统获得抗性,或产生了多种核糖体失活蛋白,使TMV病毒难以侵染[24, 25, 26]。
研究发现,垂序商陆抗病毒蛋白具有广谱的抗病毒及抑菌等作用[7, 8, 9, 10, 11, 12, 13, 14, 15, 16]。本研究通过活性追踪法,对采集于贵州省福泉的垂序商陆的枝叶中的化学成分进行抗TMV活性的追踪分离,首次从商陆中分离得到了具有较好抗病毒活性的小分子化合物——商陆皂苷和商陆皂苷H,并对其抗病毒机制进行了初步研究,这为今后继续研究该属植物提供了基础。后续工作将继续对垂序商陆的根茎、枝叶和果实中的化学成分进行抗TMV活性的追踪分离,同时对其中的三萜皂苷与商陆抗病毒蛋白(PAP)产生的联系进行探讨,为进一步开发无害、环境相容性好、多次诱导不会使植物产生特异性抗性的抗TMV激发子型生物农药提供物质基础和科学依据。
| [1] | Slusarenko A F, Freser R S, van Loon L C. Mechanisms of Resistance to Plant Diseases[M]. Netherlands: Springer, 2000: 480-486. |
| [2] | Ritzenthaler C. Resistance to plant viruses: old issue, news answers?[J]. Curr Opin Biotechnol, 2005, 16(2): 118-122. |
| [3] | 吴云锋, 曹让, 魏宁生, 等. 生物病毒农药筛选及应用[J]. 世界农业, 1995(5): 35-36. Wu Yunfeng, Cao Rang, Wei Ningsheng, et al. Screening and application of biological virus pesticides[J]. World Agric, 1995(5): 35-36.(in Chinese) |
| [4] | 陈瑞泰, 朱贤朝, 王智发, 等. 全国16个主要烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学, 1997(4): 1-7. Chen Ruitai, Zhu Xianchao, Wang Zhifa, et al. A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces(regions) in China[J]. Chinese Tobacco Sci, 1997(4): 1-7.(in Chinese) |
| [5] | 张明显, 许广恺, 吴云锋. 烟草花叶病流行原因分析[J]. 烟草科技, 1997(4): 44-45. Zhang Mingxian, Xu Guangkai, Wu Yunfeng. Analysis of tobacco mosaic virus causes[J]. Tobacco Sci & Technol, 1997(4): 44-45.(in Chinese) |
| [6] | Swain T. Secondary compounds as protective agents[J].Ann Rev Plant Physiol, 1977, 28: 479-501. |
| [7] | Duggar B M, Armstrong J K. The effect of treating the virus of tobacco mosaic with the juice of various plants[J]. Ann Missouri Bor Garden, 1925, 12(4): 359-366. |
| [8] | 韩克慧. 商陆的免疫药理和临床应用[J]. 中成药研究, 1986(12): 24-25. Han Kehui. Pokeweed immune pharmacology and clinical application[J]. Chinese Traditional Patent Medicine, 1986(12): 24-25.(in Chinese) |
| [9] | 贾金萍, 秦雪梅, 李青山. 商陆化学成分和药理作用的研究进展[J]. 山西医科大学学报, 2003, 34(1): 89-92. Jia Jinping, Qin Xuemei, Li Qingshan. Research progress on chemical constituents and pharmacological action of Phytolacca americana L[J]. J Shanxi Med Univ, 2003, 34(1): 89-92. |
| [10] | 郑钦岳, 麦凯, 潘祥福, 等. 商陆皂甙甲的抗炎作用[J]. 中国药理学与毒理学杂志, 1992, 6(3): 221-223. Zheng Qinyue, Mai Kai, Pan Xiangfu, et al. Antiinflammatory effect of esculentoside A[J]. Chinese J Pharmacol Toxicol, 1992, 6(3): 221-223.(in Chinese) |
| [11] | Williams L A D,Roesner H, Conrad J, et al. Selected secondary metabolites from the phytolaccaceae and their biological/pharmaceutical significance[J]. Rec Res Dev Phytochem, 2002, 6: 13-68. |
| [12] | Perret C, Wolfender J L, Hostettmann K. LC/ES-MS analysis of triterpene glycosides: rapid estimation of the saponin content of dried berries of Phytolacca dodecandra[J]. Phytochem Anal, 1999, 10(5): 272-278. |
| [13] | Hasrat J A, De Bruyne T, De Backer J P, et al. Cirsimarin and cirsimaritin, flavonoids of Microtea debilis(Phytolaccaceae) with adenosine antagonistic properties in rats: leads for new therapeutics in acute renal failure[J]. J Pharm Pharmacol, 1997, 49(11): 1150-1156. |
| [14] | 熊江, 周俊, 戴好富, 等. 多蕊商陆的化学成分[J]. 云南植物研究, 2002, 24(3): 401-405. Xiong Jiang, Zhou Jun, Dai Haofu, et al. Chemical constituents from Phytolacca polyandra[J]. Acta Botanica Yunnanica, 2002, 24(3): 401-405.(in Chinese) |
| [15] | 葛永辉, 张婕, 刘开兴, 等. 垂序商陆抗烟草花叶病毒活性物质提取及分离[J]. 农药, 2013, 52(9): 680-683. Ge Yonghui, Zhang Jie, Liu Kaixing, et al. Extraction and separation of anti-TMV activity extracts from Phytolacca[J]. Agrochemicals, 2013, 52(9): 680-683.(in Chinese) |
| [16] | 李洪艳, 王关林, 李建国, 等. 核糖体失活蛋白研究进展[J]. 植物学通报, 2005, 22(4): 456-462.Li Hongyan, Wang Guanlin, Li Jianguo, et al. Advances in studies of ribosome-inactivating proteins[J]. Chinese Bull Botany, 2005, 22(4): 456-462. |
| [17] | Gooding G V Jr, Hebert T T. A simple technique for purification of tobacco mosaic virus in large quantities[J]. Phytopathology, 1967, 57(11): 1285. |
| [18] | 田波, 裴美云. 植物病毒研究方法[M]. 北京: 科学出版社, 1987. Tian Bo, Pei Meiyun. Plant Virus Research Methods[M]. Beijing: Science Press, 1987.(in Chinese) |
| [19] | Ge Yonghui, Liu Kaixing, Zhang Jianxin, et al. The limonoids and their antitobacco mosaic virus(TMV) activities from Munronia unifoliolata Oliv[J]. J Agric Food Chem, 2012, 60(17): 4289-4295. |
| [20] | Wang Yongshan, Fan Hongjie, Li Yin, et al. Development of a multi-mimotope peptide as a vaccine immunogen for infectious bursal disease virus[J]. Vaccine, 2007, 25(22): 4447-4455. |
| [21] | Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning: A Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory, 1989: 315. |
| [22] | 周凤梅, 赵燕燕, 王怀荟, 等. 商陆种子的化学成分研究[J]. 齐鲁药事, 2011, 30(1): 5-8. ZhouFengmei, Zhao Yanyan, Wang Huaihui, et al. Study on the chemical composition of semen of Radix Phytolaccae[J]. Qilu Pharmaceut Affairs, 2011, 30(1): 5-8.(in Chinese) |
| [23] | Takahashi H, Namikawa Y, Tanaka M, et al. Triterpene glycosides from the cultures of Phytolaeca amerlcana[J]. Chem Pharm Bull, 2001, 49(2): 246-248. |
| [24] | Li Yanmei, Jia Yantao, Zhang Zhongkai, et al. Purification and characterization of a new ribosome inactivating protein from cinchonaglycoside C-treated tobacco leaves[J]. J Integ Plant Biol, 2007, 49(9): 1327-1333. |
| [25] | Li Yanmei, Zhang Zhongkai, Jia Yantao, et al. 3-Acetonyl-3-hydroxyoxindole: a new inducer of systemic acquired resistance in plants[J]. Plant Biotech J, 2008, 6(3): 301-308. |
| [26] | Li Yanmei, Wang Lihua, Li Shunlin, et al. Seco-pregnane steroids target the subgenomic RNA of alphavirus-like RNA viruses[J]. Proc Natl Acad Sci USA, 2007, 104(19): 8083-8088. |
| [27] | Wang Yuehu, Zhang Zhongkai, Yang Fumei, et al. Benzylphenethylamine alkaloids from Hosta plantaginea with inhibitory activity against tobacco mosaic virus and acetylcholinesterase[J]. J Nat Prod, 2007, 70(9): 1458-1461. |
| [28] | Chen Jia, Yan Xiaohui, Dong Jiahong, et al. Tabacco mosaic virus(TMV) inhibitoers from Picrasma quassioides Benn[J]. J Agric Food Chem, 2009, 57(15): 6590-6595. |
 2015, Vol. 17
2015, Vol. 17


