2. 农业部旱作节水农业重点实验室, 北京 100081;
3. 中国农业科学院 农业环境与可持续发展研究所, 北京 100081
2. Key Laboratory of Dry-land Agriculture, Ministry of Agriculture, Beijing 100081, China;
3. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081, China
干旱是制约我国玉米生产发展和产量提高的第一要素,可降低产量20%~50%[1]。近20年来,东北地区干旱化趋势十分明显[2]。干旱发生频率较高的时段主要是在苗期生长阶段,其次是灌浆成熟期[3]。水分不足往往影响玉米种子的萌发出苗,造成缺苗断垄,同时干旱胁迫使其幼苗生长受阻,发根量少且根短,苗弱,成活率低,严重影响玉米生长发育及产量[4]。因此迫切需要研究开发能够提高玉米抗耐旱性的技术或产品。
多胺(polyamines,PAs) 是生物体代谢过程中产生的具有较高生物活性的低分子质量脂肪族含氮碱的总称,被认为是植物生长调节物质或激素的第二信使[5、6]。高等植物中常见的PAs有腐胺(putrescine)、尸胺(cadaverine)、精胺(spermine)和亚精胺(spermindine,Spd)。其中Spd不仅可作为直接的胁迫保护物质调节渗透势,还可作为信号分子在胁迫信号转导中参与植物胁迫抗性机制的构建[7]。Spd能有效缓解多种非生物胁迫对植物体造成的伤害,如低温胁迫[8]、盐胁迫[9, 10, 11]、干旱胁迫[12, 13, 14]、低氧胁迫[15, 16]、淹水胁迫[17]、重金属[18]和高温胁迫[19]等。李州等[14]研究表明,外源亚精胺可显著提高干旱胁迫下白三叶Trrifolium repens L.叶片的相对含水量,降低叶绿素的降解速率,维持电解质渗透率,提高胁迫下细胞膜的稳定性。汪天等[16]研究表明,外源多胺可缓解低氧胁迫对黄瓜幼苗根系的生长抑制,且主要以Spd的形式发挥促进作用,显著增加其根系总长、总表面积和总体积以及总根尖数。关于多胺缓解逆境胁迫方面的报道较多,但外源Spd对干旱胁迫下玉米幼苗的生长有何影响,短时间胁迫下各生长指标的动态变化是怎样的,以及是否可缓解干旱胁迫造成的负面效应等未见报道。本研究以水培玉米幼苗为试验材料,研究了外源Spd 处理对干旱胁迫下幼苗生物量积累、根系特征及叶片生理特性的影响,探讨了Spd增强玉米幼苗耐旱性的生理调节机制,以期为东北地区玉米的抗旱生产提供一种新的技术手段。
1 材料与方法
1.1 试验材料
分别以抗旱性不同的玉米品种先玉335(抗旱性较强,先锋种子公司)和丰禾1号(抗旱性较弱,双城市丰禾玉米研究所)为试验材料。亚精胺(spermindine,Spd,Sigma 公司);聚二乙醇6000(PEG-6000,天津市瑞金化学品有限公司);根系扫描仪(加拿大Regent公司);CCM-200+叶绿素测定仪(澳作生态仪器有限公司);雷磁DDS-307A电导率仪(上海精科仪器有限公司)。
1.2 试验设计试验于2014年5—10月在东北农业大学园艺站温室内进行。选择均匀一致的玉米种子,经10%的次氯酸钠消毒10 min,置于(25±1) ℃的恒温箱内催芽12 h后,播种于装有蛭石的塑料托盘(直径45 cm,高度12 cm)中,于28/25 ℃(昼/夜)、自然光照条件下培养。每3 d浇灌1/2 Hoagland营养液1次,期间补充自来水。
当幼苗长至二叶一心时,选取整齐一致的幼苗,分成4组,每组60株,定植于装有25 L的1/2 Hoagland 营养液[pH(6.3±0.1)]的塑料水槽(48 cm×32 cm×15 cm)中继续培养。待幼苗长至三叶一心时进行试验处理:1)1/2 Hoagland 营养液培养(CK);2)营养液内添加0.1 mmol/L的Spd(Spd);3)营养液中添加 15%的PEG-6000模拟干旱(PEG);4)营养液内同时添加0.1 mmol/L的 Spd和15%的PEG-6000(Spd+PEG)。其中,Spd的浓度是在预备试验基础上筛选出的最适浓度。向营养液中添加Spd,预处理24 h后进行PEG干旱处理。为缓冲PEG对幼苗的冲击,将PEG分3次施入,间隔6 h,直至达到本试验所要求的浓度。处理期间,每日调整1次pH值(6.3±1),用定时插排控制气泵定时通气(40 min/h),每3 d更换1次营养液。分别于处理后的0、12、24、36、48及60 h选取第二片展开叶测定叶绿素含量,后剪取叶片测定相对含水量和相对电导率,重复3次。处理60 h后测量株高(茎基部到生长点)和地上部及根部的鲜重和干重等生长指标,并取其根系进行扫描测定。
1.3 测定项目与方法 1.3.1 幼苗生长及干(鲜)重的测定干旱处理60 h后,每处理选取5株幼苗用盒尺测定株高;用蒸馏水冲洗干净,将根、冠分开,并擦干水分称取鲜重;将鲜样品置于105 ℃烘箱中杀青20 min后转至80 ℃烘箱烘至恒重,分别称重,计算根冠比。结果取平均值,单位为g/株。
1.3.2 根长、根表面积等根系生长指标测定采用根系扫描仪进行测定,将干旱处理60 h的各处理根系用自来水清洗干净,放在透明玻璃树脂托盘(40 cm×30 cm×2 cm)内,向根盘中注入8~10 mL水以避免根系分支互相缠绕,影响测定数值,利用LS-A根系分析系统分析根长、根表面积和根体积等。
1.3.3 叶绿素的测定采用CCM-200+叶绿素测定仪进行测定,以SPAD值代表叶绿素相对含量。
1.3.4 叶片相对含水量的测定参照张志良等[20]的方法。剪下叶片后立即称取鲜重;将待测叶片放入烧杯中,加入蒸馏水,黑暗放置24 h后称饱和重;之后于80 ℃恒温烘箱中烘至恒重,称其干重。3次重复。根据公式(1)计算叶片的相对含水量(RWC),结果取平均值。
RWC/%=[(鲜重-干重)/(饱和重-干重)]×100(1)
1.3.5 细胞质膜透性的测定采用雷磁DDS-307A电导率仪进行测定,以相对电导率表示[21]。
1.3.6 数据处理利用Excel 进行数据整理并作图,DPS 7.05进行统计分析。
2 结果与分析 2.1 干旱胁迫下Spd处理对玉米幼苗生长、生物量积累和株高的影响
由图 1可以看出:与对照相比,干旱胁迫处理36 h时,两品种玉米幼苗生长均受到了不同程度的抑制,表现为植株矮小,叶色发黄且有不同程度的萎蔫,根系短,且对丰禾1号的影响更明显;而干旱胁迫下施加Spd后则可增加新根发生量。
 | 图 1 干旱胁迫下外源Spd处理36 h时玉米幼苗植株生长状况 Fig. 1 Effects of exogenous Spd on growth of maize seedlings under drought stress at 36 h |
由表 1可知:在处理60 h时,与对照相比,干旱胁迫下,两品种玉米幼苗生长均受到明显抑制,表现为株高、地上部和根部的干(鲜)重显著降低,并且对地上部的影响大于根部,根冠比均有所增加;而单纯外源Spd处理的幼苗地上、根部干(鲜)重和株高均有所增加,但对根冠比无显著影响。与对照相比,单纯干旱胁迫下,先玉335的地上部和根部鲜重分别降低了45.6%和40.3%,而其相应干重的降幅则分别达30.4%和22.4%;丰禾1号的地上部和根部鲜重分别降低了50.8%和45.2%,相应干重的降幅分别为43.2%和35.9%。干旱胁迫下先玉335和丰禾1号玉米幼苗的株高分别下降了11.7%和18.9%,说明干旱胁迫对丰禾1号生长的抑制作用更大。与单纯干旱处理相比,干旱胁迫下进行Spd处理,先玉335的地上部干重与鲜重、根部干重与鲜重及株高分别增加了16.7%、36.9%、12.3%、29.3%和11.8%,而丰禾1号则分别增加了31.2%%、40.6%、21.7%、33.5%和19.1%。可见,外源 Spd能有效缓解干旱胁迫对玉米幼苗尤其是不耐旱品种丰禾1号生长的抑制作用。
| 表 1 干旱胁迫下Spd处理对玉米幼苗生物量和株高的影响(60 h) Table 1 Effects of Spd on biomass accumulation and plant height of maize seedlings under drought stress(60 h) |
由表 2可看出:单纯Spd处理可显著提高两品种玉米幼苗的根长和根表面积,而对根体积和根平均直径影响不大;单纯干旱胁迫下,两品种玉米幼苗根系总根长、总根表面积、总根体积和根平均直径与对照相比均显著降低,其中先玉335根系上述各项指标较对照分别降低了33.9%、43.8%、33.8%和10.0%,丰禾1号分别降低了44.4%、46.3%、40.1%和10.1%,丰禾1号降低幅度大于先玉335,表明干旱胁迫对丰禾1号根系生长的抑制作用更为明显。外源Spd可缓解干旱胁迫对幼苗根系生长的抑制,经Spd+PEG处理后,先玉335根系上述各项指标较单纯干旱胁迫分别提高了25.4%、26.3%、23.5%和9.1%,丰禾1号分别提高了42.8%、30.7%、39.4%和12.8%,表明干旱胁迫下,外源Spd处理对丰禾1号根系生长抑制的缓解效果大于先玉335。
| 表 2 外源Spd处理对干旱胁迫下玉米幼苗根系生长的影响
Table 2 Effects of exogenous Spd on the growth of roots of maize seedlings under drought stress |
由图 2A和2B可知:不同处理对玉米幼苗根系长度贡献率最大的径级范围主要集中在0~0.5 mm(Ⅰ)和0.5~1.0 mm(Ⅱ),并且径级越大,对根系总长度的贡献率越小。先玉335各处理(CK,Spd,PEG,Spd+PEG)的细根(d≤1.0 mm)占总根系的比例分别为62.5%、62.3%、66.7%和71.6%,对应的丰禾1号各处理分别为59.2%、60.1%、62.7%和70.3%,说明干旱胁迫增加了玉米幼苗细根的径级比例;干旱胁迫下,Spd处理对直径为d>1.0 mm 的根的生长无明显影响。说明干旱胁迫下Spd处理主要是通过增加细根的数量来促进根系的生长。
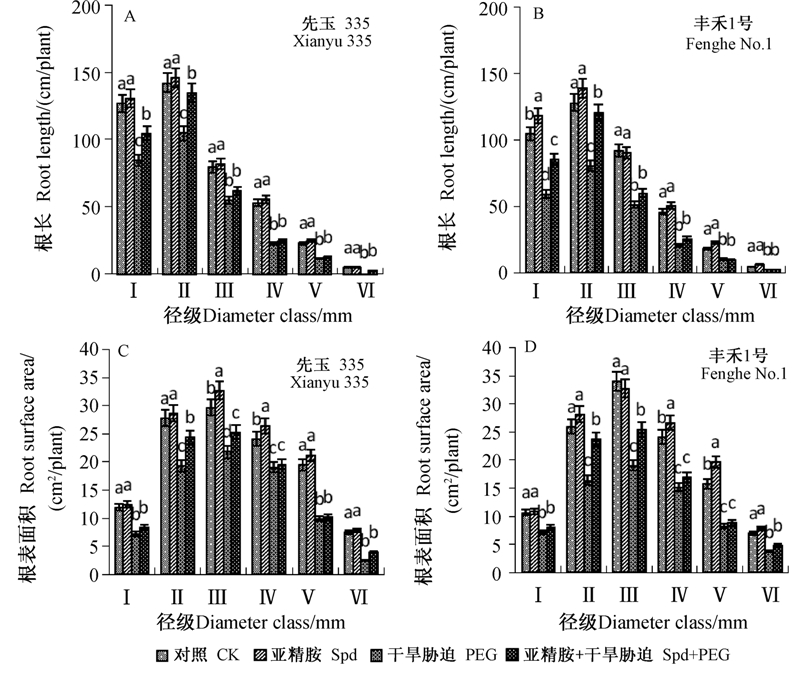 |
注:不同小写字母表示差异显著(P<0.05)。Ⅰ~Ⅵ表示径级。 Note: Different lowercase letters above the columns mean significant difference at 0.05 level. Ⅰ~Ⅵ represents diameter class.Ⅰ:0<d≤0.5 mm; Ⅱ:0.5 mm<d≤1.0 mm; Ⅲ:1.0 mm<d≤1. 5 mm; Ⅳ:1. 5 mm<d≤2. 5 mm; Ⅴ:2. 5 mm<d≤4.0 mm;Ⅵ:d>4.0 mm. 图 2 外源Spd处理对干旱胁迫下玉米幼苗不同径级根系形态指标的影响 Fig. 2 Effects of exogenous Spd on the root morphology in different diameterclasses of maize seedlings under drought stress |
由图 2C和2D可知:玉米幼苗根系总表面积与径级呈倒“V”型变化关系,径级为1.0~1. 5 mm的根系表面积占总根系表面积的比例最高。与对照相比,PEG处理根系总表面积在各径级均有不同程度降低。与单纯干旱胁迫处理相比,外源Spd处理增加了各径级根系表面积,且对径级为0.5~1.0和1.0~1.5 mm的根系的增加效果更为显著,其中先玉335分别增加了26.3%和15.8%,丰禾1号分别增加了44.8%和33.2%。说明Spd主要通过增加0.5~1.0和1.0~1.5 mm径级根系的生长、增加根系表面积、促进根系对水分和养分的吸收而增强了玉米幼苗适应干旱胁迫的能力。 2.3 干旱胁迫下Spd处理对玉米幼苗叶绿素含量的影响
由图 3可以看出:随着干旱胁迫时间的延长,与对照相比,Spd处理的两品种玉米幼苗叶片叶绿素含量略有升高但均未达到显著水平,而干旱胁迫处理玉米幼苗叶绿素含量显著下降,其中丰禾1号下降幅度较大。与单纯PEG处理相比,干旱胁迫下施加Spd可明显提高两品种玉米幼苗叶片叶绿素含量,其中先玉335叶绿素含量在12、36和60 h分别提高了3.7%、14.2%和30.2%,而丰禾1号则分别提高了5.1%、18.6%和37.9%。表明外源Spd 能够显著缓解干旱胁迫导致的玉米幼苗叶片叶绿素含量下降趋势,从而有效减缓了干旱胁迫对幼苗光合作用的抑制效应,且对抗旱性弱的品种丰禾1号具有更好的调节作用。
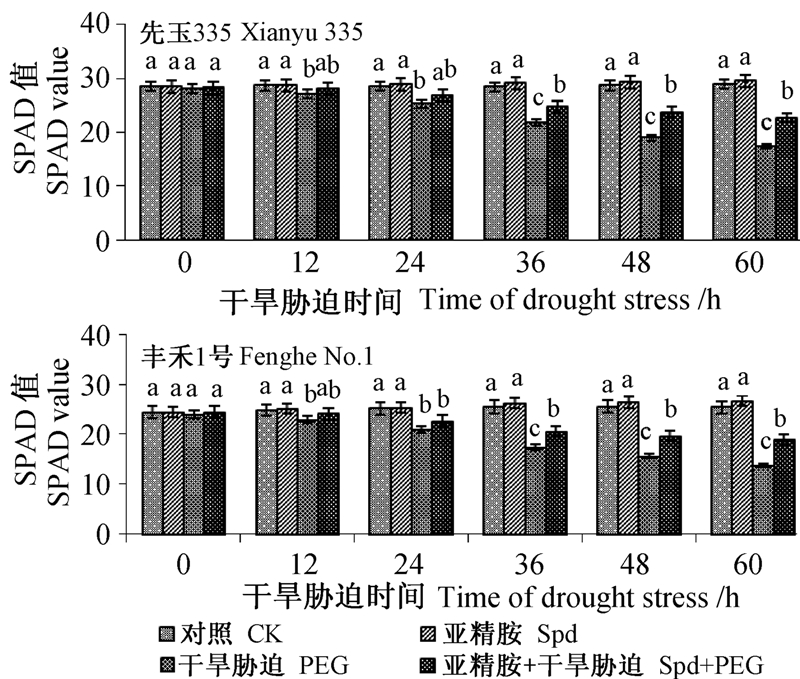 |
注:不同小写字母表示差异显著(P<0.05)。 Note: Different lowercase letters above the columns mean significant difference at 0.05 level. 图 3 外源Spd处理对干旱胁迫下玉米幼苗叶片叶绿素含量的影响 Fig. 3 ffects of Spd on chlorophyll content of maize seeding leaves under drought stress |
由图 4可以看出:干早胁迫下玉米幼苗叶片相对含水量(RWC)在处理24 h前下降缓慢,而后急速下降;至处理60 h 时,单纯干旱处理的先玉335和丰禾1号叶片的相对含水量与CK相比分别下降了34%和23%;而添加Spd虽未改变相对含水量下降的趋势,却减缓了叶片相对含水量下降幅度;抗旱性不同的玉米品种相对含水量变化幅度不同。干旱胁迫36和60 h时,Spd处理下先玉335相对于PEG处理相对含水量分别提高3.6%和9.6%,而丰禾1号则提高了4.7%和19.3%。这些结果表明,外施Spd具有减缓叶片失水的作用,对维持其正常生理功能具有重要意义,且与正常条件下相比,在干旱条件下其调控作用更为显著。同时可以看出抗旱性不同的玉米品种对干旱胁迫的反应不同,而外源Spd对其调控作用也不同。
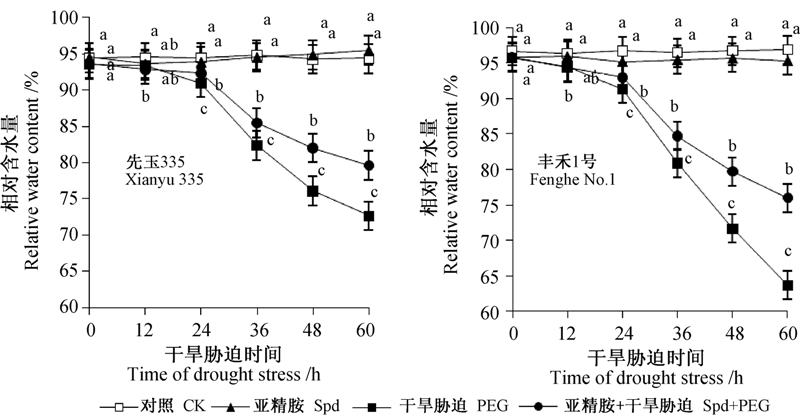 | 注:不同小写字母表示差异显著(P<0.05)。 Note: Different lowercase letters above the columns mean significant difference at 0.05 level. 图 4 外源Spd处理对干旱胁迫下玉米幼苗叶片相对含水量的影响 Fig. 4 Effects of Spd on relative water content in maize seedling leaves under drought stress |
由图 5可知:干旱胁迫下玉米幼苗叶片相对电导率呈逐步上升的趋势,且前期上升缓慢,而后急速上升。至处理60 h时,单纯干旱胁迫处理的先玉335和丰禾1号的相对电导率分别升至48.8%和60.3%。与对照相比,外源施用 Spd 对正常玉米叶片的相对电导率没有明显影响,但能显著降低干旱胁迫下叶片的相对电导率。在处理36和60 h时,干旱胁迫下外施Spd使先玉335和丰禾1号的相对电导率分别比各自干旱胁迫处理降低16.2%、26.5%和20.2%、33.9%。这表明Spd 处理减轻了因干旱胁迫造成的玉米幼苗叶片细胞内电解质的渗漏程度,对细胞膜具有一定的保护作用。
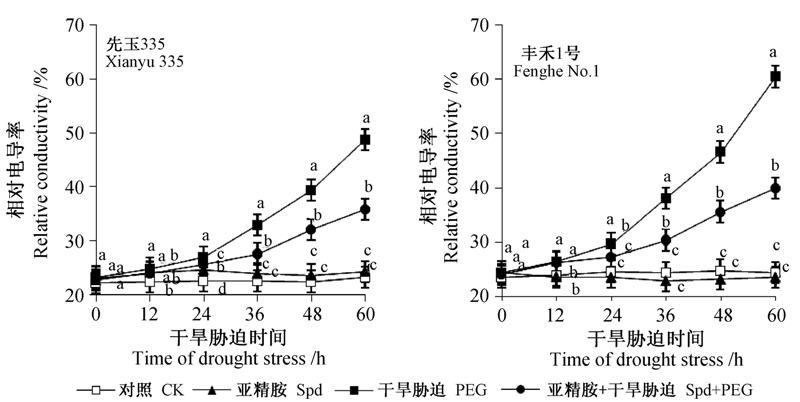 |
注:不同小写字母表示差异显著(P<0.05)。 Note: Different lowercase letters mean significant difference at 0.05 level. 图 5 外源Spd处理对干旱胁迫下玉米幼苗叶片相对电导率的影响 Fig. 5 Effects of Spd on relative conductivity of seedling leaves of maize under drought stress |
生长受抑制是干旱胁迫下植物最敏感的生理反应,也是最能直观反映植物受害程度的可测生理效应之一。在水分缺乏时,植物将在形态和生理方面产生抗旱应对策略,如干物质量以及根冠比的调整等[22]。本研究中,在PEG模拟干旱胁迫下,玉米幼苗地上部及根系生物量下降、根冠比增大、且地上部生物量的下降幅度大于根系的。这与王智威等[23]、齐健等[24]的研究结果一致。同时发现丰禾1号遭受的胁迫程度更大,表明先玉335比丰禾1号的抗胁迫能力强。干旱胁迫下经Spd处理,可显著减缓地上部及根部生物量和株高的下降幅度,表明外源Spd处理增强了玉米幼苗的抗干旱胁迫能力,缓解了其对玉米幼苗生长的抑制作用。张胜等[12]研究表明,经干旱胁迫处理后,抗旱大豆品种叶片中Spd含量明显高于不抗旱品种。甲基乙二醛-双鸟嘌呤腙(MGBG,Spd合成抑制剂)处理可导致Spd含量下降和抗旱性的降低,而外源Spd又可逆转MGBG干旱胁迫对大豆的伤害。本研究发现:外源Spd对玉米丰禾1号的影响大于先玉335,可能是因为先玉335固有的遗传特性,在干旱胁迫下可进行自我调节积累较多的多胺,调节了活性氧代谢的平衡,稳定了膜结构,从而增强了其抗旱性[7]。本研究还表明Spd对干旱胁迫下玉米幼苗的调控效果好于正常条件。
与对干旱敏感型品种丰禾1号相比,抗旱型品种先玉335的根系较发达,具有更大的根系生物量、总根长和根系总表面积。这与前人在对不同作物[25, 26]上的研究结论相似,表明发达的根系可增强其抗旱能力。本研究中,干旱胁迫下玉米幼苗根长、根表面积、根体积和根平均直径均受到明显抑制,但丰禾1号受抑制程度明显大于先玉335,表明丰禾1号对干旱胁迫更为敏感。外源施用Spd处理缓解了干旱胁迫对两品种玉米根系生长的抑制,且对丰禾1号缓解效果更明显,主要是通过增加细根(d≤1.00 mm)的数量来促进根系的伸长,以满足自身生长发育的需求,体现了玉米幼苗适应干旱胁迫处理的能力。可见,外源Spd对干旱胁迫下玉米幼苗根系形态结构的影响,主要是通过影响不同径级的根系生长而发挥作用的。
与对照相比,干旱胁迫下两个玉米品种叶片的叶绿素含量均显著降低,且丰禾1号下降幅度更明显,表明其叶绿素降解加快,合成受阻,光合作用能力受到影响。而外源Spd处理明显降低了玉米幼苗叶片叶绿素含量下降的幅度,且对丰禾1号效果更为明显,可能是Spd处理有助于减缓叶绿素合成所需氮素的流失,从而抑制叶绿素含量的下降,有利于捕获更多的光能和合成更多的碳水化合物,促进植物生长,使其适应干旱胁迫的不良环境。
在干旱胁迫下,相对含水量下降幅度越大的品种其抗干旱胁迫的能力越差。因此,一般将干旱胁迫条件下叶片相对含水量下降幅度作为衡量玉米抗干旱胁迫强弱的生理指标[27]。研究表明,适宜浓度的多胺可以通过调节保卫细胞中向内的K+通道,从而有效抑制气孔的开放,调控水分的蒸发[28]。多胺还可作为一种渗透调节物质,通过增加细胞渗透势起到调节水分散失的作用[10]。本研究中,干旱胁迫下外施Spd减缓了玉米幼苗叶片相对含水量的下降趋势,其原因可能是通过调节叶片气孔的大小降低水分散失所致。该结果和李州等[14]关于Spd对白三叶幼苗抗旱性影响的研究结果一致。
逆境胁迫可导致细胞膜结构和功能的紊乱及膜透性的变化[19]。本研究表明:外源 Spd 对细胞膜具有良好的保护和修复作用,可减轻或防止对膜系统的伤害,维持细胞膜选择性渗透能力,这可能是因为外源 Spd 能够维持机体自由基平衡,减缓由于自由基积累而导致的膜损伤[19],从而缓解膜透性增加和离子外漏。
Spd作为一种多胺类物质,具有促进细胞生长、分化、增殖和延缓衰老的作用,与植物抗逆性密切相关,能够通过调节生物膜的物理和化学性质,改变膜的稳定性及渗透性,调节生物大分子合成及酶活性等作用,延缓植物衰老进程[29]。本研究结果表明:根施0.1 mmol/L的Spd可以显著减缓干旱胁迫所导致的幼苗干(鲜)重、株高、相对含水量与叶绿素含量下降的幅度,有效缓解干旱胁迫对玉米幼苗生长的抑制程度,维持叶片正常生理机能,并可通过增加0~1.0 mm 径级根系比例促进根系长度的增加,通过增加0.5~1.5 mm径级根系比例增加根系表面积,促进根系对水分及养分的吸收,以适应干旱胁迫。但植物对干旱胁迫的适应性响应是一个复杂过程,Spd对作物干旱胁迫缓解效应的机理还有待深入研究。Spd处理对抗旱性弱的丰禾1号的缓解效果明显好于对抗旱性强的先玉335,说明Spd更有利于缓解不抗旱品种所受的干旱胁迫。
| [1] | 赵树仁, 叶青江, 荆绍凌, 等. 玉米抗旱性育种[J]. 农业与技术, 2008, 28(4): 43-44. Zhao Shuren, Ye Qingjiang, Jing Shaoling,et al. Maize drought-resistant breeding[J]. Agric Technol, 2008, 28(4): 43-44.(in Chinese) |
| [2] | 张淑杰, 张玉书, 孙龙彧, 等. 东北地区玉米生育期干旱分布特征及其成因分析[J]. 中国农业气象, 2013, 34(3): 350-357. Zhang Shujie, Zhang Yushu, Shun Longyu,et al. Analysis of distributional characteristics and primary causes of maize drought in northeast China[J]. Chin J Agrometeorol, 2013, 34(3): 350-357.(in Chinese) |
| [3] | 张淑杰, 张玉书, 纪瑞鹏, 等. 东北地区玉米干旱时空特征分析[J]. 干旱区农业研究, 2011, 29(1): 231-236. Zhang Shujie, Zhang Yushu, Ji Ruipeng,et al. Analysis of spatio-temporal characteristics of drought for maize in northeast China[J]. Agric Res Arid Areas, 2011, 29(1): 231-236.(in Chinese) |
| [4] | 高红明, 温爽, 张小丽, 等. 表油菜素内酯浸种对干旱胁迫下玉米种子萌发及幼苗生长的影响[J]. 安徽农业科学, 2006, 34(20): 5208-5209. Gao Hongming, Wen Shuang, Zhang Xiaoli,et al. Effect of epibrassinolide soaking seed on maize seed germination and seedling growth under drought stress[J]. J Anhui Agric Sci, 2006, 34(20): 5208-5209.(in Chinese) |
| [5] | Alcázar R, Marco F, Cuevas J C, et al. Involvement of polyamines in plant response to abiotic stress[J]. Biotechnol Lett, 2006, 28(23): 1867-1876. |
| [6] | Liu H P, Dong B H, Zhang Y Y, et al. Relationship between osmotic stress and the levels of free, conjugated and bound polyamines in leaves of wheat seedlings[J]. Plant Sci, 2004, 166(5): 1261-1267 |
| [7] | Kasukabe Y, He Lixiong, Nada K, et al. Overexpression of spermidine synthase enhances tolerance to multiple environmental stresses and up-regulates the expression of various stress-regulated genes in transgenic Arabidopsis thaliana[J]. Plant Cell Physiol, 2004, 45(6): 712-722. |
| [8] | 张帆, 郁继华, 颉建明, 等. 外源ALA和Spd对低温弱光下辣椒幼苗光合作用及抗氧化系统的影响[J]. 中国农业科学, 2013, 46(11): 2298-2306. Zhang Fan, Yu Jihua, Xie Jianming,et al. Influence of exogenous ALA and Spd on photosynthesis and antioxidant system of low temperature and poor light affected pepper seedlings[J]. Scientia Agricultura Sinica, 2013, 46(11):2298-2306.(in Chinese) |
| [9] | 汪志伟, 贠文俊, 颉建明, 等. 外源亚精胺对盐胁迫下辣椒幼苗生长抑制的缓解效应[J]. 甘肃农业大学学报, 2009, 44(4): 67-72. Wang Zhiwei, Yun Wenjun, Xie Jianming, et al. Mitigative effect of exogenous spermidine on growth inhibition in pepper seedlings under NaCl stress[J]. J Gansu Agric Univ, 2009, 44(4): 67-72.(in Chinese) |
| [10] | Li Bin, He Lizhong, Guo Shirong, et al. Proteomics reveal cucumber Spd-responses under normal condition and salt stress[J]. Plant Physiol Biochem, 2013, 67: 7-14. |
| [11] | Parvin S, Lee O R, Sathiyaraj G, et al. Spermidine alleviates the growth of saline-stressed ginseng seedlings through antioxidative defense system[J]. Gene, 2014, 537(1): 70-78. |
| [12] | 张胜, 刘怀攀, 陈龙, 等. 亚精胺提高大豆幼苗的抗旱性[J]. 华北农学报, 2005, 22(4): 25-27. Zhang Sheng, Liu Huaipan, Chen Long,et al. Spd enhanced resistance of soybean seedling under water stress[J]. Acta Agriculturae Boreali-Sinica, 2005, 22(4): 25-27.(in Chinese) |
| [13] | Yin Zepeng, Li Shuang, Ren Jing, et al. Role of spermidine and spermine in alleviation of drought-induced oxidative stress and photosynthetic inhibition in Chinese dwarf cherry(Cerasus humilis) seedlings[J]. Plant Growth Regul, 2014, 74(3): 209-218. |
| [14] | 李州, 彭燕, 潘明洪, 等. 亚精胺对PEG胁迫下白三叶幼苗渗透调节物质积累的影响[J]. 中国草地学报, 2014, 36(1): 31-36. Li Zhou, Peng Yan, Pan Minghong,et al. Effects of spermidine on the accumulation of osmoregulatory matter in leaves of white clover under PEG stress[J]. Chin J Grassl, 2014, 36(1): 31-36(in Chinese) |
| [15] | 李璟, 胡晓辉, 郭世荣, 等. 外源亚精胺对根际低氧胁迫下黄瓜幼苗根系多胺含量和抗氧化酶活性的影响[J]. 植物生态学报, 2006, 30(1): 118-123. Li Jing, Hu Xiaohui, Guo Shirong,et al. Effect of exogenous spermidine on polyamine content and antioxidant enzyme activities in roots of cucumber seedlings under root-zone hypoxia stress[J]. J Plant Ecol, 2006, 30(1): 118-123.(in Chinese) |
| [16] | 汪天, 李娟, 郭世荣, 等. 外源多胺对低氧胁迫下黄瓜幼苗根系生长及H+-ATP酶和H+-焦磷酸酶活性的影响[J]. 植物生理与分子生物学学报, 2005, 31(6): 637-642. Wang Tian, Li Juan, Guo Shirong,et al. Effects of exogenous polyamines on the growth and activities of H+-ATPase and H+-PPase in cucumber seedling roots under hypoxia stress[J]. J Plant Physiol Mol Biol, 2005, 31(6): 637-642.(in Chinese) |
| [17] | 僧珊珊, 王群, 张永恩, 等. 外源亚精胺对淹水胁迫玉米的生理调控效应[J]. 作物学报, 2012, 38(6): 1042-1050. Seng Shanshan, Wang Qun, Zhang Yong'en, et al. Effects of exogenous spermidine on physiological regulatory of maize after waterlogging stress[J]. Acta Agronomica Sinica, 2012, 38(6): 1042-1050.(in Chinese) |
| [18] | 王红霞, 胡金朝, 施国新, 等. 外源多胺对铜胁迫下水鳖叶片多胺代谢、抗氧化系统和矿质营养元素的影响[J]. 生态学报, 2010, 30(10): 2784-2792. Wang Hongxia, Hu Jinzhao, Shi Guoxin,et al. Effects of exogenous polyamines on polyamines metabolism, antioxidative systems and mineral nutrition responses of Hydrocharis dubia(Bl.) backer under Cu stress[J]. Acta Ecologica Sinica, 2010, 30(10): 2784-2792.(in Chinese) |
| [19] | 田婧, 郭世荣, 孙锦, 等. 外源Spd对高温胁迫下黄瓜幼苗叶片膜脂过氧化及质子泵活性的影响[J]. 应用生态学报, 2011, 22(12): 3252-3258. Tian Jing, Guo Shirong, Sun Jin,et al. Effects of exogenous spermidine on lipid peroxidation and membrane proton pump activity of cucumber seedling leaves under high temperature stress[J]. Chin J Appl Ecol, 2011, 22(12): 3252-3258.(in Chinese) |
| [20] | 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003: 67-70. Zhang Zhiliang, Qu Weijing. Plant Physiology Experiment Instruction[M]. Beijing: Higher Education Press, 2006(in Chinese) |
| [21] | 郝再彬, 苍晶, 徐仲. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2004. Hao Zaibin, Cang Jing, Xu Zhong. Plant Physiology Experiment[M]. Harbin: Harbin Institute of Technology Press, 2004.(in Chinese) |
| [22] | Liu F, Stützel H. Biomass partitioning, specific leaf area, and water use efficiency of vegetable amaranth(Amaranthus spp.) in response to drought stress[J]. Sci Hortic, 2004, 102(1): 15-27. |
| [23] | 王智威, 牟思维, 闫丽丽, 等. 水分胁迫对春播玉米苗期生长及其生理生化特性的影响[J]. 西北植物学报, 2013, 33(2): 343-351. Wang Zhiwei, Mou Siwei, Yan Lili,et al. Effects of physiological and biochemical characteristics and growth under water stress in seedling of spring maize[J]. Acta Botanica Boreal-Occidentalia Sinica, 2013, 33(2): 343-351.(in Chinese) |
| [24] | 齐健, 宋凤斌, 刘胜群. 苗期玉米根叶对干旱胁迫的生理响应[J]. 生态环境, 2006, 15(6): 1264-1268. Qi Jian, Song Fengbin, Liu Shengqun. Some physiological response of roots and leaves of Zea mays seedling to drought-stress[J]. Ecol Environ, 2006, 15(6): 1264-1268.(in Chinese) |
| [25] | 杨秀红, 吴宗璞, 张国栋. 对肥水条件反应不同的大豆品种根系性状的比较研究[J]. 中国油料作物学报, 2001, 23(3): 23-25. Yang Xiuhong, Wu Zongpu, Zhang Guodong. A comparative study on characteristics of root system between drought resistant andwater-fertilizer favorite soybean varieties[J]. Chin J Oil Crop Sci, 2001, 23(3): 23-25.(in Chinese) |
| [26] | 丁红, 张智猛, 戴良香, 等. 干旱胁迫对花生生育中后期根系生长特征的影响[J]. 中国生态农业学报, 2013, 21(12): 1477-1483. Ding Hong, Zhang Zhimeng, Dai Liangxiang,et al. Effects of drought stress on root growth characteristics of peanut during mid-to-late growth stages[J]. Chin J Eco-Agric, 2013, 21(12): 1477-1483.(in Chinese) |
| [27] | 刘玉涛, 王宇先, 郑丽华, 等. 玉米抗水分胁迫形态与生理指标研究进展[J]. 园艺与种苗, 2013(10): 55-58. Liu Yutao, Wang Yuxian, Zheng Lihua, et al. Advances in studies on resistance to water stress of morphological and physiology indexes in maize[J]. Hortic Seed, 2013(10): 55-58.(in Chinese) |
| [28] | Liu Kun, Fu Huihua, Bei Qixin, et al. Inward potassium channel in guard cells as a target for polyamine regulation of stomatal movements[J]. Plant Physiol, 2000, 124(3): 1315-1326. |
| [29] | Fariduddin Q, Varshney P, Yusuf M, et al. Polyamines: potent modulators of plant responses to stress[J]. J Plant Interact, 2012, 8(1): 1-16. |
 2015, Vol. 17
2015, Vol. 17


