2. 浙江省农药检定管理所, 杭州 310004
2. Zhejiang Pesticide Verification Management, Hangzhou, 310004, China
梨黑斑病又名裂果病,是梨种植区广泛发生的世界性病害,由菊池链格孢Alternaria kikuchiana Tanaka引起[1]。该病在韩国、日本及我国发生非常严重[2, 3],是砂梨系统的主要病害,主要侵染果实,引起裂果和早期落果,直接影响梨果的产量和品质,也可侵染叶片和新梢,还可在储藏期继续为害[4, 5]。目前生产上对梨黑斑病以化学防治为主,常用药剂有石硫合剂、多菌灵、甲基硫菌灵等。由于使用时间长,生产上时有反映防治效果下降甚至失效的现象[6],但目前尚未见有关梨黑斑病菌对常用杀菌剂抗性情况的正式研究报道。
啶酰菌胺(结构式见Scheme 1)是由巴斯夫公司开发的琥珀酸脱氢酶抑制剂类杀菌剂(SDHIs),于2005年在我国正式登记上市,是线粒体呼吸链中琥珀酸辅酶Q 还原酶抑制剂,与其他类型杀菌剂无交互抗药性[7]。研究表明,啶酰菌胺对病原菌的菌丝生长、孢子萌发、芽管伸长及附着胞形成等阶段都有较强的生物活性,目前主要用于菌核病、马铃薯早疫病和灰霉病的防治,是这些病害防治中传统药剂如苯并咪唑类和二甲酰亚胺类等杀菌剂的理想替代产品[8, 9, 10]。但目前尚未见有关啶酰菌胺在梨黑斑病防治中应用的研究报道。
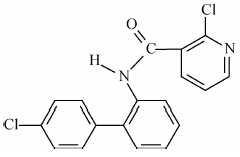 | Scheme 1 |
本研究测定了梨黑斑病菌对传统常用杀菌剂的抗性,并建立了其对啶酰菌胺的敏感性基线,以期为梨黑斑病的防治及抗药性治理提供参考。
1 材料与方法
1.1 药剂
98%多菌灵(carbendazim)、96%异菌脲(iprodione)、95%苯醚甲环唑(difenoconazole)和98%啶酰菌胺(boscalid)原药,均由浙江大学农药与环境毒理研究所提供。除多菌灵原药用0.1 mol/L的盐酸溶解外,其余原药用丙酮溶解,均配制成10 mg/mL 的母液,备用。
1.2 供试菌株的采集、分离及鉴定
于2008—2010年间从浙江、安徽和江苏3省随机采集梨黑斑病菌病样,进行常规组织分离,每个点采集分离5~10株。采样地区主要采用苯并咪唑类及二甲酰亚胺类等杀菌剂进行黑斑病的防治,至采样前均未曾使用过啶酰菌胺等SDHIs药剂。所得黑斑病菌菌株均保存于常规马铃薯葡萄糖琼脂(PDA)斜面上。各菌株均主要通过形态学结合真菌核糖体基因转录间隔区(ITS)分析进行鉴定。
ITS分析:各菌株在PDA培养基上于25 ℃黑暗条件下培养6 d后,用灭菌后的载玻片刮取菌丝。DNA提取采用UNIQ-10柱式植物基因组DNA抽提试剂盒 (上海生工)。PCR采用上游引物ITS1(5′-TCCGTAGTGAACCTGCGG-3′)和下游引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行扩增。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃ 保温10 min。DNA序列测定委托上海英骏有限公司进行[9],通过BLAST 进行比对。
1.3 梨黑斑病菌对多菌灵、异菌脲和苯醚甲环唑的抗性测定
采用菌丝生长速率法,设置区分剂量 [11, 12]。多菌灵的剂量分别设为0、5、50和100 μg/mL,以不含药剂的盐酸为对照(CK),每处理重复3次。在预培养5 d的各菌株同一圆周菌落上制取直径0.5 cm的菌碟,将其转移至含有不同浓度药剂的PDA平板中央,25 ℃下黑暗培养6 d后观察生长情况。其中,不能在含5 μg/mL 多菌灵的PDA平板上生长的菌株为敏感菌株(Car S);能在5 μg/mL 但不能在50 μg/mL 下生长的为多菌灵低水平抗性菌株(Car LR);能在50 μg/mL但不能在100 μg/mL 下生长的为中等水平抗性菌株(Car MR);能在含100 μg/mL 多菌灵的PDA平板上生长的为高水平抗性菌株(Car HR)。异菌脲的剂量分别设为0、5、20和100 μg/mL,苯醚甲环唑的剂量分别设为0、5、20和50 μg/mL,均以不含药剂的丙酮为对照(CK),每处理重复3次。根据菌株在不同剂量下的生长情况,类似地相应将其确定为Ipr S、Ipr LR、Ipr MR、Ipr HR及Dif S、Dif LR、Dif MR、Dif HR[11, 12]。
1.4 菌株对啶酰菌胺的敏感性测定
啶酰菌胺的质量浓度分别设为0、0.05、0.1、0.2、0.4、0.8、1.6和3.2 μg/mL[9],对于少数几个EC50值高于3.2 μg/mL的菌株,在试验重复时增加6.4 μg/mL 这一处理浓度。各菌株在PDA平板上预培养5 d后,在同一圆周菌落上制取直径0.5 cm的菌饼,分别转移到含有不同浓度药剂的平板中央及对照平板中央,每处理重复4次,于25 ℃下黑暗培养。6 d后测量各处理的菌落直径(cm),取平均值按(1)式计算抑制率(%)。利用DPS v13.01软件,通过药剂浓度对数值(x)和抑制率几率值(Y)之间的线性回归关系,求出毒力回归方程及EC50值。
抑制率/%=[(CK菌落增长直径-处理菌落增长直径)/CK菌落增长直径]×100(1)
1.5 菌株对啶酰菌胺的敏感性分布图制作将病菌群体对供试药剂的敏感性(EC50值)从高到低分成约10个左右的区间,统计各区间菌株占整个群体的频率(%);同时以EC50值为x轴,相应的频率(%)为Y轴,即得到病原菌群体对该种杀菌剂的敏感性分布图[8]。
2 结果与分析 2.1 梨黑斑病菌对多菌灵的抗性情况
三省共检测到144株多菌灵抗性菌株,总的抗性频率为57.1%。所有抗性菌株都能在含有100 μg/mL 多菌灵的PDA平板上生长,即全部为高水平抗性菌株(Car HR),表明梨黑斑病菌对多菌灵已产生较为严重的抗性。从地区来看,浙江、江苏和安徽分别检测到80、41和23个高抗菌株,相应的抗性频率分别为59.3%、56.2%和52.3%(表 1)。
| 表 1 不同地区梨黑斑病菌对多菌灵的抗性频率* Table 1 Resistance frequency to carbendazim in A.kikuchiana from different regions* |
梨黑斑病菌对异菌脲也已产生抗性,3省共检测到118株抗性菌株,总的抗性频率为46.8%。所有抗性菌株都能在含5 μg /mL异菌脲的PDA平板上生长,但不能在20 μg /mL及以上浓度下生长,即全部为低水平抗性菌株(Ipr LR),未检测到中抗(Ipr MR)和高抗(Ipr HR)菌株。从地区来看,浙江、江苏和安徽分别检测到68、29和21个低抗菌株,相应的抗性频率分别为50.4%、39.7%和47.7%(表 2)。
| 表 2 不同地区梨黑斑病菌对异菌脲的抗性频率* Table 2 Resistance frequency to iprodione in A.kikuchiana from different regions* |
梨黑斑病菌对苯醚甲环唑也已出现抗性,3省共检测到144株抗性菌株,总的抗性频率为57.2%,其中低抗(Dif LR)和中等抗性(Dif MR)菌株的频率均为28.6%,未检测到高抗菌株。从地区来看,浙江、江苏和安徽分别检测到83、36和25个抗性菌株,相应的抗性频率分别为61.4%、49.3%和56.8%(表 3)。
| 表 3 不同地区梨黑斑病菌对苯醚甲环唑的抗性频率*
Table 3 Resistance frequency to difenoconazole in A.kikuchiana from different pear regions* |
供试252株梨黑斑病菌对啶酰菌胺的敏感性分布见图 1,其中EC50值最高为3.85 μg/mL,最低为0.12 μg/mL,相差32.10倍,平均EC50值为(1.21± 0.12) μg/mL。从敏感性分布图上看,供试梨黑斑病菌群体对啶酰菌胺的敏感性呈连续性分布,其频率分布为近似正态的单峰曲线,因此可将其平均EC50值(1.21± 0.12) μg/mL作为其敏感性基线的参考值,用于监测田间抗药性的演化。
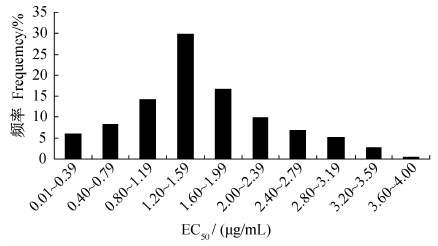 | 图 1 梨黑斑病菌对啶酰菌胺的敏感性频率分布 Fig. 1 Distribution of sensitivity frequency of A.kikuchiana to boscalid |
本研究检测了浙江、江苏和安徽3省梨黑斑病菌群体(n=252)的抗药性发生现状。结果表明:梨黑斑病菌对多菌灵已产生较为严重的抗性,抗性频率为57.1%,且检测到的抗性菌株均为高抗菌株(Car HR),3省间Car HR菌株频率由高至低依次为浙江(59.3%)、江苏(56.2%)和安徽(52.3%)。说明苯并咪唑类药剂在梨黑斑病的防治上已无进一步大面积应用的价值,应该加快引入与之无交互抗药性的替代药剂[13],以减少因抗药性导致用药量剧增所带来的农产品残留污染和环境污染等潜在风险。
梨黑斑病菌对异菌脲的抗性频率低于多菌灵,且全部为低抗菌株(Ipr LR),三省间的抗性频率也存在一定差异,分别为浙江50.4%、江苏39.7%和安徽47.7%。研究表明,异菌脲等二甲酰亚胺类杀菌剂在果蔬灰霉病等防治上的应用历史虽然也很长,但田间检测到的抗性菌株一般都为低抗菌株[11, 14, 15]。因此通过合理的混用或轮用及限制每个生长季的用药次数等科学措施,目前二甲酰亚胺类杀菌剂在果蔬灰霉病防治上仍然有不错的应用空间,近年仍可作为梨黑斑病防治的骨干药剂之一,但要注意辅以合理的抗药性治理技术。
甾醇脱甲基抑制剂类杀菌剂(DMIs)具有广谱抗菌活性,治疗活性好,常用于防治作物上白粉病和锈病等多种重要病害[16]。过去认为DMIs的抗药性是由微效多基因控制的数量性状,因此其抗药性风险很低。但近年的研究表明,不少病原菌对DMIs的抗药性也是由质量性状决定的,也会出现较严重的抗性问题[17]。本研究发现,梨黑斑病菌对苯醚甲环唑也已出现抗性,总的抗性频率为57.2%,其中低抗和中抗菌株的比例为1∶1,尚未检测到高抗菌株。由于植物病原菌对不同DMIs药剂间的交互抗性关系比较复杂,同一种真菌对不同的DMIs药剂间不一定存在交互抗性[17],因此DMIs在梨黑斑病上的继续使用需要注意抗药性治理及不同DMIs品种间的交互抗性关系;同时有关梨黑斑病菌对苯醚甲环唑抗性的机制也需进一步研究。
需要说明的是,本研究是采用区分剂量法进行的抗性检测,由于缺乏梨黑斑病菌对这些药剂的基础敏感性数据,所以其区分剂量标准主要是参考灰葡萄孢Botrytis的数据[11, 12, 18],但梨黑斑病菌与灰葡萄孢菌对这几种供试药剂的基础敏感性是否存在差异尚不确定,有待进一步验证。
啶酰菌胺属于琥珀酸脱氢酶抑制剂类(SDHIs),与其他类型杀菌剂无交互抗性,主要用于Botrytis及Alternaria属病原菌的防治与抗药性治理[9, 10]。本研究表明,啶酰菌胺对A.kikuchiana具有很高的生物活性,因而有望取代苯并咪唑类等传统杀菌剂用于梨黑斑病的防治。本研究中梨黑斑病菌群体(n=252)对啶酰菌胺的敏感性呈正态分布,该结果能够反映自然情况下病原菌对该杀菌剂的敏感性特征,因而其平均EC50 值(1.21±0.12) μg/mL 可作为敏感性基线用于其抗药性监测。同时,由于啶酰菌胺也属于抗药性风险较高的杀菌剂[9, 10, 19],因此在将其实际应用于梨黑斑病防治时一定要注意采取必要的抗药性预防策略。
| [1] | Simmons E G. Alternaria themes and variations(63-72)[J]. Mycotaxon, 1993, 48: 109-140. |
| [2] | 王宏, 常有宏, 陈志谊. 梨黑斑病病原菌生物学特性研究[J]. 果树学报, 2006, 23(2): 247-251. Wang Hong, Chang Youhong, Chen Zhiyi. Study on biological characteristics of Alternaria alternata caused occurrence of pear black spot[J]. J Fruit Sci, 2006, 23(2): 247-251.(in Chinese) |
| [3] | Baudrt A, Morzieres J P, Larue P. First report of Japanese pear black spot caused by Alternaria kikuchiana in France[J]. Plant Dis, 1993(4): 428. |
| [4] | 张艳秋. 砂梨黑斑病的发生规律与无公害防治技术[J]. 植物医生, 2007, 20(3): 40- 41. Zhang Yanqiu. Occurrence rules and non-pollution control techniques of Chinese pear black spot disease[J]. Plant Doc, 2007, 20(3): 40- 41.(in Chinese) |
| [5] | 刘邮洲, 常有宏, 陈志谊, 等. 不同梨品种对黑斑病抗性鉴定[J]. 江苏农业科学, 2009(3): 125-127. Liu Youzhou, Chang Youhong, Chen Zhiyi, et al. Appraise of resistance to pear black spot of several pear varieties[J]. Jiangsu Agric Sci, 2009(3): 125-127.(in Chinese) |
| [6] | 常有宏, 刘邮洲, 王宏, 等. 嘧霉胺与枯草芽孢杆菌B-916协同防治梨黑斑病[J]. 江苏农业学报, 2010, 26(6): 1227-1232. Chang Youhong, Liu Youzhou, Wang Hong, et al. Synergistic effect of pyrimethanil and Bacillus subtilis B-916 against Alternaria kikuchiana[J]. Jiangsu J Agric Sci, 2010, 26(6): 1227-1232.(in Chinese) |
| [7] | Evaluation of the New Active Boscalid in the Product FILAN Fungicide[M]. Canberra: Australian Pesticides and Veterinary Medicines Authority, 2004. |
| [8] | Matheron M E, Porchas M. Activity of boscalid, fenhexamid, fluazinam, fludioxonil, and vinclozolin on growth of Sclerotinia minor and S.sclerotiorum and development of lettuce drop[J]. Plant Dis, 2004, 88(6): 665-668. |
| [9] | Zhang C Q, Yuan S K, Sun H Y, et al. Sensitivity of Botrytis cinerea from vegetable greenhouse to boscalid[J]. Plant Pathol, 2007, 56(4): 646-653. |
| [10] | Veloukas T, Leroch M, Hahn M, et al. Detection and molecular characterization of boscalid-resistant Botrytis cinerea isolates from strawberry[J]. Plant Dis, 2011, 95(10): 1302-1307. |
| [11] | 张传清, 张雅, 魏方林, 等. 设施蔬菜灰霉病菌对不同类型杀菌剂的抗性检测[J]. 农药学学报, 2006, 8(3): 245-249. Zhang Chuanqing, Zhang Ya, Wei Fanglin, et al. Detection of resistance of Botryotinia fuckeliana from protected vegetables to different classes of fungicides[J]. Chin J Pestic Sci, 2006, 8(3): 245-249.(in Chinese) |
| [12] | Zhang Chuanqing, Zhu Jinwen, Wei Fanglin, et al. Sensitivity of Botrytis cinerea from greenhouse vegetables to DMIs and fenhexamid[J]. Phytoparasitica, 2007, 35(2): 300-313. |
| [13] | Brent K J. Fungicide Resistance in Crop Pathogens: How Can It Be Managed?[M]. FRAC Monograph No 1, GIFAP, Brussels, 2007. |
| [14] | Pappas A C. Evolution of fungicide resistance in Botrytis cinerea in protected crops in Greece[J]. Crop Prot, 1997, 16(3): 257-263. |
| [15] | Michaela L, Matthias K, Matthias H. Fungicide resistance phenotypes of Botrytis cinerea isolates from commercial vineyards in south west Germany[J]. J Phytopath, 2011, 159(1): 63-65. |
| [16] | Hsiang T, Yang L, Barton W. Baseline sensitivity and cross-resistance to demethylation-inhibiting fungicides in Ontario isolates of Sclerotinia homoeocarpa[J]. Eur J Plant Pathol, 1997, 103(5): 409-416. |
| [17] | Ma Zhonghua, Michailides T J. Advances in understanding molecular mechanisms of fungicide resistance and molecular detection of resistant genotypes of phytopathogenic fungi[J]. Crop Prot, 2005, 24(10): 853-863. |
| [18] | Grabke A, Fernández-Ortuño D, Amiri A, et al. Characterization of iprodione resistance in Botrytis cinerea from strawberry and blackberry[J]. Phytopathol, 2014, 104(4): 396-402. |
| [19] | Brent K J, Hollomon D W. Fungicide Resistance: The Assessment of Risk[M].Second Revised Edition. FRAC Monograph No 3, GIFAP, Brussels, 2007. |
 2015, Vol. 17
2015, Vol. 17


