多杀菌素(spinosad)系刺糖多孢菌Saccharopo-lyspora spinosa发酵产生的新型大环内酯类农用抗生素,具有触杀及胃毒作用[1, 2],能以光解方式快速降解[3],且兼具生物农药的安全性和化学农药的速效性[4]。目前,多杀菌素衍生物已达数百种[5, 6],国外已用于防治农作物病虫害[7, 8]、蚊蝇[9, 10]及仓储病虫害等 [11, 12];而我国对多杀菌素的研究仍处于实验室阶段,尚未工业化。
多杀菌素的生物合成源于聚酮链的延伸,起始单元丙酰基团在聚酮合酶的作用下按照A-A-P-A-A-A-A-A-A-A(A:乙酰基,P:丙酰基) 的顺序逐步缩合,整个过程由位于10个组装模件上的酶系催化完成,经硫酯酶环化,并依次在21元环的C9位、C17位连接鼠李糖和福乐糖胺基团[2, 13]。由此可知,在多杀菌素快速合成期,需要大量的酰基前体,它们主要来源于碳源代谢的中间产物。因此,供试碳源的分解特性对多杀菌素的合成至关重要。 葡萄糖是抗生素产生菌较好的碳源和能源,但其分解阻遏作用会抑制多种抗生素的合成,甚至使产素过程逆转[14]。植物油是一种疏水性物质,在水中的溶解度很小,可以减弱阻遏效应,且其降解产物为短链脂肪酸,可作为抗生素合成的前体[15]。此外,植物油有利于抗生素与菌体的分离,降低次级代谢产物对细胞的毒害作用[16]。因此,植物油是一种有效的非干扰性碳源,常用作大环内酯类抗生素合成的辅助性碳源。目前已有利用植物油促进放线菌次级代谢的报道,例如头孢菌素和红霉素等[16, 17],但有关植物油对刺糖多孢菌生长和多杀菌素产量的影响未见报道。笔者研究了植物油种类对多杀菌素发酵过程中pH值、脂肪酶活力、残糖和油脂利用等参数的影响,以及其代谢调节对脂肪酶基因(lip)和多杀菌素合成相关基因(gtt、gdh、epi、kre、SpnA、SpnF、SpnG、SpnP)转录水平的影响,以期筛选出最佳的辅助性脂类碳源,为进一步提高多杀菌素的产量提供理论依据。
1 材料与方法 1.1 仪器与试剂
SpectraMax M5酶标仪(美国Molecular Devices公司);LC-20AD岛津高效液相色谱仪(日本岛津公司);ND500型超微量紫外可见分光光度计(Bio Take公司);CFX96 connect型荧光定量PCR 仪器(美国BIO-RAD公司)。
葵花油和大豆油(中粮集团有限公司);菜籽油(山东鲁花集团有限公司);橄榄油(上海嘉里食品工业有限公司);芝麻油(含山县韶关鹰皇油脂有限公司);花生油(山东省临沂市花生种植合作社);对硝基苯酚棕榈酸酯(Sigma公司);2.5%多杀菌素悬浮剂(spinosad 25 SC,商品名称为菜喜,美国陶氏益农公司);RNAiso Plus试剂、PrimeScript RT Master Mix逆转录酶及SYBR Premix Ex TapⅡ(TaKa Ra公司);其他试剂均为分析纯或色谱纯。
1.2 供试菌株及其培养 1.2.1 菌株来源及培养基刺糖多孢菌S.spinosa由浙江工业大学微生物研究所保藏。供试培养基包括固体、种子和发酵培养基3种:
1)斜面及固体培养基(g/L):葡萄糖 9.0,酵母膏 3.0,玉米浆 10.0,MgSO4·7H2O 0.2,琼脂 20.0,pH 7.5。
2)一级和二级种子培养基(g/L):葡萄糖 10.0,蛋白胨 4.0,酵母粉 4.0,MgSO4·7H2O 0.5,KH2PO4 2.0,K2HPO4·3H2O 4.0,pH 8.0。
3)发酵培养基(g/L):葡萄糖 55.0,玉米粉8.0,蛋白胨 7.5,酵母膏 10.0,MgSO4·7H2O 0.5,棉籽饼粉 30.0,植物油 25.0(对照组除外),pH 8.0。
上述3种培养基分别用于刺糖多孢菌的斜面菌种培养、种子液培养和发酵液培养,灭菌条件均为115 ℃、30 min。
1.2.2 菌株培养种子培养:将刺糖多孢菌斜面菌种接入装液量为50 mL/250 mL的一级种子培养基中,于200 r/min、30 ℃条件下培养48 h,即为一级种子液;取一级种子液以体积分数10%的接种量转入装液量为100 mL/500 mL的二级种子培养基中,相同条件下培养24 h,即为二级种子液。
发酵培养:将二级种子液以体积分数10%的接种量转入装液量为30 mL/250 mL的发酵培养基中,于200 r/min、30 ℃条件下培养9 d。期间每隔24 h取样测定其pH值、还原糖、生物量、脂肪酶活力、植物油含量(对照组除外)、多杀菌素效价等理化参数。
1.3 试验设计及测定项目试验设葵花油、花生油、大豆油、芝麻油、橄榄油和菜籽油6个处理,以不添加植物油为对照。每个处理重复3次,各组取样后立即测定相应的理化参数:pH值测定采用PB-10 pH计;还原糖测定采用3,5-二硝基水杨酸法(DNS法)[18];生物量测定采用干重法[19];脂肪酶活力的测定采用对硝基苯酚法[20, 21],在pH 8.0、37 ℃条件下,以每分钟释放1 μmol 对硝基苯酚(p-NP)所需的酶量定义为1个酶活单位;残油的测定采用铜皂法[22];多杀菌素效价测定采用HPLC方法[19]。
1.4 刺糖多孢菌RNA的制备及RT-PCR分析选取大豆油、菜籽油试验组和对照组发酵培养3~7 d的样品用于RNA的制备及RT-PCR分析。提取的RNA样品经反转录后获得cDNA,用于脂肪酶基因lip、糖基侧链合成基因(gtt、gdh、epi、kre)、聚酮链合成及交联基因(SpnA、SpnF)、鼠李糖转移酶基因(SpnG)和福乐糖胺转移酶基因(SpnP)在相应检测区间内转录强度的分析。
1.4.1 刺糖多孢菌RNA的制备取1 mL上述发酵液样品于Ep管中,于1 000×g、4 ℃条件下离心10 min,收集菌体,加入l mL RNAiso Plus,振荡混匀,静置5 min;于12 000×g、4 ℃条件下离心5 min,取上清液,加入0.2 mL氯仿,漩涡振荡15 s,静置5 min;于12 000×g、4 ℃条件下离心15 min,取0.3 mL上清液,加入等量的异丙醇,混匀后静置10 min;于12 000×g、4 ℃条件下离心10 min,弃上清液,沉淀用1 mL 75%乙醇洗涤后,于7 500×g、4 ℃条件下离心5 min,弃上清液;室温干燥沉淀,加入30 μL RNase-Free dH\-2O溶解沉淀,待RT-PCR分析。
1.4.2 反转录及荧光定量PCR分析准确量取500 ng的RNA样品用于cDNA单链的反转录,按反转录试剂盒说明书(PrimeScriptTM RT Master Mix,TaKaRa Code:RR036A)合成cDNA。反转录体系为:5×Prime Script RT Master Mix 2 μL,RNase Free dH2O 5 μL,RNA 样品 500 ng,RNase Free dH2O 3-500/c。其中,c(ng/μL)为RNA样品的质量浓度。
根据内参基因和待测基因的DNA序列,利用NCBI的Pick Primers设计引物(表 1)。按照荧光定量PCR使用说明书(SYBR Premix Ex TapTMⅡ,TaKaRa Code:RR820A)完成相应模板、引物和试剂的添加。荧光定量PCR反应体系为:SYBR Premix Ex TapⅡ 5 μL,PCR Forward Primer 0.2 μL,PCR Reverse Primer 0.2 μL,cDNA样品 1 μL,RNase Free dH2O 3.6 μL。PCR反应程序为:95 ℃ 30 s;95 ℃变性5 s;60 ℃、30 s退火和延伸,循环40次。结果用2-△△Ct法分析,内参基因选用刺糖多孢菌主要Sigma因子SigA。
| 表 1 内参基因及待测基因的引物序列 Table 1 The primer sequences of reference genes and target genes |
利用Excel和Statview统计分析软件对试验数据均值和差异显著性进行分析,其中,*表示差异显著,P<0.05;**表示差异极显著,P<0.01;数据处理后用Oringin 8.0绘图。
1.5.1 多杀菌素相对效价的计算根据公式(1)和(2)计算发酵样品中多杀菌素的效价和相对效价。
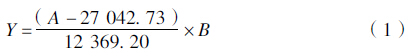
(1)式中:Y为发酵液样品的效价,mg/L;A为样品峰面积,mV·min;B为样品稀释倍数,27 042.73和12 369.20分别代表多杀菌素标准曲线y轴截距和x轴斜率[19](此标准曲线由本实验室以2.5% 的多杀菌素悬浮剂为标样制作而成)。

(2)式中:Yt为t时刻各取样点发酵液样品的效价,mg/L;YEC为对照组发酵终点时的效价,mg/L;YR为样品中多杀菌素的相对效价,%。
1.5.2 单位菌体酶活含量的计算根据公式(3)计算单位菌体酶活含量EP(U/mg),用于表征植物油对脂肪酶诱导效果及合成能力的影响。

(3)式中:Et为t时刻样品中脂肪酶酶活,U/mL;Bt为t时刻菌体生物量,mg/mL。
1.5.3 单位菌体多杀菌素相对含量的计算根据公式(4)和(5)计算单位菌体多杀菌素相对含量YPR(%),用于表征植物油对刺糖多孢菌多杀菌素合成能力的影响。

(4)式中:YE为发酵终点时各组样品的效价,mg/L;Bmax为菌体生物量峰值,g/L;YP为各组发酵终点时的效价YE与菌体生物量峰值Bmax的比值,mg/g。

(5)式中:YPO为含油试验组发酵终点时的效价与相应菌体生物量峰值的比值,mg/g。YPC为对照组发酵终点时的效价与菌体生物量峰值的比值,mg/g。YPR为单位菌体多杀菌素相对含量,%。
2 结果及分析 2.1 植物油种类对菌体生长及多杀菌素合成的影响 2.1.1 对菌体生物量及产素能力的影响
由图 1A可见:各处理在1~5 d内生长趋势相似,均在第5 天时菌体量达到最高值。其中,大豆油、葵花油、芝麻油和花生油试验组的生长延迟现象较明显,生物量相对较低,菌体自溶较早,且大豆油在发酵后期对菌体生长的抑制作用十分显著,菌体量最低,细胞在次级代谢初期已开始裂解。而菜籽油和橄榄油能够促进菌体的生长,在多杀菌素快速合成期仍保持较高的菌体活力。
 |
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 1 植物油种类对菌体生物量(A)及多杀菌素相对效价(B)的影响 Fig. 1 Influence of vegetable oils on the biomass of S. spinosa (A) and the relative titer of spinosad(B) |
从图 1B可知:不同种类植物油对多杀菌素产量的影响不同,依次为菜籽油>橄榄油>花生油>芝麻油>葵花油>大豆油。其中,菜籽油和橄榄油试验组多杀菌素的合成速率均高于其他组,并在菌体衰亡的初期仍持续合成,直至衰亡后期多杀菌素产量才趋于平稳。
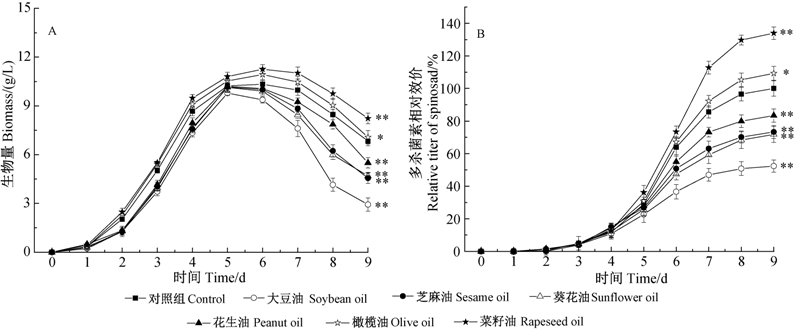
2.1.2 对单位菌体多杀菌素相对含量的影响因为多杀菌素是胞内产物,比较生长曲线和多杀菌素合成曲线(图 1)可知:刺糖多孢菌的生物量与多杀菌素产量具有一定的正相关性。由图 2可知,菜籽油试验组中菌体合成多杀菌素的能力最强,大豆油组最差,说明菜籽油不仅有利于菌体的初级代谢,也可以调节次级代谢,促进多杀菌素的高效合成。
 |
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
* and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 2 植物油种类对单位菌体多杀菌素相对含量的影响 Fig. 2 Influence of vegetable oils on the relative spinosad concentration per unit biomass |
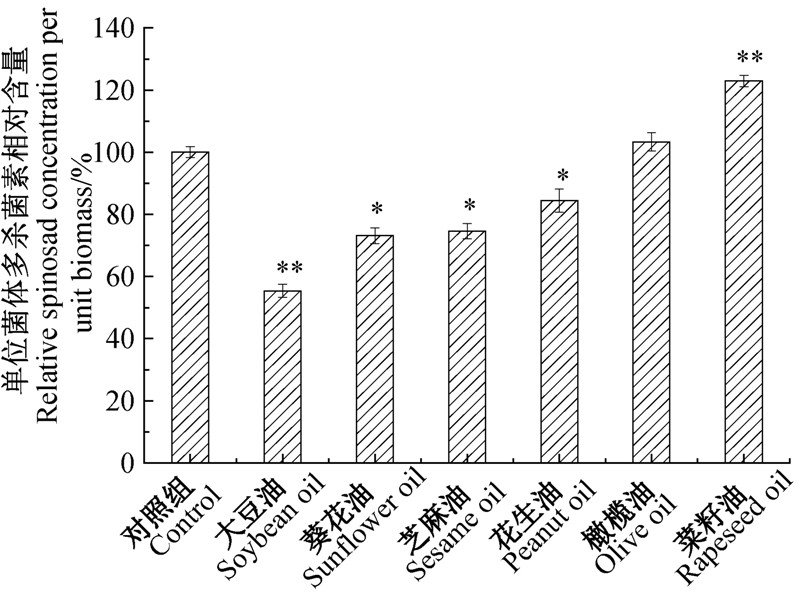
pH值是菌体代谢活动的表征,对抗生素的合成起关键的调控作用[23]。由图 3A 可见:在发酵1~2 d 内,刺糖多孢菌快速分解氮源,pH值迅速上升;在2~5 d由于碳源的快速消耗,pH值呈下降趋势;发酵5 d以后,不同植物油引起的pH值差异性逐渐显现,其中大豆油组的pH值显著升高,而橄榄油和菜籽油组的pH值仍维持在多杀菌素合成较适的范围内。从图 3B可知:在发酵1~5 d内,菌体快速生长繁殖,各组对糖的利用趋势相似;随后多杀菌素快速合成,还原糖的利用出现明显差异:菜籽油和橄榄油能够促进刺糖多孢菌对糖的利用,保持较高的消耗速率,其残糖浓度介于对照组和其他试验组间,大豆油组的残糖浓度最高。
 |
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 3 植物油种类对多杀菌素发酵过程中pH值(A)和还原糖(B)变化的影响 Fig. 3 Influence of vegetable oils on pH(A) and reducing sugar(B) during spinosad fermentation |
刺糖多孢菌对植物油的利用能力除受碳源影响外,还受脂肪酶活力的影响。由图 4A可见:在整个发酵过程中,各处理组脂肪酶活性均呈先升后降的变化趋势,但各组酶活性最大值及持续时间有明显差别。其中,菜籽油组的脂肪酶活力最高,持续时间最长,而大豆油组最低。多杀菌素自第5天时开始快速合成,因此计算此时单位菌体脂肪酶含量(图 4B)。由图 4B可知,菜籽油不仅通过增加菌体量来提高酶活性,而且作为刺糖多孢菌脂肪酶的较适诱导物,进一步提高了单位菌体的产酶量或酶活性。
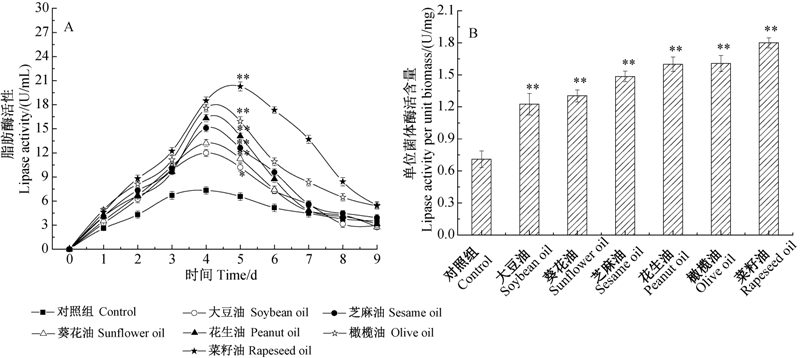 |
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 4 植物油种类对多杀菌素发酵过程中脂肪酶活性的影响 Fig. 4 Influence of vegetable oils on lipase activity during spinosad fermentation |
结果如图 5所示。在菌体生长的1~2 d内,各处理组中植物油几乎不被利用,进入对数生长期才逐渐被分解利用,至发酵中后期,因各组脂肪酶活力的差异增大,油脂的消耗曲线呈不同趋势。发酵终点时(以菜籽油处理组残油为参照),大豆油试验组残留量最高,而菜籽油的最低,因此菜籽油是较为理想的脂类碳源。
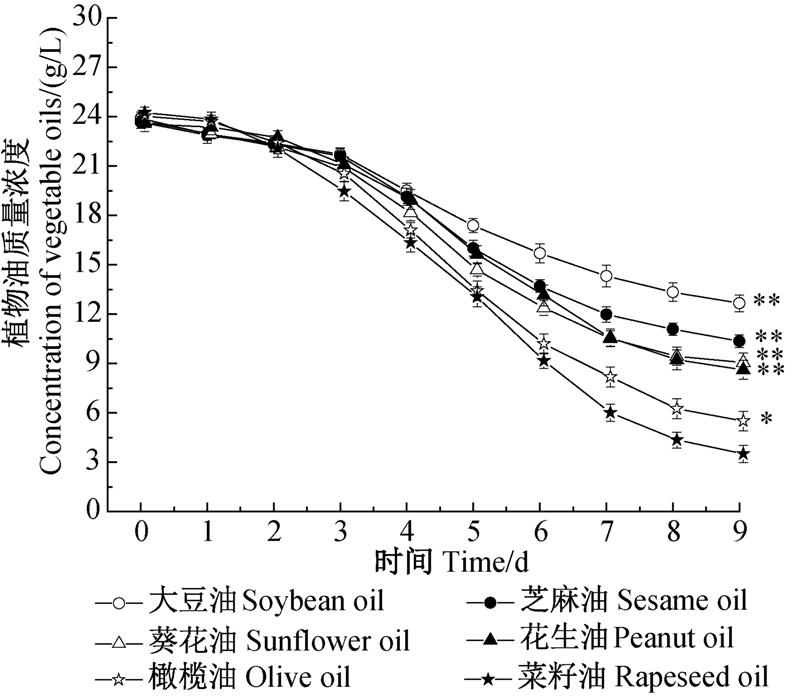 |
*表示差异显著(P<0.05);**表示差异极显著(P<0.01) 。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 5 多杀菌素发酵过程中菌体对不同种类植物油的消耗曲线 Fig. 5 Curve of lipid consumption process of S. spinosa during spinosad fermentation |
由菌体生长曲线(图 1A)、多杀菌素合成曲线(图 1B)及脂肪酶活性变化曲线(图 4A )可知:大豆油和菜籽油在多杀菌素发酵过程中的作用效果不同,因此选择这两组和对照组,利用RT-PCR检测脂肪酶基因(lip)在发酵3~6 d内的转录强度(图 6)。从图中可知:菜籽油试验组中刺糖多孢菌脂肪酶基因的转录强度最高,发酵至第5天时,其转录强度约是大豆油的2倍,对应的酶活性相差10.27 U/mL,说明其对脂肪酶的诱导效果强于大豆油。从整个转录过程可知,各组脂肪酶基因转录强度的变化与相应脂肪酶活性和油脂消耗的变化趋势是相符的。
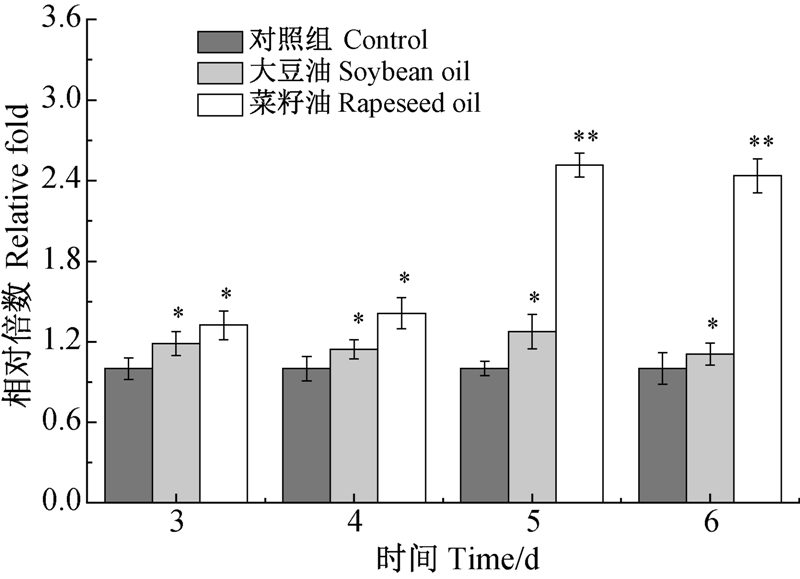 |
*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 6 植物油种类对多杀菌素发酵过程中脂肪酶基因转录水平的影响 Fig. 6 Influence of vegetable oils on the transcriptional intensity of lipase synthetic gene during spinosad fermentation |
鼠李糖既是刺糖多孢菌细胞壁脂多糖的组成部分,又与福乐糖胺一样,是多杀菌素的生物活性基团,由4个多杀菌素糖基侧链合成基因(gtt、gdh、epi、kre)负责编码,其中gtt和gdh基因编码脱氧六碳糖生物合成的共同前体TDP-4-酮-6-脱氧-D-葡萄糖,而epi和kre则在此前体的基础上合成鼠李 糖[24, 25]。由于不同种类植物油对刺糖多孢菌生长(图 1A)和多杀菌素产量(图 1B)的影响不同,因此选择发酵3~7 d的样品,检测了这4个基因 (gtt、gdh、epi、kre)在初级和次级代谢阶段转录水平的变化(图 7)。
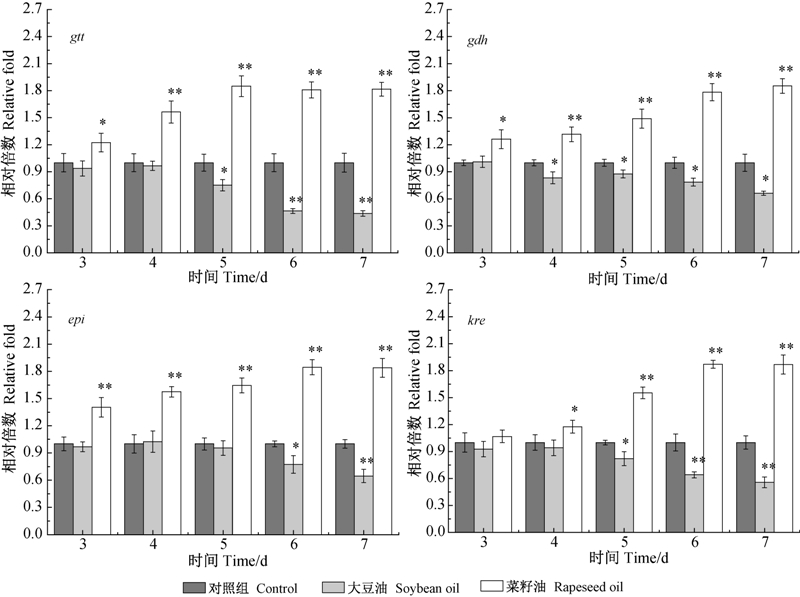 |
gtt、gdh、epi、kre分别为TDP-葡萄糖合酶基因、4′,6′-葡萄糖脱水酶合成基因、
3′,5′-差向异构酶基因和4′-酮还原酶合成基因。 gtt,gdh,epi,kre represent glucose nucleotidyl transferase gene,glucose dehydratase gene,3′,5′-epimerase gene and 4′-ketoreductase gene,respectively. *表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 7 植物油种类对多杀菌素糖基侧链合成基因转录水平的影响 Fig. 7 Influence of vegetable oils on the transcriptional intensity of saccharide chains synthetic genes during spinosad fermentation |
由图 7可知:从刺糖多孢菌迅速生长期(3~5 d)到多杀菌素快速合成期(5~7 d),菜籽油试验组中糖基侧链合成基因的转录活性显著高于大豆油试验组,而由图 1可知菜籽油对菌体生物量和多杀菌素产量的促进效果优于大豆油。这说明4个糖基合成基因均参与了初级代谢和次级代谢[26, 27],在菌体迅速生长期,各组均需gtt、gdh合成的TDP-4-酮-6-脱氧-D-葡萄糖及epi、kre合成的鼠李糖,用以保证细胞的基础代谢和细胞壁的构建;当进入发酵中后期,这4个基因在菜籽油试验组的转录强度显著提高,多杀菌素的合成速率明显高于对照组和大豆油试验组。说明菜籽油可以通过提高多杀菌素糖基侧链合成基因的转录表达,进而促进刺糖多孢菌的生长和多杀菌素产量。
2.4.3 对多杀菌素合成基因转录水平的影响为深入了解菜籽油对多杀菌素合成基因转录水平的影响,选择聚酮链合成和交联基因(SpnA,SpnF)、鼠李糖和福乐糖胺糖基转移酶基因(SpnG,SpnP),分析其在发酵4~7 d内的转录强度。由图 8可知:在多杀菌素合成初期,4个合成基因在菜籽油试验组中的转录强度均高于对照组和大豆油试验组,随着多杀菌素合成速率加快,菜籽油试验组的转录活性同步提高,而此时大豆油试验组的理化环境已不适宜菌体的生长和多杀菌素产生,菌体量下降,pH值迅速上升,多杀菌素合成基因的转录受阻,最终导致多杀菌素产量较低。
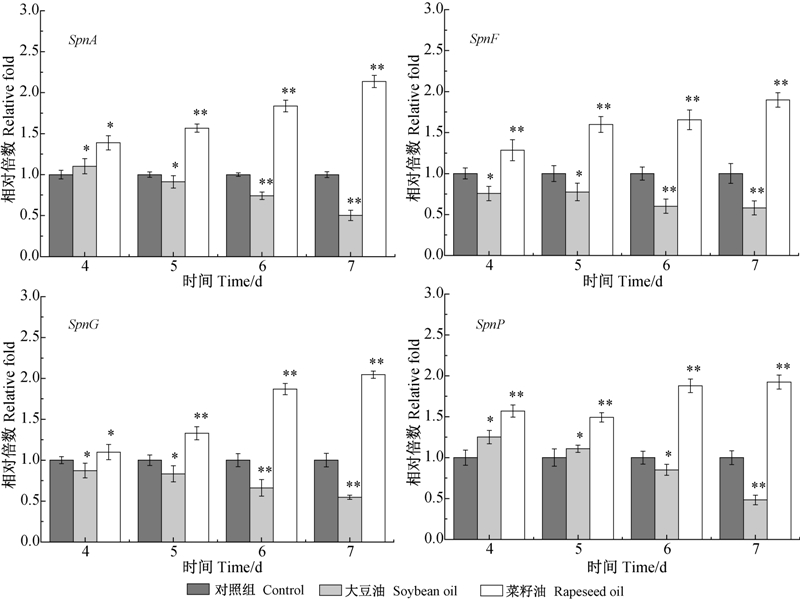 |
SpnA、SpnF、SpnG、SpnP分别为多杀菌素聚酮合酶基因、聚酮交联基因、
鼠李糖转移酶基因和福乐糖胺转移酶基因。 SpnA,SpnF,SpnG,SpnP represent polyketide synthase gene,polyketide modification gene,rhamnosyl transferase gene and forosamine transferase gene,respectively. *表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 * and ** reprsent significant difference at 0.05 and 0.01 level,respectively. 图 8 植物油种类对发酵过程中多杀菌素合成基因转录水平的影响 Fig. 8 Influence of vegetable oils on the transcriptional intensity of spinosad synthetic genes during fermentation |
多杀菌素是一种极具前景的新型农用抗生素,我国尚未掌握其工业化生产技术,主要是因为多杀菌素发酵过程中易出现碳代谢物阻遏效应。本研究尝试以植物油作为刺糖多孢菌生长和多杀菌素合成的部分碳源,通过对脂肪酶基因转录水平、脂肪酶活性及油脂量的测定发现,菜籽油对脂肪酶基因的转录表达具有显著促进作用,酶活最高、持续时间最长,在多杀菌素快速合成期仍保持较高的活性,对油脂的分解利用能力最强,是较为理想的诱导物和复合碳源。
植物油在脂肪酶的作用下水解为甘油和脂肪酸,后者经β-氧化分解产生大量酰基-CoA,既可有效地缓解速效碳源引起的阻遏效应,又是多杀菌素合成前体(乙酰-CoA、丙酰-CoA 和甲基丙二酰-CoA)的主要来源。沈兆兵等在对含有相似聚酮链生物合成途径的红霉素研究中发现,植物油能促进TCA 循环及中间代谢物琥珀酰-CoA的积累[28],并在甲基丙二酰-CoA 异构酶的作用下转化为红霉素的合成前体甲基丙二酰-CoA[29]。由此推测,植物油分解产生的酰基-CoA类代谢物,可为多杀菌素的合成提供前体,促进其快速合成。
但由于植物油的种类不同,其所含的饱和脂肪酸、不饱和脂肪酸的种类和比例各不相同[30],由于菌种的遗传背景不同,其对油脂的分解利用具有一定的选择性,因此不同植物油对同一菌株或同一种植物油对不同菌株的脂肪酶诱导作用存在差异,其油脂利用能力也不相同。杨莲芳等对红霉素的发酵研究表明,菜籽油对红霉素合成的促进作用优于大豆油[31],本研究得出了与此一致的结论。与大豆油相比,菜籽油中不饱和脂肪酸的种类和含量均较高,组分更复杂,其中可能含有促生长因子、抗生素合成调控因子、抗氧化因子等,其作用机制尚不清楚,有待进一步研究。
通过对多杀菌素合成相关基因的转录分析发现,糖基侧链合成基因和多杀菌素合成基因在菜籽油试验组中的转录水平相对较高,这与该组中生物量和多杀菌素产量偏高相吻合,说明菜籽油良好的分解特性可以促进菌体的生长和多杀菌素的合成。
综合发酵过程中pH值、还原糖、生物量、脂肪酶活力及油脂等检测参数可知,菜籽油能够促进菌体对糖和油脂的利用,生物量最高,发酵中后期仍能维持较适的pH值范围,延缓菌体的衰亡,单位菌体多杀菌素含量也最高。说明菜籽油不仅通过增加菌体量,还能以增强单位菌体产素能力的方式来提高多杀菌素的产量。因此,菜籽油是供试植物油中多杀菌素合成的最佳脂类碳源。
此外,研究发现,在含油培养基中多杀菌素的合成能力与脂肪酶活力呈正相关,这与杨连芳和卞晨光等分别对红霉素发酵的研究结论相同,即脂肪酶活力越高,菌体对油脂的利用能力越强,抗生素的产量越高[31, 32]。因此,对可利用油脂作为菌体生长及抗生素合成的刺糖多孢菌而言,除选择合适的脂类碳源外,还可利用基因工程技术在脂肪酶合成基因的上游插入强启动子或增加脂肪酶基因的拷贝数,以提高菌体对油脂的利用能力,从而进一步提高多杀菌素的产量。
| [1] | Millar N S, Denholm I. Nicotinic acetylcholine receptors: targets for commercially important insecticides[J]. Invert Neurosci, 2007, 7(1): 53-66. |
| [2] | Kirst H A. The spinosyn family of insecticides: realizing the potential of natural products research[J]. J Antibiot, 2010, 63(3): 101-111. |
| [3] | Liu Shangzhong, Li Q X. Photolysis of spinosyns in seawater, stream water and various aqueous solutions[J]. Chemosphere, 2004, 56(11): 1121-1127. |
| [4] | Thompson G D, Dutton R, Sparks T C. Spinosad-a case study: an example from a natural products discovery programme[J]. Pest Manag Sci, 2000, 56(8): 696-702. |
| [5] | Sparks T C, Crouse G D, Dripps J E, et al. Neural network-based QSAR and insecticide discovery: spinetoram[J]. J Comput-Aided Mol Des, 2008, 22(6-7): 393-401. |
| [6] | Sparks T C, Crouse G D, Durst G. Natural products as insecticides: the biology, biochemistry and quantitative structure-activity relationships of spinosyns and spinosoids[J]. Pest Manag Sci, 2001, 57(10): 896-905. |
| [7] | Wang Dong, Gong Peiyu, Li Mei, et al. Sublethal effects of spinosad on survival, growth and reproduction of Helicoverpa armigera(Lepidoptera: Noctuidae)[J]. Pest Manag Sci, 2009, 65(2): 223-227. |
| [8] | Jones T, Scott-Dupree C, Harris R, et al. The efficacy of spinosad against the western flower thrips, Frankliniella occidentalis, and its impact on associated biological control agents on greenhouse cucumbers in southern Ontario[J]. Pest Manag Sci, 2005, 61(2): 179-185. |
| [9] | Jarjees E A, McGraw B K, Messing R, et al. Effects of spinosad-based fruit fly bait GF-120 on tephritid fruit fly and aphid parasitoids[J]. Biological Control, 2005, 35(2): 155-162. |
| [10] | Antonio G E, Sánchez D, Williams T, et al. Paradoxical effects of sublethal exposure to the naturally derived insecticide spinosad in the dengue vector mosquito, Aedes aegypti[J]. Pest Manag Sci, 2009, 65(3): 323-326. |
| [11] | Nayak M K, Daglish G J, Byrne V S. Effectiveness of spinosad as a grain protectant against resistant beetle and psocid pests of stored grain in Australia[J]. J Stored Prod Res, 2005, 41(4): 455-467. |
| [12] | Vayias B J, Athanassiou C G, Milonas D N, et al. Persistence and efficacy of spinosad on wheat, maize and barley grains against four major stored product pests[J]. Crop Prot, 2010, 29(5): 496-505. |
| [13] | Hong Lin, Zhao Zongbao, Melançon C, et al. In vitro characterization of the enzymes involved in TDP-D-forosamine biosynthesis in the spinosyn pathway of Saccharopolyspora spinosa[J]. J Am Chem Soc, 2008, 130(14): 4954-4967. |
| [14] | Rokem J S, Lantz A E, Nielsen J. Systems biology of antibiotic production by microorganisms[J]. Nat Prod Rep, 2007, 24(6): 1262-1287. |
| [15] | Hu Changhua, Zou Yi, Zhao Wenting. Effect of soybean oil on the production of mycelial biomass and pleuromutilin in the shake-flask culture of Pleurotus mutilis[J]. World J Microbiol Biotechnol, 2009, 25(10): 1705-1711. |
| [16] | Hamedi J, Malekzadeh F, Saghafi-nia A E. Enhancing of erythromycin production by Saccharopolyspora erythraea with common and uncommon oils[J]. J Ind Microbiol Biotechnol, 2004, 31(10): 447-456. |
| [17] | Kim N R, Lim J S, Hong S I, et al. Optimization of feed conditions in a 2.5-1 fed-batch culture using rice oil to improve cephalosporin C production by Cephalosporium acremonium M25[J]. World J Microbiol Biotechnol, 2005, 21(5): 787-789. |
| [18] | 张永勤, 王哲平, 宋雨梅, 等. 还原糖测定方法的比较研究[J]. 食品工业科技, 2010, 31(6): 322 -323 Zhang Yongqin, Wang Zheping, Song Yumei, et al. Comparative study on the determination of reducing sugar[J]. Sci Technol Food Ind, 2010, 31(6): 322-323.(in Chinese) |
| [19] | 王子宝, 沈淑媛, 裘娟萍. 刺糖多孢菌生长特性及移种标准[J]. 农药, 2012, 51(7): 494-498. Wang Zibao, Shen Shuyuan, Qiu Juanping. Growth characteristic and inoculation standard for Saccharopolyspora spinosa [J]. Agrochemicals, 2012, 51(7): 494-498.(in Chinese) |
| [20] | Gupta N, Rathi P, Gupta R. Simplified para-nitrophenyl palmitate assay for lipases and esterases[J]. Analyt Biochem, 2002, 311(1): 98-99. |
| [21] | Margesin R, Feller G, Hmmerle M, et al. A colorimetric method for the determination of lipase activity in soil[J]. Biotechnol Lett, 2002, 24(1): 27-33. |
| [22] | 张旭, 王金龙, 胡江林. 聚醚类抗生素发酵液中残油含量的比色法检测[J]. 生物技术, 2007, 17(2): 47-49. Zhang Xu, Wang Jinlong, Hu Jianglin. Determination of oil in the broth of the polyether antibiotics fermentation by colorimetry[J]. Biotechnol, 2007, 17(2): 47-49.(in Chinese) |
| [23] | Desai R P, Leaf T, Woo E, et al. Enhanced production of heterologous macrolide aglycones by fed-batch cultivation of Streptomyces coelicolor [J]. J Ind Microbiol Biotechnol, 2002, 28(5): 297-301. |
| [24] | Waldron C, Matsushima P, Rosteck P R, et al. Cloning and analysis of the spinosad biosynthetic gene cluster of Saccharopolyspora spinosa[J]. Chem Biol, 2001, 8(5): 487-499. |
| [25] | Huang Kexue, Xia Liqiu, Zhang Youming, et al. Recent advances in the biochemistry of spinosyns[J]. Appl Microbiol Biotechnol, 2009, 82(1): 13-23. |
| [26] | Madduri K, Waldron C, Matsushima P, et al. Genes for the biosynthesis of spinosyns: applications for yield improvement in Saccharopolyspora spinosa[J]. J Ind Microbiol Biotechnol, 2001, 27(6): 399-402. |
| [27] | Madduri K, Waldron C, Merlo D J. Rhamnose biosynthesis pathway supplies precursors for primary and secondary metabolism in Saccharopolyspora spinosa[J]. J Bacteriol, 2001, 183(19): 5632-5638. |
| [28] | 沈兆兵, 陈国豪, 陈长华. 豆油在红霉素发酵中的作用及作用机制的研究[J]. 中国抗生素杂志, 2006, 31(11): 657-660. Shen Zhaobing, Chen Guohao, Chen Changhua. Study on effect of soybean oil on fermentation of erythromycin and its mechanism[J]. Chin J Antibiot, 2006, 31(11): 657-660.(in Chinese) |
| [29] | Hunaiti A A, Kolattukudy P E. Source of methylmalonyl-coenzyme a for erythromycin synthesis: methylmalonyl-coenzyme a mutase from Streptomyces erythreus[J]. Antimicrob Agents Chemother, 1984, 25(2): 173-178. |
| [30] | Hamedi J, Malekzadeh F, Saghafi-nia A E. Enhancing of erythromycin production by Saccharopolyspora erythraea with common and uncommon oils[J]. J Ind Microbiol Biotechnol, 2004, 31(10): 447-456. |
| [31] | 杨莲芳, 曹健, 张中州, 等. 不同种类植物油对红霉素发酵的影响[J]. 食品与发酵科技, 2009, 45(4): 46-48. Yang Lianfang, Cao Jian, Zhang Zhongzhou, et al. Effect of vegetable oils on the erythromycin fermentation[J]. Food Ferment Technol, 2009, 45(4): 46-48.(in Chinese) |
| [32] | 卞晨光, 宫衡, 付水林, 等. 以脂肪酶活为指标快速筛选红霉素摇瓶发酵培养基[J]. 中国抗生素杂志, 2004, 29(7): 385-387. Bian Chenguang, Gong Heng, Fu Shuilin, et al. A rapid method to select medium in shake flask of erythromycin by potency deduction of the specific activity of lipase[J]. Chin J Antibiot, 2004, 29(7): 385-387.(in Chinese) |
 2015, Vol. 17
2015, Vol. 17


