2. 湖南省农业科学院 植物保护研究所, 长沙 410125
2. Institute of Plant Protection, Hunan Academy of Agricultural Sciences, Changsha 410125, China
昆虫抗药性是防治农业害虫的重点和难点,故新型杀虫剂的研发对于预防和治理农业害虫抗药性及控制其危害具有非常重要的作用。异 NFDA1 唑啉类杀虫剂fluralaner主要通过干扰γ-氨基丁酸(GABA)门控氯离子通道发挥作用[1, 2, 3],与其作用靶标类似的杀虫剂还有环戊二烯类、苯基吡唑类和大环内酯类等[4, 5, 6]。其中环戊二烯类杀虫剂林丹(lindane)和狄氏剂(deldrin)是最早发现的作用于GABA门控氯离子通道的杀虫剂[7, 8],但两种杀虫剂均因高残留、易危害环境和人类健康、以及农业害虫对其抗性的普遍发生等原因,导致其在全球范围内的农业生产中被禁用[9, 10, 11, 12, 13]。而在异NFDA1唑啉类杀虫剂被研发之前,除了苯基吡唑类杀虫剂,如氟虫腈(fipronil)和乙虫腈(ethiprole),以及大环内酯类杀虫剂阿维菌素(abamectin)系列药剂以外,罕有其他作用于GABA门控氯离子通道的杀虫剂报道[1]。
有效的靶标受体为杀虫剂的开发提供了重要资源。目前,已商品化的160多种神经肌肉毒性杀虫剂,仅作用于不足10个神经系统的分子靶标(乙酰胆碱酯酶、乙酰胆碱受体、GABA门控氯离子通道、氯离子通道、钠离子通道、章鱼胺受体和鱼尼丁受体等)[14, 15, 16, 17, 18, 19, 20]。因此,现代农药创制在寻找新的害虫分子靶标的同时,充分利用现有分子靶标开发化学结构不同的杀虫剂,也是丰富杀虫剂品种和促进抗药性治理的有效途径。fluralaner的成功研发开创了一类全新的GABA门控氯离子通道干扰剂,引起了动物医学和农药科学工作者的关注和青睐[2, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33]。本文就近几年fluralaner及其衍生物的研发、生物效应和毒理学,以及其商品化进程的相关研究进展展开综述,旨在为促进该类化合物未来的深入研究和开发利用提供科学参考。
1 fluralaner研发历程
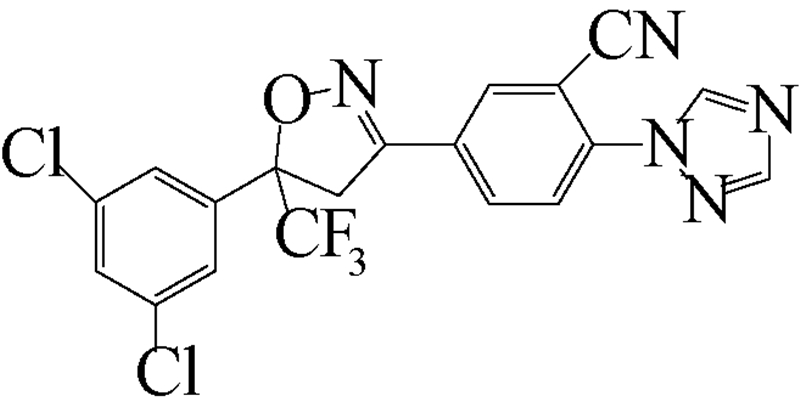
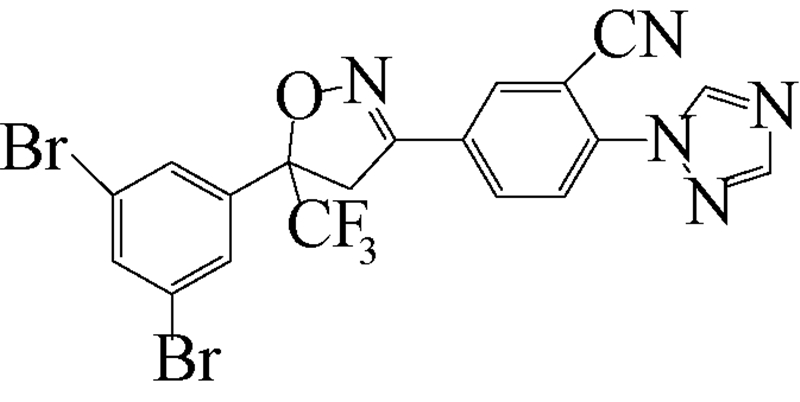
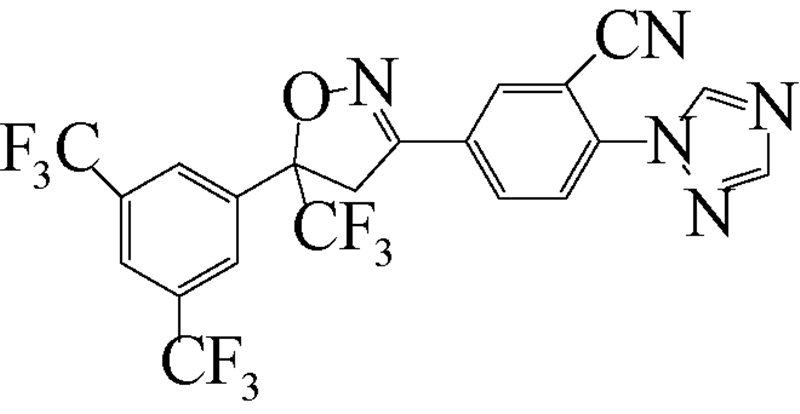
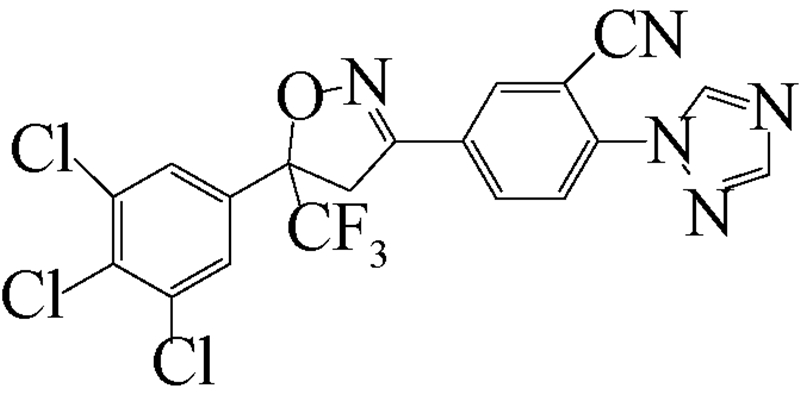
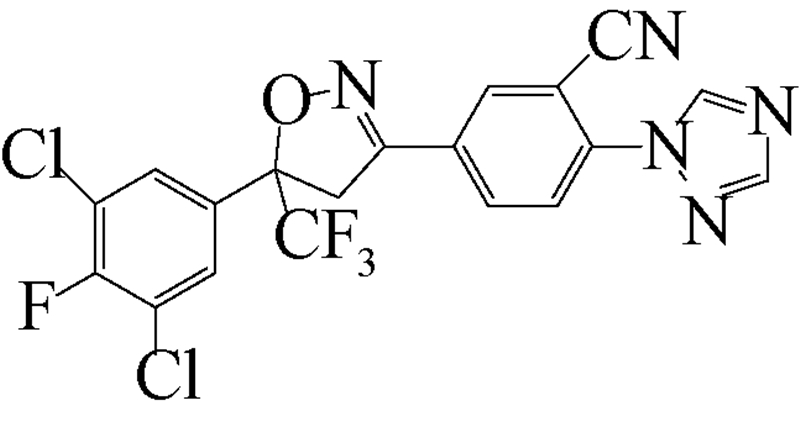
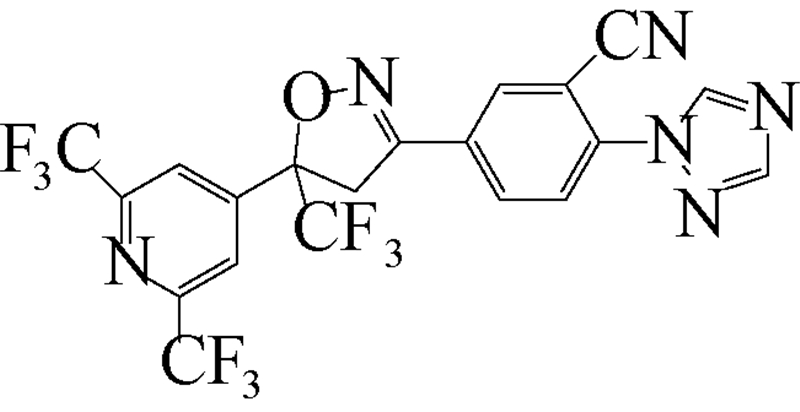
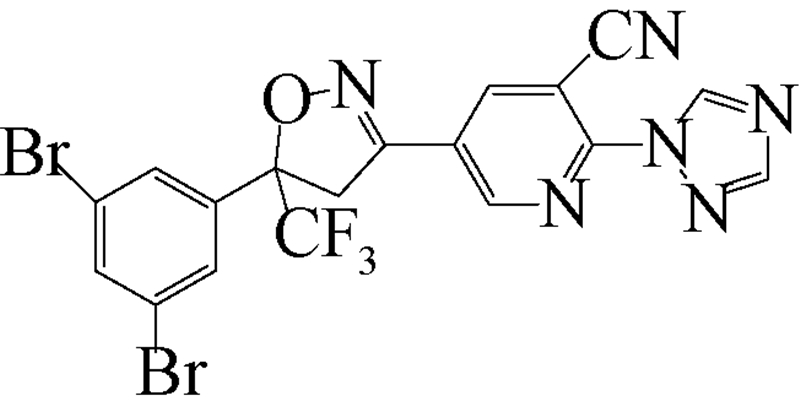
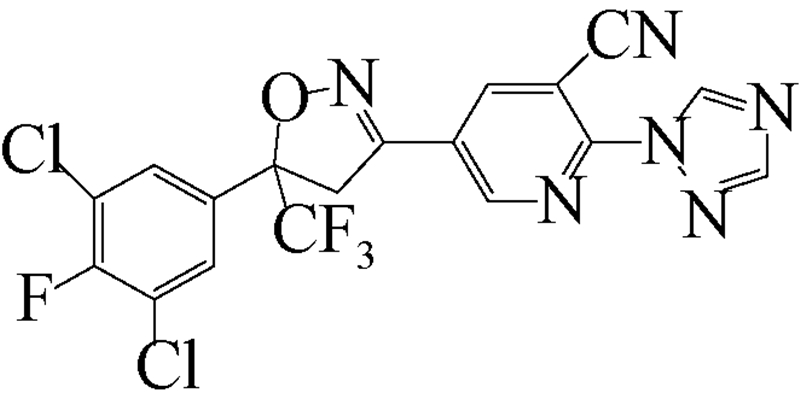
异 NFDA1 唑啉类化合物是在研究邻苯二甲酸甲酰胺(phthalic diamide)和邻甲酰氨基苯甲酰胺(anthranilic diamide)过程中意外获得的一类具有杀虫活性的化合物[34]。目前,在日本、美国和欧洲的科研团队均已积极开展了异 NFDA1 唑啉类杀虫剂的研发及其作用机理研究[1, 35, 36, 37],而fluralaner是其中最为突出的化合物之一。fluralaner的研发代号为A1443,化学名称为4-[5-(3,5-二氯苯基)-4,5-二氢-5-三氟甲基-3-异 NFDA1 唑基]-2-甲基-氮-[2-氧代-2-[(2,2,2-三氟乙基)氨基]乙基]-苯甲酰胺,具有一对对映异构体,通过高效液相色谱法,利用CHIRALPAK AD-H分析柱(2.0 cm×2.5 cm,V(己烷)∶V(乙醇)=1∶1可分离获得S构型和R构型组分(图式1)[1]。
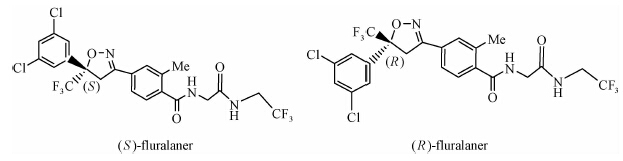 | 图式 1 fluralaner的对映异构体Scheme 1 Synthesis of fluralaner's enantiomers |
fluralaner研发历程大致如下:2004年,日本日产化学工业株式会社(Nissan Chemical Industries,Ltd.,Japan)Mita等成功研发了异 NFDA1 唑啉类广谱杀虫剂fluralaner,并于2005年取得国际专利的授权[37]。2010年,Ozoe 等详细研究和报道了fluralaner的生物和电生理活性[1]。2013年,García-Reynaga 等[3]合成了放射性配基[3H]fluralaner,用于研究fluralaner在GABA受体的作用位点和机制。2014年,Zhao(笔者)等[2]比较研究了fluralaner及其类似物在昆虫和哺乳动物GABA受体的作用位点;Gassel 等[25]和Rohdich等[28]报道了fluralaner对虱(tick)和跳蚤(flea)的生物活性;德国动物卫生创新研究所(MSD Animal Health Innovation GMBH,Germany)的研究者利用fluralaner对狗做了系列 “临床试验”[22, 24, 26, 27, 28, 29, 30, 31, 32, 33],检测了fluralaner对狗寄生虫的生物活性以及对狗的毒性等;同年fluralaner通过美国食品与药品监督管理局(Food and Drug Administration,FDA)的批准作为兽药(商品名BravectoTM)在欧美市场销售[23]。
2 fluralaner及其衍生物的杀虫活性
fluralaner是一种广谱性杀虫剂,对蜱目、蚤目、虱目、半翅目和双翅目等害虫均具有良好的杀虫活性,其毒力高于或与常用杀虫剂相当[21, 25]。从表 1可知,fluralaner对栉头蚤Ctenocephalides felis的活性优于传统杀虫剂氟虫腈和吡虫啉;对于铜绿蝇Lucilia cuprina的活性高于氟虫腈、狄氏剂、吡虫啉和溴氰菊酯;对于微小牛蜱Rhipicephalus microplus的活性远高于溴氰菊酯,对抗氟虫腈的灰飞虱Laodelphax striatellus(R)和二斑叶螨Tetranychus urticae的杀虫活性也较好。此外,fluralaner不仅与现有杀虫剂无显著的交互抗性,甚至对部分抗性害虫也具有较好的杀虫活性[21, 25]。
| 表 1 fluralaner和其他4种杀虫剂对昆虫的杀虫活性比较 Table 1 Comparison of the insecticidal activities of fluralaner and 4 other insecticides to insect pests |
进一步研究表明:fluralaner的S构型组分对栉头蚤C.felis和变异革蜱Dermacentor variabilis的LC95值分别为16和1 ng/cm2,而相应的R构型的LC95值均大于10 000 ng/cm2[1]。放射性配基 [3H]EBOB结合试验结果表明,S构型组分对家蝇Musca domestica膜蛋白的抑制性结合值(IC50)为0.083 1 nmol/L,而R构型对其抑制性结合IC50值为110 nmol/L。综合研究表明,S构型是fluralaner的主要杀虫活性组分[1]。
继Mita等[37] 对fluralaner及其衍生物的合成进行研究报道后,美国杜邦公司(DuPont Crop Protection,USA)Lahm等[35]报道了一系列与fluralaner结构类似的异 NFDA1 唑啉类化合物。该类化合物对鳞翅目(如草地贪夜蛾Spodoptera frugiperda和棉铃虫Helicoverpa zea)、同翅目(如蚕虫微叶蝉Empoasca fabae)和缨翅目(如西花蓟马Frankliniella occidentalis)等害虫均表现出良好的杀虫活性(部分化合物的杀虫活性见表 2),其中化合物1~8对4种害虫的LC50值大多在 0.1~1.0 mg/L之间[35]。
3 fluralaner对哺乳动物的毒性毒性试验结果表明,fluralaner对哺乳动物低毒或无毒[27, 30, 31, 32]。Walther等[30]通过直接口服饲喂的方法研究了fluralaner对小猎犬(beagle dog)的影响。结果表明:临床期间,当药物剂量(药量/体重,下同)达到281.3 mg/kg时,小猎犬的血检、尿检和临床化学检测等指标均正常,未表现出任何不适症状;虽然小猎犬的尸检结果与对照组存在病理学上的差异性,但暂无迹象表明这种差异与临床用药相关。Walther 等[31]又将fluralaner饲喂纯种柯利牧羊犬(collies homozyhous),当剂量达到168 mg/kg时,亦未发现任何反常症状。
此外,Zhao(笔者)等[39]通过放射性配基竞争性结合试验发现,fluralaner对体外重组表达的人GABA门控氯离子通道(β3亚基)几乎无作用,但对大鼠Rattus norvegicus的脑膜蛋白结合作用的抑制性LC50>10 000 mg/L。Ozoe 等[1]研究表明,fluralaner与昆虫GABA门控氯离子通道的亲和力远大于其与哺乳动物GABA门控氯离子通道的亲和力。以上结果说明,fluralaner与不同生物体GABA受体门控氯离子通道的亲和性具有显著的选择性[1, 2, 3, 39]。
4 fluralaner的杀虫作用机理作为一种新型异 NFDA1 唑啉类杀虫剂,fluralaner的作用机理已有相关报道。2010年,Ozoe 等[1] 通过双电极电压钳技术证实,fluralaner对家蝇M. domestica的作用靶标为其膜蛋白GABA门控氯离子通道。他们利用爪蟾卵母细胞(Xenopus oocytes)表达MdGBCl和 MdGluCl,检测了fluralaner对氯离子流的影响。结果表明,fluralaner可以阻滞GABA和谷氨酸(glutamate)诱导的氯离子流,且在突变型离子通道中存在类似的现象。与此同时,他们还利
| 表 2 苯噻菌酯抑制植物病原菌菌丝生长的毒力 Table 2 Toxicity of benzothiostrobin against mycelial growth of plant pathogens |
用放射性配基结合试验,检测了氟虫腈和fluralaner对放射性配基[3H]EBOB与家蝇膜蛋白结合的情况。结果表明,fluralaner对[3H]EBOB具有竞争性抑制作用。
从化学结构来看,fluralaner也属于苯基杂环类化合物,但结构却不同于其他相关阻滞剂(blocker),故fluralaner 与已有阻滞剂的作用位点问题值得关注和研究。Ozoe 等[1] 通过构建两个突变型离子通道,即将GABA门控氯离子通道亚基2'位的特征性氨基酸丙氨酸(alanine)突变为丝氨酸(serine)或甘氨酸(glycine),从而比较fluralaner与氟虫腈对突变型离子通道的影响差异。结果表明:氟虫腈可以影响S278A点突变的谷氨酸受体氯离子流,但fluralaner却对此无显著影响;而氟虫腈和fluralaner均可阻滞点突变(A299S)GABA门控氯离子通道的氯离子流,说明fluralaner与氟虫腈在GABA门控氯离子通道上的结合位点至少存在部分差异[1]。García-Reynage 等[3]合成了放射性配基[3H]fluralaner,并利用配基结合技术测定了[3H]fluralaner、[3H]EBOB和[3H]avermectin等放射性配基与蜜蜂Apis mellifera、家蝇M.domestica和大鼠R. norvegicus等膜蛋白的结合情况。结果表明,fluralaner可部分地结合于GABA门控氯离子通道上,与氟虫腈、狄氏剂、硫丹(α-endosulfan)、林丹、12-ketoendrin和环氧七氯(heptachlor epoxide)等杀虫剂具有不同的结合活性[2, 3]。Asahi 等[21]采用叶片喷雾法测定了氟虫腈和fluralaner对二斑叶螨T.urticae和灰飞虱L.striatellus的杀虫活性,并以爪蟾卵母细胞表达了二斑叶螨(A301→H和T350→A)和灰飞虱(A283→N)的突变型GABA门控氯离子通道,检测了氟虫腈和fluralaner对重组离子通道电流的影响,发现fluralaner对两种供试昆虫的杀虫活性以及对GABA诱导氯离子流的拮抗性均高于氟虫腈,且与氟虫腈无交互作用。
关于fluralaner与GABA和谷氨酸门控离子通道的作用差异。Gassel 等[25]比较研究了fluralaner对微小牛蜱R.microplus GABA和谷氨酸离子通道的影响强度。结果表明,fluralaner对GABA离子通道的抑制性是对谷氨酸离子通道抑制性的52倍。Ozoe 等[1]检测了fluralaner对家蝇M.domestica GABA和谷氨酸门控氯离子通道的抑制性。结果发现,fluralaner对GABA离子通道的抑制性(IC50=5.32)是对谷氨酸离子通道抑制性(IC50=79.9)的15倍。由以上研究结果可初步确定fluralaner的主要作用靶标为GABA门控氯离子通道。
5 fluralaner的应用现状及展望
目前,fluralaner作为兽药已完成了商品化,并已应用于寄生虫的防治。自2013年至今,德国动物卫生创新研究所的科研工作者对fluralaner开展了一系列试验研究,采用口服饲喂的方法比较研究了fluralaner、氟虫腈(FrontlineTM)和溴氰菊酯(ScaliborTM protectorband)对狗寄生虫栉头蚤C. felis和变异革蜱D. variabilis的防治效果。结果表明,fluralaner对栉头蚤和扁虱具有非常好的除杀效果[22, 24, 27, 28, 30, 31, 32]。2014年,默克(Merk)公司首次以fluralaner作为兽药(BravectoTM)进行了商业化生产,用于杀灭狗寄生虫虱子和跳蚤等[23]。一系列的研究表明,该药物可被狗体迅速吸收,具有见效快、半衰期长、持效期长及狗对其清除率低等特点[22, 24, 26, 27, 28, 29, 30, 31, 32, 33]。目前该药已获得美国FDA的许可认证,并在欧洲和美国等国家开始销售和推广,预计其在亚洲乃至中国的推广也指日可待。
现今,fluralaner作为农用杀虫剂和医药的研发仍处于起步阶段。GABA门控氯离子通道是良好的杀虫剂选择性靶标,但与乙酰胆碱酯酶和钠离子通道等靶标相比,已开发的对应杀虫剂品种尚匮乏。苯基吡唑类杀虫剂和环戊二烯类杀虫剂等作为昆虫GABA受体拮抗剂的成功研发,对农业害虫的有效防控和农业生产的可持续性发展至关重要。然而,由于环境安全和害虫抗药性等问题日益严峻,亟需研发新型杀虫剂,以确保农业生产的安全、高效和可持续性发展。fluralaner及其衍生物通过作用于GABA受体,对草地贪夜蛾S.frugiperda、棉铃虫H.zea、蚕豆微叶蝉E.fabae和西花蓟马F.occidentalis等害虫显示出优异的杀虫活性,预示着该类化合物作为杀虫剂具有广阔的开发前景,可以为卫生害虫和农业害虫的防治提供更多的选择[35]。
综上所述,fluralaner是一种对哺乳动物安全、杀虫活性高、且广谱的异 NFDA1 唑啉类杀虫剂。相信随着科研工作者对该类杀虫剂研究的不断深入,相关领域的商业化产品定将日益丰富,而其应用和推广工作的跟进,势必给当今农业生产所面临的害虫抗药性和环境污染严重等问题提供新的解决方案和途径。然而,国内目前尚未见与其相关的学术研究和商业报道,因此加强对该类化合物的关注显得尤为必要。
| [1] | Ozoe Y, Asahi M, Ozoe F, et al. The antiparasitic isoxazoline A1443 is a potent blocker of insect ligand-gated chloride channels[J]. Biochem Biophys Res Commun, 2010, 391(1): 744-749. |
| [2] | Zhao Chunqing, Casida J E. Insect γ -aminobutyric acid receptors and isoxazoline insecticides: toxicological profiles relative to the binding sites of [3H] fluralaner, [3H]-4'-ethynyl-4-n-propylbicycloorthobenzoate, and [3H] avermectin[J]. J Agric Food Chem, 2014, 62(5): 1019-1024. |
| [3] | García-Reynaga P, Zhao Chunqing, Sarpong R, et al. New GABA/glutamate receptor target for [3H] isoxazoline insecticide[J]. Chem Res Toxicol, 2013, 26(4): 514-516. |
| [4] | Casida J E. Insecticide action at the GABA-gated chloride channel: recognition, progress, and prospects[J]. Arch Insect Biochem Physiol, 1993, 22(1-2): 13-23. |
| [5] | Buckingham S D, Sattelle D B. GABA receptor of insects[M]//Gilbert L I, Iatrou K, Gill S S. Comprehensive Molecular Insect Science. Elsevier: Oxford, 2005,5:107-142. |
| [6] | Ozoe Y, Takeda M, Matsuda K. γ-Aminobutyric acid receptors: a rationale for developing selective insect pest control chemicals[M]//Ishaaya I, Horowitz A R. Biorational Control of Arthropod Pests: Application and Resistance Management. Netherlands: Springer, 2009: 131-162. |
| [7] | Ghiasuddin S M, Matsumura F. Inhibition of gamma-aminobutyric acid(GABA)-induced chloride uptake by gamma-BHC and heptachlor epoxide[J]. Comp Biochem Physiol C: Comp Pharmacol, 1982, 73(1): 141-144. |
| [8] | Lawrence L J, Casida J E. Interactions of lindane, toxaphene and cyclodienes with brain-specific t-butylbicyclophospho-rothionate receptor[J]. Life Sci, 1984, 35(2): 171-178. |
| [9] | Croom E L, Shafer T J, Evans M V, et al. Improving in vitro to in vivo extrapolation by incorporating toxicokinetic measurements: a case study of lindane-induced neurotoxicity[J]. Toxicol Appl Pharmacol, 2015, 283(1): 9-19. |
| [10] | Mull B, Horn W, Jann O. Investigations on the emissions of biocides and PCBs under low volume conditions[J]. Chemosphere, 2015, 118: 65-71. |
| [11] | Singh S K, Raha P, Banerjee H. Banned organochlorine cyclodiene pesticide in ground water in Varanasi, India[J]. Bull Environ Contam Toxicol, 2006, 76(6): 935-941. |
| [12] | Schnoor J L. Fate and transport of dieldrin in coralville reservoir: Residues in fish and water following a pesticide ban[J]. Science, 1981, 211(4484): 840-842. |
| [13] | Hosie A M, Baylis H A, Buckingham S D, et al. Actions of the insecticide fipronil, on dieldrin-sensitive and -resistant GABA receptors of Drosophila melanogaster[J]. Br J Pharmacol, 1995, 115(6): 909-912. |
| [14] | Matsuda K, Buckingham S D, Kleier D, et al. Neonicotinoids: insecticides acting on insect nicotinic acetylcholine receptors[J]. Trends Pharmacol Sci, 2001, 22(11): 573-580. |
| [15] | Fournier D, Bride J M, Hoffmann F, et al. Acetylcholinesterase. Two types of modifications confer resistance to insecticide[J]. J Biol Chem, 1992, 267(20): 14270-14274. |
| [16] | Ratra G S, Casida J E. GABA receptor subunit composition relative to insecticide potency and selectivity[J]. Toxicol Lett, 2001, 122(3): 215-222. |
| [17] | Forshaw P J, Lister T, Ray D E. The role of voltage-gated chloride channels in type II pyrethroid insecticide poisoning[J]. Toxicol Appl Pharmacol, 2000, 163(1): 1-8. |
| [18] | Williamson M S, Martinez-Torres D, Hick C, et al. Identification of mutations in the housefly para-type sodium channel gene associated with knockdown resistance(kdr) to pyrethroid insecticides[J]. Mol Gen Genet, 1996, 252(1-2): 51-60. |
| [19] | Evans P D, Gee J D. Action of formamidine pesticides on octopamine receptors[J]. Nature, 1980, 287(5777): 60-62. |
| [20] | Lahm G P, Cordova D, Barry J D. New and selective ryanodine receptor activators for insect control[J]. Bioorg Med Chem, 2009, 17(12): 4127-4133. |
| [21] | Asahi M, Kobayashi M, Matsui H, et al. Differential mechanisms of action of the novel γ-aminobutyric acid receptor antagonist ectoparasiticides fluralaner(A1443) and fipronil[J]. Pest Manag Sci, 2015, 71(1): 91-95. |
| [22] | Walther F M, Allan M J, Roepke R K A, et al. The effect of food on the pharmacokinetics of oral fluralaner in dogs[J]. Parasit Vectors, 2014, 7: 84. |
| [23] | U.S. Food and Drug Administration. Approves first oral drug for fleas and ticks in dogs with three month duration [DB/OL].[2014-06-05]. http://www.fda.gov/animalveterinary/newsevents/ cvmupdates/ucm399546.htm |
| [24] | Williams H, Young D R, Qureshi T, et al. Fluralaner, a novel isoxazoline, prevents flea(Ctenocephalides felis) reproduction in vitro and in a simulated home environment[J]. Parasit Vectors, 2014, 7: 275. |
| [25] | Gassel M, Wolf C, Noack S, et al. The novel isoxazoline ectoparasiticide fluralaner: selective inhibition of arthropod γ-aminobutyric acid- and L-glutamate-gated chloride channels and insecticidal/acaricidal activity[J]. Insect Biochem Mol Biol, 2013, 45: 111-124. |
| [26] | Taenzler J, Wengenmayer C, Williams H, et al. Onset of activity of fluralaner(BravectoTM) against Ctenocephalides felis on dogs[J]. Parasit Vectors, 2014, 7: 567. |
| [27] | Kilp S, Ramirez D, Allan M, et al. Pharmacokinetics of fluralaner in dogs following a single oral or intravenous administration[J]. Parasit Vectors, 2014, 7: 85. |
| [28] | Rohdich N, Roepke R K A, Zschiesche E. A randomized, blinded, controlled and multi-centered field study comparing the efficacy and safety of BravectoTM (fluralaner) against FrontlineTM(fipronil) in flea-and tick-infested dogs[J]. Parasit Vectors, 2014, 7: 83. |
| [29] | Walther F M, Fisara P, Allan M J, et al. Safety of concurrent treatment of dogs with fluralaner(BravectoTM) and milbemycin oxime-praziquantel[J]. Parasit Vectors, 2014, 7: 481. |
| [30] | Walther F M, Allan M J, Roepke R K A, et al. Safety of fluralaner chewable tablets(BravectoTM), a novel systemic antiparasitic drug, in dogs after oral administration[J]. Parasit Vectors, 2014, 7: 87. |
| [31] | Walther F M, Paul A J, Allan M J, et al. Safety of fluralaner, a novel systemic antiparasitic drug, in MDR1(-/-) collies after oral administration[J]. Parasit Vectors, 2014, 7: 86. |
| [32] | Walther F M, Fisara P, Allan M J, et al. Safety of the concurrent treatment of dogs with Bravecto TM(fluralaner) and Scalibor TM protectorband(deltamethrin)[J]. Parasit Vectors, 2014, 7: 105. |
| [33] | Wengenmayer C, Williams H, Zschiesche E, et al. The speed of kill of fluralaner(BravectoTM) against Ixodes ricinus ticks on dogs[J]. Parasit Vectors, 2014, 7: 525. |
| [34] | Casida J E. Golden age of RyR and GABA-R diamide and isoxazoline insecticides: Common genesis, serendipity, surprises, selectivity, and safety[J]. Chem Res Toxicol, 2015, 28(4): 560-566. |
| [35] | Lahm G P, Cordova D, Barry J D, et al. 4-Azolylphenyl isoxazoline insecticides acting at the GABA gated chloride channel[J]. Bioorg Med Chem Lett, 2013, 23(10): 3001-3006. |
| [36] | Shoop W L, Hartline E J, Gould B R, et al. Discovery and mode of action of afoxolaner, a new isoxazoline parasiticide for dogs[J]. Vet Parasitol, 2014, 201(3-4): 179-189. |
| [37] | Mita T, Kikuchi T, Mizukoshi T, et al. Isoxazoline-substituted benzamide compound and noxious organism control agent: WO 2005085126 [P]. 2005-03-04. |
| [38] | Coles T B, Dryden M W. Insecticide/acaricide resistance in fleas and ticks infesting dogs and cats[J]. Parasit Vectors, 2014, 7: 8. |
| [39] | Zhao Chunqing, Hwang S H, Buchholz B A, et al. GABAA receptor target of tetramethylenedisulfotetramine[J]. Proc Natl Acad Sci USA, 2014, 111(23): 8607-8612. |
 2015, Vol. 17
2015, Vol. 17