2. 湖北省丹江口市委农村工作领导小组办公室, 湖北 丹江口 442700
2. The CPC Danjiangkou Municipal Committee Rural Affairs Leading Group Office, Danjiangkou 442700, Hubei Province, China
拟除虫菊酯类杀虫剂具有高效、低毒、低残留等特点,是农用及卫生杀虫剂的支柱产品之一[1]。枸杞蚜虫是枸杞生产中的重要害虫,自拟除虫菊酯类杀虫剂引进后在该害虫的防治中取得了很好的效果[2]。但随着应用时间延长,已出现防效下降及抗药性等现象[3]。
已有研究证实,三磷酸腺苷酶(ATPase)是拟除虫菊酯类杀虫剂的重要靶标之一[4],谷胱甘肽S-转移酶(GSTs)是昆虫体内重要的解毒酶,对外源化合物的解毒代谢起着重要作用[5, 6]。枸杞蚜虫防治属于小众经济作物害虫防治范畴,研究力度尚比较薄弱。内蒙古地区是我国枸杞的主产区之一,目前种植面积约1.4万hm2,在当地的经济发展中占有重要地位[7]。本研究选择目前在枸杞蚜虫防治中、尤其在内蒙古地区尚未广泛使用的4种拟除虫菊酯类杀虫剂,研究了其对枸杞蚜虫的毒力及对ATPase、GSTs活性的影响,以期为拟除虫菊酯类杀虫剂在枸杞蚜虫防治中的应用提供参考。
1 材料与方法 1.1 供试昆虫
枸杞蚜虫Aphis sp.采自内蒙古农业大学温室内栽培的枸杞植株上。 1.2 药剂及试剂
95%氯菊酯(permethrin)原药、96%联苯菊酯(bifenthrin)原药、27%高效氯氰菊酯(beta-cypermethrin)原药和40%甲氰菊酯(fenpropathrin)原药,均为江苏扬农化工有限公司产品;ATPase测试盒及GSTs测试盒,南京建成生物工程研究所第一分所产品;其他试剂均为国产分析纯。 1.3 毒力测定
采用玻璃管药膜法[8, 9],并有改进。将杀虫药剂用丙酮配成1 000 mg/L的母液,根据预试验结果再用丙酮进一步稀释成不同浓度梯度。每种药剂6个浓度,每浓度重复3次。吸取400 μL稀释后的药液于15 mm×100 mm指形管内,迅速转动1圈,使药液均匀涂布于管内壁。将多余的药液倒出,待丙酮挥发后进行毒力测定,以仅用丙酮的处理为对照。挑取健康一致的无翅蚜虫供试,每管内接30头,在室内正常饲养条件(18~25 ℃,相对湿度50%~70%,光照为17L ∶7D)下培养3 h后检查死亡率。用毛笔轻触虫体,不动者记为死亡,对照死亡率小于10%为有效测定,并用对照死亡率进行校正。将试验中依然存活的蚜虫在-80 ℃条件下分别冷冻保存,用于后续GSTs酶活性的测定。 1.4 酶液制备及酶活性测定 1.4.1 ATPase酶液制备及酶活性测定
枸杞蚜虫ATPase酶液制备参见Feng等的方法[10],并有改进。将100头未经任何处理的健康蚜虫置于玻璃匀浆器中,加入2 mL Tris-HCl缓冲液(pH 7.4,含体积分数为0.05% 的TritonX-100),冰浴下匀浆。匀浆液于4 ℃、3 000×g下离心10 min,取上清液。上清液再于10 000×g下离心30 min,弃去上清液,沉淀用上述缓冲液溶解后作为酶源,备用。ATPase活性测定均依照ATPase测试盒说明进行。试验重复3次。 1.4.2 GSTs酶液制备及酶活性测定
参照Kao等的方法[11],并有改进。取毒力测定试验中存活并于-80 ℃冻存的枸杞蚜虫,置于玻璃匀浆器中,加入0.1 mol/L的磷酸缓冲液(pH 7.0)匀浆。匀浆液于4 ℃、10 000×g下离心15 min,取上清液作为酶源。酶活性测定依照GSTs测定试剂盒说明书进行。试验重复3次。 1.4.3 药剂对枸杞蚜虫ATPase活性的影响
将4种供试药剂用丙酮配成浓度为1×10-2 mol/L的母液,根据预试验结果,再用配好的Tris-HCl缓冲液(pH 7.4,不含TritonX-100)以10为公比稀释至所需浓度(现配现用)。向酶促反应阶段的反应体系中加入酶液和药剂,其他步骤同ATPase活力测定。按(1)式计算酶活性抑制率。
ATPase活性抑制率/%=

方法同1.4.2 节GSTs酶活力测定。 1.5 酶液中蛋白质含量测定
参照Bradford的[12]考马斯亮蓝G-250法。 1.6 数据统计方法
毒力测定数据采用POLO软件处理,计算LC50值和斜率(b)。对抑制率结果进行反正弦转换后利用SAS软件进行差异显著性分析。对同一浓度下同种药剂对两种ATPase的抑制率进行t-检验分析。
2 结果与分析 2.1 供试4种杀虫剂对枸杞蚜虫的毒力
结果见表 1。其中,联苯菊酯对枸杞蚜虫的致死中浓度(LC50)最小,仅为4.34 mg/L,表明枸杞蚜虫对联苯菊酯最敏感,其次为氯菊酯和高效氯氰菊酯,甲氰菊酯的LC50值最大。
|
|
表 1 供试4种拟除虫菊酯类杀虫剂对枸杞蚜虫的毒力 Table 1 Toxicity of four pyrethroid insecticides to Aphis sp. |
由图 1可见,4种杀虫剂对枸杞蚜虫Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性均有不同程度的抑制作用,且抑制作用呈明显的剂量-效应关系——随药剂浓度升高,抑制程度加强。其中,联苯菊酯与氯菊酯对两种ATPase的抑制趋势相同,在不同浓度下均表现为对Na+-K+-ATPase的抑制率高于对Ca2+-Mg2+-ATPase;甲氰菊酯和高效氯氰菊酯则是在高浓度下对Na+-K+-ATPase的抑制率高于对Ca2+-Mg2+-ATPase,而随着药剂浓度降低,其对两种ATPase抑制率的差异逐渐缩小,最终趋于一致。在最高浓度1×10-4 mol/L时,联苯菊酯对枸杞蚜虫Ca2+-Mg2+-ATPase活性的抑制率与其他3种药剂间存在显著性差异;而当浓度降低至1×10-8 mol/L时,则氯菊酯与其他3种药剂间对Ca2+-Mg2+-ATPase活性的抑制率差异显著。
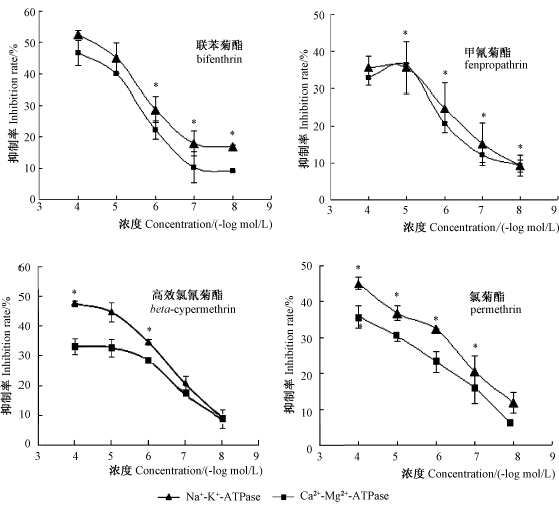 |
*同一浓度下药剂对Na+-K+-ATPase和Ca2+-Mg2+-ATPase抑制率的差异显著性(P<0.05)。 * Indicates significant differences between inhibition to Na+-K+-ATPase and Ca2+-Mg2+-ATPase under the same concentration(P<0.05). 图 1 供试4种拟除虫菊酯类药剂对枸杞蚜虫ATPase的抑制作用Fig. 1 Inhibition of ATPase activity by four pyrethroid insecticides |
结果见图 2。经不同浓度联苯菊酯处理后,对枸杞蚜虫GSTs活性表现为高浓度时具有一定的抑制作用,低浓度时有一定的诱导作用,但低浓度处理组与对照间无显著差异。不同浓度高效氯氰菊酯和氯菊酯对枸杞蚜虫GSTs活性均有一定程度的抑制作用,最高抑制率为85.02%。甲氰菊酯各浓度处理组枸杞蚜虫GSTs活性均高于对照,且与对照间差异显著,但其GSTs活性被诱导程度与药剂浓度无关,当甲氰菊酯质量浓度为180 mg/L时,试虫GSTs活性被诱导程度最高,达对照的3.26倍。
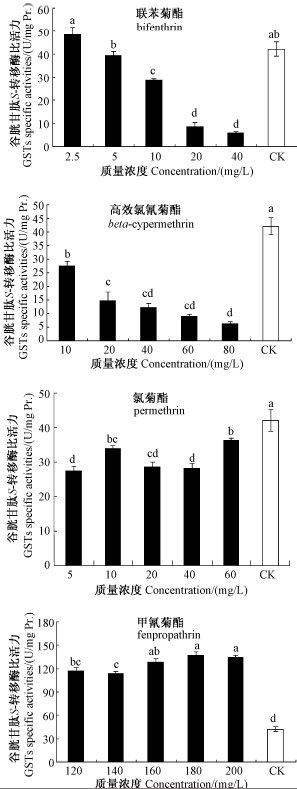 | 图 2 供试4种拟除虫菊酯类杀虫剂对枸杞蚜虫谷胱甘肽S-转移酶活性的影响 Fig. 2 Effect of four pyrethroid insecticides on GSTs activities of Aphis sp. |
王金富等[13]研究了7种化学药剂对枸杞蚜虫的毒力,其中,联苯菊酯的毒力最强,24 h-LC50值为0.63 mg/L;本研究中,联苯菊酯对枸杞蚜虫的3 h-LC50值为4.34 mg/L,在供试的4种药剂中毒力也最强。南宁丽等[14]测定发现,4.5%高效氯氰菊酯乳油对枸杞蚜虫具有较高的毒性。本研究表明,联苯菊酯和氯菊酯对枸杞蚜虫活性较高,可用于该害虫的防治;而甲氰菊酯防效较差,不建议用于枸杞蚜虫防治;高效氯氰菊酯对内蒙古枸杞蚜虫的LC50值与南宁丽的结果相比偏大,因此在实践中应慎重使用。
现有研究表明,大多数拟除虫菊酯类杀虫剂都可抑制昆虫体内的Na+-K+-ATPase活性[15]。何运转等[16]研究发现,氯菊酯对敏感家蝇Na+-K+-ATPase活性具有明显的抑制作用,并认为神经系统中的Na+-K+-ATPase可能是拟除虫菊酯类杀虫剂的重要靶标之一。何恒果等[17]报道,甲氰菊酯对抗性和敏感品系柑橘全爪螨的Na+-K+-ATPase具有一定程度的抑制作用。笔者等[18, 19]前期的研究也表明,联苯菊酯等拟除虫菊酯类杀虫剂对二化螟Na+-K+-ATPas及Ca2+-Mg2+-ATPase活性均具有一定的抑制作用。Luo等[20]的研究结论与之类似。本研究中,4种拟除虫菊酯类杀虫剂对枸杞蚜虫Na+-K+-ATPase及Ca2+-Mg2+-ATPase的活性均产生了不同程度的抑制作用,与文献报道一致。而何运转等[21]的研究却表明,溴氰菊酯和氯菊酯对家蝇Ca2+-Mg2+-ATPase基本无抑制作用。
梁沛等[7]研究了亚致死剂量高效氯氰菊酯对小菜蛾GSTs的影响,发现小菜蛾敏感品系GSTs活性比对照升高了70%。赵玲等[22]研究发现,低浓度时高效氯氟氰菊酯对意大利蝗GSTs活性具有诱导作用。尹晓辉等[23]的研究表明,采用亚致死剂量溴氰菊酯处理120 h后,麦穗鱼卵巢、肾、肠和鳃等组织内的GSTs活性均有明显增加。本研究中,低浓度联苯菊酯和供试各浓度甲氰菊酯对枸杞蚜虫GSTs活性也具有明显的诱导作用,与上述文献结论类似。
但汤方等[24]的研究却表明,联苯菊酯、高效氯氰菊酯、甲氰菊酯等对分月扇舟蛾GSTs活性均有一定程度的抑制作用。本研究中,高浓度联苯菊酯及供试各浓度氯菊酯和高效氯氰菊酯对枸杞蚜虫GSTs活性也均有一定程度的抑制作用。
| [1] | Shafer T J, Meyer D A, Crofton K M. Developmental neurotoxicity of pyrethroid insecticides: critical review and future research needs[J]. Environ Health Perspect, 2005, 113(2): 123-136. |
| [2] | 徐常青, 刘赛, 徐荣, 等. 我国枸杞主产区生产现状调研及建议[J]. 中国中药杂志, 2014, 39(11): 1979-1984. XU Changqing, LIU Sai, XU Rong, et al. Investigation of production status in major wolfberry producing areas of China and some suggestions[J]. China J Chinese Materia Medica, 2014, 39(11): 1979-1984. (in Chinese) |
| [3] | 任月萍, 胡忠庆. 宁夏枸杞主要病虫害化学防治研究进展[J]. 宁夏农学院学报, 2004, 25(3): 89-91. REN Yueping, HU Zhongqing. The progress of research on chemical control for main diseases and insect pests of Chinese wolfberry in Ningxia[J]. J Ningxia Agr Coll, 2004, 25(3): 89-91. (in Chinese) |
| [4] | Clark J M, Matsumura F. The action of two classes of pyrethroids on the inhibition of brain Na-Ca and Ca-Mg ATP hydrolyzing activities of the American cockroach[J]. Comp Biochem Physiol Part C: Comp Pharmacol, 1987, 86(1): 135-145. |
| [5] | Grant D F, Matsumura F. Glutathione S-transferase 1 and 2 in susceptible and insecticide resistant Aedes aegypt[J]. Pestic Biochem Physiol, 1989, 33(2): 132-143. |
| [6] | 梁沛, 夏冰, 石泰, 等. 阿维菌素和高效氯氰菊酯亚致死剂量对小菜蛾谷胱甘肽S-转移酶的影响[J]. 中国农业大学学报, 2003, 8(3): 65-68. LIANG Pei, XIA Bing, SHI Tai, et al. Effect of sublethal doses of abamectin and β -cypermethrin on glutathione S-transferases in diamondback moth Plutella xylostella (L.) [J]. J China Agr Univ, 2003, 8(3): 65-68. (in Chinese) |
| [7] | 2014年中国宁夏枸杞行业市场分析报告[DB/OL]. (2014-10-28). http://www.chinadmd.com/file/acieacaiie3ozxaecuwxietw_1.html Analysis report of wolfberry market of Ningxia in China in 2014[DB/OL]. (2014-10-28). http://www.chinadmd.com/file/acieacaiie3ozxaecuwxietw_1.html (in Chinese) |
| [8] | Shotkoski F A, Mayo Z B, Peters L L. Induced disulfoton resistance in green bugs (Homoptera:Aphididae)[J]. J Econ Entomol, 1990, 83(6): 2147-2152. |
| [9] | 鲁艳辉, 杨婷, 高希武. 禾谷缢管蚜和麦长管蚜玻璃管药膜法敏感毒力基线的建立[J]. 昆虫学报, 2009, 52(1): 52-58. LU Yanhui, YANG Ting, GAO Xiwu. Establishment of baseline susceptibility data to various insecticides for aphids Rhopalosiphum padi (L.) and Sitobion avenae (Fabricius)(Homoptera: Aphididae) by the method of residual film in glass tube[J]. Acta Entomological Sinica, 2009, 52(1): 52-58. (in Chinese) |
| [10] | Feng Guolei, Marion J R, Clark J M. Suppression of pyrethroid-dependent neurotransmitter release from synaptosomes of knockdown-resist ant house flies under pulsed-depolarization condition during continuous perfusion[J]. Pestic Biochem Physiol, 1992, 42(1): 64-77. |
| [11] | Kao C H, Hung C F, Sun C N. Parathion and methyl parathion resistance in diamondback moth (Lepidoptera: Plutellidae) larvae[J]. J Econ Entomol, 1989, 82(5): 1299-1304. |
| [12] | Bradford M M. A rapid and sensitive method for quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254. |
| [13] | 王金富, 马孝林, 邓景丽, 等. 7种化学药剂对枸杞蚜虫的室内毒力[J]. 西北农业学报, 2010, 19(5): 105-107. WANG Jinfu, MA Xiaolin, DENG Jingli. Toxicity determination of seven chemicals on wolfberry Aphis in the laboratory[J]. Acta Agricultura Boreali-Occidentalis Sinica, 2010, 19(5): 105-107. (in Chinese) |
| [14] | 南宁丽, 李锋, 吴晓刚, 等. 6种杀虫剂对枸杞蚜虫的毒力测定结果[J]. 甘肃农业科技, 2003(12): 41-42. NAN Ningli,LI Feng, WU Xiaogang, et al. Toxicity of six insecticides to wolfberry Aphis [J]. Gansu Agr Sci Techn, 2003(12): 41-42.(in Chinese) |
| [15] | Clark J M, Matsumura F. Two different types of inhibitory effects of pyrethroid on nerve Ca and Ca-Mg-ATPase activity in the squid, Loligo pealei[J]. Pestic Biochem Physiol, 1982, 18(2): 180-190. |
| [16] | 何运转, 李梅, 冯国蕾, 等. 拟除虫菊酯对家蝇Na+-K+-ATPase抑制作用的研究[J]. 昆虫学报, 1999, 42(1): 19-24. HE Yunzhuan, LI Mei, FENG Guolei, et al. Inhibition of pyrethroid insecticides on nerve Na+-K+-ATPase in house flies(Musca domestica)[J]. Acta Entomologica Sinica, 1999, 42(1): 19-24. (in Chinese) |
| [17] | 何恒果, 赵志模, 王进军. 柑橘全爪螨Na+-K+-ATPase的生化毒理学特性研究[J]. 果树学报, 2011, 28(1):102-107. HE Hengguo, ZHAO Zhimo, WANG Jinjun. Biochemical and toxicological characterizations of Na+-K+-ATPase in citrus red mite,Panonychus citri McGregor (Acari:Tetranychidae) [J]. J Fruit Sci,2011,28(1): 102-107. (in Chinese) |
| [18] | 李海平, 冯涛, 陶岭梅, 等. 九种常用杀虫剂对二化螟线粒体ATPase活力的抑制作用[J]. 昆虫学报, 2006, 49(2): 254-259. LI Haiping, FENG Tao, TAO Lingmei, et al. Inhibition of ATPase activity in mitochondria of Chilo suppressalis by nine common insecticides [J]. Acta Entomologica Sinica, 2006, 49(2): 254-259. (in Chinese) |
| [19] | Li Haiping, Feng Tao, Liang Pei, et al. Effect of temperature on toxicity of pyrethroids and endosulfan, activity of mitochondrial Na+-K+-ATPase and Ca2+-Mg2+-ATPase in Chilo suppressalis(Walker)(Lepidoptera: Pyralidae)[J]. Pestic Biochem Physiol, 2006, 86(3): 151-156. |
| [20] | Luo Ma, Bodnary R P. The effect of insecticides on (Ca2+-Mg2+)-ATPase and the ATP dependent calcium pump in moth brain synaptosomes and synaptosome membrane vesicle from the bertha armyworm, Mamestra configurate WiK[J]. Pestic Biochem Physiol, 1988, 30(2): 155-165. |
| [21] | 何运转, 李梅, 何凤琴, 等. 拟除虫菊酯对家蝇Ca2+-ATPase和Ca2+-Mg2+-ATPase的抑制作用[J]. 昆虫学报, 2001, 44(3): 297-303. He Yunzhuan, Li Mei, He Fengqin, et al. Inhibition of pyrethroid insecticides on nerve Ca2+-ATPase, Ca2+-Mg2+-ATPase in house flies ( Musca domestica )[J]. Acta Entomologica Sinica, 2001, 44(3): 297-303. (in Chinese) |
| [22] | 赵玲, 赵莉, 肖宏伟, 等. 高效氯氟氰菊酯对意大利蝗的杀虫活性及对谷胱甘肽S-转移酶活性的影响[J]. 植物保护, 2014, 40(3): 130-132. ZHAO Ling, ZHAO Li, XIAO Hongwei, et al. Insecticidal activities of lambda-cyhalothrin(EC) to Calliptamus italicus and effects on glutathione S-transferases(GSTs)[J]. Plant Prot, 2014, 40(3): 130-132. (in Chinese) |
| [23] | 尹晓辉, 林荣华, 陶传江, 等. 溴氰菊酯对麦穗鱼谷胱甘肽S-转移酶(GSTs)的影响[J]. 农药学学报, 2005, 7(3): 249-253. YIN Xiaohui, LIN Ronghua, TAO Chuanjiang, et al. The effect of deltamethrin on specific activities of GSTs in Pseudorasbora parva[J]. Chin J Pestic Sci, 2005, 7(3): 249-253. (in Chinese) |
| [24] | 汤方, 李丽, 高希武. 植物次生物质和杀虫剂对分月扇舟蛾谷胱甘肽S-转移酶的抑制作用[J]. 应用昆虫学报, 2012, 49(6): 1513-1518. TANG Fang, LI Li, GAO Xiwu. Inhibition of glutathione S-transferase activity by insecticides and allelochemicals in Clostera anastomosis[J]. Chin J Appl Entomol, 2012, 49(6): 1513-1518. (in Chinese) |
 2015, Vol. 17
2015, Vol. 17


