烟草甲Lasioderma serricorne (Fabricius) 是最重要的烟草仓储害虫之一,危害各种仓储粮食、中草药、烟草等,尤其对卷烟生产会造成重大损失[1, 2, 3],目前生产上主要使用常规的化学药剂通过喷洒或熏蒸[1]、或采用温湿度调控进行防治[4, 5]。采用熏蒸等化学药剂进行防治会导致烟草甲抗药性增强[6],而采用温湿度调控法耗能大,同时会影响烟叶质量。采用化学信息素诱捕技术不仅不会导致靶标害虫的抗药性,也不会影响有益昆虫,有利于节约能源,保护环境,同时可避免仓储粮食被污染。国外从20世纪80年代开始对烟草甲化学信息素进行研究[7],有关烟草甲性信息素化学合成的报道很多[7, 8, 9, 10, 11, 12, 13];而国内有关化学信息素来源方面的报道主要集中在从植物中寻找具有驱避或杀虫活性的化合物方面[14, 15],有关性信息素化学合成的研究报道不多[16, 17],且成本也较高,化合物合成或纯化方法亟待改进。
4,6-二甲基-7-羟基-3-壬酮(Scheme 1,7)和2,6-二乙基-3,5-二甲基-3,4-二氢吡喃(Scheme 1,8)是烟草甲性信息素的两个主要组分,其质量比为4 :1[7]。其中组分8有4个立体异构体,异构体之间生物活性相近,但总体低于组分7,其合成方法较为简单,多是由4,6-二甲基-7-羟基-3-壬酮(7)经脱水环化得到[7, 8];组分7有8个立体异构体,其中(4R,6S,7S)、(4S,6S,7S)、(4R,6R,7R)和 (4S,6R,7R) 4种异构体的生物活性远高于(4R,6R,7S)、(4S,6R,7S)、(4R,6S,7R)和(4S,6S,7R)[18]。
目前有关组分7合成的报道较多[10, 11, 12, 13, 16, 17]。Mori等[10]采用手性源原料和手性助剂合成了(4S,6S,7S)-7及其异构体,但合成步骤冗长(超过20步),价格昂贵,实验周期长。Baker等[11]合成了(4RS,6S,7S)-7一组混旋体,但在实验中使用了对水敏感的硅醚和极易燃烧的硼烷,合成难度很大。Fujita等[12]采用手性源原料,经13步反应合成了(4S,6S,7S)-7,但收率低。 Lozanova等[13]合成了(4S,6RS,7RS)-74种构型的混旋体,虽然反应原料简单,反应易于操作,实验步骤少,但反应第1步收率只有38%,总收率仅为10%。古昆等[16] 合成了(4RS,6RS,7S)- 7 混旋体,但实验中使用了硅烷,且中间体为对水敏感的硅醚等,实验条件苛刻,成本过高。吴江等[17]以丙炔醇和脯氨酸为原料合成了(4S,6S,7S)- 7,虽然原料简单易得,但是合成步骤多(超过20步),总收率低于6%;且实验中多次使用对水敏感的有机金属试剂,不利于操作。因此,探索更为经济实用的合成路线具有重要的现实意义。
笔者以2,4-二甲基戊二酸为原料,经酯化和还原反应得到化合物2;再经氧化、与格氏试剂反应得到化合物4;化合物4经选择性保护分子中的一个羟基,及氧化和脱保护反应,合成了烟草甲性信息素组分之一7的混旋体;7经脱水环化反应得到了另一组分8 的外消旋体。合成路线见 Scheme 1。
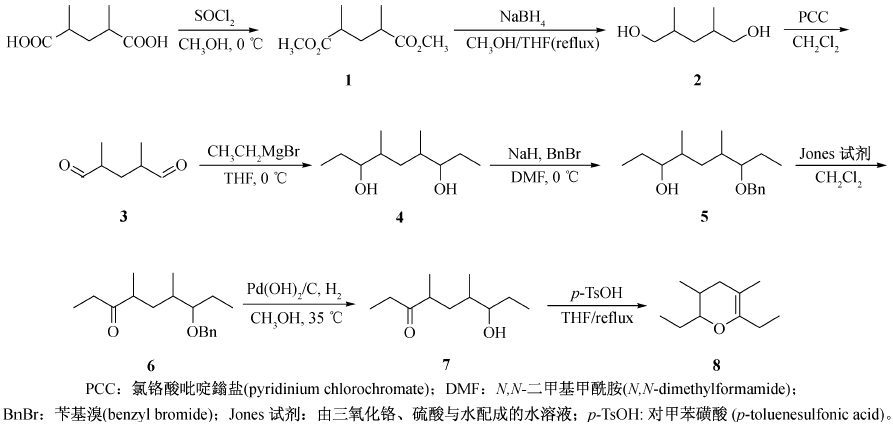 | Scheme 1 |
Bruker AV600型核磁共振仪(CDCl3为溶剂,TMS为内标)。Bruker AV500型核磁共振仪(CDCl3为溶剂,TMS为内标)。德国 Esquire HTC 液-质联用仪。 Agligent 6820 气相色谱仪,检测条件:HP-5(5%苯基聚硅氧烷)色谱柱(30 m×0.25 mm);氮气4 mL/min,氢气 35 mL/min,空气 350 mL/min;升温程序:初始温度60 ℃,保持1 min;第一阶段升温速率10 ℃/min,终温180 ℃,保持1 min;第二阶段升温速率10 ℃/min,终温250 ℃,保持10 min。
2,4-二甲基戊二酸(纯度98%),Acros试剂; PCC(氯铬酸吡啶鎓盐,纯度98.5%),北京安司莫森技术有限公司;硅胶H,青岛海洋化工厂;THF(四氢呋喃)和CH2Cl2(二氯甲烷)使用前经过无水处理。其余试剂均为分析纯。 1.2 化合物的合成及结构鉴定 1.2.1 2,4-二甲基-1,5-戊二酸二甲酯 (1) 的合成
参考文献[19]方法制备。以2,4-二甲基戊二酸为原料,通过酯化反应得到2,4-二甲基-1,5-戊二酸二甲酯,收率:96%,b.p. 113~115 ℃/664 Pa。 1.2.2 2,4-二甲基-1,5-戊二醇( 2 )的合成
参考文献[20]方法制备。在干燥的烧瓶中依次加入13.2 g化合物 1 (70 mmol)、干燥的四氢呋喃(250 mL)和11.0 g硼氢化钠(280 mmol),加热至60 ℃。在剧烈搅拌下,缓慢滴加无水甲醇(25 mL),滴加完毕后升至65 ℃,反应过夜。冷至室温,加入10%的氢氧化钠水溶液(100 mL),搅拌1 h。减压除去溶剂,用乙酸乙酯(500 mL)萃取,水相用乙酸乙酯(250 mL)再萃取2次,合并有机相,依次用饱和碳酸氢钠溶液(40 mL ×2)和饱和食盐水(40 mL× 2)洗涤,无水硫酸镁干燥。过滤,浓缩,经柱层析[洗脱剂V(石油醚) :V(乙酸乙酯)=1 :1]纯化得无色液体8.7 g,收率94%;b.p. 125~127 ℃/664 Pa(文献值[21]:收率75%;b.p. 165 ℃/133 Pa)。MS,m/z:155[M+Na]+。 1.2.3 2,4-二甲基-1,5-戊二醛(3)的合成
参考文献[22]方法制备。化合物 2 经氯铬酸吡啶鎓盐氧化得粗品化合物 3 ,直接用于下一步反应。 1.2.4 4,6-二甲基-3,7-壬二醇(4)的合成
参考文献[23]方法制备。在干燥的烧瓶中加入镁屑(7.2 g,0.30 mol)和乙醚(120 mL),在氩气保护下缓慢滴加溴乙烷(19.14 mL,0.25 mol)的乙醚(30 mL)溶液,控制滴加速度使反应液保持微沸。滴加完毕后,升温回流2 h,得溴乙烷格氏试剂。冷至室温备用。
将所得粗品 3 溶于乙醚(20 mL),在冰浴和氩气保护下缓慢滴加上述溴乙烷格氏试剂,搅拌至原料消失[TLC检测,展开剂V(石油醚) :V(乙酸乙酯)=1 :2]。将反应液倒入置于冰浴中的饱和氯化铵溶液中(200 mL),再加入乙醚(200 mL),搅拌至镁盐完全溶解。分液,有机相依次用蒸馏水和饱和食盐水洗涤,无水硫酸钠干燥。过滤,浓缩,柱层析[洗脱剂V(石油醚) :V(乙酸乙酯)=1 :1]纯化得无色液体(9.3 g)。两步收率86%。b.p. 159~161 ℃/664 Pa;1H NMR (600 MHz,CDCl3),δ :0.83~0.89 (m,12H),1.19~1.26 (m,2H),1.43~1.54 (m,4H),1.69~1.73 (m,2H),3.43~3.52 (m,2H);13C NMR (500 MHz,CDCl3),δ :7.05,7.13,14.82,15.36,27.58,28.11,33.38,33.65,35.29,36.53,75.93,76.22;MS,m/z:211[M+Na]+。 1.2.5 化合物5的合成
参考文献[24]方法制备。将化合物 4 经氢化钠处理后选择性保护一个羟基,制备得到化合物 5 ,产率90%(文献值[25]90%)。b.p. 180~182 ℃/664 Pa;1H NMR (500 MHz,CDCl3),δ :0.84~0.99 (m,12H),1.20~1.23 (m,2H),1.44~1.54 (m,6H),3.27~3.30 (m,2H),4.51 (s,2H),7.26~7.34 (m,5H);13C NMR (500 MHz,CDCl3),δ :7.38,7.52,14.54,15.15,19.55,28.00,28.45,31.95,35.58,37.01,73.13,75.23,76.23,127.42,127.86,128.29,128.88,129.14,138.70;MS,m/z:301[M+Na]+。 1.2.6 化合物6的合成
参考文献[26]方法制备。将化合物 5 (2.8 g,10 mmol) 溶于丙酮(100 mL),搅拌下滴加Jones试剂,当溶液变成红色时,暂停滴加,待重新出现绿色再继续滴加,如此反复直至溶液保持红棕色,指示反应结束(溶液底部有绿色固体产生)。过滤,浓缩,粗品经柱层析[洗脱剂V(石油醚) :V(乙酸乙酯)=100 :1]纯化得无色液体(2.6 g),产率95%(文献值[25]:收率80%)。 b.p. 168~170 ℃/664 Pa;1H NMR (500 MHz,CDCl3),δ :0.92~1.00 (m,12H),1.55~1.59 (m,4H),1.91~2.05 (m,3H),3.18~3.22 (m,1H),3.32~3.35 (m,1H),4.49 (s,2H),7.26~7.34 (m,5H);13C NMR (500 MHz,CDCl3),δ :9.39,10.48,12.14,13.58,17.45,22.12,22.71,29.76,31.16,35.27,36.52,67.46,79.02,80.70,148.08,148.69,161.02,202.22;MS,m/z:299[M+Na]+。 1.2.7 化合物7的合成 参考文献[27]方法制备。在圆底烧瓶中加入化合物 6 (1.4 g,5 mmol)、甲醇(100 mL)和10%氢氧化钯/碳(0.2 g),将烧瓶与氢气袋连接,用氢气和瓶内空气进行多次置换,将溶液升至35 ℃,在氢气氛围中搅拌。TLC检测[展开剂V(石油醚) :V(乙酸乙酯)=20 :1] 至反应完全后,过滤,浓缩,粗品经柱层析[洗脱剂V(石油醚) :V(乙酸乙酯)=4 :1]纯化得无色透明液体860 mg,收率92%(文献值[13]86%);b.p. 121~123 ℃/664 Pa;1H NMR (600 MHz,CDCl3),δ :0.85~1.29 (m,12H),1.49~1.60 (m,4H),1.75~1.81 (m,1H),2.47~2.52 (m,3H),3.25~3.34 (m,1H);13C NMR (500 MHz,CDCl3),δ :7.84,9.56,16.30,16.46,26.77,27.11,29.99,30.63,44.06,72.64,215.356,215.67;MS,m/z:209[M+Na]+。 1.2.8 化合物8的合成 参考文献[28]方法制备。在干燥的烧瓶中依次加入化合物 7 (365 mg,1.96 mmol)、干燥二氯甲烷(20 mL)、对甲苯磺酸(113 mg,0.59 mmol)和4A分子筛粉末(500 mg),加热回流至原料消失[TLC检测,展开剂V(石油醚) :V(乙酸乙酯)=5 :1]。减压浓缩,残余物溶于乙醚(50 mL),依次用饱和碳酸氢钠溶液(5 mL ×2)和饱和食盐水(5 mL× 2)洗涤,无水硫酸镁干燥。过滤,浓缩,粗品经柱层析纯化得无色透明液体283 mg,收率86%;b.p. 102~105 ℃ [文献值[13]:b.p.37~38 ℃/598 Pa;MS(m/z):168]。1H NMR (600 MHz,CDCl3),δ :0.85~0.87 (d, J=9.0 Hz,3H),0.94~0.97 (t,J=7.5 Hz,3H),1.00~1.02 (t,J=7.2 Hz,3H),1.52~1.57 (m,7H),3.17~3.22 (m,1H),1.91~1.92 (m,1H),2.08~2.09 (m,2H),3.54~3.59 (m,1H);13C NMR (500 MHz,CDCl3),δ :13.10,13.75,17.49,18.92,20.07,21.59,31.21,38.04,40.03,72.97,117.09,146.86;MS,m/z:191[M+Na]+。
2 结果与讨论
笔者以商品化的化工产品2,4-二甲基戊二酸为原料,通过一系列常规简单的合成步骤,分别以61%和52%的收率合成了两种烟草甲性信息素的混旋体。在化合物 1 的还原反应中,以硼氢化钠为还原剂、甲醇和四氢呋喃为溶液体系[19],以94%的高收率合成了二醇化合物 2 ,从而避免了使用对水敏感的氢化锂铝以及由此带来的繁琐的后处理过程。化合物 5 的合成中引入空间位阻较大的苄基作为保护基团[24],以90%的收率合成了单保护的化合物 5 ,使得双保护的副产物大大减少;若采用常规的二氢吡喃作为保护基团,则产率不足60%,而双保护副产物收率可达40%。化合物 5 的氧化采用Jones试剂代替常用的PCC(氯铬酸吡啶鎓盐),实验现象明显,后处理简便,收率高。化合物 8 的合成采用对甲苯磺酸代替浓硫酸作为催化剂,以分子筛为吸水剂,实验操作方便、安全。本研究所采用的合成路线合成步骤少,操作简便,单步反应及总收率高,实验中未使用硅烷或硅醚等对水高度敏感的原料,实验更安全。所合成的化合物 4 通过氧化可以得到二酮化合物,通过选择性还原可以得到具有手性的烟草甲性信息素化合物[16]。
| [1] | Ryan L. Post-harvest Tobacco Infestation Control[M]. London: Chapman & Hall, 1995. |
| [2] | 王方晓, 魏重生, 冯小明. 烟草甲的研究[J]. 中国烟草科学, 1998(2): 45-47. Wang Fangxiao, Wei Chongsheng, Feng Xiaoming. Study of cigarette beetle (Lasioderma serricorne(F.)) [J]. Chin Tobacco Sci, 1998(2): 45-47. (in Chinese) |
| [3] | Arbogast R T, Kendra P E, Mankin R W, et al. Insect infestation of a botanicals warehouse in north-central Florida[J]. J Stored Prod Res, 2002, 38(4): 349-363. |
| [4] | Imai T, Harada H. Low-temperature as an alternative to fumigation to disinfest stored tobacco of the cigarette beetle, Lasioderma serricorne(F.) (Coleoptera: Anobiidae) [J]. Appl Entomol Zoo, 2006, 41(1): 87-91. |
| [5] | 任广伟, 张连涛. 烟仓害虫的发生与防治[J]. 烟草科技, 2003(2): 45-47. Ren Guangwei, Zhang Liantao. Occurrence and control of pests during tobacco storage [J]. Tobacco Sci Technol, 2003(2): 45-47. (in Chinese) |
| [6] | Zettler J L, Keevr D W. Phosphine resistance in the cigarette beetle(Coleoptera: Anobiidae) associated with tobacco storage in the southeastern United States[J]. J Econ Entomol, 1994, 87(3): 546-550. |
| [7] | Levinson H Z, Levinson A R, Francke W, et al. The pheromone activity of anhydroserricornin and serricornin for male cigarette beetles (Lasioderma serricorne. F) [J]. Naturwissenschaften, 1981, 68(3): 148-149. |
| [8] | Mochizuki K, Mori M, Chuman T, et al. Reinvestigation of anhydroserricornin, (2S, 3S)-2, 6-diethyl-3, 5-dimethyl-3, 4-dihydro-2H-pyran, as a sex pheromone component for male cigarette beetle[J]. J Chem Ecol,1986, 12(1): 179-186. |
| [9] | Masuda Y, Fujita K, Mori K. Synthesis of (4R, 6S, 7R)-7-hydroxy-4, 6-dimethyl-3-nonanone and (3R, 5S, 6R)-6-hydroxy-3, 5-dimethyl-2-octanone, the pheromone components of the bostrychid beetle, Dinoderus bifoveolatus[J]. Biosci Biotechnol Biochem, 2003, 67(8): 1744-1750. |
| [10] | Mori M, Nomi H, Chuman T, et al. Synthesis and absolute stereochemistry of serricornin [(4S, 6S, 7S)-4, 6-dimethyl-7-hydroxy-3-nonanone)], the sex pheromone of cigarette beetle[J]. Tetrahedron, 1982, 38(24): 3705-3711. |
| [11] | Baker R, Delin J A. Synthesis of 4RS, 6S, 7S-serricornine and the corresponding pair of racemates[J]. J Chem Soc Chem Commun, 1983: 147-148. |
| [12] | Fujita K, Mori K. New synthesis of serricornin, the female sex pheromone of the cigarette beetle[J]. Biosci Biotechnol Biochem, 2001, 65(6): 1429-1433. |
| [13] | Lozanova A V, Stepanov A V, Veselovsky V V. Synthesis of a biologically active analog of the sex pheromone of cigarette beetle (Lasioderma serricorne (F.)) [J]. Russian Chem Bul, 2005, 54(5): 1254-1257. |
| [14] | Wang Ying, You Chunxue, Wang Chengfang, et al. Chemical constituents and insecticidal activities of the essential oil from Amomum tsaoko against two stored-product insects[J]. J Oleo Sci, 2014, 63(10): 1019-1026. |
| [15] | Yang Kai, You Chunxue, Wang Chengfang, et al. Composition and repellency of the essential oils of Evodia calcicola Chun ex Huang and Evodia trichotoma (Lour.) Pierre against three stored product Insects[J]. J Oleo Sci, 2014, 63(11): 1169-1176. |
| [16] | 古昆, 李鲜, 陈静波, 等. 烟草甲性信息素(7S)-(-)-4, 6-二甲基-7-羟基-3-壬酮的立体选择性合成[J]. 应用化学, 2001, 18(8): 662-663. Gu Kun, Li Xian, Chen Jingbo, et al. The stereoselective synthesis of tobacco beetle pheromone-(7S)-(-)-4, 6-dimethyl-7-hydroxyl-3-nonanone[J]. Chin J Appl Chem, 2001, 18(8): 662-663. (in Chinese) |
| [17] | 吴江, 匡晓帆. 烟草甲性信息素的合成[J]. 四川大学学报:自然科学版, 1999, 36(6): 1100-1105. Wu Jiang, Kuang Xiaofan. Synthesis of the sex pheromone of Lasioderma serricorne[J]. J Sichuan Univ:Nat Sci Ed, 1999, 36(6): 1100-1105. (in Chinese) |
| [18] | Chuman T, Mochizuki K, Mori M, et al. The pheromone activity of (±)-serricornins for male cigarette beetle (Lasioderma serricorne F.) [J]. Agric Biol Chem, 1982, 46(2): 593-595. |
| [19] | Bhaskar D, Hosangadi, Rajesh H D. An efficient general method for esterification of aromatic carboxylic acids[J]. Tetrahedron Lett, 1996, 37(26): 6375-6378. |
| [20] | Cho B T, Yoon N M. Convenient procedure for the reduction of carboxylic acids via acyloxyborohydrides[J]. Bull Korean Chem Soc, 1982, 3(4): 149-152. |
| [21] | Equi A M, Brown A M, Cooper A, et al. Oxidation of putrescine and cadaverine derivatives by diamine oxidases[J]. Tetrahedron, 1991, 47(3), 507-518. |
| [22] | Sharpless K B, Akashi K. Oxidation of alcohols to aldehydes by reagents derived from chromyl chloride[J]. J Am Chem Soc, 1975, 97(20): 5927-5928. |
| [23] | Kharasch M S, Reinmuth O. Grignard Reactions of Nonmetallic Substances[M]. New York: Prentice-Hall, Inc,1954. |
| [24] | Kuhn R, Löw I, Trischmann H. Die konstitution der lycotetraose[J]. Chem Ber, 1957, 90(2): 203-218. |
| [25] | Sabitha G, Srinivas C, Maruthi C, et al. Synthesis of (4R, 6S, 7R)-7-hydroxy-4, 6-dimethyl-3-nonanone and (3R, 5S, 6R)-6-hydroxy-3, 5-dimethyl-2-octanone[J]. Tetrahedron: Asymmetry, 2011, 22(24): 2071-2079. |
| [26] | Djerassi C, Hart P A, Warawa E J. Optical rotatory dispersion studies. LXXXIX. The oxtant rule and the t-butyl group. Synthesis of steroidal t-butyl ketones[J]. J Am Chem Soc, 1964, 86(1): 78-85. |
| [27] | Pearlman W M. Noble metal hydroxides on carbon nonpyrophoric dry catalysts[J]. Tetrahedron Lett, 1967, 8(17): 1663-1664. |
| [28] | Kodama M, Yokoo S, Matsuki Y, et al. Synthesis of macrocyclic terpenoids by intramolecular cyclization V. transannular reactions of hedycaryol isomers[J]. Tetrahedron Lett, 1979, 20(19): 1687-1690. |
 2015, Vol. 17
2015, Vol. 17


