2. 浙江省化工研究院, 国家南方农药创制中心浙江基地, 杭州 310023
2. Zhejiang Base of National Southern Pesticide Research Centre, Zhejiang Research Institute of Chemical Industry, Hangzhou 310023, China
嘧啶水杨酸类化合物是以嘧啶磺酰脲类化合物为先导经结构优化而得到的,属于ALS抑制剂[1]。目前此类化合物国外已成功开发的品种有:日本组合化学公司开发的嘧草硫醚(pyrithiobac-sodium,KIH2031)[2]、嘧草醚(pyriminobac-methyl,KIH-6127)[3, 4]和双草醚(bispyribac-sodium,KIH2023)[4];LG化学公司开发的嘧啶肟草醚(pyribenzoxim)[5, 6]和瑞士诺华公司开发的环酯草醚(pyriftalid)[7];中国科学院上海有机化学研究所和浙江省化工研究院开发的丙酯草醚和异丙酯草醚[8]也属于该类化合物。这类化合物通常是在植物体内降解为嘧啶氧基水杨酸(I)而发挥作用[2],为此,笔者设计合成了一类与(I) 具有类似结构的嘧啶联吡唑甲酰胺衍生物(II)。
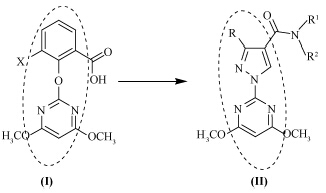
具体合成路线见 Scheme 1 。
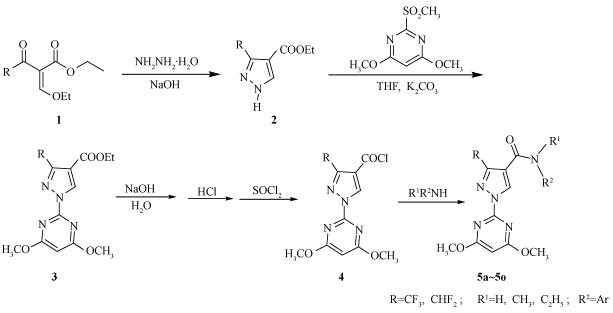 | Scheme 1 |
WRS-1A型数字熔点仪(温度未校正);Varian-400型核磁共振仪(以CDCl3或DMSO-d6为溶剂,以TMS为内标);LCQ-Advantage质谱仪(ESI-MS)。4,6-二甲氧基-2-甲磺酰基嘧啶(98%,阿拉丁试剂有限公司),其他试剂为市售化学纯或分析纯。 1.2 化合物的合成 1.2.1 3-氟代甲基-1H-吡唑-4-甲酸乙酯(2) 的合成
参考文献[9]的方法,以2-乙氧基亚甲基-4,4,4-三氟-3-氧-丁酸乙酯或2-乙氧基亚甲基-4,4-二氟-3-氧-丁酸乙酯为原料,通过环化反应,分别得到3-三氟甲基-1H-吡唑-4-甲酸乙酯(2a)和3-二氟甲基-1H-吡唑-4-甲酸乙酯2b),产率分别为70.1%和71.3%,m.p.分别为101 ~103 ℃(文献值[9]m.p. 98 ~99 ℃)和105 ~107 ℃(文献值[9]m.p. 110 ~111 ℃)。 1.2.2 中间体 1-(4,6-二甲氧基-嘧啶-2-)-3-三氟甲基-吡唑-4-甲酸乙酯(3a)的合成
将10.0 mmol 4,6-二甲氧基-2-甲砜基嘧啶、10.0 mmol 化合物 2 、15.0 mmol无水碳酸钾和20 mL四氢呋喃(THF)混合后回流10 h,冷却,过滤,滤液浓缩,脱溶后用10 mL 甲醇重结晶得白色固体,收率88.5%,m.p. 135 ~137 ℃。1H NMR(400 MHz,CDCl3),δ : 1.39(t,J=7.1 Hz,3H,-CH3),4.07(s,6H,-pyrimidyl 4,6-OCH3 ),4.38(q,J1=7.0 Hz,J2 =7.1 Hz,2H,-CH2),6.06(s,1H,-pyrimidyl 5-H),9.07(s,1H,-parazolyl 5-H)。
同法合成1-(4,6-二甲氧基-嘧啶-2-)-3-二氟甲基-吡唑-4-甲酸乙酯(3b),淡黄色固体,收率88.0%,m.p.138 ~140 ℃。1H NMR(400 MHz,CDCl3),δ :1.40(t,J=7.2 Hz,3H,-CH3),4.07(s,6H,-pyrimidyl 4,6-OCH3),4.38(q,J1=7.0 Hz,J2=7.1 Hz,2H,-CH2),6.05(s,1H,-pyrimidyl 5-H),7.10(t,J=52 Hz,1H,-CHF2),9.03(s,1H,-parazolyl 5-H)。 1.2.3 中间体 1-(4,6-二甲氧基-嘧啶-2-)-3-三氟甲基-吡唑-4-甲酰氯(4a)的合成
参照文献[10]的方法进行。将108.0 mmol氢氧化钠和40 mL水配成的碱液加入到含90 mmol化合物 3a 的50 mL乙醇溶液中,回流3 h后冷却,用10%稀盐酸酸化到pH=2,析出白色固体,水洗后晾干,得到中间体1-(4,6-二甲氧基-嘧啶-2-)-3-三氟甲基-吡唑-4-甲酸,收率90.2%,1H NMR(400 MHz,DMSO),δ :4.02(s,6H,-pyrimidyl 4,6-OCH3),6.38(s,1H,-pyrimidyl 5-H),9.17(s,1H,-parazolyl 5-H),13.38(b,1H,-carboxyl 1-H)。
将30.0 mmol 1-(4,6-二甲氧基-嘧啶-2-)-3-三氟甲基-吡唑-4-甲酸与20 mL二氯亚砜一起回流2 h,放出大量氯化氢气体后减压蒸出过量的二氯亚砜,得橙色油状物(4a),不经提纯直接用于后续反应。
同法合成中间体1-(4,6-二甲氧基-嘧啶-2-)-3-二氟甲基-吡唑-4-甲酰氯(4b)。 1.2.4 目标化合物5a ~5o合成通法
单口瓶中加入2.2 mmol三乙胺、10 mL THF和2.0 mmol取代苯胺,室温搅拌下滴入2.0 mmol化合物 4 与5.0 mL THF配成的溶液,室温下搅拌过夜。脱溶浓缩,薄层层析(TLC)分离[展开剂为V(乙酸乙酯) ∶V(石油醚)=1 ∶2],得到目标产物。 1.3 除草活性测定方法
参照《国家南方农药创制中心生测标准程序》[11]。 准确称取一定量的原药(精确至0.000 1 g),用含1%吐温-80乳化剂的DMF溶解配制成0.01 ~ 0.05 g/mL的母液,用蒸馏水稀释成所需浓度备用。以5%异丙酯草醚(pyribambenz isopropyl)乳油(浙江省化工研究院有限公司提供)为对照药剂,以喷施同等液量清水为空白对照。
温室盆栽法:供试靶标为芥菜Brassica juncea、稗草Echinochloa crusgalli、繁缕Stellaria media、早熟禾Poa annua、小藜Chenopodium album和棒头草Polypogon fugax。供试杂草种子采收于未使用除草剂的荒地,种子发芽率≥85%。取内径7.5 cm花盆,装复合土(V(菜园土) ∶V(育苗基质)=1 ∶2)至3/4处,直接播种上述6种杂草靶标种子20枚,覆土0.2 cm,采用自动喷雾塔按化合物有效成分150 g/hm2的剂量分别进行苗前土壤喷雾处理和苗后茎叶喷雾处理,喷雾面积0.097 m2,药液量10 mL,工作压力0.2 MPa,着液量40%。苗前土壤处理为种植杂草后即进行喷雾处理,苗后茎叶喷雾是待杂草长至2 ~3叶期时进行处理,重复4次。待杂草叶面药液晾干后移入温室(白天15 ℃±2 ℃,夜间5 ℃±3 ℃,自然光照)培养,50 d后按照十级目测法[12]调查化合物的除草活性,目测数据转换为处理杂草植株相对于空白对照的生物量抑制百分数。
2 结果与讨论 2.1 化合物的合成
目标化合物的理化性质、质谱和 1H NMR数据见表 1。
|
|
表 1 化合物5a ~5o的理化性质、质谱及1H NMR数据 Table 1 The physical and chemical data,MS and 1H NMR of the componds 5a-5o |
盆栽试验结果(表 2)表明:在有效成分150 g/hm2 剂量下采用苗后茎叶喷雾处理时,化合物5i对芥菜、繁缕和小藜3种阔叶杂草的抑制率达80%;化合物 5c、5i和5k对繁缕的抑制率达90%以上,总体而言,其活性明显大于对照药剂异丙酯草醚。在150 g/hm2剂量下,采用苗前土壤喷雾处理时,化合物 5b和5c 对繁缕的抑制率达100%,其活性与异丙酯草醚的活性相当。除表 2中所列化合物外,其余化合物的除草活性均小于20%。所有目标化合物对稗草、早熟禾和棒头草均无活性。
|
|
表 2 部分目标化合物的除草活性 Table 2 The herbcidal activities of compounds 5a-5o |
初步分析发现:R2为苄基时活性高于为苯基的化合物,如5a的活性高于5e;R2为苯基时,邻对位取代活性大于间位取代,如5c的活性高于5f;苗后处理,5i对3种阔叶杂草均表现出很好的活性。R2与目标化合物中N相连基团的邻对位多取代有助于活性和杀草谱的提高。
| [1] | Koo S S C, Ann S C, Lim J S, et al. Biological activity of the new herbicide LGC-40863{benzophenone O-[2, 6-bis[(4, 6-dimethoxy 2-pyrimidinyl)oxy]benzoyl]oxime}[J]. Pestic Sci, 1997, 51(2): 109-114. |
| [2] | Toyokawa Y, Kajiwara I. Pyrimidine derivatives, processes for their production, and herbicidal method and composition: EP 315889[P]. 1989-05-17. |
| [3] | Kawamuru N. 6-[1-(N-Alkoxyimino)ethyl] salicylic acid derivatives and its production: JP 4368361[P]. 1992-12-21. |
| [4] | Toyokawa Y, WADA N. Pyrimidine derivatives, processes for their production, and herbicidal method and composition: .EP 321846[P] 1989-06-28. |
| [5] | Lim Y H, Rim J S. Pyrimidine derivatives, processes for their preparation and their use as herbicide: EP 658549[P]. 1995-06-21. |
| [6] | 李海屏. 20世纪80年代以来世界除草剂新品种开发进展及特点[J]. 农药科学与管理, 2004, 25(4): 26-39. Li Haiping. Developing progress and characteristics of herbicides novel varieties in the world from the 1980s [J]. Pestic Sci Admin, 2004, 25(4): 26-39.(in Chinese) |
| [7] | Allard J I, Hudetz M. Synergistic herbicidal composition and method for weed control: EP 768034[P]. 1997-04-06. |
| [8] | Lü Long, Wu Jun, Chen Jie, et al. New 2-pyrimidinyloxy-N-aryl-benzylamine derivatives their processes and uses: WO 0234724[P]. 2003-07-16. |
| [9] | Arunasal M, Velauth C, Cumaran H, et al. Process for the production of pyrazoles: EP 1997808[P]. 2008-03-12. |
| [10] | Walter H, Stierli D, et al. Novel microbiocides: WO 2009024342[P]. 2009-02-26. |
| [11] | 胡伟群, 朱卫刚, 陈定花, 等. 甲氧基丙稀酸酯类新化合物ZJ1621的生物活性[J]. 农药学学报, 2007, 9(3): 240-244. Hu Weiqun, Zhu Weigang, Chen Dinghua, et al. Biological activity of novel strobilurin compound ZJ1621[J]. Chin J Pestic Sci, 2007, 9(3): 240-244.(in Chinese) |
| [12] | Schnick P J, Stewark-wade S, Boland G J. 2,4-D and Scherotinia minor to control common dandelion[J]. Weed Sci, 2002, 50:173-178. |
 2015, Vol. 17
2015, Vol. 17