2. 西北农林科技大学 旱区作物逆境生物学国家重点实验室, 陕西 杨凌 712100;
3. 西北农林科技大学 植物保护学院, 陕西 杨凌 712100
2. State Key Laboratory of Crop Stress Biology for Arid Areas, Northwest A & F University, Yangling 712100, Shaanxi Province, China;
3. College of Plant Protection, Northwest A& F University, Yangling 712100, Shaanxi Province, China
由禾顶囊壳小麦变种 Gaeumannomyces graminis var. tritici(简称Ggt)引起的小麦全蚀病是小麦生产上的毁灭性病害之一,对农业生产造成严重损失。由于缺乏抗性品种和对环境友好的化学药剂,因此,生物防治成为防治小麦全蚀病的主要措施之一[1]。植物内生细菌是一类普遍分布于健康植物组织或细胞间隙、多样性丰富的微生物类群[2]。目前,已经从不同种类的植物中分离得到包括54个属129种内生细菌,其中芽孢杆菌最为常见[3]。植物内生芽孢杆菌由于其具有对人畜低毒、对环境低污染的特性,是较为理想的生防资源,已成为生防菌剂开发的热点。枯草芽孢杆菌 Bacillus subtilis 是一类广泛分布的好氧性革兰氏阳性杆状细菌[4],通过竞争、拮抗和诱导植物抗性来起到生物防治的作用[5]。枯草芽孢杆菌能够产生两大类抗菌物质:一是核糖体合成的抗菌蛋白和抗菌肽;二是非核糖体合成的脂肽类化合物[6,7,8,9,10],主要包括surfactin[11,12]、fengycin[13,14]和iturin[12, 15] 3大类。脂肽类化合物一般是由1个 β -羟基脂肪酸与7~10个氨基酸肽链通过内酯键形成环状结构[6]。surfactin除具有表面活性外,还具有抑制细菌、病毒和支原体的作用,fengycin对丝状真菌有强烈的抑制作用,iturin主要抑制真菌生长[16]。
生防细菌E1R-j是从小麦根部分离到的一株内生枯草芽孢杆菌[17],具有良好的植物病害生防效果,其菌悬液可以使小麦全蚀病在温室和田间的发病率分别降低70.7%和55.3%[18],其去菌发酵滤液除了对小麦条锈菌夏孢子萌发的抑制率高达84.1%[19]外,还对萝卜、白菜幼苗具有明显的促进生长作用[20]。此外,有研究表明,E1R-j不仅能够产生抗菌蛋白,还有部分小分子物质也具有很高的抑菌活性,推测其可能为脂肽类化合物[21]。为了进一步明确该菌株产生的抗菌物质的种类及作用机理,笔者对其抑菌活性物质进行了分离、纯化及结构分析,并利用扫描电镜技术研究了其对小麦全蚀病菌菌丝的影响。
1 材料和方法 1.1 供试菌株及培养枯草芽孢杆菌菌株E1R-j,由西北农林科技大学旱区作物逆境生物学国家重点实验室分离所得,具体培养方法为:接种一环菌株E1R-j于100 mL的LB液体培养基中,28 ℃、180 r/min下培养12 h,种子液按体积分数为3.0%的接种量接入50 mL Landy培养基(葡萄糖20.0 g,L-谷氨酸钠5.0 g,MgSO4 0.5 g,KCl 0.5 g,KH2PO4 1.0 g,CuSO4 0.16×10-3 g,FeSO4 0.15×10-3 g,MnSO4 5.0×10-3 g,H2O 1 000 mL) 28 ℃,180 r/min培养72 h。
小麦全蚀病菌Gaeumannomyces graminis var. tritici、苹果树腐烂病菌Valsa mali、番茄灰霉病菌Botrytis cinerea、番茄早疫病菌Alternaria solani、苹果炭疽病菌Glomerella cingulata,均由西北农林科技大学旱区作物逆境生物学国家重点实验室保存,病菌按常规方法在PDA平板培养基上繁殖、保存备用。
1.2 脂肽类化合物的提取和分离采用酸沉淀法进行提取。将上述发酵液于4 ℃、1×104 r/min下离心30 min后,去除菌体,收集发酵上清液,用6 mol/L的盐酸调节pH至2.0,在 4 ℃下静置24 h后于1×104 r/min离心20 min,收集沉淀,冷冻干燥后用甲醇多次抽提,合并抽提液作为粗提液备用。
采用快速蛋白液相色谱(FPLC)梯度洗脱进行分离[16]。利用AKTA Purifier 10液相分析系统,选择RESOURCETMRPC反相色谱柱(30 mm×6.4 mm,15 μ m)。流动相A为含体积分数为0.1% 三氟乙酸(TFA)的水溶液;流动相B为含0.09% TFA的乙腈溶液。流速为1 mL/min;检测波长为 215 nm;洗脱过程为40 min内流动相B的体积分数由10%增加到60%。分别收集各保留时间所对应的组分,置于超净台中室温下吹干,分别用1 mL甲醇溶解,备用。
1.3 抑菌活性测定采用牛津杯法[22]测定。将靶标真菌小麦全蚀菌从试管中转接到新鲜的PDA平板中央,于25 ℃恒温培养箱中培养3 d后,沿菌丝边缘打取直径为5 mm 的菌饼,转接到新鲜的PDA平板上(距培养皿中心25 mm的两侧)。于25 ℃培养1 d后,在接有靶标菌的平板中央放置灭菌牛津杯,分别加入200 μ L 1.2节收集到的不同组分和甲醇粗提液,25 ℃ 下培养3 d后测量抑菌圈的直径,计算平均抑菌带宽。以甲醇作对照,每个处理重复3次。
1.4 抗菌活性组分的初步鉴定采用基质辅助激光解吸附飞行时间质谱(MALDI-TOF/TOF-MS)对收集到的活性组分样品进行分析,初步鉴定其成分(由上海中科公司代为测定)。
1.5 热稳定性测定方法取纯化后的各抑菌活性组分(50 μ L),分别在25、40、60、80和100 ℃水浴中处理30 min和121 ℃下高压处理30 min,按照1.3节的方法进行抑菌活性测定。
1.6 抗菌活性组分的抑菌作用研究 1.6.1 抗菌活性组分对小麦全蚀病菌菌丝生长的影响采用平板对峙培养法[18] 测定。取小麦全蚀病菌菌饼(直径5 mm)置于PDA平板中央,将纯化后的抗菌活性组分接种于距离平板中央25 mm处。每处理重复3皿。以不接种活性组分的处理为对照。25 ℃培养3 d后,分别于正常和被抑制菌丝的边缘取样(10 mm ×10 mm),参照康振生[23]的方法进行扫描样品加工,在扫描电镜下观察菌丝特征。
1.6.2 抗菌活性组分对其他植物病原真菌的抑制作用按照1.3节牛津杯法分别以番茄早疫病菌、苹果炭疽病菌、番茄灰霉病菌和苹果树腐烂病菌作为靶标菌,测定抗菌活性组分的抑菌作用。
2 结果与分析 2.1 脂肽类化合物的分离FPLC 层析分析结果(图 1)表明:在E1R-j菌株产生的甲醇粗提物中至少有4类组分,即P1、P2、P3和P4,并且每类组分都不是单一的峰,表明这4类组分均不是单一物质。这也符合B. subtilis产生的脂肽类物质通常有很多结构相似的同系物或异构体,因此很难分离得到单一的某类脂肽物质的特性[16]。
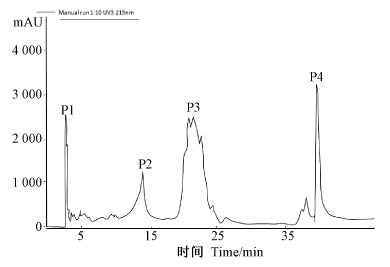 | 图 1 枯草芽孢杆菌菌株E1R-j脂肽类化合物的FPLC洗脱峰 Fig. 1 FPLC elution curve of lipopeptides produced by Bacillus subtilis strain E1R-j |
通过对所分离的4类组分进行抑菌活性追踪,发现不同组分对小麦全蚀病菌抑菌作用不同,其中P3抑制效果最好,平均抑菌带宽为32.51 mm,P1次之,平均抑菌带宽为29.53 mm,P2和 P4仅有微弱的抑制作用(图 2)。说明其主要抑菌活性成分为P3。
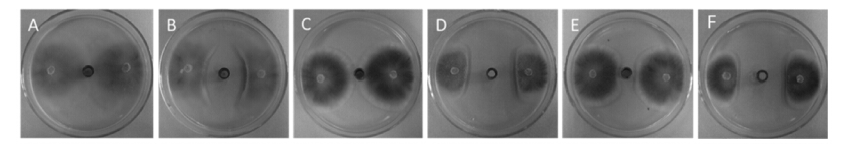 | A:对照(control);B: P1; C: P2; D: P3; E: P4; F:脂肽粗提物(lipopeptide exract)。 图 2 枯草芽孢杆菌菌株E1R-j所产脂肽对小麦全蚀病菌的抑制作用 Fig. 2 Antifungal activity of lipopeptides produced by B.subtilis strain E1R-j to Gaeumannomyces graminis var. triticvi |
采用MALDI-TOF/TOF-MS对抑菌活性较好的P1和P3组分进行分析:P1由于成分复杂而未能成功鉴定;而P3的一级质谱显示为组分1([M+H]+ 1 477.846、1 491.898、1 505.960)和组分2([M+H]+ 1 513.964、1 527.992)的两组同系物(图 3A)。其中组分1的相对分子质量依次相差14,即恰好一个CH2,推测其属脂肪酸链上差一个亚甲基或是肽链6位上Ala被Vla代替所导致,该物质与已报道的脂肽类化合物fengycins的相对分子质量一致[24]。fengycins是枯草芽孢杆菌脂肽中重要的一类物质,具有强烈抑制真菌的作用。一般由一条 β -羟基脂肪酸链和10个氨基酸残基的小肽组成,分为fengycins A和fengycins B两种类型,当肽链第6位上的氨基酸是Ala时,属于fengycins A,而当肽链第6位上的氨基酸是Val时则属于fengycins B[25]。 目前,关于fengycins化合物的鉴定主要是依据其质谱分子峰及特征离子峰[25]。进一步用MALDI-TOF/TOF-MS分析本研究得到的上述具有5种 相对分子质量的肽片段,分别获得了相应肽片段的MS/MS图:[M+H]+为1 477.846组分,其特征离子峰为966和1 080(图 3B),这与fengycins A的特征离子峰一致[25];[M+H]+分别为1 491.898和1 505.960 的组分,其特征离子峰分别为994和 1 108 (图 3C和3D),这与fengycins B的特征峰一致[25]。
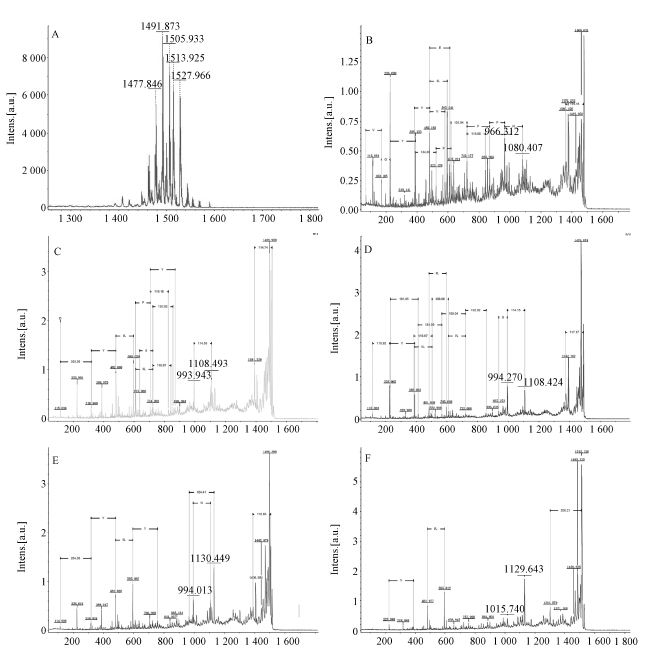 | A: P3的一级质谱图; B,C,D,E,F: 分别是1 477.846,1 491.898,1 505.960,1 513.964和1 527.992的二级质谱图。 A: MALDI-TOF spectrum of P3; B,C,D,E,F: MALDI-TOF/TOF spectrum of procures ions of 1 477.846, 图 3 枯草芽孢杆菌菌株E1R-j脂肽类化合物P3的MALDI-TOF/TOF-MS分析 Fig. 3 MALDI-TOF/TOF mass spectrum of lipopeptides P3 produced by B. subtilis strain E1R-j |
组分2([M+H]+ 分别为1 513.964和1 527.992)的相对分子质量同样相差14,其特征离子峰为1 130(图 3E和3F)。这类化合物与张晓云等[26]在萎缩芽孢杆菌CAB-1中鉴定到的[M+H]+分别为1 500.041、1 513.839和1 527.566的化合物相似,推断其应该为一类新的化合物,其结构尚待确认。
2.4 活性组分P3的热稳定性活性组分P3在25、40、60、80和100 ℃水浴中处理30 min以及121 ℃ 高压灭菌处理30 min后,其抑菌活性均未明显下降(图 4),说明其具有热稳定性。
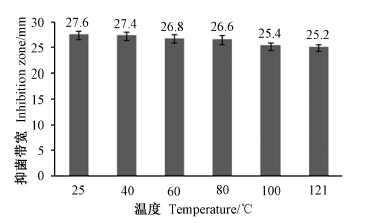 | 图 4 脂肽类化合物P3经不同温度处理后对小麦全蚀菌的抑制效果 Fig. 4 The inhibitory effect of P3 on the wheat take-all disease after being-treated by different temperature |
电子显微镜观察结果(图 5)显示:正常的小麦全蚀病菌菌丝纤细直长,粗细均匀一致,表面光滑;而经P3处理后,菌丝生长明显受到抑制,表现为菌丝分枝增多,且不规则弯曲,菌丝细胞膨大、细胞壁溃解,使得细胞质外溢,进而丧失活力。
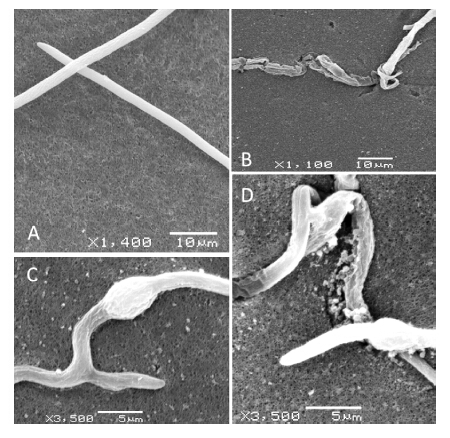 | A: 正常菌丝; B: 菌丝断裂; C: 菌丝膨大,表面粗糙; D: 细胞质外渗。 A: Hypha of Ggt untreated; B: Mycelium break; C: Swollen hyphal and rough mycelium surface; D: Cytoplasm exosmosis of hyphae. 图 5 P3对小麦全蚀病菌菌丝形态的影响 Fig. 5 Effects of P3 on the hypha morphology of G.graminis |
测定结果(图 6)表明: P3组分对供试4种病原真菌的抑制效果不同,其中对番茄早疫病菌的作用最强,平均抑菌带宽达25.20 mm,对番茄灰霉病菌和苹果树腐烂病菌次之,平均抑菌带宽分别为19.08 mm和17.28 mm,对苹果炭疽病菌则没有明显的抑制作用。
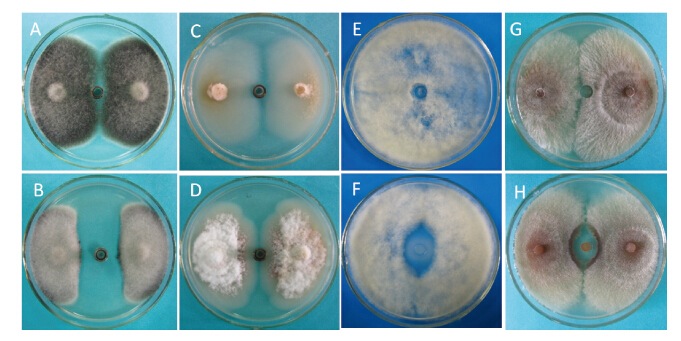 |
A:未处理的番茄早疫病菌;B: P3处理的番茄早疫病菌;C: 未处理的苹果炭疽病菌;D: P3处理的苹果炭疽病菌;
E: 未处理的番茄灰霉病菌;F: P3处理的番茄灰霉病菌; G: 未处理的苹果树腐烂病菌; H: P3处理的苹果树腐烂病菌。 A: Untreated Alternaria solani; B: A.solani treated with P3; C: Untreated Glomerella cingulata; D: G. cingulata treated with P3;E: Untreated Botrytis cinerea; F: B. cinerea treated with P3; G: Untreated Valsa mali; H: V.mali treated with P3. 图 6 枯草芽孢杆菌菌株 E1R-j产生的脂肽类化合物P3对4种靶标菌的抑制作用 Fig. 6 The antifungal activity of lipopeptide P3 produced by B. subtilis strain E1R-j to four target microbes |
通过盐酸沉淀、甲醇萃取及反向高效液相色谱等技术,从枯草芽孢杆菌B.subtilis E1R-j菌株的发酵上清液中分离到了具有抗菌活性的脂肽类化合物P3,并研究了其对小麦全蚀病菌及其他4种供试病原菌的抑菌活性。质谱分析发现,活性组分P3可分为两组:组分1分别是含有17个碳原子的fengycins A、含有16个碳原子的fengycins B和含有17个碳原子的fengycins B。可见,fengycins B是这组fengycins同系物中的主要类型。组分2的二级质谱特征峰为1 130,目前尚未见相似报道,具体的分子结构有待进一步确定,有望发现新的脂肽化合物同系物的结构。
有研究表明,fengycins对丝状真菌有明显的抑菌效果,其抑菌机制主要有两种[27]:在低浓度时,通过在生物膜中形成孔道,从而导致膜的通透性改变而发挥作用;在高浓度时,通过去污剂的作用方式破坏生物膜的结构,丧失半透性的作用,使细胞内的重要代谢物质外渗。本研究结果表明,枯草芽孢杆菌E1R-j菌株发酵液中产生的抗菌活性物质对小麦全蚀病菌的菌丝生长发育的影响,主要表现为菌丝畸形和细胞质外渗等,这与已有的对芽孢杆菌所产生的脂肽类物质的对植物病原真菌菌丝生长抑制的报道一致[13];此外,P3对高温的耐受性很好,这也与之前报道的有关fengycins家族的理化特性相一致[28]。
目前,有关枯草芽孢杆菌产生脂肽类化合物的报道很多,一般具有抗真菌和抗细菌、抗病毒、抗支原体、抗昆虫活性以及表面活性剂的特性,其抗菌谱广,稳定性高,对热不敏感[28]。张翼等[29]研究表明,内生枯草芽孢杆菌YS45对油菜菌核病菌的主要抑菌活性物质为fengycins同系物;曹小红等[30]发现,纳豆芽孢杆菌Bacillus natto TK-1发酵产生的脂肽类化合物具有较为广泛的抑菌谱,对灰霉以及镰胞霉的抑菌效果尤为明显;黄现青等[31]对枯草芽孢杆菌fmbj菌株发酵产生的脂肽类化合物进行了抗菌谱分析,发现其对革兰氏阳性菌、革兰氏阴性菌及真菌均有不同程度的抑制效果。然而,有关利用植物内生细菌发酵产生的脂肽类物质防治小麦全蚀病菌的研究较少。本研究发现,枯草芽孢杆菌B. subtilis E1R-j菌株产生的脂肽类物质对小麦全蚀病菌、苹果树腐烂病菌、番茄灰霉病菌和番茄早疫病菌均有一定的抑制作用,尤其对小麦全蚀病菌和番茄早疫病菌有很高的抑制作用,显示了其在植物疾病防治方面的应用潜力。
| [1] | Cook R J. Take-all of wheat[J]. Physiolog Molec Plant Pathol, 2003, 62(2): 73-86. |
| [2] | Ryan R P, Germaine K, Franks A, et al. Bacterial endophytes: recent developments andapplications [J]. FEMS Microbiol Lett, 2008, 278(1): 1-9. |
| [3] | 石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展 [J]. 生态学报, 2006, 26(7): 2395-2401. Shi Jingying, Chen Weixin, Liu Aiyuan. Advances in the study of endophytes and their effects on control of plant diseases[J]. Acta Ecologica Sinica, 2006, 26(7): 2395-2401. (in Chinese) |
| [4] | 刘雪. 枯草芽孢杆菌B-332菌株发酵条件及其抗菌物质分离纯化的研究[D]. 北京: 中国农业科学院, 2007. Liu Xue. Research onthe ferrentation mediaof Bacillus Subtilis and the purification of its antifungal substances[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007. (in Chinese) |
| [5] | 陈中义, 张杰, 黄大昉. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J]. 植物病理学报, 2003, 33(2): 97-103. Chen Zhongyi, Zhang Jie, Huang Dafang. Research progress on antimicrobial mechanism and genetic engineering of Bacillus for plant diseases biocontrol [J]. Acta Phytopathol Sinicia, 2003, 33(2): 97-103. (in Chinese) |
| [6] | Ongena M, Jacques P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol [J]. Trends Microbiol, 2008, 16(3): 115-125. |
| [7] | Zhao Xin, Zhou Zhijiang, Han Ye, et al. Isolation and identification of antifungal peptides from Bacillus BH072, a novel bacterium isolated from honey [J]. Microbiol Res, 2013, 168(9): 598-606. |
| [8] | 黄曦, 许兰兰, 黄荣韶, 等. 枯草芽孢杆菌在抑制植物病原菌中的研究进展 [J]. 生物技术通报, 2010(1): 24-29. Huang Xi, Xu Lanlan, Huang Rongshao, et al. Research advance in controlling plant diseases by Bacillus subtilis[J]. Biotechnol Bull, 2010(1): 24-29. (in Chinese) |
| [9] | Falardeau J, Wise C, Novitsky L, et al. Ecological and mechanistic insights into the direct and indirect antimicrobial properties of Bacillus subtilis lipopeptides on plant pathogens [J]. J Chem Ecol, 2013, 39(7): 869-878. |
| [10] | Jacques P. Surfactin and Other Lipopeptides from Bacillus spp. [M]//Soberón-Chávez G. Biosurfactants. Berlin, Heidelberg: Springer, 2011: 57-91. |
| [11] | 别小妹, 陆兆新, 吕凤霞, 等. Bacillus subtilis fmbR 抗菌物质的分离和鉴定 [J]. 中国农业科学, 2006, 39(11): 2327-2334. Bie Xiaomei, Lu Zhaoxin, Lü Fengxia, et al. Isolation and identification of the antimicrobial substance produced by Bacillus subtilis fmbR[J]. Scientia Agricultura Sinica, 2006, 39(11): 2327-2334. (in Chinese) |
| [12] | Ahimou F, Jacques P, Deleu M. Surfactin and iturin A effects on Bacillus subtilis surface hydrophobicity [J]. Enzyme Microb Technol, 2000, 27(10): 749-754. |
| [13] | Vanittanakom N, Loeffler W, Koch U, et al. Fengycin-a novel antifungal lipopeptide antibiotic produced by Bacillus subtilis F-29-3 [J]. J Antibiot, 1986, 39(7): 888-901. |
| [14] | Liu J, Zhou T, He D, et al. Functions of lipopeptides bacillomycin D and fengycin in antagonism of Bacillus amyloliquefaciens C06 towards Monilinia fructicola [J]. J Molec Microbiol Biotechnol, 2011, 20(1): 43-52. |
| [15] | Yu G Y, Sinclair J B, Hartman G L, et al. Production of iturin A by Bacillus amyloliquefaciens suppressing Rhizoctonia solani [J]. Soil Biol Biochem, 2002, 34(7): 955-963. |
| [16] | 李宝庆, 鹿秀云, 郭庆港, 等. 枯草芽孢杆菌 BAB-1 产脂肽类及挥发性物质的分离和鉴定 [J]. 中国农业科学, 2010, 43(17): 3547-3554. Li Baoqing, Lu Xiuyun, Guo Qinggang, et al. Isolation and identification of lipopeptides and volatile compounds produced by Bacillus subtilis strain BAB-1 [J]. Scientia Agricultura Sinica, 2010, 43(17): 3547-3554. (in Chinese) |
| [17] | 宫宇飞, 乔红萍, 魏国荣, 等. 内生枯草芽孢杆菌 E1R-J 发酵条件的优化 [J]. 西北农业学报, 2008, 17(1): 61-64. Gong Yufei, Qiao Hongping, Wei Guorong, et al. Optimizing of fermentation conditions of endophytic bacteria E1R-J [J]. Acta Agricultura Boreali-Occident Sinica, 2008, 17(1): 61-64. (in Chinese) |
| [18] | Liu Bing, Qiao Hongping, Huang Lili, et al. Biological control of take-all in wheat by endophytic Bacillus subtilis E1R-j and potential mode of action [J]. Biol Contr, 2009, 49(3): 277-285. |
| [19] | Li Hui, Zhao Jie, Feng Hao, et al. Biological control of wheat stripe rust by an endophytic Bacillus subtilis strain E1R-j in greenhouse and field trials [J]. Crop Prot, 2013, 43: 201-206. |
| [20] | 王心选, 高小宁, 郑刚, 等. 内生枯草芽孢杆菌 E1R-J 对萝卜、白菜促生作用 [J]. 西北农业学报, 2009, 18(6): 231-236. Wang Xinxuan, Gao Xiaoning, Zheng Gang, et al. The growth-promoting effect of endophytic bacteria E1R-J on radish and cabbage [J]. Acta Agricultura Boreali-Occident Sinica, 2009, 18(6): 231-236. (in Chinese) |
| [21] | 黄保全, 黄丽丽, 康振生, 等. 小麦内生枯草芽孢杆菌 E1R-j 胞外抗菌蛋白的分离纯化和性质 [J]. 西北农业学报, 2009, 18(6): 285-290. Huang Baoquan, Huang Lili, Kang Zhensheng, et al. Purification and characterization of an extracellular antifungal proteinfrom wheat endophytic Bacillus subilis strain E1R-j [J]. Acta Agricultura Boreali-Occident Sinica, 2009, 18(6): 285-290. (in Chinese) |
| [22] | 高小宁, 陈金艳, 黄丽丽, 等. 油菜菌核病内生拮抗细菌的筛选及防病作用研究 [J]. 农药学学报, 2010, 12(2): 161-167. Gao Xiaoning, Chen Jinyan, Huang Lili, et al. Screening of antagonistic endophyhic bacteria and their roles in control of Sclerotinia sclerotiorum in canola [J]. Chin J Pestic Sci, 2010, 12(2): 161-167. (in Chinese) |
| [23] | 康振生. 植物病原真菌的超微结构 [M]. 北京: 中国科学技术出版社, 1996. Kang Zhensheng. Ultra Structure of Plant Pathogenic Fungi [M]. Beijing: China Science and Technology Press, 1996. (in Chinese) |
| [24] | Vater J, Kablitz B, Wilde C, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry of lipopeptide biosurfactants in whole cells and culture filtrates of Bacillus subtilis C-1 isolated from petroleum sludge [J]. Appl Environ Microbiol, 2002, 68(12): 6210-6219. |
| [25] | Wang J, Liu J, Wang X, et al. Application of electrospray ionization mass spectrometry in rapid typing of fengycin homologues produced by Bacillus subtilis [J]. Lett Appl Microbiol, 2004, 39(1): 98-102. |
| [26] | Zhang Xiaoyun, Li Baoqing, Wang Ye, et al. Lipopeptides, a novel protein, and volatile compounds contribute to the antifungal activity of the biocontrol agent Bacillus atrophaeus CAB-1 [J]. Appl Microbiol Biotechnol, 2013, 97(21): 9525-9534. |
| [27] | Deleu M, Paquot M, Nylander T. Fengycin interaction with lipid monolayers at the air-aqueous interface-implications for the effect of fengycin on biological membranes [J]. J Coll Interf Sci, 2005, 283(2): 358-365. |
| [28] | Sun Lijun, Lu Zhaoxin, Bie Xiaomei, et al. Isolation and characterization of a co-producer of fengycins and surfactins, endophytic Bacillus amyloliquefaciens ES-2, from Scutellaria baicalensis Georgi [J]. World J Microbiol Biotechnol, 2006, 22(12): 1259-1266. |
| [29] | 张翼, 白晨, 冉国华, 等. 柑橘内生细菌YS45的鉴定抗菌物质分析及其对油菜菌核病的防治作用[J]. 植物病理学报, 2009, 39(6): 638-645. Zhang Yi, Bai Chen, Ran Guohua, et al. Characterization of endophytic bacterial strain YS 45 from the citrus xylem and its biocontrol activity against Sclerotinia stem rot of rapeseed[J]. Acta Phytopathologica Sinica, 2009, 39(6): 638-645. (in Chinese) |
| [30] | 曹小红, 蔡萍, 李凡, 等. 利用响应面法优化Bacillus natto TK-1 产脂肽发酵培养基 [J]. 中国生物工程杂志, 2007, 27(4): 59-65. Cao Xiaohong, Cai Ping, Li Fan, et al. Medium optimization for lipopeptide produced by Bacillus natto TK-1 using response surface methodology [J]. China Biotechnol, 2007, 27(4): 59-65. (in Chinese) |
| [31] | 黄现青, 别小妹, 吕凤霞, 等. 枯草芽孢杆菌 fmbJ 产脂肽抑制点青霉效果及其桃防腐试验 [J]. 农业工程学报, 2008, 24(1): 263-267. Huang Xianqing, Bie Xiaomei, Lü Fengxia, et al. Inhibitory effect of lipopeptides from Bacillus Subtilis fmbJ on Penicillium notatum and its antisepsis to peach[J]. Trans CSAE, 2008, 24(1): 263-267. (in Chinese) |
 2015, Vol. 17
2015, Vol. 17


