片剂在我国农药领域应用还不是十分普遍,生物农药的片剂类型就更为少见。目前市场上的农药片剂主要有泡腾片剂、水分散片剂、熏蒸片剂和烟雾片剂等[1]。片剂一般由原药、填料、吸附剂、粘合剂、助流剂、润滑剂、崩解剂、颜料等组成,其特点是计量准确,使用时不需称量,操作方便,产品理化性质稳定[2],且能够避免和改善常规农药加工中存在的加工工艺复杂、安全性低、对生产设备要求高等不足。目前已商品化的农药片剂有西玛津 (simazine)、禾草丹(thiobencarb)、利谷隆(linuron)、达草灭(norflurazon)等除草剂的泡腾片,百菌清(chlorothalonil)、噻菌灵(thiabendazole)、甲基硫菌灵(thiophanate-methyl)等杀菌剂的泡腾片,异丙威(isoprocarb)、马拉硫磷(malathion)等杀虫剂的泡腾片,磷化铝等熏蒸片剂及氯氰菊酯(cypermethrin)等烟雾片剂[1],以及 25% ~50%氟吗啉(flumorph)水分散片剂[3]等。
根结线虫病由根结线虫引起,其中最主要的是南方根结线虫Meloidogyne incognita[4]。该病害始于植株根部,可引起根结,影响植株正常生长并导致产量损失,甚至绝产。近年来,根结线虫病在设施蔬菜生产中发生越来越严重。目前对根结线虫生物防治方法的研究已越来越受到人们的重视,有关利用生防微生物及生物农药防治根结线虫的研究报道较多,包括穿刺芽孢杆菌[5]、食线虫真菌[6]、链霉菌[7]、中药材[8]、植物源提取物[9]等。
玫瑰黄链霉菌Streptomyces roseoflavus Men-myco-93-63菌株是从马铃薯疮痂病自然衰退土壤中分离到的一株对多种植物病原菌具有抑制作用的拮抗链霉菌[10]。魏学军[11]研究证实了该菌株发酵液对蔬菜根结线虫具有较好的抑制作用;武志朴[12]发现该菌株发酵液能很好地防治甘薯茎线虫病害。李永亮、闫震等前期已就Men-myco-93-63菌株的液体发酵和固体发酵工艺进行了优化,研制出了其水剂、乳油、可湿性粉剂及颗粒剂等不同剂型[13,14]。为了提高生物菌剂的储存期限,延长其使用寿命,保证防治效果,冯龙[15]通过优化Men-myco-93-63片剂所需的碳源、氮源和加工工艺等,研制出了该生防菌的片剂,贮藏4个月后片剂中的活菌含量仍保持在2.0×105 cfu/g水平,该片剂施用量为1.0 g/株时,对棉花黄萎病的田间防效可达74.76% ~88.66%。本研究于温室条件下,采用盆栽试验及平板稀释法测定了Men-myco-93-63片剂对黄瓜根结线虫病的防治效果及其对根际土壤中微生物区系的影响,旨在明确Men-myco-93-63活菌片剂在蔬菜根结线虫防治中的应用前景。
Men-myco-93-63固体发酵物是本研究室发明的一种以玉米芯为固体基质,对玫瑰黄链霉菌Men-myco-93-63进行深层发酵的产物(专利申请号201310078132.1),在本研究中作为阳性对照的一种。淡紫拟青霉Paecilomyces lilacinus是目前研究最多的防治根结线虫的生防因子,市场上已经有其成品淡紫拟青霉颗粒剂,在田间用于蔬菜根结线虫的防治[16],因此本研究采用淡紫拟青霉颗粒剂作为另一种阳性对照。
1 材料和方法 1.1 供试材料 1.1.1 菌株玫瑰黄链霉菌S.roseoflavus Men-myco-93-63菌株,由河北农业大学植物保护学院分子植物病理学和植物病害生物防治实验室保存。
1.1.2 蔬菜品种黄瓜品种为津优一号。
1.1.3 对照药剂淡紫拟青霉颗粒剂(P.lilacinus granule,活菌总数≥5×109 cfu/g),厦门多多生物科技有限公司;Men-myco-93-63固体发酵物(活菌总数≥1×108 cfu/g),参照张艳杰等[17]的方法制备,于4 ℃保存。
1.1.4 培养基常规PDA培养基,用于玫瑰黄链霉菌Men-myco-93-63的活化培养;牛肉膏蛋白胨培养基,用于筛选土壤中的细菌;马丁\|孟加拉红培养基(葡萄糖 10 g,蛋白胨 5 g,MgSO4 ·7H2O 0.5 g,K2HPO4 1 g,孟加拉红0.033 3 g,卡那霉素 0.02 g,琼脂 20 g,水 1 000 mL),用于筛选土壤中的真菌;高氏一号合成培养基(可溶性淀粉 20 g,MgSO4 ·7H2O 0.5 g,KNO3 1 g,K2HPO4 0.5 g,FeSO4 ·7H2O 0.01 g,NaCl 0.5 g,琼脂 20 g,水 1 000 mL),用于筛选土壤中的放线菌;4号培养基(花生饼粉20 g,可溶性淀粉30 g,葡萄糖10 g,蔗糖20 g,果糖0.2 g,酵母浸膏2 g,NaCl 5 g,(NH4)2SO4 6 g,KH2PO4 0.2 g,CaCO3 2.5 g,FeSO4 ·7H2O 0.7 g,ZnSO4 ·7H2O 0.7 g,水 1 000 mL),用于制备玫瑰黄链霉菌Men-nyco-93-63发酵液。
1.2 试验方法 1.2.1 Men-myco-93-63片剂制备参考冯龙[15]的方法制备,该片剂活菌含量为3.00×107 cfu/g,于4 ℃保存。
1.2.2 温室盆栽试验将黄瓜籽消毒催芽后,在穴盘中育苗,于2014年4月3日两叶一心期时定植。所用土壤为采自黄瓜根结线虫病发生严重的大棚中的病土。共设6个试验处理,每处理重复10次。 处理Ⅰ :空白对照;处理Ⅱ :Men-myco-93-63片剂 0.5 g/株;处理Ⅲ :Men-myco-93-63片剂 1.0 g/株;处理Ⅳ :Men-myco-93-63片剂 1.5 g/株;处理Ⅴ :Men-myco-93-63固体发酵物与病土体积比为1 ∶200;处理Ⅵ:淡紫拟青霉颗粒剂(活菌总数≥5×109 cfu/g)1.5 g/株。以处理Ⅴ和处理Ⅵ作为阳性对照。
1.2.3 调查取样分别于处理后20、30、40、50和60 d取土样,调查土壤中真菌、细菌、放线菌及根结线虫数量。
处理60 d后观察根结情况,计算各处理的病情指数和防效。病情分级标准[18]为:0级,无根结;1级,根结占根系的25%以下;2级,根结占26% ~50%;3级,根结占51% ~75%;4级,根结占75%以上。


取250 mL三角瓶,加入玻璃珠及90 mL蒸馏水,灭菌后冷却,加入10 g土壤,即得到土样的10倍稀释液,于28 ℃、160 r/min 下恒温培养24 h,用无菌水分别配制成稀释度为10-2、10-3和10-4的土壤悬浮液。吸取20 μ L 稀释度为10-3或10-4的悬浮液,采用涂平板法检测其中可培养微生物的数量。
利用牛肉膏蛋白胨培养基筛选细菌,于涂平板后1 d统计细菌菌落数;用马丁\|孟加拉红培养基筛选真菌,于涂平板后5 d统计真菌菌落数;采用高氏一号合成培养基(临用时每300 mL加3%重铬酸钾1 mL)筛选放线菌[19],于涂平板后5 d统计放线菌菌落数。
1.2.5 土壤中根结线虫的分离及计数取植株根际土壤样品,采用过筛法[20]分离根结线虫:将100 g土样加入5 L量杯中,加水充分搅拌,静置3 min,将水层倒入上层为180目(筛孔径0.088 mm)下层为500目(孔径0.030 mm)的套筛中。收集500目筛上的线虫,于量筒中用水定容至150 mL,于显微镜(100×)下统计根结线虫数量。
1.2.6 数据处理采用Excel及SPSS软件进行数据统计及差异显著性分析。
2 结果与分析 2.1 Men-myco-93-63片剂对黄瓜根结线虫病的防效于黄瓜生长末期观察其根部发病情况,结果见表 1。空白对照发病最为严重,病情指数达75;施用Men-myco-93-63片剂的处理病情指数均较空白对照低,且差异显著,其中1.5 g/株处理组病情指数最低(33.33),相对防效最高(55.56%),高于Men-myco-93-63固体发酵物(发酵物与病土体积比为1 ∶200)(相对防效为50.00%)及淡紫拟青霉颗粒剂(相对防效为54.17%)处理。结果表明,Men-myco-93-63片剂对温室中黄瓜根结线虫病具有较好的防治效果。
|
|
表 1 Men-myco-93-63片剂对黄瓜根结线虫病的防治效果 Table 1 Control efficacy of Men-myco-93-63 tablets against cucumber root-knot nematode |
温室黄瓜定植后,土壤中根结线虫的初始密度为每100 g土壤含线虫1 600条左右,药剂处理后线虫数量总体呈先上升后下降的趋势(图 1),最终(处理60 d后)土壤中根结线虫数量均较其初始密度高,但以空白对照的增加量为最高。Men-myco-93-63片剂对根结线虫的防控效果随其用量的增加而提高,其中1.5 g/株处理组线虫增加量最少,为每100 g土壤900条;Men-myco-93-63固体发酵物(1 ∶200)处理组线虫增加量为每100 g土壤2 780条,淡紫拟青霉颗粒剂处理组线虫增加量为每100 g土壤1 050条。结果表明,Men-myco-93-63片剂 1.5 g/株对黄瓜根结线虫的防控效果优于其固体发酵物(1 ∶200)和淡紫拟青霉颗粒剂的处理。
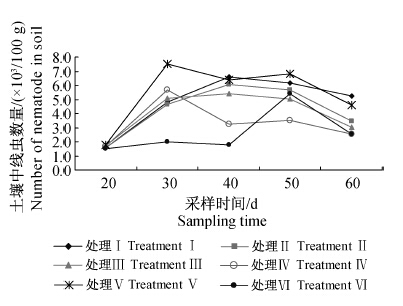 | 处理Ⅰ:空白对照;处理Ⅱ~Ⅳ:Men-myco-93-63片剂, 0.5 g/株、1.0 g/株、1.5 g/株;处理Ⅴ:Men-myco-93-63固体 发酵物与病土体积比为1 ∶200;处理Ⅵ:淡紫拟青霉颗粒剂 (活菌总数≥5×109cfu/g)1.5 g/株。 TreatmentⅠ: blank control; Treatment Ⅱ to Ⅳ: Men-myco- 93-63 tablets,0.5 g/plant,1.0 g/plant and 1.5 g/plant; Treatment Ⅴ: the volume ratio of Men-myco-93-63 solid state fermentation and soil was 1 ∶200; Treatment Ⅵ: P.lilacinus(≥5×109cfu/g) 1.5 g/plant. 图 1 施用Men-myco-93-63片剂后土壤中线虫数量的动态变化 Fig. 1 Dynamic change of the nematodes number in soil after applying Men-myco-93-63 tablets |
土壤中可培养细菌的初始量为6.5×105 cfu/g左右,施用Men-myco-93-63片剂后,细菌数量整体呈上升趋势,且各处理均高于空白对照(图 2)。至黄瓜生长季末(处理60 d后),Men-myco-93-63片剂1.0 g/株处理组细菌数量最高,达2.55×106 cfu/g,比空白对照增加了225.45%,差异显著;其次是片剂1.5 g/株处理组,细菌数量比空白对照增加了163.41%;而淡紫拟青霉颗粒剂处理组细菌数量较空白对照低,减少了15.85%(表 2)。由此可见,Men-myco-93-63片剂的施用增加了土壤中可培养细菌的数量。
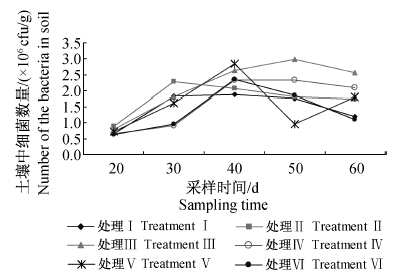 | 处理Ⅰ:空白对照;处理Ⅱ~Ⅳ:Men-myco-93-63片剂, 0.5 g/株、1.0 g/株、1.5 g/株;处理Ⅴ:Men-myco- 93-63固体发酵物与病土体积比为1 ∶200;处理Ⅵ: 淡紫拟青霉颗粒剂(活菌总数≥5×109 cfu/g)1.5 g/株。 TreatmentⅠ: blank control; Treatment Ⅱ to Ⅳ: Men-myco- 93-63 tablets,0.5 g/plant,1.0 g/plant and 1.5 g/plant; Treatment Ⅴ: the volume ratio of Men-myco-93-63 solid state fermentation and soil was 1 ∶200; Treatment Ⅵ: P.lilacinus(≥5×109 cfu/g) 1.5 g/plant. 图 2 施用Men-myco-93-63片剂后土壤中细菌数量的动态变化 Fig. 2 Dynamic change of the bacteriums number in soil after applying Men-myco-93-63 tablets |
|
|
表 2 施用Men-myco-93-63片剂60d后土壤中细菌数量增长情况 Table 2 Change of the bacteriums number in soil after applying Men-myco-93-63 tablets |
土壤中可培养真菌的初始量为550 cfu/g左右。至黄瓜生长季末(处理60 d 后),淡紫拟青霉颗粒剂处理组真菌数量最多,为2.47×103 cfu/g;而施用Men-myco-93-63片剂处理后真菌数量均较空白对照低,其中1.0 g/株处理组最低,为1.07×103 cfu/g(图 3),比空白对照降低了66.43%(表 3),且与淡紫拟青霉处理组差异显著。表明施用Men-myco-93-63片剂可有效降低根际土壤中的真菌含量,其中1.0 g/株处理的效果最好。
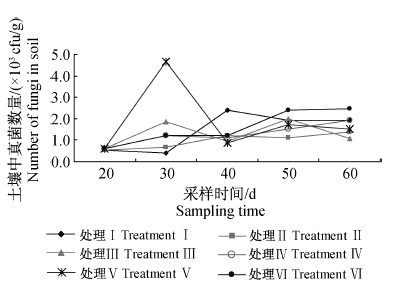 | 处理Ⅰ:空白对照;处理Ⅱ~Ⅳ:Men-myco-93-63片剂, 0.5 g/株、1.0 g/株、1.5 g/株;处理Ⅴ:Men-myco- 93-63固体发酵物与病土体积比为1 ∶200;处理Ⅵ: 淡紫拟青霉颗粒剂(活菌总数≥5×109 cfu/g)1.5 g/株。 TreatmentⅠ: blank control; Treatment Ⅱ to Ⅳ: Men-myco- 93-63 tablets,0.5 g/plant,1.0 g/plant and 1.5 g/plant; Treatment Ⅴ: the volume ratio of Men-myco-93-63 solid state fermentation and soil was 1 ∶200; Treatment Ⅵ: P.lilacinus(≥5×109 cfu/g) 1.5 g/plant. 图 3 施用Men-myco-93-63片剂后土壤中真菌数量的动态变化 Fig. 3 Dynamic change of the fungus number in soil after applying Men-myco-93-63 tablets |
|
|
表 3 施用Men-myco-93-63片剂60 d后土壤中真菌数量增长情况 Table 3 Change of the fungus number in soil after applying Men-myco-93-63 tablets |
根际土壤中可培养放线菌的初始量在3.5×104 cfu/g左右,药剂处理后放线菌数量整体呈上升趋势(图 4)。至黄瓜生长末期(处理60 d后),空白对照放线菌数量为1.43×105 cfu/g;Men-myco-93-63片剂1.0 g/株处理组放线菌数量最高,达2.28×105 cfu/g,显著高于Men-myco-93-63固体发酵物(1 ∶200)和淡紫拟青霉颗粒剂处理组;其次是片剂1.5 g/株处理组,放线菌数量为2.15×105 cfu/g。检测结果显示,经Men-myco-93-63片剂1.0和1.5 g/株处理后,根际土壤中可培养放线菌数量增幅明显且持续增加,分别增加了75.45%和67.27%(表 4),与空白对照差异显著。研究表明,Men-myco-93-63片剂1.0 g/株处理能够明显提高土壤中放线菌的数量。
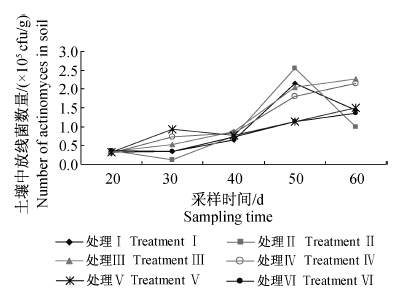 | 处理Ⅰ:空白对照;处理Ⅱ~Ⅳ:Men-myco-93-63片剂, 0.5 g/株、1.0 g/株、1.5 g/株;处理Ⅴ:Men-myco- 93-63固体发酵物与病土体积比为1 ∶200;处理Ⅵ: 淡紫拟青霉颗粒剂(活菌总数≥5×109 cfu/g)1.5 g/株。 TreatmentⅠ: blank control; Treatment Ⅱ to Ⅳ: Men-myco- 93-63 tablets,0.5 g/plant,1.0 g/plant and 1.5 g/plant; Treatment Ⅴ: the volume ratio of Men-myco-93-63 solid state fermentation and soil was 1 ∶200; Treatment Ⅵ: P.lilacinus(≥5×109 cfu/g) 1.5 g/plant. 图 4 施用Men-myco-93-63片剂后土壤中放线菌数量的动态变化 Fig. 4 Dynamic change of the actinomyces number in soil after applying Men-myco-93-63 tablets |
|
|
表 4 施用Men-myco-93-63片剂60 d后土壤中放线菌数量增长情况 Table 4 Change of the actinomyces number in soil after applying Men-myco-93-63 tablets |
土壤微生物区系是植物生长和病害发生的重要影响因素,也是生物防治中影响生防菌定殖和发挥作用的因素之一。土壤微生物种类繁杂,主要有细菌、真菌、放线菌,其中尤以细菌的种类和数量最多[21]。病原物的入侵会破坏原土壤的微生物结 构[22],生防微生物的施用则可改善土壤微生物结构[23,24],使其有利于植物生长,但不同生防菌对土壤微生物区系的影响不同。史怀等[25]采用淡紫拟青霉菌剂防治菜豆根结线虫,发现其对根结线虫的抑制率达到71.6%,施用菌剂15 d后,土壤中真菌含量增加,而细菌和放线菌含量降低,30 d后,除放线菌外,细菌和真菌均恢复到施药前的水平,表明生物菌剂的施用对土壤中原有的微生物群落结构和土壤生态环境无显著影响。张婷等[26]将枯草芽孢杆菌B.subtilis B006与淡紫拟青霉Str.NH-PL-03复合菌剂施用于设施黄瓜连作土壤中,发现根际土壤中真菌群体总量显著减少,而细菌总量显著增加,并 能促进TRF139等有益菌群增殖,抑制TRF341等有害菌群的增殖。尹淑丽等[27]通过施用生防菌细菌D、放线菌317和木霉菌,研究了黄瓜不同生育时期根际土壤中微生物数量的动态变化。发现接种细菌D和放线菌317后细菌数量上升,真菌数量下降,放线菌数量变化不明显; 而接种木霉后则明显提高了根际土壤中放线菌和真菌的数量,对细菌数量影响不明显。本研究采用平板稀释法,对根际土壤中的可培养微生物数量在黄瓜整个生长周期内的动态变化进行了检测,发现施用玫瑰黄链霉菌Men-myco-93-63片剂后,根际土壤中细菌、放线菌和真菌数量总体呈增长趋势,其中当片剂施用量为1.0 g/株时,细菌、放线菌数量增加最多,分别比初始时增加了1.76×106和1.93×105 cfu/g,真菌数量增加最少,为0.47× 103 cfu/g,3种可培养微生物的总量增加了195.35%。 由此看出,生防菌Men-myco-93-63片剂的施用可有效提高土壤中细菌和放线菌数量,控制真菌数量,改善根际土壤中可培养微生物的结构。
农药片剂一般是溶解后喷雾或者在水中应用。魏娇洋等[28]研制了解淀粉芽孢杆菌X-278片剂,其对棉花黄萎病的防效高达86.34%;马建华等[29]研制了一种根部施用的0.5%吡虫啉控释片剂,可控制瓜蚜的为害;胡述泉[30]采用农用链霉素泡腾片剂防治烟草青枯病,防效为29.77%;仉欢等[31]采用56%磷化铝熏蒸片剂防治黄瓜根结线虫病,防效在50%以上。本研究通过根部施用Men-myco-93-63片剂防治黄瓜根结线虫病,在使用量为1.5 g/株时,防效可达55.56%,高于Men-myco-93-63固体发酵物(发酵物与病土体积比为1 ∶200),与市售的淡紫拟青霉颗粒剂效果相当。而且片剂施用简单,用量少,便于储存及运输,因此生防链霉菌的片剂类型更适合在生产上推广和应用。玫瑰黄链霉菌Men-myco-93-63片剂作为一种生防链霉菌活菌剂型,是对生物农药剂型的一次创新,虽然目前尚未实现其在常温下长期保存,仍需在4 ℃条件下进行保存,但本研究为Men-myco-93-63片剂的生产、应用,以及根结线虫防治绿色环保新方法的提出提供了重要的依据,具有一定的理论和实践意义。
| [1] | 谢毅, 吴学民. 现代农药剂型新进展[J]. 精细与专用化学品, 2006, 14(21): 1-3. Xie Yi, Wu Xuemin. New progress on preparation forms of modern pesticide[J]. Fine Spec Chem, 2006, 14(21): 1-3.(in Chinese) |
| [2] | 郑铁军. 农药新剂型的研究[J]. 黑龙江农业科学, 2003(1): 35-37. Zheng Tiejun. Study and prospect on the new forms of pesticide agent[J]. Heilongjiang Agric Sci, 2003(1): 35-37.(in Chinese) |
| [3] | 王勇, 孔宪滨, 张文革, 等. 农药新剂型——水分散片剂[J]. 农药, 2004, 43(6): 254-256. Wang Yong, Kong Xianbin, Zhang Wenge, et al. The pesticide formulation water—water dispersible tablet[J]. Chin J Pesitic, 2004, 43(6): 254-256.(in Chinese) |
| [4] | 李洪涛, 张翠绵, 沈江卫, 等. 黄瓜根结线虫拮抗菌筛选及作用机理初探[J]. 河北大学学报: 自然科学版, 2006, 26(1): 91-96. Li Hongtao, Zhang Cuimian, Shen Jiangwei, et al. The bio-control of Meloidogyne incognita by antagonistic microorganism in cucumber[J]. J Hebei Univ: Natl Sci Ed, 2006, 26(1): 91-96.(in Chinese) |
| [5] | 董炜博, 石延茂, 迟玉成, 等. 穿刺巴氏杆菌防治植物根结线虫病的研究现状及其应用前景[J]. 中国生物防治, 1999, 15(2): 89-93. Dong Weibo, Shi Yanmao, Chi Yucheng, et al. Status and prospect of biocontrol of plant root-knot nematode diseases by Pasteuria penetrans[J]. Chinese J Biol Control, 1999, 15(2): 89-93.(in Chinese) |
| [6] | 李天飞, 张克勤, 刘杏忠. 食线虫菌物分类学[M]. 北京: 中国科学技术出版社, 2000:39-147. Li Tianfei, Zhang Keqin, Liu Xingzhong. Nematophagous Fungi Taxonomy[M]. Beijing: China Science and Technology Press, 2000:39-147.(in Chinese) |
| [7] | 鄢小宁, 林茂松, 刘亮山. 南方根结线虫拮抗链霉菌的筛选和鉴定[J]. 中国生物防治, 2004, 20(3): 202-205. Yan Xiaoning, Lin Maosong, Liu Liangshan. Screening of antagonistic streptomycete from soils against Meloidogyne incognita[J]. Chinese J Biol Control, 2004, 20(3): 202-205.(in Chinese) |
| [8] | 王 蓉, 时立波, 吴海燕. 3种中药材对番茄根围土壤线虫影响及对根结线虫的毒力[J]. 湖北农业科学, 2011, 50(14): 2870-2872. Wang Rong, Shi Libo, Wu Haiyan. Effects of three kinds of Chinese herbal medicine on soil nematode of tomato rhizosphere soil and its toxicity to the root-knot nematode[J]. Hubei Agric Sci, 2011, 50(14): 2870-2872.(in Chinese) |
| [9] | 丁 琦, 徐守健, 闫 磊, 等. 具杀线虫作用的植物源化合物研究[J]. 世界农药, 2006, 28(2): 33-40. Ding Qi, Xu Shoujian, Yan Lei, et al. Study on phytochemicals of killing nematode[J]. World Pestic, 2006, 28(2): 33-40.(in Chinese) |
| [10] | 董立. 拮抗链霉菌Men-myco-93-63的复壮及其抗生素的提取纯化[D]. 保定: 河北农业大学, 2002. Dong Li. Selection of rejuvenated strain of Men-myco-93-63, extraction and purification of its antibiotics[D]. Baoding: Agricultural University of Hebei, 2002.(in Chinese) |
| [11] | 魏学军. 蔬菜根结线虫生防菌的筛选与鉴定[D]. 保定: 河北农业大学, 2004. Wei Xuejun. The screening and identification of biocontrol agents to vegetable root-knot nematodes[D]. Baoding: Agricultural University of Hebei, 2004.(in Chinese) |
| [12] | 武志朴. 玫瑰黄链霉菌Men-myco-93-63防治甘薯茎线虫病初步研究[D]. 保定: 河北农业大学, 2005. Wu Zhipu. Biocontrol of sweet potato stem nematodes using Streptomyces Men-myco-93-63[D]. Baoding: Agricultural University of Hebei, 2005.(in Chinese) |
| [13] | 李永亮.链霉菌Men-myco-93-63抗生素的提取纯化及生防制剂的研究[D].保定:河北农业大学,2004. Li Yongliang.Studyontheextraction,isolation,purificationandbiologicalformulationoftheantibioticfromstreptomycesstrainMen-myco-93-63[D]. Baoding:AgriculturalUniversityofHebei,2004.(inChinese) |
| [14] | 闫震,孟庆芳,李爱霞,等.玫瑰黄链霉菌Men-myco-93-63固体发酵培养基的优化[J].西北农业学报,2010,19(12):166-171. Yan Zhen, Meng Qingfang, Li Aixia, et al.Optimizationofsolid-statefermentationmediumforstreptomycesroseoflavusMen-myco-93-63[J].ActaAgriculturaeBoreali-OccidentalisSinica,2010,19(12):166-171.(inChinese) |
| [15] | 冯龙. 玫瑰黄链霉菌Men-myco-93-63营养型片剂的研制及应用[J]. 河北农业大学学报, 2014,37(5): 77-81. Feng Long. Development of nutrient tablets of Streptomyces roseoflavus Men-myco-93-63 and its application[J]. J Agric Univ Hebei, 2014, 37(5): 77-81.(in Chinese) |
| [16] | 姜培増, 李宏园, 陈铁保. 淡紫拟青霉防治植物线虫研究进展[J]. 中国农业科技导报, 2006, 8(6): 38-41. Jiang Peizeng, Li Hongyuan, Chen Tiebao. Advance in Paecilmyces Lilacinus research for plant parasitic nematodes control[J]. Rev China Agric Sci Technol, 2006, 8(6): 38-41.(in Chinese) |
| [17] | 张艳杰, 魏学军, 寇宏达, 等. 玫瑰黄链霉菌Men-myco-93-63抗南方根结线虫相关酶活性及其防效[J]. 西北农业学报, 2013, 22(4): 184-190. Zhang Yanjie, Wei Xuejun, Kou Hongda, et al. The enzyme activity and control efficiency of Streptomyces roseoflavus Men-myco-93-63 against root knot nematode[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2013, 22(4): 184-190.(in Chinese) |
| [18] | 孙建华, 齐军山, 冯欣, 等. Sr18生物杀线虫制剂防治黄瓜根结线虫病研究[J]. 华北农学报, 2005, 20(4): 74-78. Sun Jianhua, Qi Junshan, Feng Xin, et al. Study on efficacy of bio-nematicide from Sr18 fungus for biological control of cucumber root-knot nematode[J]. Acta Agriculturae Boreali-Sinica, 2005, 20(4): 74-78.(in Chinese) |
| [19] | 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002:124-125. Zhao Bin, He Shaojiang. Microbiology Experiment[M]. Beijing: Science Press, 2002:124-125.(in Chinese) |
| [20] | 刘维志. 植物病原线虫学[M]. 北京: 中国农业出版社, 2004:372-373. Liu Weizhi. Plant Pathogenic Nematology[M]. Beijing: China Agriculture Press, 2004:372-373.(in Chinese) |
| [21] | Kennedy A C. Bacterial diversity in agroecosystems[J]. Agric Ecosyst Environ, 1999, 74(1-3): 65-76. |
| [22] | Marschner P, Crowley D E, Lieberei R. Arbuscular mycorrhizal infection changes the bacterial 16s rDNA community composition in the rhizosphere of maize[J]. Mycorrhiza, 2001, 11(6): 297-302. |
| [23] | Paulitz T C, Linderman R G. Interaction between fluorescent pseudomonads and VA-mycorrhizal fungi[J]. New Phytol, 1989, 113(1): 37-45. |
| [24] | Marshner P, Crowley D E. Physiological activity of a bioluminescent Pseudomonas fluorescens (Strain 2-79) in the rhizosphere of mycorrhizal and non-mycorrhizal pepper(Capsicum annuum L. )[J]. Soil Biol Biochem, 1996, 28(7): 869-876. |
| [25] | 史怀, 林抗美, 朱育箐, 等. 淡紫拟青霉菌剂防治菜豆根结线虫的药效及对土壤微生物群落的影响[J]. 中国农学通报, 2008, 24(增刊1): 77-79. Shi Huai, Lin Kangmei, Zhu Yuqing, et al. Control efficacy of Paecilomyces lilacinus on bean root-knot nematode and effect on soil microorganisms[J]. Chinese Agric Sci Bull, 2008, 24(Suppl. 1): 77-79.(in Chinese) |
| [26] | 张婷, 李世东, 廖作清. "秸秆降解生防菌强化技术"对黄瓜连作土壤微生物区系的影响[J]. 中国生态农业学报, 2013, 21(11): 1416-1425. Zhang Ting, Li Shidong, Liao Zuoqing. Effects of intensified corn stalk degradation by biocontrol agents on soil microbial community in continuous cucumber cropping[J]. Chinese J Eco-Agric, 2013, 21(11): 1416-1425.(in Chinese) |
| [27] | 尹淑丽, 麻耀华, 张丽萍, 等. 不同生防菌对黄瓜根际土壤微生物数量及土壤酶活性的影响[J]. 北方园艺, 2012(1): 10-14. Yin Shuli, Ma Yaohua, Zhang Liping, et al. Effects of different biocontrol agents on soil microbial number and enzyme activity in the cucumber rhizosphere[J]. Northern Horticul, 2012(1): 10-14.(in Chinese) |
| [28] | 魏娇洋, 冯龙, 陈英化, 等. 解淀粉芽孢杆菌X-278片剂的研制、定殖及田间防效[J]. 农药学学报, 2014, 16(3): 347-353. Wei Jiaoyang, Feng Long, Chen Yinghua, et al. Development, colonization and field control efficacy of Bacillus amyloiquefaciens X-278 tablets[J]. Chin J Pestic Sci, 2014, 16(3): 347-353.(in Chinese) |
| [29] | 马建华, 张 怡, 张 蓉, 等. 一种新型根用控释农药片剂防治瓜蚜技术研究[J]. 农药, 2009, 48(10): 777-778. Ma Jianhua, Zhang Yi, Zhang Rong, et al. Controlling technology of control-releasing imidacloprid tablet for root using against Aphis gossypii Glover[J]. Agrochemicals, 2009, 48(10): 777-778.(in Chinese) |
| [30] | 胡述泉. 农用链霉素泡腾片剂对烟草青枯病防治效果的初步研究[J]. 作物研究, 2009, 23(1): 27-29. Hu Shuquan. Preliminary study on control effect of effervescent troche of agricultural streptomycin against tobacco bacterial wilt[J]. Crop Res, 2009, 23(1): 27-29.(in Chinese) |
| [31] | 仉 欢, 王开运, 朱玉坤. 56%磷化铝片剂对黄瓜根结线虫的防效和对黄瓜生长的影响[J]. 农药, 2011, 50(8): 608-610. Zhang Huan, Wang Kaiyun, Zhu Yukun. Control efficacy of aluminium phosphide 56% tablet on cucumber root-knot disease and effect on cucumber growth[J]. Agrochemicals, 2011, 50(8): 608-610.(in Chinese) |
 2015, Vol. 17
2015, Vol. 17


