2. 河南农业大学 植物保护学院, 郑州 450002;
3. 中国农业大学 应用化学系, 北京 100193
2. College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, China;
3. Applied Chemical Department, China Agricultural University, Beijing 100193, China
新烟碱类杀虫剂具有杀虫谱广、杀虫活性高以及对哺乳动物低毒的特点,主要用来防治刺吸式口器的害虫[1, 2],但其对蜜蜂的高毒性以及害虫对其的抗药性问题也引起了世界上的广泛关注[3, 4, 5, 6]。因此,亟需开发全新高效、低毒的化合物作为替代产品。
以茚虫威和氰氟虫腙为代表的硝基缩氨基胍类杀虫剂杀虫谱广,可有效防治各种鳞翅目害虫[7]。其作用机制为活性基团缩氨基脲作用于昆虫的钠离子通道,通过改变轴突膜对离子的渗透性抑制昆虫的神经传导,导致昆虫麻痹而死[8]。
N′-硝基缩氨基胍类化合物是将新烟碱类与缩氨基脲类化合物的两个活性单元拼接到1个分子中得到的一类具有全新结构的化合物,其对蚜虫(Aphididae)和烟粉虱 Bemisia tabaci (Gennadius)具有较好的毒力[9]。其中对桃蚜的LC50值小于30 μ g/mL,对梅大尾蚜的LC50值小于50 μ g/mL;在500 μ g/mL下,对烟粉虱的致死率大于50%。该类化合物由中国农业大学创制,目前已获得包括美国、欧盟、中国和印度等多个国家的专利授权,其中一个代表性化合物戊吡虫胍(结构式见 Scheme 1 )即将进行商品化。Su50[N′-硝基-1-异丙基-2-(4-硝基苯亚甲基) 氨基胍]和Su56(N′-硝基-1-烯丙基-2-正丙基氨基胍)(结构式见 Scheme 1 )是两种新的硝基缩氨基胍类化合物,其结构与戊吡虫胍类似。前期研究发现,这类化合物对同翅目类昆虫桃蚜、桃粉蚜和棉蚜具有很好的杀虫活性[9, 10]]。笔者比较系统地研究了Su50和Su56对同翅目害虫蚜虫的室内毒力和拒食活性,并初步研究了其对棉蚜羧酸酯酶(CarE)、乙酰胆碱酯酶(AChE)、谷胱甘肽S\|转移酶(GSTs)和多功能氧化酶(MFO)等相关酶活性影响,以期找到这两个化合物最优的作用靶标害虫以及其可能的生化作用机理。
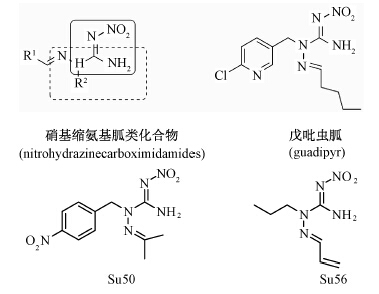 | Scheme 1 |
Su50原药和Su56原药(纯度均为90%,由中国农业大学理学院自行合成[9, 10]); 对照药剂为95.1%吡虫啉(imidacloprid)原药,连云港立本农药化工有限公司。磷酸二氢钠、 牛血清白蛋白(BSA)和磷酸氢二钠,北京广达恒益有限公司;乙二胺四乙酸钠(EDTA)和 N,N-二甲基甲酰胺(DMF),北京化工厂;苯甲基磺酰氟(PMSF)、 还原型辅酶Ⅱ(NADPH)、 α -乙酸萘酯( α -NA)和二硫代苏糖醇(DTT),北京耀北生物技术有限公司;对硝基苯甲醚,美国 Sigma公司;考马斯亮蓝 G-250 和固蓝 RR 盐,上海化学试剂采购供应站;苯基硫脲(PTU),上海试剂一厂;1-氯-2,4-二硝基苯(CDNB),中国医药公司北京分公司;还原型谷胱甘肽(GSH),东风生化技术公司。其余试剂为国产分析纯。
1.1.2 主要仪器Infinite M200 PRO 光栅型多功能酶标仪(上海安景科技有限公司);96 孔酶标板(上海科兴生物技术有限公司);5417R冷冻离心机(艾本德中国有限公司)。
1.1.3 试验靶标棉蚜Aphis gossypii Glover、苹果黄蚜Aphis citricola van der Goot、梅大尾蚜Hyalopterus amygdali Blanchard,均采自中国农业科学院植物保护研究所未施用过新烟碱类杀虫剂的植物上;桃蚜Myzus persicae Sulzer,采自北京市昌平区桃园,接触过多种药剂。
1.2 试验方法 1.2.1 对蚜虫的毒力测定采用带虫叶片浸渍法[11]。将带有30~50 头大小一致无翅成蚜的植株叶片浸入系列浓度药液中5 s后取出,吸掉多余药液,晾干,放入垫有滤纸的培养皿(9 cm)中,每浓度3次重复。置于25 ℃±1 ℃恒温培养箱中培养。24 h 后在双目解剖镜下检查死亡率,用细毛笔轻触蚜虫腹部,不动者视为死亡。数据用DPS version 7.05软件处理,分别计算Su50和Su56对棉蚜、桃蚜、苹果黄蚜和梅大尾蚜的LC50值。以蒸馏水[含体积分数为0.05%的TritonX-100(曲拉通)]作空白对照,以吡虫啉为对照药剂。
1.2.2 拒食活性测定参考张钟宁等[12]的方法,并略作修改。将Su50和Su56用0.05%的曲拉通水溶液稀释成 200、100和20 mg/L的质量浓度梯度。取大小相同的新鲜棉花叶片,用毛笔在棉花叶片中脉一侧均匀涂抹Su50和Su56稀释液,叶脉另一侧涂0.05%的曲拉通水溶液作为对照。将叶片置于垫有湿润滤纸的培养皿中。提前挑取大小均匀、龄期相同的棉蚜饥饿2 h,待叶片晾干后,于每个处理叶片中脉接入30~50头棉蚜,用保鲜膜封口。24 h后统计叶片中脉两侧的蚜虫栖息数。每个处理重复3次。按(1)式计算拒食率。
拒食率/%=[(对照区栖息蚜虫数-处理区栖息蚜虫数)/对照区栖息蚜虫数]×100 (1)
1.2.3 酶活力测定 1.2.3.1 药剂处理用0.05%的曲拉通水溶液分别配制Su56和吡虫啉对棉蚜的亚致死浓度(LC10、LC25)药液,将带有大小均一无翅成蚜的棉花叶片在药液中浸渍5 s,室温晾干后放入垫有滤纸的培养皿(9 cm)中,24 h后取大小一致的活成虫7 mg用于制备酶液。
1.2.3.2 酶液制备取药剂处理后的无翅成蚜7 mg 置于冰上,用玻璃研磨器研磨。加入 pH 7.0、浓度为0.04 mol/L的磷酸缓冲液(PBS)1 mL,冰浴匀浆,匀浆液在 4 ℃、12 000 r/min下离心10 min,取上清液作为 EST 酶液,重复3次。以相同方法,采用pH 7.8、 0.1 mol/L的磷酸缓冲液(含1 mmol/L 的EDTA)制备 GSTs 酶液;采用 pH 7.8、0.1 mol/L 的磷酸缓冲液(含 1 mmol/L 的EDTA,1 mmol/L 的DTT,1 mmol/L 的PTU,0.4 mmol/L的 PMSF和质量分数为20%的甘油)制备MFO酶源。每处理3次重复。
1.2.3.3 羧酸酯酶活性测定采用酶标仪参照van Asperen[13]的方法测定,并适当改进。反应体系为5 mL 3×10-4 mol/L的底物(含1×10-6 mol/L的毒扁碱),每个待测酶液设置4个梯度,分别加入0、0.1、0.2和0.4 mL酶液,相应地分别加入pH 7.0、 0.04 mol/L 的磷酸缓冲液1.0、0.9、0.8和 0.6 mL。混匀后置于30 ℃的摇床上反应30 min,最后每个试管中加入1 mL显色剂(现配现用)。摇匀后,室温下静置30 min,用酶标仪在600 nm下测定OD值。重复3次。
1.2.3.4 乙酰胆碱酯酶活性测定参照Gorun等[14]的方法。反应体系为:0.1 mL Asch-DTNB;每个待测酶液设置4个梯度,分别为 0、0.1、0.2和 0.3 mL,相应地分别加入pH 7.4、0.1 mol/L的磷酸缓冲液2.6、2.5、2.4和2.3 mL,置于27 ℃摇床上振荡反应15 min,加入0.5 mL浓度为1×10-3mol/L 的毒扁碱,在412 nm下测定OD值。重复3次。
1.2.3.5 谷胱甘肽S-转移酶活性测定参照Oppenoorth等[15]的方法。反应体系为:0.3 mL 50 mmol/L 的谷胱甘肽,0.1 mL 0.16% 的CDNB,0.2 mL 酶液,2.4 mL 66 mmol/L的磷酸缓冲液,空白对照中加入2.6 mL 66 mmol/L的磷酸缓冲液。在340 nm下连续测定5 min内OD变化值。重复 3次。
1.2.3.1.2.3.6 多功能氧化酶活性测定参照 Yang等[16]的方法,略有改动。反应体系为:100 μ L 200 mmol/L 的对硝基苯甲醚,90 μ L酶液,10 μ L 36 mmol/L 的NADPH。在405 nm下连续测定30 min 内OD的值变化。重复3次。
1.2.3.7 蛋白质含量测定采用 Bradfold等[17]的考马斯亮蓝(G-250)方法测定。
1.3 数据统计分析与处理采用DPS version7.05统计软件计算毒力回归线和致死中浓度(LC50)。酶活力测定结果用SPSS软件进行方差分析。用SPSS软件Duncan新复极差检验法对拒食活性进行分析。
2 结果与分析 2.1 Su50和Su56对蚜虫的毒力由表 1数据可知:Su50和Su56对4种供试蚜虫均有一定的毒力,但差异不显著。其中,Su50对棉蚜的毒力最高,对苹果黄蚜次之,对梅大尾蚜最差;而Su56对苹果黄蚜的毒力最高,对棉蚜次之,对梅大尾蚜毒力最差;两个化合物对桃蚜的毒力相同,均稍低于吡虫啉的毒力。两个化合物对梅大尾蚜的毒力较低,可能与梅大尾蚜身体表面有一层疏水的分泌物有关。
|
|
表 1 Su50和Su56对蚜虫的毒力 Table 1 Toxicity of Su50 and Su56 to aphids |
结果(表 2)表明:Su50和Su56对棉蚜均有较好的拒食活性,在20、100和200 mg/L下其拒食率均大于40%,其中Su56的活性高于Su50。值得注意的是,Su50在不同质量浓度下对棉蚜的拒食活性存在差异,其中在100 mg/L下的拒食率显著高于在200和20 mg/L下的拒食率,表明Su50对棉蚜的拒食活性并非随药剂质量浓度的增加而一直增加;而Su56在不同质量浓度下的拒食率则无显著差异。
|
|
表 2 Su50和Su56对棉蚜拒食活性 Table 2 Antifeedant activity of Su50 and Su56 on Aphis gossypii Glover |
考虑Su56对棉蚜的毒力与Su50差异不显著,但拒食活性更好,结构更简单,因此选择Su56进一步测定了其在不同亚致死浓度下对棉蚜相关酶活性 的影响,结果见表 3。可以看出:经LC10和LC25浓度Su56处理的棉蚜,其羧酸酯酶活性略有降低,但差异不显著(P>0.05)。 与空白对照相比,Su56在LC10浓度下处理,棉蚜乙酰胆碱酯酶活性显著降低,但显著高于吡虫啉在LC10浓度下的处理。
|
|
表 3 亚致死剂量的Su56对棉蚜相关酶活性的影响 Table 3 The effects of the sub lethal concentrations of Su56 on the activity of related enzyme of Aphis gossypii Glouer |
Su56分别在LC10和LC25浓度下处理棉蚜后,其谷胱甘肽S-转移酶及多功能氧化酶的活性与对照相比变化均不显著(P>0.05)。与吡虫啉处理相比,在LC10浓度下,Su56处理棉蚜的羧酸酯酶、谷胱甘肽S-转移酶和多功能氧化酶的活性均显著提高,而在LC25浓度下则差异不显著(P>0.05)。
3 讨论关于硝基缩氨基胍类化合物的杀虫活性早有报道[8,9,10]。本研究表明:Su50与Su56对同翅目类蚜虫具有一定的毒杀活性,但差异不显著,而且除对梅大尾蚜外,两个化合物对几种蚜虫的毒力只是稍低于吡虫啉,具有较好的开发前景。已有研究表明,戊吡虫胍对同翅目类蚜科、飞虱科及粉虱科害虫具有良好的田间防效,并且对抗吡虫啉的害虫具有很好的杀灭效果[18,19]。Su50和Su56属戊吡虫胍类似物,建议今后增加对室内试验虫种的筛选,同时进一步开展田间药效试验,对最佳防治对象、用药浓度以及施药方式进行深入研究。
本研究结果显示,Su50及Su56均具有一定的拒食活性。由于这两种化合物是通过将新烟碱类与缩氨基脲类杀虫剂的活性结构单元结合在一起而合成的全新的硝基缩氨基胍类化合物,推测其作用方式可能与吡虫啉相似,因此其内吸杀虫活性以及对烟碱型乙酰胆碱受体的作用也需进一步研究。
昆虫通过提高其体内解毒酶活性而将进入体内的有毒化合物氧化、还原、水解或结合,以增强其水溶性,使之易于排出体外,或把其转变成低毒或无毒的物质,从而达到解毒的目的。昆虫体内的解毒酶主要包括多功能氧化酶(MFO)、酯酶(ESTs)和谷胱甘肽S\|转移酶(GSTs)等[20,21]。本研究从昆虫对杀虫剂解毒代谢机制出发,研究经新化合物Su56处理后昆虫体内3种解毒酶及乙酰胆碱酯酶活性的变化。结果表明:经亚致死浓度下的Su56处理后棉蚜体内的4种相关酶的活性均有变化,表明该药剂可引起棉蚜体内的生理代谢反应。其中羧酸酯酶、谷胱甘肽S-转移酶、多功能氧化酶活力变化不明显;乙酰胆碱酯酶的活力明显降低,表现为抑制作用,与亚致死浓度下吡虫啉对桃蚜乙酰胆碱酯酶活性的抑制作用一致[22]。乙酰胆碱酯酶在桃蚜对吡虫啉的抗性中起一定作用[23],本研究结果为Su56在以后的推广使用中延缓抗性发生具有重要的指导作用。
| [1] | 成四喜,雷筱娱. 新烟碱类杀虫剂在华专利分析[J]. 农药,2012, 51(9): 632-633. Cheng Sixi, Lei Xiaoyu. Analysis of neonicotinoid insecticide patents in China [J]. Agrochemicals, 2012, 51(9):632-633. (in Chinese) |
| [2] | Song Feng, You Zhiqi, Yao Xiangmei, et al. Specific loops D, E and F of nicotinic acetylcholine receptor β 1 subunit may confer imidacloprid selectivity between Myzus persicae and its predatory enemy Pardosa pseudoannulata [J]. Insect Biochem Mol Biol, 2009, 39(11): 833-841. |
| [3] | Mota-Sanchez D, Hollingworth R M, Grafius E J, et al. Resistance and cross-resistance to neonicotinoid insecticides and spinosad in the Colorado potato beetle, Leptinotarsa decemlineata (Say) (Coleoptera: Chrysomelidae) [J]. Pest Manag Sci, 2006, 62(1): 30-37. |
| [4] | Koo H N, An J J, Park S E, et al. Regional susceptibilities to 12 insecticides of melon and cotton aphid, Aphis gossypii (Hemiptera: Aphididae) and a point mutation associated with imidacloprid resistance[J]. Crop Prot,2014,55:91-97. |
| [5] | Wang Kaiyun, Guo Qinglong, Xia Xiaoming, et al. Resistance of Aphis gossypii (Homoptera: Aphididae) to selected insecticides on cotton from five cotton production regions in Shandong, China [J]. J Pestic Sci, 2007, 32: 372-378. |
| [6] | Boily M, Sarrasin B, DeBlois C, et al. Acetylcholinesterase in honey bees (Apis mellifera) exposed to neonicotinoids, atrazine and glyphosate: laboratory and field experiments[J]. Environ Sci Pollut Res, 2013, 20(8): 5603-5614. |
| [7] | 覃兆海. 2007年第16届英国植保会议公布的新农药品种[J]. 农药研究与应用, 2008,12(1): 7-8. Qin Zhaohai. New pesticides reported in XVI international plant protection congress (Glasgow)[J]. Agrochem Res Appl, 2008, 12(1):7-8. (in Chinese) |
| [8] | 袁小勇. 含硝基缩氨基胍活性结构的甲氧基丙烯酸酯类化合物的合成、生物活性与构效关系研究[D]. 北京:中国农业大学,2013:133. Yuan Xiaoyong. Synthesis, bioactivity and 3D-QSAR of the novel strobilurin containing hydrocarbylidenehydrazinecar-boximidamide[D]. Bejing:China Agricultural University, 2013:133.(in Chinese) |
| [9] | 张政,苏旺苍,王蕾,等. N'-硝基缩氨基胍类化合物的合成及其杀虫活性[J]. 农药学学报, 2013,15(4): 381-387. Zhang Zheng, Su Wangcang,Wang Lei, et al. Synthesis and insecticidal activity of 2-arylidene-1-hydrocarbonyl-N'-nitrohydrazinecarboximidamides [J]. Chin J Pestic Sci, 2013, 15(4):381-387. (in Chinese) |
| [10] | 杨冬燕,王蕾,贾长青,等. 芳亚甲基硝基缩氨基胍类化合物的合成及杀虫活性 [J]. 高等学校化学学报,2014, 35(8): 1703-1709. Yang Dongyan, Wang Lei, Jia Changqing, et al. Syntheses and insecticidal activities of nitro arylideneamino guanidine derivatives [J]. Chem J Chinese Univ, 2014, 35(8):1703-1709. (in Chinese) |
| [11] | NY/T 1154.6—2006,农药室内生物测定准则 杀虫剂 第6部分:杀虫活性试验浸虫法[S].2006. NY/T 1154.6—2006,Pesticides guidelines for laboratory bioactivity tests Part 6: Theimmersion test for insecticide activity[S].2006. (in Chinese) |
| [12] | 张钟宁,刘珣,娄照祥,等. 蓼二醛对蚜虫的拒食活性[J]. 昆虫学报, 1993, 36(2): 172-176. Zhang Zhongning, Liu Xun, Lou Zhaoxiang, et al. The antifeedant activity of polygodial aganist aphids [J]. Acta Entom Sinica, 1993, 36(2):172-176. (in Chinese) |
| [13] | van Asperen K. A study of housefly esterases by means of a sensitive colormetric method [J]. J Insect Physiol, 1962, 8(4): 401-414. |
| [14] | Gorun V, Proinov I, Băltescu V, et al. Modified Ellman procedure for assay of cholinesterases in crude enzymatic preparations [J]. Analyt Biochem, 1978, 86(1): 324-326. |
| [15] | Oppenoorth F J, van der Pas L J T, Houx N W H.Glutathione S-transferase and hydrolytic activity in a tetrachlorvinphos-resistant strain of housefly and their influence on resistance [J]. Pestic Biochem Physiol, 1979, 11(1-3):176-178. |
| [16] | Yang Y, Wu Y, Chen S, et al. The involvement of microsomal oxidases in pyrethroid resistance in Helicoverpa armigera from Asia [J]. Insect Biochem Mol Biol, 2004, 34(8):763-773. |
| [17] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Anal Biochem, 1976, 72(12):248-254. |
| [18] | 韩金涛,苏旺苍. 新型硝基缩氨基胍类杀虫剂:戊吡虫胍 [J]. 山东农药信息, 2013(12):19-20. Han Jintao,Su Wangcang. The novel nitrohydrazine-carboximidamides insecticide: guadipyr[J]. Shandong Pestic News, 2013(12):19-20. (in Chinese) |
| [19] | Su Wangcang, Zhou Yihui, Ma Yongqiang, et al. N'-Nitro-2-hydrocarbylidenehydrazinecarboximidamides: design, synthesis, crystal structure, insecticidal activity, and structure activity relationships [J]. J Agric Food Chem, 2012, 60(20): 5028-5034. |
| [20] | 张文吉, 张友军,韩熹莱. 棉铃虫不同龄期幼虫羧酸酯酶、谷胱甘肽转移酶、乙酰胆碱酯酶研究[J]. 植物保护学报, 1996,23(2): 157-162. Zhang Wenji, Zhang Youjun, Han Xilai. Studies on the carboxylesterase glutathione-S-transferase and acetylcholinesterase in different ages of Helicoverpa armigera larva [J]. Acta Phytophylac Sinica, 1996, 23(2):157-162. (in Chinese) |
| [21] | 杨帅. 大豆蚜对吡虫啉的抗性监测及抗性机理研究[D]. 哈尔滨:东北农业大学,2012:115. Yang Shuai. Study on monitoring and mechanisms of imidacloprid resistance in soybean aphid, Aphis glycines [D]. Harbin: Northeast Agricultural University, 2012: 115. (in Chinese) |
| [22] | 曾春祥,王进军.吡虫啉亚致死剂量处理对桃蚜烟碱型乙酰胆碱酯酶的时间与剂量效应[J].植物保护,2007,33(2):50-54. Zeng Chunxiang, Wang Jinjun. Time and dose effects of sub lethal imidacloprid concentrations on acetylcholinesterase in Myzus persicae [J]. Plant Prot, 2007, 33(2):50-54. (in Chinese) |
| [23] | Choi B R, Lee S W, Yoo J K. Resistance mechanisms green peach aphid of Myzus persicae (Homoptera: Aphididae) to imidacloprid [J]. Kor J Appl Entom, 2001, 40(3):265-271. |
 2015, Vol. 17
2015, Vol. 17


