2. 江苏省农业科学院 食品质量安全与检测研究所, 南京 210014
2. Institute of Food Safety and Inspection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
毒死蜱(chlorpyrifos),化学名称为O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,是美国陶氏益农化学公司于1965年研发的一种高效、低毒、广谱的有机磷杀虫、杀螨剂[1]。作为代替高毒有机磷农药的重要品种,毒死蜱在我国已被广泛推广使用,生产规模和使用量逐年增加,而由此带来的对生态环境和人体健康的潜在危险性亦不容忽视。研究表明:毒死蜱的毒性可以通过生物富集作用影响整个生态系统[2];其对水生生物毒性较高[3];此外,毒死蜱还是一种可疑的环境内分泌干扰物质,长期接触可对内分泌系统、呼吸系统、神经系统或免疫系统带来危害[4, 5, 6],并可能增加患肺癌的几率[7, 8]。
微生物降解是环境中残留农药降解的一种重要途径。截至2011年报道,从受污染的土壤、污泥或污水等特殊环境中分离得到的具有毒死蜱降解特性的微生物已达50余株[9],其中部分菌株或其代谢酶已被应用于土壤污染修复[10, 11],或蔬菜残留农药降解等[12, 13, 14]。植物内生菌是指一生或至少一生中的某个阶段能进入活体植物组织内、并与宿主植物建立和谐共生关系的一类微生物[15]。植物内生菌在植物对受污染环境的适应过程中发挥重要作用:可促进植物在受污染环境下生长[16, 17],减轻污染物对植物的毒害[18],参与植物体内金属离子转运积累和增强植物对重金属的耐受性[19],提高植物对污染物的代谢活性[20, 21]。目前,有关具有毒死蜱降解的活性植物内生菌的研究尚未见报道。 笔者从生长在农药厂废液池旁的植物体内分离筛选到了一株对毒死蜱具有降解作用的植物内生细菌XFP-gy,采用生理生化试验及16SrDNA同源性比对法对其菌属进行了鉴定,并初步测定了其对毒死蜱的降解特性及影响因素,旨在为进一步研究内生菌在植物适应农药污染、代谢体内农药以及增强农药污染植株的修复提供借鉴和材料。
1 材料与方法 1.1 试验材料 1.1.1 供试植物小飞蓬Conyza canadensis (L.) Cronq,采集自江苏省农业科学院农药厂农药废液池旁。
1.1.2 主要试剂97%毒死蜱原药(chlorpyrifos,TC)(南京红太阳股份有限公司); 99.9%毒死蜱标准品(chlorpyrifos,Standard)(德国Dr. Ehrensterfer);色谱纯乙腈(德国Darmstadt);其他试剂除特别说明外均为分析纯。16S rDNA序列扩增引物由上海生工公司合成;2×Taq PCR Master Mix由DBI Bioscience公司提供。
1.1.3 培养基无机盐培养基(MSM):0.4 g MgSO4·7H2O,0.2 g FeSO4·7H2O,0.2 g K2HPO4,0.2 g(NH4)2SO4,0.08 g CaSO4,去离子水1 000 mL,pH 7.0~7.2。富集培养基:3 g牛肉膏,5 g蛋白胨,5 g氯化钠,去离子水 1 000 mL,pH 7. 0~7.2,用于菌株的富集扩大培养。加富培养基:在MSM培养基中加入1 000 mg/L蛋白胨和1 000 mg/L牛肉膏,用于菌株的斜面保存和平板培养。分离纯化培养基:在MSM培养基内添加15~20 g/L琼脂粉。毒死蜱标准品用乙腈配成母液(20 g/L),过0.22 μm细菌过滤器后加入预先灭菌的培养基中至所需浓度。
1.1.4 仪器设备MX-F型漩涡混合器及D1008型离心机(SCILOGEX公司);Life Pro 基因扩增仪(杭州博日科技有限公司);DYY-6C型电泳仪(北京市六一仪器厂);STARTER 2100型实验室pH计(奥豪斯仪器有限公司);a-1506型紫外分光光度计(上海奥析科学仪器有限公司);Agilent Technologies 1200高效液相色谱仪(美国安捷伦科技公司)。
1.2 植物内生毒死蜱降解菌的分离筛选与纯化分别将小飞蓬根、茎、叶用自来水冲洗干净,自然风干后进行表面消毒。消毒步骤参照刘莉华等[22]的方法并做一定修改:先用75%的酒精浸泡3~5 min,再用无菌水冲洗3~4次,用2.5%的 NaClO2漂洗2~5 min,无菌水清洗5次。经表面消毒的植物样品于已灭菌研钵内研磨,吸取汁液均匀涂布于加富培养基平板上,于30 ℃条件下避光培养。待长出菌落后挑取单菌落进一步划线培养于以含毒死蜱为单一碳源的MSM培养基上,进行分离纯化。选取能连续5次在以毒死蜱为惟一碳源的无机盐培养基上生长的菌株,保存于加富培养基斜面上,供进一步研究。
1.3 分离菌株的鉴定 1.3.1 生理生化试验参照东秀珠等的《常见细菌系统鉴定手册》[23]进行。
1.3.2 16SrDNA测序和系统发育分析用灭菌牙签挑取在富集培养基平板上生长24 h的单菌落,放入装有10 μL无菌水的Eppendorf管中搅匀,于100 ℃水浴中温育2 min,离心1 min,冰盒冷却后的上清液用作PCR扩增反应的模板。用于16SrDNA扩增的PCR反应引物为一对原核生物通用引物,正向引物为27F(5-AGAGTTTGATCMTGGCTCAG-3),反向引物为1492R(5-GGTTACCTTGTTACGAC TT-3)。PCR反应体系为2×Taq PCR Mix 10 μL,引物27F与1492R各0.5 μL,DNA模板4 μL,重蒸水5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,循环30次;72 ℃ 10 min;4 ℃保存。PCR产物的纯化和测序委托生工生物工程(上海)股份有限公司完成,测序条件为双向,引物为27F与1492R。将测序得到的长度为 1 052 bp 的16SrDNA序列登陆NCBI,在BLAST中选择16SrDNA核酸对比,然后与GenBank中的16SrDNA核酸数据进行BLAST分析,利用ClustalX 1.8.1进行比对,用MEGA 6.06软件进行多序列同源性分析,用Kimura2-parameter距离模型计算距离并构建Neighbor-Joining系统发育树,数据用Bootstrap法重复检验(1 000次)。同时将序列上传到EzBioCloud,寻找与目的菌株最为相近的模式菌种。 1.4 分离菌株对毒死蜱的降解特性 1.4.1 菌悬液制备
将分离纯化后的菌株接种于富集培养基,在30 ℃、200 r/min下避光培养24 h(对数生长期),取20 mL菌液于4 ℃、5 000 r/min下离心15 min,浓缩菌体用0.85%的无菌生理盐水冲洗3次,用无菌生理盐水稀释配制成菌悬液母液,调整菌液浓度使OD600值为1.0左右。 1.4.2 分离菌株的生长及对毒死蜱的降解特性
以2%的接菌量将菌悬液接种于MSM培养基或加富培养基中,添加毒死蜱至其质量浓度为20 mg/L,测定初始OD600值和毒死蜱含量。以不接菌(加入与接菌液等体积的无菌生理盐水)的培养基作为对照,每处理重复3次。于30 ℃、200 r/min下避光培养,分不同时间取样测定OD600值及毒死蜱残留量。 1.4.3 温度和初始pH值对菌株降解效率的影响
用1 mol/L的氢氧化钠或1 mol/L的盐酸调节MSM培养基的pH值分别为4、5、6、7、8、9,灭菌后,添加毒死蜱至其质量浓度为20 mg/L,按2%的接菌量接入菌悬液,分别置于25、30和35 ℃及200 r/min下避光培养6 d,取样测定培养液中毒死蜱的残留量。每处理重复3次。 1.4.4 接菌量对菌株降解效率的影响
于MSM培养基中分别按0.5%、2%、5%、8%和10%的接菌量接入菌悬液。添加毒死蜱至其质量浓度为20 mg/L,调整培养液的pH值为7.0~7.2,于 30 ℃、200 r/min下避光培养,分别于初始和第3、6、9 天取样测定培养液中毒死蜱残留量。每处理重复3次。 1.4.5 毒死蜱质量浓度对菌株降解效率的影响
将MSM培养基中毒死蜱的初始质量浓度分别设置为100、80、50和10 mg/L,按2%的接菌量接入菌悬液,培养、取样及测定方法同1.4.4节。每处理重复3次。
1.5 毒死蜱提取分析方法 1.5.1 提取及净化取待测液体培养基2 mL,加重蒸石油醚(60~90 ℃)2 mL,振荡2 min,静置分层;重复提取3次;合并有机相,氮气吹干后用色谱纯乙腈定容至1 mL,过0.45 μm滤膜,待高效液相色谱测定。
1.5.2 高效液相色谱条件色谱柱为ZORBA×SB-C18柱(4.6 mm×250 mm,5 μm);流动相为V(乙腈)∶ V(水)=90∶10;流速1.0 mL/min;检测波长290 nm;柱温为室温;进样量20 μL;在上述条件下毒死蜱的保留时间为5.5~5.6 min,检出限为0.05 mg/L。
2 结果与分析 2.1 小飞蓬内生毒死蜱降解菌的分离筛选分别从小飞蓬的根、茎、叶中各分离出一株能连续5次在含50 mg/L毒死蜱的MSM培养基上生长的菌株,其中从根和叶中分离出的内生菌株通过形态观察、生理生化试验和16SrDNA测序结果分析确定为同一菌种。该菌株在以毒死蜱为惟一碳源的MSM培养基上生长良好,命名为XFP-gy。
菌株XFP-gy为革兰氏阴性,杆状。在以毒死蜱为惟一碳源的MSM平板上,XFP-gy生长缓慢,48 h后才可见菌落,且菌落细小稀薄,白色半透明,透明水解带清晰可见。在加富培养基上XFP-gy生长较快,24 h即可见菌落,白色半透明,随培养时间延长,菌落渐变为黄色,部分地方呈放射状,质地光滑黏稠(见图 1)。
 | 图 1 菌株XFP-gy生长48 h的菌落形态Fig. 1 The colonial morphology of strain XFP-gy(48 h) |
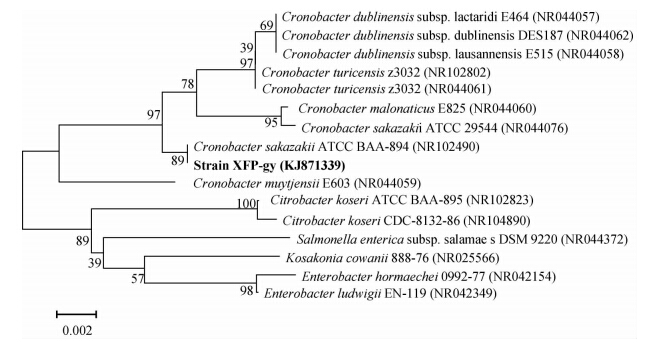 | 各个分支上的数值为经过1 000次重复检验得出的误差百分数。括号中为各菌株的GeneBank序列号。 Bootstrap values obtained with 1 000 repetitions are indicated as percentages at all branches. GeneBank accession numbers are given in brackets.图 2 基于分离菌株XFP-gy与亲缘关系相近菌株的16SrDNA序列的邻接系统发育树Fig. 2 Neighbor-joining phylogenetic tree based on the 16SrDNA gene sequences of strain XFP-gy and relating species |
在NCBI上经BLAST同源性比较发现,菌株XFP-gy(NCBI登记号:KJ871339)与阪崎克罗诺杆菌属中部分菌株的16SrDNA序列相似性达99%以上,其中与菌株Cronobacter sakazakii ATCC BAA-895和Cronobacter sakazakii ATCC 29544的序列相似性分别达99.70%和99.40%。将XFP-gy的16SrDNA序列与相近属种菌株的16S rDNA序列通过比对后构建系统发育树(图 2),表明菌株XFP-gy位于Cronobacter分支,与Cronobacter sakazakii聚于同一分支。在EzBioCloud上,XFP-gy与模式菌种Cronobacter sakazakii ATCC 29544(T)(NCBI登记号: EF088379)的16SrDNA序列相似度为97.41%。结合生理生化试验结果(表 1),初步鉴定菌株XFP-gy属于阪崎克罗诺杆菌属。
| 表 1 菌株XFP-gy的生理生化特性Table 1 Physiological-biochemical characteristics of strain XFP-gy |
以2%接菌量接入XFP-gy,在以20 mg/L毒死蜱为单一碳源的MSM培养基中,菌株XFP-gy生长缓慢,第6天时达到生长高峰,随后缓慢进入衰退期(图 3)。培养基中的毒死蜱在前6 d 被快速降解,随后逐渐变缓,可能是由于菌株生长进入衰退期后降解能力下降,以及MSM培养基中不断积累的毒死蜱降解代谢物阻碍了菌株对毒死蜱的降解[24, 25]。至第9天时毒死蜱的残留量为4.43 mg/L,降解率达77.28%。而在未接菌的对照处理中,第9 天时毒死蜱的降解率仅为0.78%。
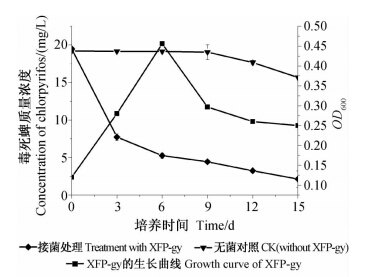 | 图 3 菌株XFP-gy在MSM培养基中的生长曲线及毒死蜱降解曲线Fig. 3 Growth curve of strain XFP-gy and degradation dynamic of chlorpyrifos in MSM |
加富培养基是在MSM培养基中添加了牛肉膏和蛋白胨,补充的碳、氮源可以加速菌株XFP-gy的生长,并提高其对毒死蜱的降解效率。在加富培养基中,菌株XFP-gy在24 h内快速生长并达生长高峰(图 4),积累了大量生物量,之后可快速降解培养液中的毒死蜱,第2 天至第4 天培养液中毒死蜱的含量急剧下降,至第5 天时降解率已达97.95%,第6 天时已检测不到毒死蜱残留。
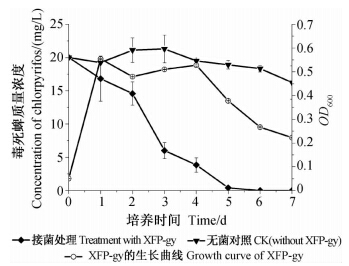 | 图 4 菌株XFP-gy在加富培养基中的生长曲线及毒死蜱降解曲线Fig. 4 Growth curve of strain XFP-gy and degradation dynamic of chlorpyrifos in enriched media |
由图 5可知:在pH 5.0~7.0范围内,菌株XFP-gy对毒死蜱的降解效率较高,最适初始pH为7.0;在相同pH条件下,温度对毒死蜱降解影响不大,30 ℃下降解率略高。30 ℃、pH 7.0条件下培养6 d,毒死蜱降解率达74.35%。
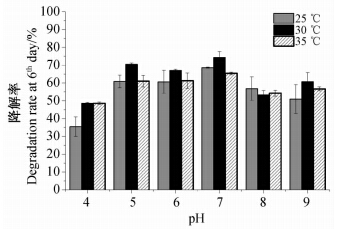 | 图 5 不同温度和初始pH值条件下菌株XFP-gy对毒死蜱的降解率Fig. 5 Degradation rate of chlorpyrifos by strain XFP-gy under different temperature and initial pH value |
由图 6可知:在毒死蜱含量为20 mg/L的MSM培养基中,加大菌株XFP-gy的初始接菌量,其对毒死蜱的降解效率明显提高。接菌量为2%~10%时,毒死蜱在0~3 d被快速降解,随后降解速率变缓;接菌量分别为2%、5%、8%和10%时,第9 天毒死蜱的降解率分别为77.28%、76.97%、86.06%和93.57%;而当接菌量为0.5%时,菌株XFP-gy的适应期延长,0~6 d毒死蜱降解缓慢,6~9 d快速降解,至第9 天时降解率为68.04%。
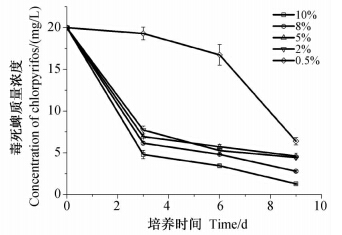 | 图 6 不同接菌量下菌株XFP-gy降解毒死蜱的动态曲线Fig. 6 Degradation dynamic of chlorpyrifos by strain XFP-gy under different initial inoculum amount |
在菌株XFP-gy接菌量为2%、底物毒死蜱的质量浓度在10~100 mg/L范围内时,菌株对毒死蜱的降解率随底物质量浓度的增加逐渐降低(图 7)。当毒死蜱初始质量浓度为10 mg/L时,至第9 天培养液中已检测不到毒死蜱残留;当毒死蜱初始质量浓度分别为50、80 和100 mg/L,至第9 天时其降解率分别为61.67%、41.37%和43.39%。
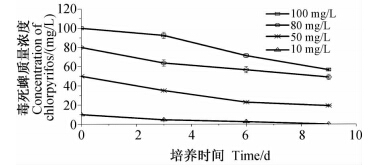 | 图 7 不同底物毒死蜱质量浓度下菌株XFP-gy降解毒死蜱的动态曲线Fig. 7 Degradation dynamic of chlorpyrifos by strain XFP-gy under different initial concentration |
从农药厂废液池旁生长的小飞蓬植株体内,分离到一株能以毒死蜱作为惟一碳源生长的植物内生细菌XFP-gy,其在以含20 mg/L毒死蜱为单一碳源的MSM培养基中,第6 天时生长达到高峰,第9天时对毒死蜱的降解率达77.28%。生理生化指标及16SrDNA同源性比对分析,初步鉴定该菌为阪崎克罗诺杆菌属(Cronobacter sp.),其亲缘关系与阪崎克罗诺杆菌Cronobacter sakazakii最为接近。菌株XFP-gy降解毒死蜱的最适培养条件为30 ℃和pH 值7.0,加大接菌量或降低毒死蜱的初始质量浓度均可提高菌株对毒死蜱的降解效率。已有报道指出,Cronobacter sakazakii属细菌,可用于降解石油和烃类环境污染物[26]及处理酒厂废水中的糖蜜类黑精等[27]。本文首次报道了植物内生菌Cronobacter sp.可降解毒死蜱,进一步拓展了该属细菌在农药污染治理领域的用途。
相对于已报道的从土壤、污泥或污水等特殊环境中分离筛选出的毒死蜱降解菌[11],本文报道的内生菌XFP-gy对毒死蜱的降解活性偏低,这可能与该菌分离自植物体内、受毒死蜱残留选择压力相对较小有关。植物内生菌更重要的作用在于可促进宿主植物生长,提高植物对环境污染的抗逆性,促进植物对污染物的代谢降解,以及增强植物的生物修复作用等[19, 20, 28]。近年来,利用植物内生菌可定植于植物体内的特点进行环境污染的生物修复已成为研究热点[20]:如Andreolli等[29]利用内生菌Burkholderia fungorum DBT1将多环芳烃的生物修复效率提高了99%;Chen等[30]利用内生菌提高了水生植物对污染水源的修复效率;Ho等[31]利用Achromobacter xylosoxidans F3B株系对酚类污染物进行生物修复,接菌植物对污染物的去除率高达100%。另外,利用定植于农作物体内的内生菌对残留农药进行降解,也可能成为保障农药污染区农产品生产安全的一条有效途径。关于植物内生细菌XFP-gy在植物体内的定植,以及其在植物代谢体内残留农药及适应农药污染中的作用还需进一步深入研究。
致谢:感谢江苏省农业科学院食品质量安全与检测研究所仪器分析一室为本实验提供了HPLC仪器,以及仲建锋博士、沈燕博士、张霄博士和徐重新等人对试验进程的指导!| [1] | 王家文. 毒死蜱市场竞争优势及发展建议[J]. 精细化工原料及中间体, 2010(2): 17-21. Wang Jiawen. Market competitive advantages and development suggetions of chlorpyrifos[J]. Fine Chem Ind Raw Mater Intermed, 2010(2): 17-21.(in Chinese) |
| [2] | 陈舜华, 钟创光, 赵小奎. 几种淡水动植物对14C-毒死蜱的吸收、分布和消长的研究[J]. 核农学报, 1998, 12(5): 286-292. Chen Shunhua, Zhong Chuangguang, Zhao Xiaokui. Absorption, distribution, dynamics of 14C-chlorpyrifos in several kinds of animals and plants in fresh water ecosystem[J]. Acta Nucleatae Sinica, 1998, 12(5): 286-292.(in Chinese) |
| [3] | López-Mancisidor P, Carbonell G, Fernández C, et al. Ecological impact of repeated applications of chlorpyrifos on zooplankton community in mesocosms under mediterranean conditions[J]. Ecotoxicology, 2008, 17(8): 811-825. |
| [4] | Berent S, Giordani B, Albers J W, et al. Effects of occupational exposure to chlorpyrifos on neuropsychological function: a prospective longitudinal study[J]. Neurotoxicology, 2014, 41: 44-53. |
| [5] | Johnson D E, Seidler F J, Slotkin T A. Early biochemical detection of delayed neurotoxicity resulting from developmental exposure to chlorpyrifos[J]. Brain Res Bull, 1998, 45(2): 143-147. |
| [6] | Raun Andersen H, Vinggaard A M, Hj Rasmussen T, et al. Effects of currently used pesticides in assays for estrogenicity, androgenicity, and aromatase activity in vitro[J]. Toxicol Appl Pharmacol, 2002, 179(1): 1-12. |
| [7] | Alavanja M C, Dosemeci M, Samanic C, et al. Pesticides and lung cancer risk in the agricultural health study cohort[J]. American J Epidemiol, 2004, 160(9): 876-885. |
| [8] | Lee W J, Blair A, Hoppin J A, et al. Cancer incidence among pesticide applicatiors exposed to chlorpyrifos in the agricultural health study[J]. J National Cancer Inst, 2004, 96(23): 1781-1789. |
| [9] | 武春媛, 陈楠, 李勤奋, 等. 毒死蜱降解菌及其降解机理研究进展[J]. 热带作物学报, 2011, 32(10): 1989-1994. Wu Chunyuan, Chen Nan, Li Qinfen, et al. Research progress in chlorpyrifos degrading microorganisms and biodegrading mechanisms[J]. Chinese J Trop Crops, 2011, 32(10): 1989-1994.(in Chinese) |
| [10] | 刘红梅, 戚晓娴, 刘婕, 等. 微生物降解酶制剂对采后甘蓝毒死蜱残留的去除作用[J]. 广东农业科学, 2013, 39(20): 73-76. Liu Hongmei, Qi Xiaoxian, Liu Jie, et al. Degradation of chlorpyrifos residual by enzyme preparation in the postharvest cabbage, Brassica oleracea[J]. Guangdong Agric Sci, 2013,39(20): 73-76.(in Chinese) |
| [11] | 杨丽, 赵宇华, 张炳欣, 等. 一株毒死蜱降解细菌的分离鉴定及其在土壤修复中的应用[J]. 微生物学报, 2005, 45(6): 905-909. Yang Li, Zhao Yuhua, Zhang Bingxin, et al. Isolation and characterization of a chlorpyrifos degrading bacteria and its bioremediation application in soil[J]. Acta Microbiologica Sinca, 2005, 45(6): 905-909.(in Chinese) |
| [12] | 兰亚红, 谢明, 陈福良, 等. 施氏假单胞菌JHY01菌株毒死蜱降解酶的定位及其提取条件的优化[J]. 中国生物防治, 2008, 24(4): 349-353. Lan Yahong, Xie Ming, Chen Fuliang, et al. Localization and extraction conditionss of chlorpyrifos-degrading enzyme from Pseudomonas stutzeri[J]. Chinese J Biol Control, 2008, 24(4): 349-353.(in Chinese) |
| [13] | 王利, 余贤美, 贺春萍, 等. 毒死蜱降解细菌 WJl-063 的鉴定及酶促降解特性[J]. 热带作物学报, 2009, 30(3): 357-361. Wang Li, Yu Xianmei, He Chunping, et al. Identification of chlorpyrifos-degrading bacterial strain and characterization of its enzymatic degradation[J]. Chinese J Trop Crops, 2009, 30(3): 357-361.(in Chinese) |
| [14] | 钟国华, 何玥, 刘萱清, 等. 毒死蜱高效降解酶保护剂配方优化及稳定性[J]. 中国农业科学, 2009, 42(1): 136-144. Zhong Guohua, He Yue, Liu Xuanqing, et al. Optimization of enzyme protectant of chlorpyrifos-biodegradation fungi and its stability[J]. Scientia Agricultura Sinica, 2009, 42(1): 136-144.(in Chinese) |
| [15] | Wilson D. Endophyte: the evolution of a term, and clarification of its use and definition[J]. Oikos, 1995, 73(2): 274-276. |
| [16] | Ho Y N, Shih C H, Hsiao S C, et al. A novel endophytic bacterium, Achromobacter xylosoxidans, helps plants against pollutant stress and improves phytoremediation[J]. J Biosci Bioeng, 2009, 108(1): S75-S95. |
| [17] | Zhang Yanfeng, He Linyan, Chen Zhaojin, et al. Characterization of lead-resistant and ACC deaminase-producing endophytic bacteria and their potential in promoting lead accumulation of rape[J]. J Hazard Mater, 2011, 186(2-3): 1720-1725. |
| [18] | Weyens N, Truyens S, Dupae J, et al. Potential of the TCE-degrading endophyte Pseudomonas putida W619-TCE to improve plant growth and reduce TCE phytotoxicity and evapotranspiration in poplar cuttings[J]. Environ Pollut, 2010, 158(9): 2915-2919. |
| [19] | Chen Liang, Luo Shenglian, Xiao Xiao, et al. Application of plant growth-promoting endophytes(PGPE) isolated from Solanum nigrum L. for phytoextraction of Cd-polluted soils[J]. Appl Soil Ecol, 2010, 46(3): 383-389. |
| [20] | Newman L A, Reynolds C M. Bacteria and phytoremediation: new uses for endophytic bacteria in plants[J]. Trends Biotechnol, 2005, 23(1): 6-8. |
| [21] | Phillips L A, Germida J J, Farrell R E, et al. Hydrocarbon degradation potential and activity of endophytic bacteria associated with prairie plants[J]. Soil Biol Biochem, 2008, 40(12): 3054-3064. |
| [22] | 刘莉华, 刘淑杰, 陈福明, 等. 接种内生细菌对龙葵吸收积累镉的影响[J]. 环境科学学报, 2013, 33(12): 3368-3375. Liu Lihua, Liu Shujie, Chen Fuming, et al. Effect of endophytic bacteria inoculation on cadmium uptake in Solanum nigrum L[J]. Acta Scientiae Circumstantiae, 2013, 33(12): 3368-3375.(in Chinese) |
| [23] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. Dong Xiuzhu, Cai Miaoying. Common Bacteria Identification System Manual[M]. Beijing: Science Press, 2001.(in Chinese) |
| [24] | Briceño G, Fuentes M S, Palma G, et al. Chlorpyrifos biodegradation and 3,5,6-trichloro-2-pyridinol production by actinobacteria isolated from soil[J]. Inter Biodet Biodegrad, 2012, 73: 1-7. |
| [25] | Li Jingquan, Liu Juan, Shen Wenjing, et al. Isolation and characterization of 3,5,6-trichloro-2-pyridinol-degrading Ralstonia sp. strain T6[J]. Bioresour Technol, 2010, 101(19): 7479-7483. |
| [26] | Jain R M, Mody K, Mishra A, et al. Isolation and structural characterization of biosurfactant produced by an alkaliphilic bacterium Cronobacter sakazakii solated from oil contaminated wastewater[J]. Carbohyd Polym, 2012, 87(3): 2320-2326. |
| [27] | Yadav S, Chandra R. Biodegradation of organic compounds of molasses melanoidin(MM) from biomethanated distillery spent wash(BMDS) during the decolourisation by a potential bacterial consortium[J]. Biodegradation, 2012, 23(4): 609-620. |
| [28] | Barac T, Taghavi S, Borremans B, et al. Engineered endophytic bacteria improve phytoremediation of water-soluble, volatile, organic pollutants[J]. Nature Biotechnol, 2004, 22(5): 583-588. |
| [29] | Andreolli M, Lampis S, Poli M, et al. Endophytic Burkholderia fungorum DBT1 can improve phytoremediation efficiency of polycyclic aromatic hydrocarbons[J]. Chemosphere, 2013, 92(6): 688-694. |
| [30] | Chen W M, Tang Y Q, Mori K, et al. Distribution of culturable endophytic bacteria in aquatic plants and their potential for bioremediation in polluted waters[J]. Aquatic Biol, 2012, 15(2): 99-110. |
| [31] | Ho Y N, Mathew D C, Hsiao S C, et al. Selection and application of endophytic bacterium Achromobacter xylosoxidans strain F3B for improving phytoremediation of phenolic pollutants[J]. J Hazard Mater, 2012, 219-220: 43-49. |
 2015, Vol. 17
2015, Vol. 17


