大白菜霜霉病是由寄生霜霉Peronospora parasitica(Pers.) Fr.侵染所致的世界性病害,主要发生在春秋两季,喜较低的温度,在多雨高湿或雾大露重的条件下易发生,流行年份可造成减产50%~60%[1]。
氟吡菌胺(fluopicolide)是由德国拜耳公司研发的苯甲酰胺类杀菌剂,对马铃薯晚疫病菌、葡萄霜霉病菌及黄瓜霜霉病菌均具有优异的杀菌活性[2,3]。但目前尚未见关于寄生霜霉对氟吡菌胺敏感性的研究报道。笔者拟通过系统研究氟吡菌胺对寄生霜霉不同生长发育阶段的影响,以期明确氟吡菌胺对该病原菌各生长发育阶段的抑制活性,并建立其敏感基线,为进一步探索氟吡菌胺对寄生霜霉的作用机制以及田间抗药性监测提供参考。
1 材料与方法 1.1 供试材料
药剂:97.20%氟吡菌胺(fluopicolide,德国拜耳作物科学有限公司)原药,由中国农业大学刘西莉教授惠赠。定量称取氟吡菌胺原药(粉末),以丙酮为溶剂,配成质量浓度为1×104 μg/mL的母液。将母液用无菌水稀释得到系列浓度梯度药液。
菌株: 于2011—2012年间分别从山东省潍坊市、烟台市、济南市和青岛市等不同地区未施用过苯甲酰胺类杀菌剂的大白菜田采集寄生霜霉样本60份,采用离体子叶冷冻法[4]保藏于青岛农业大学真菌学研究室,用于氟吡菌胺的室内毒力测定。其中一个菌株C1116采自山东省青岛市农业科学院试验田,为对氟吡菌胺敏感的田间野生菌株,用于测定氟吡菌胺对寄生霜霉不同生长发育阶段的影响。 取出冰箱中冷冻保藏的菌株,用无菌水洗脱霉层,接种至健康子叶背面,置于 15 ℃、12 h光/暗交替条件下保湿培养6~7 d至长出新鲜霉层,用无菌水洗脱新鲜霉层,制成孢子囊悬浮液,于显微镜(10×10)下调节孢子囊悬浮液的浓度至2×104 spore/mL,备用。
寄主植物:选用易感病的大白菜品种“鲁白七号”保存并繁殖病菌,幼苗培养参照杨丽娟等[4]的方法进行。 1.2 试验方法 1.2.1 氟吡菌胺对寄生霜霉的室内毒力测定
采用笔者等创立的离体子叶浸泡法[5]测定氟吡菌胺对60株寄生霜霉菌株的室内毒力。 采摘大小一致、生长健壮的大白菜子叶,用自来水冲洗干净后,将子叶从叶柄基处剪下,自然晾干。分别取10 mL各浓度的药液于直径为60 mm的玻璃培养皿中,加入10 μL 体积分数为5%的Tween-20,混匀。将子叶背面朝下浸泡于药液中,每皿10片子叶,于15 ℃、12 h光/暗交替培养箱中浸泡3 h后接种。空白对照采用含等量丙酮的无菌水处理。将浸泡好的子叶转移至直径为14 cm的培养皿中,底层铺无菌水润湿的滤纸,子叶背面朝上置于湿滤纸上,待其自然晾干或风干后,将配好的新鲜孢子囊悬浮液接种于子叶背面,每片子叶接种10 μL,转入15 ℃、12 h光/暗交替培养箱中培养6~7 d。待对照发病率达到80%后进行病情调查, 测量各处理子叶的病斑面积, 参照杨丽娟等[4]的标准,根据病斑面积占子叶总面积的百分比划分病级。按公式(1)和(2)分别计算病情指数及抑制率。

参考张纯胄等[6]所用的凹玻片保湿法并有改进。吸取40 μL新鲜孢子囊悬浮液(2×104 spore/mL)于灭菌的凹玻片上,分别与6个不同质量浓度(1.08、0.72、0.48、0.32、0.16、0.08 μg/mL)的氟吡菌胺药液等量混合,使得稀释后药剂的质量浓度分别为0.54、0.36、0.24、0.16、0.08和0.04 μg/mL。每处理设3次重复,空白对照为含等量丙酮的无菌水。将凹玻片置于塑料培养皿中保湿,于15 ℃、12 h光/暗条件下培养 5 h后,在显微镜(10×10)下随机观察3个视野中孢子囊的萌发 情况(芽管长度大于孢子囊的短半径则视为萌发),要求孢子囊总数不低于200个,计算孢子囊萌发率[7]。根据对照及各处理的萌发率,按(3)式计算孢子囊萌发抑制率。
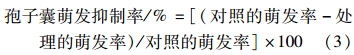
采用凹玻片保湿法[6]。吸取50 μL新鲜孢子囊悬浮液(2×104 spore/mL)于灭菌凹玻片上,分别与2.16、1.44、0.96、0.64和0.16 μg/mL的氟吡菌胺药液等量混合,使稀释后药剂的质量浓度分别为1.08、0.72、0.48、0.32、0.16和0.08 μg/mL。每处理设3次重复,空白对照为含等量丙酮的无菌水。将凹玻片置于塑料培养皿中保湿,于15 ℃、12 h光/暗条件下培养3 h后,采用Olympus BX53 显微镜拍照记录芽管的初始长度,继续于15 ℃、12 h光/暗条件下培养5 h后,再次显微拍照记录芽管伸长情况,测量芽管的最终长度,按照公式(4)和(5)分别计算芽管伸长量及芽管伸长抑制率。

采用离体子叶浸泡法[5]测定,试验具体操作步骤参见王岩等[8]的叶碟法,药剂浓度梯度为8.00、4.00、2.00、1.00、0.50和0.25 μg/mL,浸泡时间改为3 h。
病斑面积调查:参考乔桂双等[9]所用的方法并进行了改进。以五角硬币为参照,拍照记录各处理和对照子叶的病斑,通过Adobe Photoshop CS5软件计算子叶上病斑与五角硬币的面积比,换算出病斑的实际面积,根据公式(6)计算病斑面积扩展量,按(7)式求得各浓度处理的病斑扩展抑制率。
孢囊梗密度调查方法:用透明胶带将子叶背面的病斑粘贴在载玻片上,于显微镜(10×10)下观察孢囊梗密度,并拍照记录。
产孢量调查方法:用10 mL离心管将每处理中10片子叶背面的病斑充分洗脱,制成孢子囊悬浮液,混匀后吸取20 μL,于显微镜(10×10)下计数,并换算为每毫升孢子囊悬浮液中所含的孢子囊数量,进而得到单位病斑面积的产孢量。

以药剂浓度的对数为横坐标,抑制率机率值为纵坐标作毒力回归曲线。试验结果中的所有萌发率和抑制率均通过反正弦转换,采用SAS 9.2 软件的最小显著差异法(LSD法)比较各处理萌发率和抑制率的差异显著性。 2 结果与分析 2.1 寄生霜霉对氟吡菌胺的敏感基线
氟吡蓖胺对 60株寄生霜霉菌株的毒力测定结果(见图 1)表明:各菌株之间对该杀菌剂的敏感性差异较小,其中菌株LY01的EC50值最大,为0.802 2 μg/mL,而菌株C1305的EC50值最小,为0.163 2 μg/mL,两者相差4.92倍。
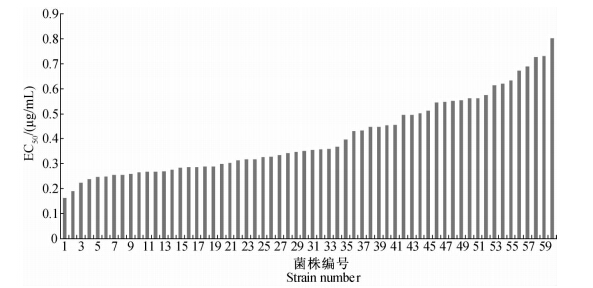 | 图 1 供试60株寄生霜霉对氟吡菌胺的EC50值分布Fig. 1 Distribution of EC50 values of 60 tested isolates ofP.parasitica to fluopicolide |
采用SPSS软件进行K-S法正态性检验,得Z=1.320,P=0.061(>0.05),表明60株寄生霜霉菌株对氟吡菌胺的敏感性频率符合正态分布(见图 2)。根据野生型病原菌群体对药剂敏感性为正态分布的原理[10],可将这些菌株的EC50平均值0.405 3 μg/mL 作为寄生霜霉对氟吡菌胺抗药性监测的敏感基线。
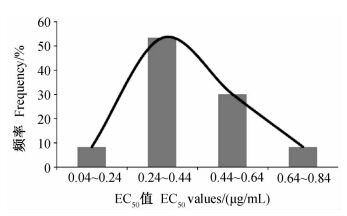 | 图 2 供试60株寄生霜霉对氟吡菌胺的敏感性频率分布Fig. 2 Sensitivity frequency distribution of 60 tested isolatesof P.parasitica to fluopicolide |
试验结果(见表 1)表明:氟吡菌胺能够有效地抑制寄生霜霉离体孢子囊的萌发,且随着药剂浓度升高,抑制效果越明显。当药剂质量浓度不低于0.16 μg/mL时,各处理的平均萌发率与对照之间差异显著,当药剂质量浓度为0.54 μg/mL时则能完全抑制病原菌孢子囊的萌发。其毒力回归方程为y=4.602 4X+9.352 4(R2 =0.933 2),有效抑制中浓度(EC50)为0.113 3 μg/mL。
|
|
表 1 氟吡菌胺对寄生霜霉离体孢子囊萌发的影响 Table 1 Effect of fluopicolide on sporangium germination in vitro of P.parasitica |
试验结果(见表 2)表明:随药剂浓度升高,氟吡菌胺对寄生霜霉芽管伸长的抑制率也逐渐升高,且不同浓度处理间差异显著,当药剂质量浓度为1.08 μg/mL时,抑制率达95.29%。其毒力回归方程为y=2.337 7X+6.250 5(R2=0.944 4),EC50值为0.291 8 μg/mL。
|
|
表 2 氟吡菌胺对寄生霜霉芽管伸长的影响(n=3) Table 2 Effect of fluopicolide on germ tube elongation of P.parasitica |
表 3中结果表明:氟吡菌胺能够有效抑制已发病大白菜子叶上病斑的扩展,当药剂质量浓度≥1.00 μg/mL时,各处理病斑扩展量与对照间差异显著,药剂对病斑扩展的抑制率也与最低浓度处理组之间差异显著。其毒力回归方程为y=1.119 8X+5.091 9(R2=0.944 2),EC50值为0.827 8 μg/mL。
|
|
表 3 氟吡菌胺对寄生霜霉病斑扩展和孢子囊形成的影响(n=3) Table 3 Effect of fluopicolide on lesion expansion and sporangial formation of P.parasitica |
氟吡菌胺能够有效抑制寄生霜霉孢囊梗的形成,且随药剂浓度升高,孢囊梗的密度明显降低(图 3)。
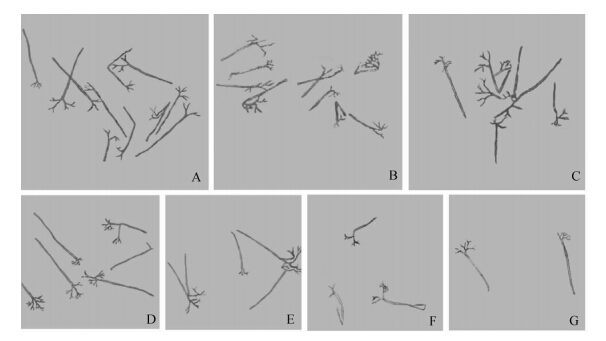 | 图 3 氟吡菌胺对寄生霜霉孢囊梗形成的影响(10×10)Fig. 3 Effect of fluopicolide on sporangiophore formation of P.parasitica(10×10) A.对照CK;B.0.25 μg/mL;C.0.50 μg/mL;D.1.00 μg/mL;E.2.00 μg/mL;F.4.00 μg/mL;G.8.00 μg/mL |
氟吡菌胺对寄生霜霉孢子囊形成的抑制结果见表 3。单位病斑面积产孢量随药剂浓度升高有所降低,但差异不明显,当药剂质量浓度≥4.00 μg/mL时,对产孢的抑制率与最低浓度处理组间差异显著。其毒力回归方程为y=0.883 5X+4.889 8(R2=0.938 2),EC50值为1.332 7 μg/mL。 3 结论与讨论
本研究表明,氟吡菌胺对寄生霜霉各生长发育阶段均有抑制作用,其中对离体孢子囊萌发阶段的抑制效果最明显,此外依次是芽管伸长阶段和病斑扩展阶段,最不敏感的是产孢阶段。因此,在相关的生物测定试验中,不宜采用常规的孢子萌发抑制法测定氟吡菌胺对寄生霜霉的抑菌作用。基于药剂对病原菌扩展的抑制作用,并综合考虑试验方法的可操作性、稳定性及准确性,推荐采用离体子叶浸泡法[5]测定氟吡菌胺对病斑扩展的EC50值,用以建立敏感基线并进行田间抗药性监测。本研究确定了寄生霜霉对氟吡菌胺的敏感基线为0.405 3 μg/mL,供试60株寄生霜霉菌株的EC50值呈连续的单峰曲线分布,敏感性频率分布近似正态分布,未出现抗药性亚群体。所得结果可为寄生霜霉对氟吡菌胺的抗性风险评估提供依据。
氟吡菌胺的作用机制独特,Toquin等[11]认为,氟吡菌胺的作用机理是影响类似血影蛋白的蛋白,诱导这些蛋白在菌丝和游动孢子中从细胞膜到细胞质的快速重新分配,从而影响膜的稳定,尤其是菌丝的顶端伸长。已有文献报道其对卵菌病原菌生命周期的多个阶段均有作用,且主要影响游动孢子的释放和孢子囊的萌发; 而咪唑菌酮(fenamidone)、烯酰吗啉(dimethomorph)、甲霜灵(metalaxyl)、苯酰菌胺(zoxamide)及丙森锌(iprovalicarb)等杀菌剂均未显示具有类似的作用机制[3]。因此氟吡菌胺可与目前大多数杀菌剂交替使用,且其与大多数杀菌剂尚无交互抗性报道[12],是较理想的卵菌纲杀菌剂。
| [1] | 裘维蕃. 农业植物病理学[M]. 北京: 农业出版社, 1982: 403. Chiu Weifan. Agricultural Plant Pathology[M]. Beijing: Agronomy Press, 1982: 403.(in Chinese) |
| [2] | 朱卫刚, 胡伟群, 张蕊蕊, 等. 新型杀菌剂氟吡菌胺室内杀菌活性[J]. 农药, 2012, 51(12): 922-923. Zhu Weigang, Hu Weiqun, Zhang Ruirui, et al. Study on the fungicidal activity of novel fungicide fluopicolide[J]. Agrochemicals, 2012, 51(12): 922-923.(in Chinese) |
| [3] | Tafforeau S, Wegmann T, Latorse M P, et al. Fluopicolide, a novel fungicide with a unique mode of action, setting a new standard for Oomycete control [C]//Proceedings of the BCPC International Congress-Crop Science & Technology 2005. Glasgow: British Crop Protection Council, 2005:79-86. |
| [4] | 杨丽娟, 梁晨, 李宝笃. 大白菜霜霉病菌寄生霜霉孢子囊的保藏方法[J]. 菌物学报, 2013,32(6): 1071-1078. Yang Lijuan, Liang Chen, Li Baodu. The preservation methods for sporangia of Chinese cabbage downy mildew pathogen Peronospora parasitica[J]. Mycosystema, 2013, 32(6): 1071-1078.(in Chinese) |
| [5] | 杨丽娟, 赵洪海, 梁晨, 等. 一种测定大白菜霜霉病菌对甲霜灵敏感性方法的建立及应用[J]. 植物保护, 2015, 41(1): 122-125. Yang Lijuan, Zhao Honghai, Liang Chen, et al. Establishment and application on a method for testing the sensitivity of Peronospora parasitica to metalaxyl[J]. Plant Protection, 2015, 41(1):122-125.(in Chinese) |
| [6] | 张纯胄, 胡学博, 陈永兵, 等. 几种杀菌剂对白菜霜霉病菌孢子萌发的抑制及田间药效[J]. 浙江农业学报, 2000, 12(2): 104-105. Zhang Chunzhou, Hu Xuebo, Chen Yongbing, et al. Suppression of several fungicides on sporangia germination of Peronospora parasitica and their field efficiency [J]. Acta Agriculturae Zhejiangensis, 2000, 12(2): 104-105.(in Chinese) |
| [7] | 慕立义. 植物化学保护研究方法[M]. 北京: 中国农业出版社, 1997: 74. Mu Liyi. The Research Methods of Plant Chemical Protection [M]. Beijing: China Agriculture Press, 1997: 74.(in Chinese) |
| [8] | 王岩, 冯明鸣, 刘西莉, 等. 黄瓜霜霉病菌不同发育阶段对烯肟菌酯的敏感性[J]. 中国农业科学, 2006, 39(9): 1810-1816. Wang Yan, Feng Mingming, Liu Xili, et al. Sensitivity of Pseudoperonospora cubensis at different development stages to enostrobilurin[J]. Scientia Agricultura Sinica, 2006, 39(9): 1810-1816.(in Chinese) |
| [9] | 乔桂双, 王文桥, 韩秀英, 等. 两种候选甲氧基丙烯酸酯类杀菌剂对黄瓜霜霉病的作用方式[J]. 植物保护学报, 2009, 36(2): 173-178.(in Chinese) Qiao Guishuang, Wang Wenqiao, Han Xiuying, et al. Mode of action of two candidate strobilurin fungicides against cucumber downy mildew[J]. Acta Phytophylacica Sinica, 2009, 36(2): 173-178.(in Chinese) |
| [10] | 盖钧镒. 试验统计方法[M]. 北京: 中国农业出版社, 2000: 58-59. Gai Junyi. Methods of Experimental Statistics [M].Beijing: China Agriculture Press, 2000: 58-59.(in Chinese) |
| [11] | Toquin V, Barja F, Sirven C, et al. Novel tools to identify the mode of action of fungicides as exemplified with fluopicolide[M]//Gisi U,Chet I,Gullino L M. Recent Developments in Management of Plant Diseases, Plant Pathology in the 21st Century Contributions to the 9th International Congress 1, New York: Springer, 2010:19-36. |
| [12] | 翟明涛, 王开运, 许辉, 等. 抗氟吡菌胺辣椒疫霉菌株的诱导及其生物学特性的研究 [J]. 植物病理学报, 2014, 44(1): 88-96. Zhai Mingtao, Wang Kaiyun, Xu Hui, et al. Induction and characteristics of Phytophthora capsici isolates resistant to fluopicolide[J]. Acta Phytopathologica Sinica, 2014, 44(1): 88-96.(in Chinese) |
 2015, Vol.
2015, Vol. 


