拟除虫菊酯类杀虫剂(pyrethroid insecticides)是在天然除虫菊素的化学结构基础上衍生的一类超高效杀虫剂,其杀虫毒力显著优于有机氯、有机磷和氨基甲酸酯类等杀虫剂,对鳞翅目、鞘翅目、双翅目、半翅目及蜚蠊目等农业和卫生害虫均有极高的防治效果[1,2]。研究表明,拟除虫菊酯类杀虫剂在昆虫体内主要作用于神经系统,延缓轴突膜内外电压敏感性钠通道的开闭,且对电压敏感的钙通道、氯通道以及γ-氨基丁酸受体等具有抑制作用,从而扰乱昆虫神经系统的正常生理功能,致使昆虫死亡[3]。近年来,农药残留毒性及其对动物内分泌的扰乱作用引起了世界各国科学家的高度关注[4]。拟除虫菊酯类杀虫剂被划分为环境内分泌干扰物(Endocrine disrupting chemicals)[5],具有环境激素类物质的特性,对哺乳动物的神经系统、心血管系统、免疫和肝脏等正常生理活动均有很大影响[6,7],即使是低剂量的长期接触也会引起高等动物慢性疾病[8,9]。
I型(不含CN基)和II型(含CN基)拟除虫菊酯类杀虫剂均对害虫具有高效的杀虫活性,目前有关其对昆虫细胞的毒性及差异性研究尚未见报道,尤其对高等动物细胞的毒性作用更有待深入研究。本研究以氯菊酯(permethrin)和高效氯氰菊酯(β-cypermethrin)为研究对象,比较研究 I型 和II型拟除虫菊酯类杀虫剂对果蝇胚胎S2、草地贪夜蛾Sf-9细胞系以及人子宫颈癌HeLa细胞系、人肝癌HepG2细胞系和人胚胎肾上皮HEK293细胞系等的毒性,旨在为阐明拟除虫菊酯类杀虫剂的高效杀虫活性和对哺乳动物生理毒性提供细胞学依据。
1 材料与方法 1.1 供试细胞株
果蝇胚胎S2细胞系(Drosophila Schneider 2 cell line,S2)、草地贪夜蛾卵巢Sf-9细胞系(Spodoptera frugiperdaSf-9 cell line,Sf-9)、人子宫颈癌HeLa细胞系(Human cervical carcinoma cell line,HeLa)、人肝癌HepG2细胞系(Human hepatocellular carcinoma cell line,HepG2)和人胚胎肾上皮HEK293细胞系(Human embryonic kidney 293 cell line,HEK293)均购自中国科学院细胞研究所,由本实验室长期保存。S2细胞采用Schneiders Drosophila昆虫培养基于28℃恒温培养;Sf-9细胞采用SFX昆虫培养基于28℃恒温培养;HeLa、HepG2和Hek293细胞均采用Dulbeccos Modified Eagles Medium(DMEM)高糖培养基于37℃的二氧化碳恒温培养箱中培养。上述3种培养基中均添加质量分数为10%的胎牛血清和1%的青霉素-链霉素溶液。 1.2 供试试剂及配制
98%高效氯氰菊酯(β-cypermethrin)和95%氯菊酯(permethrin)原药,由上海市农药研究所惠赠。Schneiders Drosophila昆虫培养基和SFX昆虫培养基,购自美国Gibco Invitrogen公司;DMEM培养基、1%的青霉素-链霉素溶液和胎牛血清,均购自美国HyClone公司;噻唑蓝(MTT)和牛血清白蛋白(BSA),均购自美国Biosharp公司;二甲亚砜(DMSO)和胰蛋白酶Trypsin(0.25% EDTA),购自北京索来宝科技有限公司;其他试剂均购自上海凌峰化学试剂有限公司。
高效氯氰菊酯和氯菊酯母液配制:准确称取原药100.0 mg,用DMSO溶解并配制成质量浓度为1.0×104 μg/mL的母液,于4 ℃棕色瓶中保存。使用时用无血清细胞培养基稀释,使每处理中DMSO的浓度低于1.0%。
MTT母液的配制:准确称取MTT粉末50.0 mg,以与细胞相应的无血清培养基定容至10 mL,抽滤得质量浓度为5.0 mg/mL的母液,置于4 ℃保存,备用。
吖啶橙染液的配制:准确称取吖啶橙粉末1.0 mg,溶解于10 mL 磷酸盐生理盐水(PBS,pH 7.2)中,配制成质量浓度为100 μg/mL的储备液,置于4 ℃保存,备用,使用时等量稀释。 1.3 细胞活力测定
采用MTT法并稍作改进[10]。取密度为1×106 cells/mL并处于对数生长期的细胞,接种到96孔细胞培养板的第2~7行,每孔100 μL,分别置于28 ℃和37 ℃恒温培养箱中培养。待单层细胞贴壁生长至约70%汇合度(confluence)时,第1行加入细胞培养基,作空白对照;第2行加入含1%DMSO的细胞培养基,作溶剂对照;其他各行依次加入经细胞培养基处理的高效氯氰菊酯或氯菊酯稀释液,每孔加液量均为100 μL。高效氯氰菊酯或氯菊酯质量浓度分别为10、25、50、75、100、125、150、175、和200 μg/mL。试验设3次重复。分别于培养24和72 h后,向每孔中加入20 μL 0.5 mg/mL的MTT,再分别置于28 ℃或37 ℃恒温培养箱中继续孵育4 h。去除培养基,加入150 μL DMSO溶解蓝紫色结晶甲瓒(formazan),置摇床上低速振荡10 min后用MultiSkan FC 酶标仪(美国Thermo Scientific公司)分别在波长 493 nm和630 nm处测定吸光度值(OD值),按(1)式计算药剂对供试细胞活力抑制率。采用最小二乘法计算药剂对细胞的半数抑制浓度(IC50)和毒力回归方程。
细胞活力抑制率/%=[1-(处理孔平均OD值/对照孔平均OD值)]×100(1) 1.4 细胞形态观察
取密度为1×106 cells/mL并处于对数生长期的HeLa细胞接种于96孔细胞培养板中,置于37 ℃恒温二氧化碳培养箱中培养,待单层细胞贴壁生长至约70%汇合度时,分别加入经细胞培养基处理的高效氯氰菊酯和氯菊酯,使终浓度为100 μg/mL。分别于处理24、48和72 h后收集细胞,用PBS清洗2次后,再用PBS将细胞悬浮。取100 μL细胞悬浮液与4 μL吖啶橙染液混匀30 s后涂布于载玻片上,盖上盖玻片,置于用蓝光激发的荧光显微镜下观察细胞形态,并进行拍照。 1.5 数据统计分析
所有数据均表示为平均值±标准差(SD)。以药剂的质量浓度对数(logρ)为横坐标,细胞活力抑制率(%)为纵坐标进行绘图,来显示药剂对细胞活力影响的作用规律。使用SPSS17.0软件(SPSS Inc.,美国)进行数据分析,采用变异数方差分析法(Analysis of Variance)进行差异显著性分析,并进行LSD检验。差异显著性水平设为0.05。
2 结果与分析 2.1 高效氯氰菊酯和氯菊酯对昆虫S2和Sf-9细胞活力的影响
经药剂处理24 h后,S2和Sf-9细胞活力均随药剂质量浓度的升高而逐渐降低。图 1结果表明:当药剂处理浓度大于50 μg/mL时,高效氯氰菊酯和氯菊酯对S2和Sf-9细胞活力的抑制作用均表现出逐渐增强的趋势,两者对S2的抑制作用差异不显著,但高效氯氰菊酯对Sf-9细胞活力的抑制作用显著强于氯菊酯的(P<0.05);当药剂质量浓度为10和25 μg/mL时,高效氯氰菊酯和氯菊酯均能促进S2和Sf-9细胞增殖,但S2细胞对低浓度药剂更敏感,且氯菊酯对S2细胞增殖的促进作用显著强于高效氯氰菊酯的(P<0.05)。
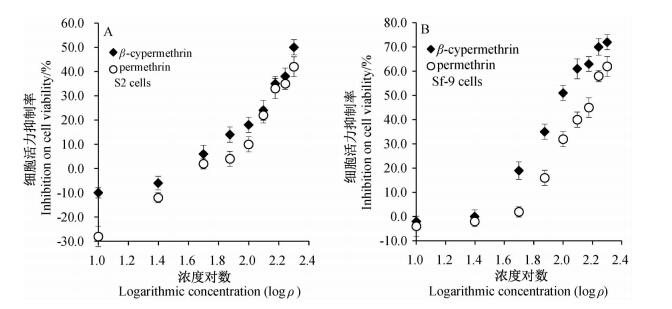 | 图 1 高效氯氰菊酯和氯菊酯对昆虫S2(A)和Sf-9(B)细胞活力的影响Fig. 1 Inhibitory activity of permethrin and β-cypermethrin on the viability of S2(A) and Sf-9(B) cells |
结果(图 2)表明:两种药剂对HeLa和HepG2细胞活力的抑制作用均随着药剂质量浓度的升高而逐渐降低,随着暴露时间的延长而显著增强;高效氯氰菊酯对HeLa细胞增殖基本没有促进作用,但10、25和50 μg/mL氯菊酯在处理24 h后能显著促进HeLa细胞增殖,72 h后此作用显著减弱(P<0.05);HepG2细胞对药剂的敏感性显著强于HeLa的,同浓度药剂对HepG2细胞活力的抑制作用也显著高于HeLa细胞。当浓度大于50 μg/mL时,两种药剂对HeLa和HepG2细胞活力的抑制作用无显著差异(P<0.05)。
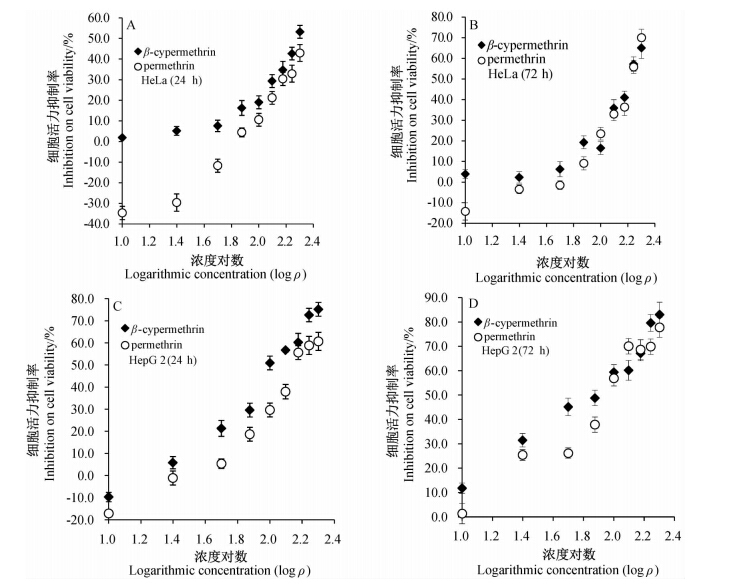 | 图 2 高效氯氰菊酯和氯菊酯对人癌HeLa(A 24 h,B 72 h)和HepG2(C 24 h,D 72 h)细胞活力的影响Fig. 2 Inhibitory activity of β-cypermethrin and permethrin on human cervical carcinoma HeLa cells (A 24 h,B 72 h) and human hepatocellular carcinoma HepG2 cells(C 24 h,D 72 h) |
由图 3可知:用高效氯氰菊酯和氯菊酯处理HEK293细胞24 h后,均可强烈促进HEK293细胞增殖,尤其在药剂质量浓度为50、75和100 μg/mL时,HEK293细胞活力显著高于对照,且氯菊酯对HEK293细胞活力的促进作用也显著强于高效氯氰菊酯(P<0.05)。当HEK293暴露药剂72 h时,药剂对细胞活力的促进作用显著减弱,而高浓度175和200 μg/mL药剂对细胞活力呈现抑制作用,高效氯氰菊酯对细胞活力的抑制作用显著强于氯菊酯的。
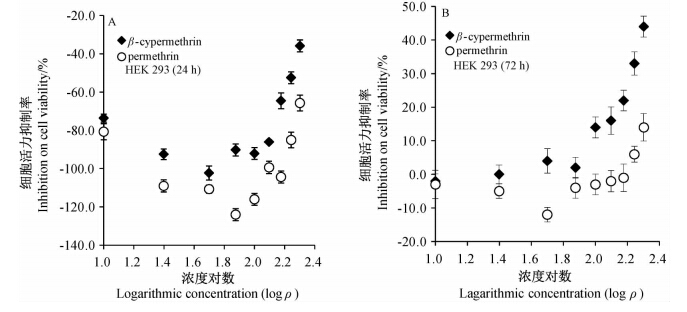 | 图 3 高效氯氰菊酯和氯菊酯对人胚胎肾上皮HEK293细胞活力的抑制作用(A 24 h,B 72 h)Fig. 3 Inhibitory activity of β-cypermethrin and permethrin on human embryonic kidney 293 cells(A 24 h,B 72 h) |
由表 1数据看出:供试细胞暴露药剂24 h时,高效氯氰菊酯和氯菊酯抑制HEK293细胞活力的IC50值均大于300 μg/mL,对S2、Sf-9、HeLa和HepG2细胞活力的IC50值均大于100 μg/mL;当暴露72 h时,高效氯氰菊酯和氯菊酯的抑制作用均显著增强,其中对HepG2细胞活力的IC50值分别降至63.03和97.04 μg/mL,但氯菊酯对HEK293细胞活力的IC50值仍大于300 μg/mL。IC50值统计结果表明,两种药剂间没有显著差异。
|
|
表 1 高效氯氰菊酯和氯菊酯对供试细胞活力抑制作用的毒力回归方程(n=3) Table 1 Inhibitory regression equation of permethrin and β-cypermethrin against the viability of insect and human cells |
由图 4可以看出:经药剂处理24 h时,HeLa细胞数量与对照间差异不显著,但氯菊酯可导致细胞偏小,且大小不一,而高效氯氰菊酯引起HeLa细胞核固缩,染色质明显退化形变;经药剂处理48h时,HeLa细胞数量减少,氯菊酯引起HeLa细胞质松散形变,细胞核固缩边极化,而高效氯氰菊酯引起HeLa细胞核浆界限不清,细胞固缩,胞外介质明显减少;经药剂处理72 h时,仅有少数细胞形态存在于氯菊酯处理中,但明显偏小,其他细胞多呈高度固缩态或裂解,细胞质内黄绿色荧光均明显减弱或消失,而经高效氯氰菊酯处理的细胞多呈胞质分散裂解或高度固缩状。
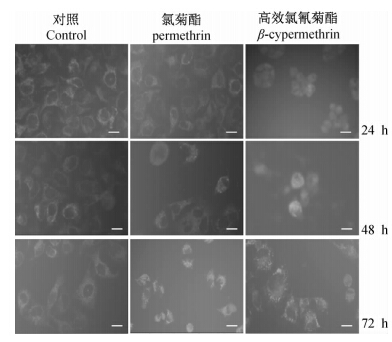 | 图 4 经100 μg/mL高效氯氰菊酯或氯菊酯处理24、48和 72 h后的HeLa细胞形态(×200倍)Fig. 4 Fluorescent morphology of HeLa cells after exposure to 100 μg/mL β-cypermethrin or permethrin for 24 h,48 h and 72 h(×200) |
本研究表明,氯菊酯和高效氯氰菊酯能够对昆虫非神经细胞(如果蝇胚胎S2细胞系和草地贪夜蛾卵巢Sf-9细胞系)的增殖及活力均产生显著影响,高浓度氯菊酯和高效氯氰菊酯对S2和Sf-9细胞活力均表现出强烈的抑制作用,而低浓度药剂处理却能促进细胞增殖。拟除虫菊酯类杀虫剂在引起昆虫神经中毒的同时,也能强烈影响虫体内其他器官和组织的细胞功能。Nikou等报道,昆虫对拟除虫菊酯类杀虫剂的抗性导致CYP6 P450的超量表达,而超表达的P450可能同时具有内源激素分子功能而导致昆虫的适合度降低[11]。笔者推测,氯菊酯和高效氯氰菊酯具有抑制非神经细胞活力或促进非神经细胞增殖的作用,这可能对其发挥杀虫效果具有协同作用。研究还发现,氯菊酯和高效氯氰菊酯对Sf-9细胞活力的抑制作用显著大于氨基甲酸酯类杀虫剂灭多威(methomyl)[12]。
大部分拟除虫菊酯类农药属于环境激素类物质。研究表明,青春发育期的小鼠暴露于氯氰菊酯和氯菊酯中,可显著降低其睾丸和肝脏中与胆固醇合成、转移以及睾酮合成途径中关键基因的表达,导致其肝细胞产生氧化损伤[13 --------- 14];长期摄入氯氰菊酯可对雄性生殖系统产生遗传毒性和子代行为发生改变等[15]。本研究结果表明,不同浓度的高效氯氰菊酯和氯菊酯对供试细胞HeLa、HepG2和HEK293等的增殖和活力抑制的影响存在显著差异,且该差异与药剂的处理时间相关。高浓度氯菊酯和高效氯氰菊酯处理对人的HeLa和HepG2癌细胞活力表现出强烈的抑制作用,而低浓度处理却对细胞增殖具有促进作用,尤其是氯菊酯和高效氯氰菊酯对HEK293细胞增殖具有强烈的促进作用。推测其原因可能是由于高效氯氰菊酯和氯菊酯对细胞发育具有激素的特性所致。高效氯氰菊酯对细胞的作用速度比氯菊酯的快,而在相同浓度时氯菊酯对人细胞增殖的促进作用强于高效氯氰菊酯的。可能是由于癌细胞HeLa和HepG2对药剂的吸收效率显著高于正常细胞HEK293。吖啶橙细胞染色结果表明,尽管100 μg/mL的氯菊酯或高效氯氰菊酯对HeLa细胞活力的抑制作用较弱,但药剂已经引起细胞形变、固缩或坏死。综合数据说明,氯菊酯和高效氯氰菊酯被人体摄入后,能够对人体的生理功能产生强烈的调节作用,具有诱发癌细胞发生和生理病变的风险。
传统的拟除虫菊酯类杀虫剂具有高效的害虫防治效果和一定的环境激素危害等双重特点,大大促进了含氟、醚和肟醚等低毒新型拟除虫菊酯类杀虫剂的研发[16]。利用昆虫和人离体细胞系来研究拟除虫菊酯类杀虫化合物的作用特性,将有助于拟除虫菊酯类杀虫剂的合理应用,为新型杀虫剂的创制提供降低动物细胞毒性的依据。有关拟除虫菊酯类杀虫剂对昆虫和高等动物非神经细胞的作用机制仍有待深入研究。
| [1] | 刘尚钟, 王敏, 陈馥衡. 拟除虫菊酯类农药的研究和展望[J]. 农药, 2004, 43(7): 289-293. Liu Shangzhong, Wang Min, Chen Fuheng. Research progress and development prospect of pyrethroid pesticide [J]. Chin J Pestic, 2004, 43(7): 289-293.(in Chinese) |
| [2] | Miller T A, Adams M E. Insecticide Mode of Action [M]. New York: Academic Press, 1982: 3-27. |
| [3] | Soderlund D M, Nipple D C. The molecular biology of knockdown resistance to pyrethroid insecticides [J]. Insect Biochem Mol Biol, 2003, 33: 563-577. |
| [4] | Colborn T. Our Stolen Future [M]. New York: Penguin Group, 1996: 1-60. |
| [5] | Stoker T E, Parks L O, Gray L E, et al. Endocrine-disrupting chemicals: prepubertal exposures and effects on sexual maturation and thyroid function in the male rat. A focus on the EDSTAC recommendations[J]. Crit Rev Toxicol, 2000, 30(2): 197-252. |
| [6] | Shulda Y, Arora A, Singh A. Tumourigenic studies on deltamethrin in Swiss albino mice [J]. Toxicol, 2001, 163(1): 1-9. |
| [7] | Kasat K, Go V, Pogo B G. Effects of pyrethroid insecticides and estrogen on WNT10B proto-oncogene expression [J]. Environ Int, 2002, 28(5): 429-432. |
| [8] | Sinha C, Agrawal A K, Islam F, et al. Mosquito repellent(pyrethroid-based) induced dysfunction of blood-brain barrier permeability in developing brain [J]. Int J Dev Neurosci, 2004, 22(1): 31-37. |
| [9] | Kolaczinski J H, Curtis C E. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: a review of the debate [J]. Food Chem Toxicol, 2004, 42(5): 697-706. |
| [10] | Mosman T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays [J]. J Immunol Method, 1983, 65(1-2): 55-63. |
| [11] | Nikou D, Ranson H, Hemingway J. An adult-specific CYP6 P450 gene is over expressed in a pyrethroid-resistant strain of the malaria vector, Anopheles gambiae [J]. Gene, 2003, 318: 91-102. |
| [12] | 郑丙莲, 杨红, 洪华珠, 等. 八种昆虫离体细胞系对灭多威农药的敏感性研究 [J]. 生物技术通报, 2000,(5): 30-32. Zheng Binglian, Yang Hong, Hong Huazhu, et al. Sensitivity research of eight insect cell lines to methomyl insecticide [J]. Biotechnol Inform, 2000,(5): 30-32.(in Chinese) |
| [13] | Wang X Z, Liu S S, Sun Y, et al. Beta-cypermethrin impairs reproductive function in male mice by inducing oxidative stress [J]. Theriogenol, 2009, 72(5): 599-611. |
| [14] | Farag A T, Goda N F, Shaaban N A, et al. Effects of oral exposure of synthetic pyrethroid, cypermethrin on the behavior of F\-1-progeny in mice [J]. Reprod Toxicol, 2007, 23(4): 560-567. |
| [15] | Soderlund D M, Clark J M, Sheets L P, et al. Mechanisms of pyrethroid neurotoxicity: implications for cumulative risk assessment [J]. Toxicol, 2002, 171(1): 3-59. |
| [16] | Shafer T J, Meyer A D, Crofton K M. Developmental neurotoxicity of pyrethroid insecticides: critical review and future research needs [J]. Environ Health Perspect, 2005, 113(2): 123-136. |
 2015, Vol.
2015, Vol. 


