2. 中国农业大学 理学院, 北京 100193
2. College of Science, China Agricultural University, Beijing 100193, China
乳状液属于液-液分散体系,即将一种液体以微小液滴的形式分散于另一种与其不相溶的液体中,根据内外相不同,可以分为水包油(O/W)型、油包水(W/O)型和多重乳状液,其制备过程中需要添加合适的乳化剂以维持体系的稳定。乳化剂通常由表面活性剂、聚合物和亲水性固体颗粒等组成,通过吸附于油-水界面形成界面膜,降低界面张力,产生静电斥力和空间位阻等而维持乳状液的稳定[1,2,3,4,5]。乳状液的稳定性易受到制备方法[6]、乳化剂类型[7]和用量[1]、温度[8]、电解质离子[9]以及介质pH值[10]等的影响,在制备和贮存过程中容易出现奥氏熟化(ostwald ripening)、聚结、分层、破乳等不稳定现象[11,12,13]。尽管乳状液存在诸多不稳定问题,但是凭借其可增溶有机物、作为合成无机材料的模板、参与生化分离、充当反应介质和控制药物释放等特殊功能,在食品、日用化学品、医药和石油化工等行业得到了广泛的应用[14,15,16,17,18]。随着胶体与界面科学的快速发展,亚微乳液(100 nm≤d≤500 nm)和Pickering乳液(乳化剂为亲水性固体颗粒)等新型乳液不断出现,人们对食品和石油化工等领域乳状液的形成及其稳定机理也开展了大量的研究工作,开发了比较成熟的研究方法和先进的仪器设备,如冷冻蚀刻技术(freeze-etching)、多重光散射技术(multiple light scattering)和动态光散射技术(DLS),以及旋转液滴界面张力仪(spinning drop interfacial tensiometer)、Zeta电位仪(Zeta potential analyzer)、透射电子显微镜(TEM)、差示扫描量热仪(DSC)和流变仪(rheometer)等[19,20,21,22,23,24]。
农药水乳剂(emulsion,oil in water,EW),是指将不溶于水的液体农药或固体农药溶于与水不相溶的有机溶剂中,通过输入能量(如高剪切和均质等)并借助适当的乳化剂,使其以微小液滴分散在水中而形成的、一定时期内动力学稳定的、外观呈乳白色的O/W型乳状液[25]。水乳剂具有高效、低毒和环保等突出优点,已成为传统农药剂型乳油的主要替代剂型之一[26]。然而,由于水乳剂属于热力学不稳定体系,在加工和贮存过程中普遍存在着液滴聚结变大、沉降析水甚至析油和破乳等不稳定现象[27]。最初人们在研制农药水乳剂时主要采用制备尝试、冷贮和热贮后目测乳液稳定性等较粗放的手段评价配方的好坏,导致试验效率低,且结果有时不准确,因而严重制约了农药水乳剂的快速发展[28]。因此,若能将食品、石油和日用化学品等领域中有关提高乳状液稳定性的成熟研究方法及先进仪器设备成功应用到农药水乳剂的研究开发中,对于农药水乳剂助剂选择、体系稳定性提高以及产品性能发挥等都具有重要意义。
近年来,关于农药水乳剂应用的研究不断增多,但主要集中在常规的配方开发方面,采用微观、精准的方法表征水乳剂物理稳定性的报道并不多。本文拟在综述食品和石油等行业乳状液稳定性表征方法的基础上,进一步总结这些表征方法在农药水乳剂研发中的应用现状,探讨农药水乳剂研发中存在的问题,旨在促进农药水乳剂的发展。
1 乳状液物理稳定性表征方法
良好的物理稳定性既是乳状液应用的前提,也是相关学者研究的热点,因此,对乳状液物理稳定性进行快速、准确的表征至关重要。随着物理化学尤其是胶体与界面化学的快速发展,乳状液物理稳定性表征方法得到了不断的积累与创新,出现了液滴粒径及其分布测定、电导率测定、微观结构研究、拟三元相图研究等多种表征方法。 1.1 通过测定液滴粒径及其分布表征乳状液的稳定性
乳状液由于液滴粒径大小不均匀,小液滴容易与大液滴合并,加速聚结、沉降及析油等不稳定现象的发生[29,30]。此外,根据斯托克斯公式,液滴的沉降速率与其粒径大小有关,即粒径越小,沉降速率越慢[31]。奥氏熟化是乳状液体系中经常发生的一种不稳定现象,是指由于两相间存在一定的溶解度,且大液滴溶解度低于小液滴,从而导致小液滴消失,而大液滴增大的现象[32]。根据LSW理论[33],发生奥氏熟化时液滴平均粒径的三次方与时间呈线性关系。由此可见,液滴粒径越小,分布越集中,越有利于乳状液体系的稳定。因此,通过测定体系液滴粒径大小及其分布可以判断乳状液的稳定性。近年来,一些新的粒度测试方法和仪器应运而生,其中基于动态光散射原理的激光粒度仪以其快速、准确、重复性好的突出优点已得到广泛应用,为乳状液液滴粒径的测定和稳定性评价提供了方便。
Meliana等[34]通过激光粒度仪测定了乳状液中液滴平均粒径随时间变化的情况,研究了4种油相组成各不相同的乳状液的奥氏熟化率及稳定性。结果表明:油相的疏水性越强,乳状液的奥氏熟化现象越不明显,所对应乳状液的稳定性也越好。
Vladisavljevic′等[35]以液滴平均粒径及其分布作为衡量指标,研究了不同工艺参数对多孔玻璃膜(SPG)制备的单分散O/W型乳状液和W/O/W型多重乳状液稳定性的影响。结果发现:当壁面剪切应力为30 Pa时,所获得的液滴均匀度较高,乳状液稳定性最好;此外,在159 d的贮存期内,以0.37 Pa的壁面剪切应力制备的单分散O/W型乳状液液滴的粒径及分布未发生改变。 1.2 通过电导率测定表征乳状液的稳定性
由于水是电的良导体,所以O/W型乳状液比W/O型乳状液的电导率大。随着贮存时间的延长,乳状液内部液滴间相互合并,粒径变大,油水相比例发生改变,出现具有不同导电性质的富水相和富油相,通过测定同一高度处乳状液的电导率,绘制出该高度处电导率随时间变化的曲线,根据所得曲线可预测乳状液的稳定性。通过电导率测定表征乳状液稳定性不受分层界面状况的影响,简单易行,已被广泛应用于石油、食品等领域乳状液稳定性的研究[36]。此外,利用相转变组分(PIC)法制备的乳状液的相行为和利用相转变温度(PIT)法制备的乳状液的相转变温度均与体系电导率的变化关系密切[37,38],而相行为和相转变温度又会显著影响乳状液的稳定性,因此,通过电导率测定有助于研究PIC法和PIT法制备的乳状液的稳定性。
倪良等[36]采用电导率法,分别测定了不同时间下、含正己醇和不含正己醇的乳状液(硝基苯-水-十二烷基硫酸钠)中富油相的电导率,提出了增比电导率(κr)新概念,给出了κr随时间t的变化率(dκr/dt)与时间的关系曲线,并求得该曲线上的极值点tmax和dκr/dt,从而定量判断乳状液的稳定性,取得了令人满意的效果。
Mei等[39]通过测定乳状液电导率随温度变化的情况,考察了无机盐(NaCl和Na2SO4)对石蜡油纳米乳液相转变温度(PIT)的调控作用,发现电导率测定对PIT的确定有积极意义,同时还发现无机盐的盐析作用可以使体系获得合适的PIT,从而制备出稳定的纳米乳液。 1.3 通过微观结构研究表征乳状液的稳定性
通过观察乳状液的微观结构,可以获得乳化剂的溶解状态、液滴粒径大小、分布以及乳状液的类型(简单乳液和多重乳液)等相关信息,同时可定性分析乳状液界面膜的组成[40],而这些特征均与乳状液的稳定性密切相关。近年来,对乳状液样品采用液氮(78 K)快速冷冻和淤积在氮中(68 K)冷冻的方法,可以保持样品各组分的组织形态和相互结构关系,然后通过真空扫描电子显微镜(SEM)或透射电子显微镜可直观、清楚地揭示样品的内部形貌[41],因此在一定程度上有助于乳状液稳定性的研究。
Liu等[42]在未对样品进行稀释的情况下,通过迅速冷冻后拍摄TEM显微照片(图 1和图 2),比较了不同能量输入条件对甲苯-聚乙二醇辛基苯基醚(triton X-100)-水形成的O/W型乳状液粒径分布的调控作用,发现就同一体系而言,输入的能量不同,所获乳状液液滴的粒径大小及其分布类型也不同。该方法能够在不进行稀释的情况下形象、直观地表现乳状液的内部形貌。
 | 图 1 输入不同能量条件下采用聚乙二醇辛基苯基醚制备的乳状液的TEM显微照片[42] Fig. 1 TEM micrographs of emulsions prepared using
triton X-100 under different conditions of energy input[42]
(a). 1 min,18 000 r/min;(b). 3 min,22 000 r/min;
(c). 7 min,22 000 r/min.
比例尺为1 μm;聚乙二醇辛基苯基醚 质量分数为3% The scale bar was 1 μm; the mass fraction of triton X-100 was 3% |
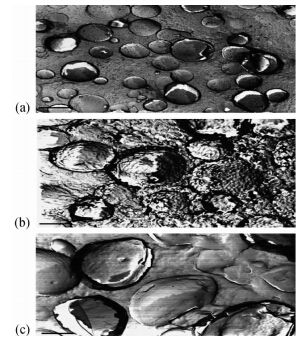 | 图 2 输入不同能量条件下采用聚乙二醇辛基苯基醚制备的乳状液的TEM显微照片[42]Fig. 2 TEM micrographs of emulsions prepared using
triton X-100 under different conditions of energy input[42]
(a). 1 min,18 000 r/min;(b). 3 min,22 000 r/min;
(c). 7 min,22 000 r/min.
比例尺为1 μm;聚乙二醇辛基苯基醚
质量分数为10% |
拟三元相图是研究多组分分散体系相行为的直观而有效的方法。该方法借助偏光显微镜观察液晶相的形成,以准确确定相区边界,再以表面活性剂、油和水为三角相图的3个顶点(分别用S、O和W表示),在相图上标出各点的组成及相态,绘制拟三元相图[43]。通过该相图可以直观表现出乳液区的大小及各组分的比例,确定使用不同乳化剂下形成乳状液所需的乳化剂用量范围,同时还可看出乳化剂品种和用量等因素变化对乳状液形成的影响,从而有效提高筛选的效率和准确性,在一定程度上克服了实验的盲目性[44]。
Morais等[45]通过绘制拟三元相图,成功制备了以胭脂油、咖啡油和茶树油混合物为油相的O/W型乳状液,该乳状液属于假塑性流体,已被用于化妆品领域,显示出了活性成分控释和稳定性高等突出优点。
Shakeel等[46]在以Lauroglycol-90(丙二醇单月桂酸甘油酯)为油相、Transcutol-HP(二乙二醇单乙基醚)为乳化剂制备抗癌药物咖啡碱的W/O型纳米乳液时,通过比较拟三元相图中乳液面积的大小筛选稳定的配方,最后发现以异丙醇作为助乳化剂,且助乳化剂与乳化剂质量比为1∶1时,相图上所形成的纳米乳液面积最大。 1.5 通过液滴表面电动特性研究表征乳状液的稳定性
在乳状液体系中,由于离子型表面活性剂、蛋白质、聚合物和固体颗粒等乳化剂分子的吸附作用而使得分散相液滴表面带有正电荷或负电荷,通过这些电荷离子的交换作用形成双电层(吸附层和扩散层)。当两个液滴彼此靠近时,由于扩散层发生重叠,导致从吸附层到递质内部产生电位差,称为Zeta电位,从而提供一定的静电斥力,表现为液滴表面的电动特性。根据经典的DLVO理论[47]:当Zeta电位绝对值较高时,可以削弱或抵消范德华引力,避免液滴间因相互靠近而聚结变大,从而提高乳状液的物理稳定性;相反,当Zeta电位绝对值较低时,液滴间斥力减小并逐渐靠近,最终因相互吸引而团聚,从而破坏乳状液的稳定性。因此,Zeta电位绝对值大小在一定程度上反映了乳状液液滴间相互作用力的强弱。但在实际研究中,由于体系组成、乳化剂种类和用量、测试方法等的不同,稳定乳状液液滴所需的Zeta电位绝对值大小也不尽相同,且跨度较大(30~80 mV),因此在评价乳状液物理稳定性时需要综合考虑,不能仅以乳状液液滴Zeta电位绝对值的高低作为衡量稳定与否的指标。目前关于Zeta电位的测定方法主要有电泳法、电渗法及流动电位法等,其中以电泳法应用最为广泛。
Wicek等[48]在研究正烷烃-卵磷脂水溶液形成的W/O型乳状液的液滴表面性质与其稳定性的关系时发现:卵磷脂可以改变油-水界面自由能和液滴的Zeta电位,随着Zeta电位绝对值的减小,液滴的有效直径逐渐增大。表明卵磷脂主要依靠静电斥力来保持乳状液的稳定。Cho等[21]通过Zeta电位测定,研究了带电多糖对脂肪滴乳状液的稳定作用,结果表明:混合阴离子型多糖(角叉菜胶和果胶)可在被乳球蛋白质(β-lactoglobuli)包裹的脂肪滴表面形成竞争吸附,由于角叉菜胶本身具有较高的电荷密度,当pH=3.5时,吸附了角叉菜胶的脂肪滴带有较高的负电荷,同时由于角叉菜胶能够有效地从脂肪滴表面置换果胶,因此该乳状液的稳定性相对较高。
Xin等[49]研究发现,阴离子型表面活性剂十二烷基磺酸钠可以显著提高用乳化剂Tween-20与Span-20复配制备的乳状液液滴的Zeta电位绝对值(由最初的33 mV增大到80 mV以上),使得液滴间的静电斥力增强,乳状液的稳定性得到明显改善。Nambam等[50]研究了不同类型表面活性剂与聚合物在液滴界面的竞争吸附,发现阴离子型表面活性剂(十二烷基磺酸钠)被选择性地吸附在液滴界面,可与短链聚合物发生协同作用,导致液滴Zeta电位绝对值显著升高(由最初的7 mV增大到45 mV),从而提高了乳状液的稳定性。 1.6 通过剪切流变性质研究表征乳状液的稳定性
乳状液具有流体的一般特征,体系的流变性与内部粒子间的各种相互作用力密切相关,在一定程度上影响着其乳化、絮凝、聚结、沉降、奥氏熟化以及相转变等过程[51]。乳状液的流变性比较复杂,不仅受内相体积分数、乳化剂浓度等因素影响,而且还受温度、剪切条件和时间等的影响[52,53]。因此,对不同条件下乳状液体系的流变特性进行研究,不论是在理论基础还是应用方面都具有十分重要的意义。流变仪能够直接利用多种流变模型对乳状液样品的流变学数据进行拟合,从而获得相应的流变参数,同时结合体系外观状态和液滴粒度测定等,可以对乳状液的稳定性进行评价。
Souza等[24]通过测定剪切流变性质,研究了用非离子型乳化剂制备的桔油乳状液的相转变过程及稳定性,获得了体系黏度随温度变化的曲线,结果表明:该桔油乳状液的流变曲线均显示了两个峰值,其中一个峰值与相分离过程有关,而另一个峰值与相转变过程相关,其剪切流变性质测定结果与微量热法测试结论一致。Lizarraga等[54]分别利用均质机(ultra turrax,UT)和匀浆器(valve homogenizer,VH)制备了以乳清蛋白浓缩物(whey protein concentrate,WPC)为乳化剂的浓乳状液,通过测定剪切流变性质研究了各乳状液的稳定机制。结果表明:采用UT制备的乳状液属于牛顿流体,出现了轻微絮凝现象;使用VH制备的乳状液在WPC浓度较低时属于牛顿流体,而当WPC浓度较高时则表现出剪切变稀和滞后现象,絮凝现象明显,体系黏度随WPC浓度增大而增大,说明絮凝的发生依赖于WPC的浓度,是由损耗(depletion mechanism)和桥联(bridging flocculation)作用所致。 1.7 通过多重光散射技术表征乳状液的稳定性
由于乳状液通常为乳白色不透明体系,在采用粒径大小及分布测定法、显微镜观察法和分光光度法等进行研究时都需要对乳状液进行稀释,因而严重降低了研究的准确性。法国Formulaction公司基于多重光散射技术,研究开发了一系列不同型号的Turbiscan Lab分散稳定性分析仪,能够在不需要稀释和破坏样品的基础上,利用穿透力极强的近红外脉冲光源(λ=880 nm)进行垂直扫描,通过测量底部的背散射光强度和顶部的透射光强度,给出沉淀层、浮油层或澄清层厚度随时间变化的关系曲线,快速、准确地分析悬浮液、乳状液和泡沫液等分散体系的乳化、絮凝和沉淀等现象,并可定量分析上述现象发生的速率以及粒子的平均粒径、浓度等特性[55,56]。
Liu等[57]利用Turbiscan Lab分散稳定性分析仪,分析了两种生物破乳剂对O/W型乳状液的破乳作用,实时扫描发现,其中稳定性破坏较大的样品,其透射光和背散射光强度均发生了显著变化,表明该仪器能够预测不同生物破乳剂的破乳效率和破乳过程,有利于通过测定乳状液的稳定性来快速筛选有效的生物破乳剂。Kang等[18]也利用Turbiscan Lab分散稳定性分析仪研究了聚合物和表面活性剂对重油乳状液的稳定机制。图 3是添加不同聚合物和表面活性剂制备的重油乳状液的背散射光变化图谱,从中可见:添加聚合物和表面活性剂后,乳状液中液滴粒径增大且液滴迁移被显著抑制,乳状液的稳定性明显提高。 1.8 通过油/水界面张力测定表征乳状液的稳定性
由于乳状液是由互不相溶的两相形成的分散体系,因而会形成极大的弯曲相界面,弯曲界面内外存在压力差,液滴内的压力大于液滴外的压力,其所需做的功既包括因界面积增大而产生的可逆功(W),也包括为克服弯曲界面形变产生的附加压力所做的功(ΔP),分别由公式(1)和公式(2)(Laplace公式)[58,59]计算而得:
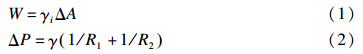
式(1)中:γi为油/水界面张力,ΔA为增加的界面面积。式(2)中:Rl和R2是曲面的凹面曲率半径,γ是表面张力;对于球型液滴,上式中ΔP=2γ/R。
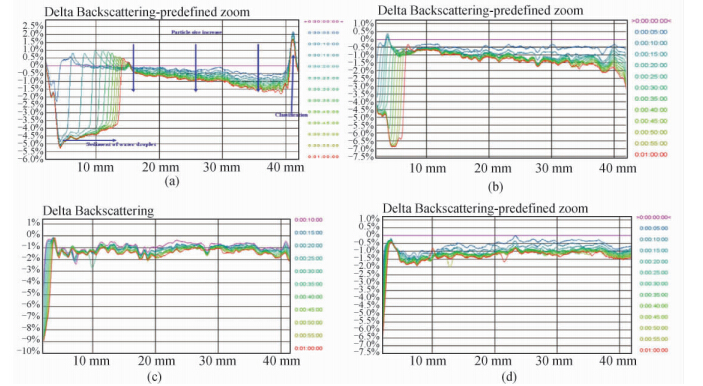 | 图 3 不同W/O型乳状液的背散射光谱图[18]Fig. 3 Backscattering profiles of different synthetic W/O emulsions[18]
(a). 不添加聚合物和表面活性剂;(b). 添加400 mg/L 表面活性剂;(c). 添加300 mg/L 聚合物;(d). 添加300 mg/L
聚合物+400 mg/L 表面活性剂 (a). W/O crude emulsion without polymer/surfactant;(b). W/O crude emulsion stabilized by 400 mg/L surfactant;(c). W/O crude emulsion stabilized by 300 mg/L polymer;(d). W/O crude emulsion stabilized by 300 mg/L polymer + 400 mg/L surfactant |
由公式(1)和(2)可知,界面张力越大、界面积增加越多,体系所需做的可逆功就越大,相界面能越大,而通过降低体系中的油水界面张力将有助于乳化的进行和乳状液的相对稳定。因此,油水界面张力测定成为了研究乳状液稳定性的一种重要手段。
Pichot等[20]利用界面张力测定系统,研究了当亲水性二氧化硅颗粒存在时,添加不同种类和浓度的表面活性剂对液滴界面吸附性能的影响。结果表明:亲水性二氧化硅通过影响表面活性剂在液滴界面的吸附而影响乳状液的稳定性,其对W/O型表面活性剂在界面的吸附无影响,而对O/W型表面活性剂影响显著:低浓度时,二氧化硅颗粒与表面活性剂同时吸附于界面,共同修饰界面结构,浓度较高时,则表面活性剂起主要作用。El-Din等[60]采用高能乳化法制备了油-水比不同的4种煤油纳米乳液,并研究了混合表面活性剂与纳米乳液稳定性及其界面张力的关系,发现混合表面活性剂能够显著降低纳米乳液的界面张力,且界面张力随着混合表面活性剂浓度的增大而降低,而界面张力降低有助于获得液滴最小且稳定性较好的纳米乳液。 1.9 通过热稳定性研究表征乳状液的稳定性
许多物质在加热或冷却过程中均会发生融化、凝固、晶型转变、分解、吸附、脱附等物理化学变化,这些变化必将伴随体系焓的改变,因而产生热效应。差示扫描量热法(differential scanning calorimetry,DSC)是在程序控温条件下,测量输入样品和参比物的功率差与温度关系的热分析方法,可测定比热容、焓变、结晶速率等多种热力学参数[24]。DSC曲线则是以样品吸热或放热的速率(即热流量dQ/dt)为纵坐标、以时间t或温度T为横坐标得到的,其中曲线离开基线的位移代表样品吸热或放热的速率,曲线中的峰或谷所包围的面积则代表热量的变化。峰顶向上为放热峰,峰顶向下为吸热峰,峰面积越大,则热效应越大[61,62]。一般而言,物质的蒸发、分解、还原和相转变等过程表现为吸热,而物质的氧化、结晶和化学吸附等表现为放热。近年来,DSC法已被广泛应用于乳状液稳定性研究中,均获得了快速、可靠的结果。
Arima等[63]通过差示扫描量热法,分别研究了高亲油性蔗糖低聚酯(SOE,P-170)和高亲水性蔗糖低聚酯(SOE,P-1670)对以棕榈油为油相乳状液低温稳定性(结晶温度)的影响。结果表明:在不添加两种蔗糖低聚酯的情况下,该乳状液在从60~0 ℃冷冻过程中会发生不稳定现象,且在0 ℃时只能稳定1 d;添加P-170能够提高乳状液的结晶温度,明显抑制结晶化等不稳定现象的产生;当同时添加两种物质时,对结晶化的抑制效果更佳,乳状液体系更稳定。Li等[22]也采用差示扫描量热法研究了通过相转变组分法制备的石蜡纳米乳液在冷冻和加热时的稳定性。从DSC曲线可以看出:高温会导致液滴聚结,不利于纳米乳液的稳定;而低温时液滴形态呈不规则球形,保证了纳米乳液的稳定性;这与显微镜下观察的结果一致。 1.10 通过界面扩张流变性质研究表征乳状液的稳定性
乳化剂分子通过紧密排列在液滴周围形成一定强度的界面膜,阻止了小液滴的聚结合并,从而使乳状液保持较高的稳定性,而界面扩张流变学研究可阐明乳化剂所形成的界面膜在外力作用下的流动和形变,因此是研究乳状液稳定性的一种重要手段[64]。在实际应用中,通常采用Langmuir槽和气泡/液滴扩张两种技术,运用小幅低频振荡和界面张力弛豫分析方法,系统研究不同条件下扩张频率对扩张模量和相角等参数的影响规律[65]。其中相角即粘性部分和弹性部分的比值,是对界面膜粘弹特性的定量表征,相角越小,表示界面膜弹性越强。而界面扩张粘弹性反映了界面膜抵抗扩张形变的能力,与乳状液的稳定性密切相关。因此,研究界面扩张流变学可以加深对界面膜微观结构的认识,深刻反映与液/液界面现象相关的内在规律,有助于了解乳化剂分子在界面上的吸附及其相互作用,对阐明乳状液稳定性和破乳机理均具有重要意义。
Saiki等[66]通过界面扩张流变特性测定,研究了添加十二烷基磺酸钠后的聚二甲基硅油单分散浓乳状液中液滴结构的不稳定性。结果表明:乳状液不稳定结构的出现与弹性模量G′(elastic modulus)和粘性模量G″(viscous modulus)的交叉点 γco(G′/G″)有关,而结构不稳定的原因是液滴变形诱导形成了滑移面,γco能够作为衡量乳状液中结构稳定和液滴间相互作用平衡的指标。Dicharry等[67]通过测定不同频率下乳状液的扩张流变性能,研究了水/原油(W/O型)乳状液的稳定性,发现存在于原油中的沥青质和胶质等天然表面活性剂可以在界面上形成凝胶,而该W/O型乳状液的稳定性与凝胶的强度和玻璃化转变温度呈正相关。 2 乳状液稳定性表征方法在农药水乳剂研制中的应用
水乳剂以水为介质,与乳油和微乳剂相比,其显著降低了有机溶剂和乳化剂的用量,是国际公认的绿色环保农药剂型之一[68,69,70]。1993年,水乳剂开始在我国登记,截至2014年9月,国内登记的水乳剂产品已达878个[71]。目前,水乳剂在我国农药市场所占的份额还非常有限,仍具有广阔的发展前景。但当前在农药水乳剂的研发中存在以下突出问题[72,73,74]:1)水乳剂在热力学上不稳定,易出现奥氏熟化、沉降、析油等物理不稳定现象;2)理论基础薄弱,关于不同因素对水乳剂稳定性的影响机理等研究尚不够深入;3)物理稳定性表征手段还比较宏观、粗放,导致产品开发周期长,生产效率低。以上问题的存在,严重影响了产品的货架寿命和药效发挥,制约了水乳剂的进一步推广应用,也在一定程度上影响了其对传统乳油产品的替代。
近年来,随着人们环保意识的不断增强,对水乳剂的需求量逐年上升,而有关其形成与稳定机理等的研究也开始受到关注,研究内容主要涉及乳化剂的选择、加工方法和设备的比较以及温度等外界因素对水乳剂物理稳定性的影响等,一些在食品及石油等领域中成熟应用的表征方法和先进的仪器设备也逐渐被运用到了水乳剂配方研制和稳定性的提高中[75],取得了显著的成效。
齐武等[76]通过测定液滴粒径大小及其分布,研究了直接乳化法、反相乳化法和D相乳化法等加工方法对高效氯氟氰菊酯(lambda-cyhalothrin)水乳剂的影响。结果表明:直接乳化法制备的水乳剂液滴粒径较大,反相乳化法和D相乳化法制备的水乳剂液滴粒径相对较小,且D相乳化法制备的水乳剂液滴粒径分布较窄。张晓光等[77]从表面张力、临界胶束浓度(cmc)和亲水亲油平衡(HLB)值等方面分析了二元复配乳化剂对阿维菌素(abamectin)水乳剂稳定性的影响;从液滴粒径、表面张力和Zeta电位等方面考察了三元复配乳化剂对水乳剂稳定性的影响。结果表明:EL-40与 EL-20复配具有较低的表面张力,可制备较稳定的水乳剂;添加乳化剂1601 和 L64对水乳剂稳定性有一定的提高作用,而添加乳化剂A(辛基酚聚氧乙烯醚磷酸酯)则可明显提高水乳剂的稳定性,其原因是由于乳化剂A显著降低了液滴粒径和表面张力,提高了Zeta电位。
笔者等[78]通过测定液滴的平均粒径和Zeta电位,研究了体系pH值、乳化温度和电解质离子对以三苯乙烯基苯酚聚氧乙烯醚磷酸酯三乙醇胺盐(SCP)为乳化剂的异丙甲草胺(metolachlor)水乳剂稳定性的影响。结果发现:当pH=9时,液滴平均粒径最小,Zeta电位绝对值最大,水乳剂稳定性最好;乳化温度较低时,液滴平均粒径较大,Zeta电位绝对值较小,水乳剂稳定性较差;温度过高时,水乳剂稳定性也变差;添加电解质离子可使液滴平均粒径增大,Zeta电位绝对值减小,水乳剂稳定性降低。
Wang等[79]通过先形成微乳液再稀释得到乳状液的两步处理法获得了稳定性较高的、以葵酸甲酯为油相的纳米乳液,同时通过相图研究发现:在双连续性微乳区或O/W型微乳区存在油相与表面活性剂的最佳比例(Ros),说明相行为与体系组分是影响纳米乳液形成的重要因素。采用该方法制备的氯氰菊酯(cypermethrin)纳米乳液的稳定性与商品化的氯氰菊酯微乳液相当。陈丹等[80]借鉴微乳剂相行为分析方法,利用拟三元相图系统研究了非离子型与阴离子型表面活性剂及其不同复配比例、油相中有效成分含量及不同水质下阿维菌素溶液-表面活性剂-水体系的相行为,通过分析相关因子与相行为的关系,建立了稳定的水乳剂体系形成模型,可以有效指导农药水乳剂配方的开发与应用。
张源等[81]测定了乳化剂辛烯基琥珀酸淀粉钠用量、盐离子、pH值和温度等因素对液滴Zeta电位及表面吸附量的影响。结果表明:辛烯基琥珀酸淀粉钠通过吸附于液滴表面,为其提供较强的静电斥力和空间位阻作用而维持高效氯氟氰菊酯水乳剂的稳定。伍翔等[82]通过测定Zeta电位,研究了氯化钠对三唑磷(triazophos)水乳剂物理稳定性的影响。结果表明:当氯化钠用量<3%时,水乳剂液滴中位粒径减小,对界面膜的强度基本无影响;而当氯化钠用量过高时则会导致中位粒径增大,水乳剂两相间的界面张力增大,界面膜强度显著降低,从而使得水乳剂稳定性下降。
Liu等[83]采用测定液滴粒径大小及其分布的方法,研究了混合乳化剂中两种乳化剂质量比和乳化剂总质量分数对联苯菊酯(bifenthrin)纳米乳液液滴平均粒径和跨距的影响,利用多重光散射技术研究了乳化剂质量比和乳化剂总质量分数对纳米乳液稳定性的影响。结果表明:多重光散射技术的短期扫描结果与动态光散射技术测定的液滴平均粒径随时间变化的结果一致。郭勇飞等[84]通过4.5%高效氯氰菊酯(beta-cypermethrin)水乳剂配方的研制,证明了来自Turbiscan Lab分散稳定性分析仪的稳定性参数(SI)可以作为判定水乳剂稳定性的量化指标,其结果与传统热贮稳定性和冻融稳定性试验结果一致,SI<4.0的4.5%高效氯氰菊酯水乳体系具有较好的稳定性。
程敬丽等[59]研究了不同乳化剂种类和加工设备对30%毒死蜱(chlorpyrifos)、6.9%精 NFDA1 唑禾草灵(fenoxaprop-p-ethyl)和5.7%氟氯氰菊酯(cyfluthrin)水乳剂制备及体系稳定性的影响。结果表明:合适的乳化剂可以降低界面张力,而适宜的加工设备能够增大体系的机械能,从而获得优良的配方。王振等[85]通过对液滴粒径、表面张力和接触角的测定,选用国内常见乳化剂进行了高效氟氯氰菊酯(beta-cyfluthrin)水乳剂配方的筛选。结果发现:4种具有较好稳定性的配方,其粒径(中位径)在 0.8~2.12 μm之间,药剂表面张力在40~53 mN/m之间,显著低于去离子水的表面张力(73.66 mN/m);药剂在苹果叶面上的接触角为46~74 °,且在0~60 s内呈显著下降趋势;表明配方均具有较好的稳定性和润湿性,铺展速度快,易润湿。谭玉荣等[86]以高温析油率为指标,研究了共乳化剂用量对10%溴虫腈(chlorfenapyr)水乳剂稳定性的影响,发现适宜用量的共乳化剂能够提高水乳剂的高温稳定性。其原因是由于共乳化剂排列在胶束周围,与乳化剂分子一起形成了强度更大的混合膜,同时降低了油/水界面张力。
Zhang等[87]首次利用差示扫描量热法研究了不同乳化剂组合所制备的醚菊酯(ethofenprox)水乳剂的结晶温度,并与液滴粒径及黏度测定相结合,为水乳剂的乳化剂筛选以及获得良好的贮存和冻融稳定性提供了有效途径。
从已有研究报道看,人们对农药水乳剂物理稳定性的研究已由最初简单的配方研制逐渐向理论研究转变,并已取得一定的成果,同时研究手段与仪器设备也有所创新,但是仍主要集中在液滴粒径、Zeta电位和表面张力测定等乳状液稳定性研究方法的运用方面,对于水乳剂流变学和热稳定性等的研究相对较少。作为乳油的主要替代剂型之一,今后将有更多的农药品种需要制备成水乳剂,因此,关于农药水乳剂稳定性的提高仍需做大量深入细致的研究工作。 3 展望
水乳剂是以乳状液为基础制备的一种农药制剂,其与食品和石油等行业中的乳状液存在一定区别,主要体现在:1)为了获得良好的生物活性,水乳剂中常添加多种助剂,其成分相对复杂,干扰稳定性的因素较多;2)水乳剂中通常添加有黄原胶、硅酸镁铝等增稠剂,体系黏度较大;3)水乳剂多为O/W型乳状液,油相为液体原油或者固体原药的有机溶剂溶液,导致油相密度增大,液滴容易沉降。由此可见,农药水乳剂稳定性研究存在一定的难度。进入21世纪,水乳剂以其高效、低毒和环境相容性好等优点成为了国内外农药加工领域研究和开发的热点,而如何提高水乳剂的物理稳定性是延长产品货架寿命和改善使用性能的关键所在。今后在水乳剂研究开发中,需要对已有的乳状液稳定性研究方法进行适当的调整与改进,否则难以获得满意的效果;同时还应注重学科间的交叉渗透。相信随着胶体与界面科学的不断发展,将会有越来越多成熟的研究方法、手段以及先进的仪器设备被运用于水乳剂稳定性研究,从而促进农药水基性剂型的不断发展。
| [1] | Izquierdo P, Esquena J, Tadros T F, et al. Formation and stability of nano-emulsions prepared using the phase inversion temperature method[J]. Langmuir, 2002, 18(1): 26-30. |
| [2] | Rotureau E, Leonard M, Marie E, et al. From polymeric surfactants to colloidal systems(1): amphiphilic dextrans for emulsion preparation[J]. Colloids Surf A, 2006, 288(1-3): 131-137. |
| [3] | Sztukowski D M, Yarranton H W. Oilfield solids and water-in-oil emulsion stability[J]. J Colloid Interface Sci, 2005, 285(2): 821-833. |
| [4] | Ma Hairan, Forssell P, Partanen R, et al. Improving laccase catalyzed cross-Linking of whey protein isolate and their application as emulsifiers[J]. J Agric Food Chem, 2011, 59(4): 1406-1414. |
| [5] | Wulff-Pérez M, Torcello-Gómez A, Martín-Rodríguez A, et al. Bulk and interfacial viscoelasticity in concentrated emulsions: the role of the surfactant[J]. Food Hydrocoll, 2011, 25(4): 677-686. |
| [6] | Solè I, Maestro A, Pey C M, et al. Nano-emulsions preparation by low energy methods in an ionic surfactant system[J]. Colloids Surf A, 2006, 288: 138-143. |
| [7] | Yuan Yuan, Gao Yanxiang, Zhao Jian, et al. Characterization and stability evaluation of β-carotene nanoemulsions prepared by high pressure homogenization under various emulsifying conditions[J]. Food Res Int, 2008, 41(1): 61-68. |
| [8] | Mei Zhen, Liu Shangying, Wang Lei, et al. Preparation of positively charged oil/water nano-emulsions with a sub-PIT method[J]. J Colloid Interface Sci, 2011, 361(2): 565-572. |
| [9] | Ashrafizadeh S N, Motaee E, Hoshyargar V. Emulsification of heavy crude oil in water by natural surfactants[J]. J Pet Sci Eng, 2012, 86-87: 137-143. |
| [10] | Tcholakova S, Denkov N D, Ivanov I B, et al. Coalescence stability of emulsions containing globular milk proteins[J]. Adv Colloid Interface Sci, 2006, 123-126: 259-293. |
| [11] | Capek I. Degradation of kinetically-stable O/W emulsions[J]. Adv Colloid Interface Sci, 2004, 107(2): 125-155. |
| [12] | Robins M M, Watson A D, Wilde P J. Emulsions-creaming and rheology[J]. Curr Opin Colloid Interface Sci, 2002, 7(5-6): 419-425. |
| [13] | Jafari S M, Assadpoor E, He Yinghe, et al. Re-coalescence of emulsion droplets during high-energy emulsification[J]. Food Hydrocoll, 2008, 22(7): 1191-1202. |
| [14] | Scott L L, Duncan S E, Sumner S S, et al. Influence of emulsifying component composition on creams formulated with fractionated milkfat[J]. J Agric Food Chem, 2003, 51(20): 5933-5940. |
| [15] | Gilbert L, Loisel V, Savary G, et al. Stretching properties of xanthan, carob, modified guar and celluloses in cosmetic emulsions[J]. Carbohydr Polym, 2013, 93(2): 644-650. |
| [16] | Hansen T, Holm P, Rohde M, et al. In vivo evaluation of tablets and capsules containing spray-dried O/W-emulsions for oral delivery of poorly soluble drugs[J]. Int J Pharm, 2005, 293(1-2): 203-211. |
| [17] | Anne S, Geir R F, Herman H, et al. A multivariate analysis on the influence of indigenous crude oil components on the quality of produced water. Comparison between bench and rig scale experiments[J]. J Dispersion Sci Technol, 2010, 31(3): 392-408. |
| [18] | Kang Wanli, Xu Bin, Wang Yongjian, et al. Stability mechanism of W/O crude oil emulsion stabilized by polymer and surfactant[J]. Colloids Surf A, 2011, 384(1-3): 555-560. |
| [19] | Chebil A, Desbrières J, Nouvel C, et al. Ostwald ripening of nanoemulsions stopped by combined interfacial adsorptions of molecular and macromolecular nonionic stabilizers[J]. Colloids Surf A, 2013, 425: 24-30. |
| [20] | Pichot R, Spyropoulos F, Norton I T. Competitive adsorption of surfactants and hydrophilic silica particles at the oil-water interface: interfacial tension and contact angle studies[J]. J Colloid Interface Sci, 2012, 377(1): 396-405. |
| [21] | Cho Y H, Decker E A, McClements D J. Competitive adsorption of mixed anionic polysaccharides at the surfaces of protein-coated lipid droplets[J]. Langmuir, 2009, 25(5): 2654-2660. |
| [22] | Li Caifu, Mei Zhen, Liu Qian, et al. Formation and properties of paraffin wax submicron emulsions prepared by the emulsion inversion point method[J]. Colloids Surf A, 2010, 356(1-3): 71-77. |
| [23] | Wu Nana, Huang Xu, Yang Xiaoquan, et al. In vitro assessment of the bioaccessibility of fatty acids and tocopherol from soybean oil body emulsions stabilized with ι-carrageenan[J]. J Agric Food Chem, 2012, 60(6): 1567-1575. |
| [24] | Souza V B, Spinelli L S, Gonzalez G, et al. Determination of the phase inversion temperature of orange oil/water emulsions by rheology and microcalorimetry[J]. Anal Lett, 2009, 42(17): 2864-2878. |
| [25] | 华乃震. 安全和环保型的农药水乳剂[J]. 现代农药, 2003, 2(5): 27-31. Hua Naizhen. Pesticides EW formulation for safety and environmenatal protection[J]. Modem Agrochem, 2003, 2(5): 27-31.(in Chinese) |
| [26] | Mulqueen P. Recent advances in agrochemical formulation[J]. Adv Colloid Interface Sci, 2003, 106(1-3): 83-107. |
| [27] | 张登科, 魏方林, 朱国念, 等. 我国农药水乳剂的发展现状及稳定机理研究[J]. 现代农药, 2007, 6(5): 1-4. Zhang Dengke, Wei Fanglin, Zhu Guonian, et al. Development status of pesticide emulsion oil in water in our country and research of stability mechanism[J]. Modem Agrochem, 2007, 6(5): 1-4.(in Chinese) |
| [28] | 李姝静, 郭勇飞, 李彦飞, 等. 农药水乳剂稳定性机制研究进展[J]. 现代农药, 2012, 11(4): 6-10. Li Shujing, Guo Yongfei, Li Yanfei, et al. Research progress on stability mechanism of pesticide emulsion in water[J]. Modem Agrochem, 2012, 11(4): 6-10.(in Chinese) |
| [29] | Taylor P. Ostwald ripening in emulsions[J]. Adv Colloid Interface Sci, 1998, 75(2): 107-163. |
| [30] | Sadtler V M, Imbert P, Dellacherie E. Ostwald ripening of oil-in-water emulsions stabilized by phenoxy-substituted dextrans[J]. J Colloid Interface Sci, 2002, 254(2): 355-361. |
| [31] | Chanamai R, McClements D J. Creaming stability of flocculated monodisperse oil-in-water emulsions[J]. J Colloid Interface Sci, 2000, 225(1): 214-218. |
| [32] | Madras G, McCoy B J. Continuous distribution theory for ostwald ripening: comparison with the LSW approach[J]. Chem Eng Sci, 2003, 58(13): 2903-2909. |
| [33] | Verma S, Kumar S, Gokhale R, et al. Physical stability of nanosuspensions: investigation of the role of stabilizers on ostwald ripening[J]. Int J Pharm, 2011, 406(1-2): 145-152. |
| [34] | Meliana Y, Cala N A, Lin C T, et al. Ostwald ripening of two-component disperse phase miniemulsions containing monomer and reactive costabilizer[J]. J Dispersion Sci Technol, 2010, 31(11): 1568-1573. |
| [35] | Vladisavljević G T, Schubertb H. Influence of process parameters on droplet size distribution in SPG membrane emulsification and stability of prepared emulsion droplets[J]. J Membr Sci, 2003, 225(1-2): 15-23. |
| [36] | 倪良, 蒋文华, 韩世钧. 电导法研究硝基苯/水/十二烷基硫酸钠乳状液的稳定性[J]. 化工学报, 2001, 52(12): 1104-1108. Ni Liang, Jiang Wenhua, Han Shijun. Stability of emulsion composed of nitrobenzene/water/sodium dodecyl sulfate by conductance measurement[J]. J Chem Ind Eng, 2001, 52(12): 1104-1108.(in Chinese) |
| [37] | Verdinelli V, Vuano B, Schulz P C, et al. Inversion properties of n-alkane phosphonic acids stabilized emulsions: HLB dependence[J]. J Dispersion Sci Technol, 2009, 30(10): 1538-1544. |
| [38] | Kong Ming, Chen Xiguang, Park H. Design and investigation of nanoemulsified carrier based on amphiphile-modified hyaluronic acid[J]. Carbohydr Polym, 2011, 83(2): 462-469. |
| [39] | Mei Zhen, Xu Jian, Sun Dejun. O/W nano-emulsions with tunable PIT induced by inorganic salts[J]. Colloids Surf A, 2011, 375(1-3): 102-108. |
| [40] | Qhattal H S S, Wang Shu, Salihima T, et al. Nanoemulsions of cancer chemopreventive agent benzyl isothiocyanate display enhanced solubility, dissolution, and permeability[J]. J Agric Food Chem, 2011, 59(23): 12396-12404. |
| [41] | Izquierdo P, Esquena J, Tadros Tharward F, et al. Phase behavior and nano-emulsion formation by the phase inversion temperature method[J]. Langmuir, 2004, 20(16): 6594-6598. |
| [42] | Liu Enhui, Mcgrath K M. Emulsion microstructure and energy input, roles in emulsion stability[J]. Colloids Surf A, 2005, 262(1-3): 101-112. |
| [43] | Wang Lijuan, Dong Jinfeng, Chen Jing, et al. Design and optimization of a new self-nanoemulsifying drug delivery system[J]. J Colloid Interface Sci, 2009, 330(2): 443-448. |
| [44] | Eastoe J, Ellis C. De-gassed water and surfactant-free emulsions: history, controversy, and possible applications[J]. Adv Colloid Interface Sci, 2007, 134-135: 89-95. |
| [45] | Morais G G, Santos O D H, Oliveira W P, et al. Attainment of O/W emulsions containing liquid crystal from annatto oil(Bixa orellana), coffee oil, and tea tree oil(Melaleuca alternifolia) as oily phase using HLB system and ternary phase diagram[J]. J Dispersion Sci Technol, 2008, 29(1): 297-306. |
| [46] | Shakeel F, Ramadan W. Transdermal delivery of anticancer drug caffeine from water-in-oil nanoemulsions[J]. Colloids Surf B, 2010, 75(1): 356-362. |
| [47] | Fritz G, Schädler V, Willenbacher N, et al. Electrosteric stabilization of colloidal dispersions[J]. Langmuir, 2002, 18(16): 6381-6390. |
| [48] | Wiącek A E. Electrokinetic properties of n-tetradecane/lecithin solution emulsions[J]. Colloids Surf A, 2007, 293(1-3): 20-27. |
| [49] | Xin Xia, Zhang Hongxing, Xu Guiying, et al. Influence of CTAB and SDS on the properties of oil-in-water nano-emulsion with paraffin and Span 20/Tween 20[J]. Colloids Surf A, 2013, 418: 60-67. |
| [50] | Nambam J S, Philip J. Competitive adsorption of polymer and surfactant at a liquid droplet interface and its effect on flocculation of emulsion[J]. J Colloid Interface Sci, 2012, 366(1): 88-95. |
| [51] | Afoakwa E O, Paterson A, Fowler M. Factors influencing rheological and textural qualities in chocolate-a review[J]. Trends Food Sci Technol, 2007, 18(6): 290-298. |
| [52] | Zhang Xiaoguang, Liu Jiexiang. Effect of arabic gum and xanthan gum on the stability of pesticide in water emulsion[J]. J Agric Food Chem, 2011, 59(4): 1308-1315. |
| [53] | Calero N, Muñoz Z, Cox P W, et al. Influence of chitosan concentration on the stability, microstructure and rheological properties of O/W emulsions formulated with high-oleic sunflower oil and potato protein[J]. Food Hydrocoll, 2013, 30(1): 152-162. |
| [54] | Lizarraga M S, Pan L G, Añon M C, et al. Stability of concentrated emulsions measured by optical and rheological methods. Effect of processing conditions-I. Whey protein concentrate[J]. Food Hydrocoll, 2008, 22(5): 868-878. |
| [55] | Celia C, Trapasso E, Cosco D, et al. Turbiscan Lab® Expert analysis of the stability of ethosomes and ultradeformable liposomes containing a bilayer fluidizing agent[J]. Colloids Surf B, 2009, 72(1): 155-160. |
| [56] | De La Salles K T S, Canselier J P, Gourdon C. Characterization of a two-aqueous phase system containing a nonionic surfactant[J]. J Dispersion Sci Technol, 2005, 26(3): 303-313. |
| [57] | Liu Jia, Huang Xiangfeng, Lu Lijun, et al. Turbiscan Lab® Expert analysis of the biological demulsification of a water-in-oil emulsion by two biodemulsifiers[J]. J Hazard Mater, 2011, 190(1-3): 214-221. |
| [58] | Wang Weixing, Zhou Zhiang, Nandakumar K, et al. Effect of charged colloidal particles on adsorption of surfactants at oil-water interface[J]. J Colloid Interface Sci, 2004, 274(2): 625-630. |
| [59] | 程敬丽, 朱金文, 魏方林, 等. 机械能与界面张力在农药水乳剂制备中的作用机理研究[J]. 农药学学报, 2004, 6(2): 62-67. Cheng Jingli, Zhu Jinwen, Wei Fanglin, et al. The mechanism research of the engine energy and the surface tension on preparation of pesticide emulsion in water[J]. Chin J Pestic Sci, 2004, 6(2): 62-67.(in Chinese) |
| [60] | El-Din M R N. Study on the stability of water-in-kerosene nano-emulsions and their dynamic surface properties[J]. Colloids Surf A, 2011, 390(1-3): 189-198. |
| [61] | Garti N, Aserin A, Tiunova I, et al. A DSC study of water behavior in water-in-oil microemulsions stabilized by sucrose esters and butanol[J]. Colloids Surf A, 2000, 170(1): 1-18. |
| [62] | Rao Jiajia, McClements D J. Formation of flavor oil microemulsions, nanoemulsions and emulsions: influence of composition and preparation method[J]. J Agric Food Chem, 2011, 59(9): 5026-5035. |
| [63] | Arima S, Ueji T, Ueno S, et al. Retardation of crystallization-induced destabilization of PMF-in-water emulsion with emulsifier additives[J]. Colloids Surf B, 2007, 55(1): 98-106. |
| [64] | Bos M A, Van Vliet T. Interfacial rheological properties of adsorbed protein layers and surfactants: a review[J]. Adv Colloid Interface Sci, 2001, 91(3): 437-471. |
| [65] | 朱艳艳, 徐桂英. 界面扩张流变方法研究大分子与表面活性剂的相互作用[J]. 物理化学学报, 2009, 25(1): 191-200. Zhu Yanyan, Xu Guiying. Investigation of macromolecule/surfactant interaction by interfacial dilational rheology method[J]. Acta Phys-Chim Sin, 2009, 25(1): 191-200.(in Chinese) |
| [66] | Saiki Y, Horn R G, Prestidge C A. Droplet structure instability in concentrated emulsions[J]. J Colloid Interface Sci, 2008, 320(2): 569-574. |
| [67] | Dicharry C, Arla D, Sinquin A, et al. Stability of water/crude oil emulsions based on interfacial dilatational rheology[J]. J Colloid Interface Sci, 2006, 297(2): 785-791. |
| [68] | 冯建国, 张小军, 于迟, 等. 我国农药剂型加工的应用研究概况[J]. 中国农业大学学报, 2013, 18(2): 220-226. Feng Jianguo, Zhang Xiaojun, Yu Chi, et al. General situation of applied studies on pesticide formulations processing in China[J]. J China Agric Univ, 2013, 18(2): 220-226.(in Chinese) |
| [69] | 陈福良, 尹明明. 农药微乳剂概念及其生产应用中存在问题辨析[J]. 农药学学报, 2007,9(2): 110-116. Chen Fuliang, Yin Mingming. Discussion on pesticide microemulsion concept and its problems in production and application[J]. Chin J Pestic Sci, 2007, 9(2): 110-116.(in Chinese) |
| [70] | Green J M, Beestman G B. Recently patented and commercialized formulation and adjuvant technology[J]. Crop Prot, 2007, 26(3): 320-327. |
| [71] | 农业部农药检定所.企业版农药电子手册[DB/OL].(2014-10-08) [2014-09-30]. Institute for the Control of Agrochemicals Ministry of Agriculture. Enterprise pesticide electronic manual[DB/OL].(2014-10-08) [2014-09-30]. http://www.ny100.cn |
| [72] | 华乃震. 影响农药水乳剂稳定性因素与控制(上)[J]. 世界农药, 2010, 32(4): 1-4. Hua Naizhen. Factors influencing the stability of pesticides EW formulations and controlling measures(1)[J]. World Pestic, 2010, 32(4): 1-4.(in Chinese) |
| [73] | Elshafei Gamal M S, El-Said M M, Attia Hanaa A E, et al. Environmentally friendly pesticides: essential oil-based W/O/W multiple emulsions for anti-fungal formulations[J]. Ind Crops Products, 2010, 31(1): 99-106. |
| [74] | 孔令娥, 张嘉坤, 江华, 等. 有机膨润土对农药水乳剂稳定性的协同作用及其机制[J]. 农药学学报, 2012, 14(1): 83-88. Kong Linge, Zhang Jiakun, Jiang Hua, et al. Study on the synergistic effect and mechanism of organic bentonite for maintaining the stability of the pesticide emulsion oil in water formulation [J]. Chin J Pestic Sci, 2012, 14(1): 83-88.(in Chinese) |
| [75] | David K R. Colloid and interface science in formulation research for crop protection products[J]. Curr Opin Colloid Interface Sci, 2000, 5(5-6): 280-287. |
| [76] | 齐武. 拟除虫菊酯类农药水乳剂的研制与开发[D]. 南京: 南京林业大学, 2005. Qi Wu. The research and development of pyrethroid pesticide emulsion in water[D]. Nanjing: Nanjing Forestry University, 2005.(in Chinese) |
| [77] | 张晓光, 刘洁翔, 王海英, 等. 阿维菌素水乳剂的稳定性[J]. 物理化学学报, 2010, 26(3): 617-625. Zhang Xiaoguang, Liu Jiexiang, Wang Haiying, et al. Stability of avermyctin emulsion in water [J]. Acta Physico-Chimica Sinica, 2010, 26(3): 617-625.(in Chinese) |
| [78] | 冯建国, 张小军, 范腾飞, 等. 体系pH、乳化温度和电解质离子对异丙甲草胺水乳剂稳定性的影响[J]. 高等学校化学学报, 2012, 33(11): 2521-2525. Feng Jianguo, Zhang Xiaojun, Fan Tengfei, et al. Effects of pH value, emulsification temperature and electrolytical ions on the stability of metolachlor emulsion in water[J]. Chem J Chinese Univ, 2012, 33(11): 2521-2525.(in Chinese) |
| [79] | Wang Lijuan, Li Xuefeng, Zhang Gaoyong, et al. Oil-in-water nanoemulsions for pesticide formulations[J]. J Colloid Interface Sci, 2007, 314(1): 230-235. |
| [80] | 陈丹, 黄啟良, 吕和平, 等. 拟三元相图在农药水乳剂配方筛选中的应用研究[J]. 现代农药, 2008, 7(4): 25-28. Chen Dan, Huang Qiliang, Lü Heping, et al. Studies on the application of the pseudo-ternary phase diagram in screening pesticide emulsion in water[J]. Modem Agrochem, 2008, 7(4): 25-28.(in Chinese) |
| [81] | 张源, 商建, 张小兵, 等. 酯化淀粉乳化剂制备的高效氯氟氰菊酯O/W乳液的稳定机制[J]. 应用化学, 2012, 29(3): 332-339. Zhang Yuan, Shang Jian, Zhang Xiaobing, et al. Stability mechanism of lambda-cyhalothrin O/W emulsion prepared with esterified starch as emulsifier[J]. Chinese J Appl Chem, 2012, 29(3): 332-339.(in Chinese) |
| [82] | 伍翔, 魏方林, 魏晓林, 等. 震荡制乳的可行性及NaCl影响水乳剂体系稳定性[J]. 农药, 2006, 45(7): 452-455. Wu Xiang, Wei Fanglin, Wei Xiaolin, et al. Feasibility of vibration induced emulsions and the mechanism of NaCl effects on EW system stability[J]. Agrochemicals, 2006, 45(7): 452-455.(in Chinese) |
| [83] | Liu Ying, Wei Fanglin, Wang Yangyang, et al. Studies on the formation of bifenthrin oil-in-water nano-emulsions prepared with mixed surfactants[J]. Colloids Surf A, 2011, 389(1-3): 90-96. |
| [84] | 郭勇飞, 尹明明, 陈福良. 光散射技术在4.5%高效氯氰菊酯水乳剂物理稳定性研究中的应用[J]. 农药学学报, 2010, 12(1): 79-84. Guo Yongfei, Yin Mingming, Chen Fuliang. Application of light scattering technology for studying the physical stability of beta-cypermethr in 45 EW[J]. Chin J Pestic Sci, 2010, 12(1): 79-84.(in Chinese) |
| [85] | 王振, 高越, 李光玉. 高效氟氯氰菊酯水乳剂配方及其润湿性能研究[J]. 中国农学通报, 2012, 28(27): 250-254. Wang Zhen, Gao Yue, Li Guangyu. Study of formula and wet-spreading of beta-cyfluthrin EW[J]. Chin Agric Sci Bull, 2012, 28(27): 250-254.(in Chinese) |
| [86] | 谭玉荣, 庞民好, 张金林, 等. 10%溴虫腈水乳剂配方研究[J]. 农药学学报, 2007, 9(4): 423-426. Tan Yurong, Pang Minhao, Zhang Jinlin, et al. Study on formulation of chlorfenapyr 10% EW[J]. Chin J Pestic Sci, 2007, 9(4): 423-426.(in Chinese) |
| [87] | Zhang Xiaoguang, Liu Jiexiang, Fan Zhijin. Stability of etofenprox in water emulsion induced by block copolymer and surfactant[J]. Colloids Surf A, 2013, 422: 191-198. |
 2015, Vol.
2015, Vol. 


