有机磷类杀虫剂具有高效广谱的特点,已被广泛用于农业及卫生害虫的控制[1]。由于在靶标生物和非靶标生物间的低选择性及高毒性,2007年,甲胺磷(methamidophos)、对硫磷(parathion)、甲基对硫磷(methyl parathion)、久效磷(monocrotophos)及磷胺(phosphamidon)等5种有机磷杀虫剂在我国已被禁用[2]。但是,由于此类杀虫剂具有廉价、高效以及低生物累积性等优点,因此目前仍有一些生物选择性好的有机磷类杀虫剂被广泛使用。Casida等[3]报道,在2103年销售使用的232种杀虫剂中,有91种是有机磷类杀虫剂和氨基甲酸酯类杀虫剂,即在目前使用的杀虫剂中,有机磷类杀虫剂仍占有较大比重。
有机磷类杀虫剂进入生物体内后,可对生物体造成多种急性或慢性毒性效应。在生物体内,有机磷类杀虫剂可发生多种生物转化或代谢反应,形成毒性不同的多种代谢产物,从而导致其生物毒性发生变化。其生物转化不仅与药剂的解毒代谢相关,有些还与其毒性的发挥以及生物选择性等密切相关。此外,许多昆虫对有机磷类杀虫剂产生的代谢抗性也与抗性昆虫对药剂代谢作用的改变有关。因此,了解有机磷类杀虫剂的生物代谢机制,对于掌握其毒理机制和生物选择性,有效治理害虫对此类杀虫剂的抗药性,安全合理地使用有机磷杀虫剂均具有重要的意义。
由于对有机磷类杀虫剂对非靶标生物毒性的关注,目前,此类杀虫剂的生物代谢研究主要集中于药剂在大鼠、小鼠等哺乳动物体内的代谢产物、途径及相关代谢毒理[4,5]等方面,对于此类药剂在鱼等环境生物中的代谢及毒性也有研究报道[6],而对于其在昆虫中代谢的研究,则主要集中在与药剂毒性密切相关的活化代谢研究,以及抗性昆虫由于对有机磷杀虫剂代谢的改变所导致的代谢抗性等方面[7,8,9]。
有关有机磷类杀虫剂代谢的研究报道较多,早在20世纪80年代就有学者综述了其代谢途径及生物活化与解毒作用[10],随后也有文章综述了昆虫对有机磷类杀虫剂抗性机制的研究进展[11,12]。近年来,随着对有机磷类杀虫剂生物代谢及其分子机制研究的深入,针对昆虫对此类杀虫剂产生代谢抗性的分子机制研究也取得了一些进展[13]。因此,本文拟在综述有机磷类杀虫剂代谢途径的基础上,对参与其代谢的细胞色素P450酶系(P450s)、水解酯酶、谷胱甘肽硫转移酶(GSTs),以及这些生物代谢酶在有机磷类杀虫剂代谢中的作用等研究成果进行总结,并就昆虫对此类杀虫剂的代谢抗性机制、尤其是分子机制的研究进展进行综述,旨在为全面掌握有机磷类杀虫剂的代谢及相关毒理学机制提供参考。 1 有机磷杀虫剂的结构特点及代谢途径
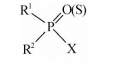
有机磷类杀虫剂主要包括有机磷酸酯类(organophosphates,OPs)和硫代有机磷酸酯类(organophosphorothioates,OPTs,简称硫代磷酸酯类)。在此类杀虫剂分子(Scheme 1)中,通常含有1个磷酰键(PO)或硫代磷酰键(PS),构成有机磷(膦)酸酯或硫代有机磷(膦)酸酯。其中,R1和R2直接与P原子结合,或通过O(S)原子与P原子相连,而吸电子的离去基团X则直接或通过O(S)原子间接与P原子相连。当此类杀虫剂被磷酸酯酶水解时,X可从P原子上释放离去,从而表现为解毒代谢作用[10]。
 | Scheme 1 |
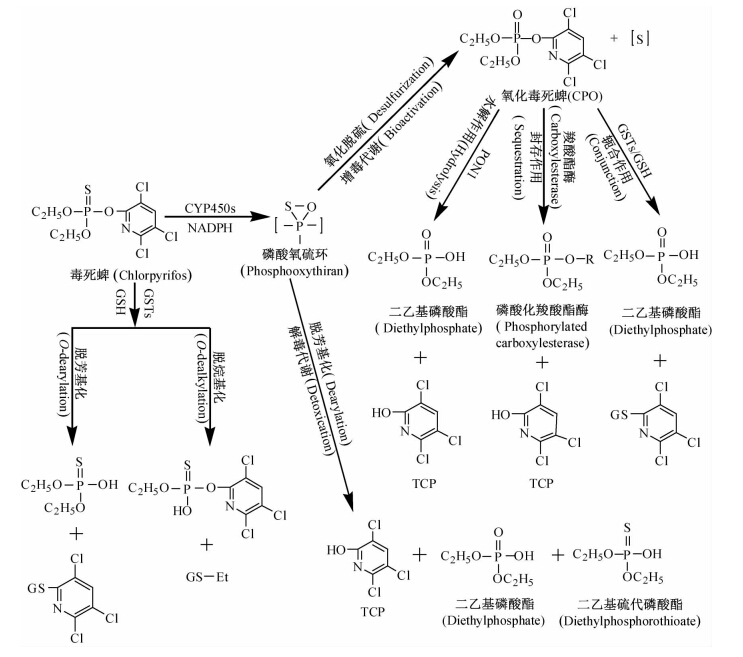
目前已明确多种有机磷类杀虫剂的代谢途径。如被广泛应用的硫代磷酸酯类杀虫剂毒死蜱在进入动物体内后,将经历氧化、水解、封存及轭合等多种代谢反应,并产生相应的代谢物[7,14,15](图 1)。其他有机磷类杀虫剂的代谢途径均与此类似。下面拟分别对有机磷类杀虫剂的氧化、水解、轭合等代谢途径及相关的代谢酶进行具体介绍。
1.1 有机磷类杀虫剂的氧化代谢及相关氧化酶 1.1.1 氧化代谢途径有机磷类杀虫剂在生物体内的氧化代谢主要是在P450s的催化下进行的[16,17]。其氧化代谢反应主要包括硫代磷酸酯的氧化脱硫、硫醚结构R1—S—R2 的亚砜化及砜化(sulfoxidation)、脱芳基(dearylation)或脱烷基(dealkylation)、芳香脂肪链及O、N、P所连接甲基的脱甲基以及羟基化反应等[10]。其中,硫代磷酸酯的氧化脱硫是最重要的氧化增毒代谢反应,而有机磷酸酯的脱芳(烷)基则是重要的解毒代谢反应。
在P450s的催化作用下,毒死蜱首先转化成不稳定的磷酸氧硫环(phosphooxythiran)中间体,该中间体进一步发生氧化脱硫反应和脱芳(烷)基反应[7](图 1)。其中,氧化脱硫反应可使分子中的 PS 键转化为 PO 键,形成氧化毒死蜱(chlorpyrifos oxon,CPO),其比母体化合物具有更高的生物毒性。因此,硫代磷酸酯类杀虫剂在生物体内所发生的氧化脱硫反应属于生物毒性增强的增毒代谢。此类反应在昆虫体内广泛存在,决定了化合物的高杀虫活性,而由于氧化脱硫反应在哺乳类动物体内却很少发生,从而使得硫代磷酸酯类杀虫剂在昆虫与哺乳动物间具有了较高的生物选择性。
除氧化脱硫反应外,在P450s的催化作用下,磷酸氧硫环还可发生脱芳基或脱烷基反应,形成低毒的代谢产物,此途径属于解毒代谢反应。如毒死蜱在P450s的催化下,不仅可以氧化脱硫形成氧化毒死蜱,而且还可脱芳基形成低毒的二乙基磷酸酯(diethylphosphate)、二乙基硫代磷酸酯(diethylphosphorothioate)以及三氯吡啶醇(2,3,5-trichloro-4-pyridinyl alcohol,TCP)(图 1)。与毒死蜱类似,对硫磷在P450s的作用下,也可通过氧化脱硫形成对氧磷(paraoxon)或通过脱芳基形成对硝基酚、二乙基磷酸酯和二乙基硫代磷酸酯。二乙基磷酸酯和二乙基硫代磷酸酯对胆碱酯酶均无抑制活性,不会对生物产生相应的毒性作用[1]。
虽然硫代磷酸酯的氧化代谢中间体——磷酸氧硫环难以被检测到,但已有许多研究表明,在有机磷类杀虫剂的生物代谢反应中,增毒代谢产物和解毒代谢产物是同时存在的。如在小鼠体内,毒死蜱通过氧化代谢可同时产生增毒产物氧化毒死蜱和解毒产物三氯吡啶醇[18]。由于不同生物对有机磷类杀虫剂的解毒代谢与增毒代谢反应比例有所不同,从而导致了不同生物对该类杀虫剂的敏感性不同[18]。 1.1.2 参与有机磷类杀虫剂氧化代谢的生物酶 参与有机磷类杀虫剂氧化代谢反应的生物酶主要是细胞色素P450酶系(P450s)和黄素单加氧酶(flavin monooxygenases,FMOs)。 1.1.2.1 细胞色素P450酶系的作用
P450s是普遍存在于从细菌到人的几乎所有生物体中的生物酶,其在生物体内组成了非常重要的代谢系统,参与了诸如激素、脂肪酸和类固醇等内源化合物的浓度调节。此外,P450s通过催化氧化反应的发生,在生物体对杀虫剂及植物毒素等外源化合物的代谢中也发挥着重要作用[19]。在一些昆虫中,由P450s参与的对杀虫剂代谢作用的增强,导致了昆虫种群对杀虫剂抗性的产生[19]。
P450s在有机磷类杀虫剂的氧化代谢中发挥着重要作用。其不仅可催化硫代磷酸酯发生氧化脱硫反应形成增毒代谢物,还可通过脱芳(烷)基反应形成解毒代谢物[19],此外,P450s还可以催化含有硫醚结构的有机磷化合物氧化生成相应的亚砜及砜,催化有机磷酸酯中的芳香脂肪链及O、N、P所连接甲基的脱甲基以及羟基化等反应[10]。
P450s在哺乳动物肝脏内含量最高,而有机磷类杀虫剂的代谢也主要是在哺乳动物肝脏内进行的。Buratti等[8]使用人类肝微粒体以及cDNA表达的P450s同工酶,进行了有机磷类杀虫剂的体外代谢研究,发现CYP3A4是催化有机磷酸酯砜化反应的主要同工酶,CYP2B6和CYP2C19则分别是催化毒死蜱和二嗪磷脱硫氧化反应的同工酶。在哺乳动物体内,对硫磷主要被CYP3A4/5和CYP2C8氧化而活化,所产生的对氧磷主要被CYP2B6代谢成p-硝基酚[16]。此外,不同的P450同工酶催化有机磷酸酯反应时,产生活化产物和解毒产物的比例也有所不同。CYP1A2、CYP3A4和CYP2C9催化倍硫磷形成了浓度相近的氧化物和亚砜;CYP2B6更易催化倍硫磷形成倍硫磷氧化物,而CYP2C19则主要催化倍硫磷形成亚砜[20]。当倍硫磷的浓度小于100 μmol/L时,CYP1A2催化倍硫磷形成氧化物和亚砜的活性最高,而当倍硫磷浓度大于100 μmol/L时,则是CYP3A4的催化活性最高[20]。
P450s除了能催化有机磷类杀虫剂的氧化反应外,还可以催化一些此类杀虫剂的还原解毒反应,如P450s不仅能将对硫磷氧化为毒性更强的对氧磷,还能将对硫磷还原成多种无毒产物,如氨基对硫磷(aminoparathion)、二乙基磷硫酰酸(diethylphosphorothioic)和p-硝基酚、脱乙基对硫磷(desethyl parathion)和乙醛等[16]。 1.1.2.2 黄素单加氧酶的作用
P450s在对外源物质的氧化代谢中发挥了主要作用,然而,黄素单加氧酶在一些化合物氧化代谢中的作用也不可忽视[21]。
FMOs是一组依赖黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced form of nicotinamide adenine dinucleotide phosphate,NADPH)和分子氧的微粒体酶。FMOs能氧化代谢很多含S、Se、N、P等杂原子的外源化合物,使其形成杂原子氧化物,这些代谢物不仅具有相对较低的毒性或致癌性,而且更易被排出体外[22]。
FMOs的氧化循环作用与P450s的氧化作用是截然不同的。P450s是通过单电子的单加氧酶催化氧化反应,而FMOs则是双电子氧化酶机制[21,23]。P450s通过共氧化以及自由基而进行的氧化过程,会产生对细胞大分子和生物组织具有毒害作用的代谢物,而FMOs氧化生成的绝大部分代谢物毒性却有所降低。因此,在一些情况下,虽然P450s与FMOs具有交叉的底物特异性,但是两者会形成不同的代谢物,而且这些代谢物也具有不同的毒理及药理性质[21]。
FMOs与P450s在氧化能力上也存在一定的差异。与FMOs相比,虽然P450s也可以氧化化合物中的杂原子,但是其催化效率比FMO低得多;但在砜化反应中则是P450s的催化作用更为有效;与P450s具有一定的可诱导性相比,生物体内的FMOs是不可被诱导的[21]。此外,在对杂原子化合物的氧化代谢中,P450s和FMOs之间还具有相互补充的功能:FMOs参与了对植物中含有杂原子的亲核化合物及代谢物的代谢,但是当生物体不具有FMOs活性时,这些物质将会通过P450s进行代谢[21]。
FMOs所具有的独特氧化代谢能力,导致了其与生物对一些毒性物质的敏感性密切相关。当动物体内缺乏FMOs时,虽然仍可通过P450s对外源物质进行代谢,但这些动物会对一些毒性化学物质表现为高敏感性;而具有高水平FMOs活性的动物则可将毒性物质代谢掉,从而显示出较低的敏感性。例如,5个不同的FMO基因亚家族编码了哺乳动物的5种FMO,其中,在成人肝脏中最重要的是FMO3,而在大鼠肝脏中FMO3的量却很少,因而导致了二者之间对一些物质的代谢差异及敏感度差异[23]。
FMOs也在有机磷类杀虫剂的生物氧化中发挥着重要作用。含有硫脲、硫醚结构的有机磷类杀虫剂如甲拌磷和乙拌磷,均可被FMOs氧化生成S-氧化物[21]。FMOs也是影响含硫杀虫剂如硫代磷酸酯类以及含氮杀虫剂如氨基甲酸酯类化合物生物转化和生物活性的重要微粒体酶。FMO1和FMO3在三唑磷(triazophos)、内吸磷(demeton)及地虫硫磷(fonofos)的砜化反应中发挥催化作用,并且FMO1对所有氨基甲酸酯和硫代磷酸酯类杀虫剂均具有很强的催化作用[17]。Leoni等[20]研究发现,催化形成倍硫磷亚砜的是FMO1,而FMO1主要在肝脏外组织中表达,并且其活性大于FMO3和FMO5总活性的90%。
P450s和FMOs是两种不同的氧化酶系,虽然P450s和FMOs均可催化外源化合物的硝基、硫基以及含磷化合物发生氧化反应,但P450s还可以催化这些化合物中的碳发生羟基化[10]。此外,当P450s中的CYP2C家族同工酶具有最高的催化形成亚砜的活性时,成人肝脏中FMO3同工酶则表现出了最低的催化硫醚化合物砜化的活性[24]。
因此,虽然P450s在对外源物质的氧化代谢中发挥了主要作用,但FMOs在一些化合物包括有机磷类杀虫剂的氧化代谢中的作用也不可忽视。 1.2 有机磷类杀虫剂的生物水解及相关水解酶
水解是有机磷类杀虫剂在生物体内发生的重要生物转化反应之一。在多种水解酯酶的催化下,有机磷类杀虫剂可以被水解为毒性较低的水解产物,从而失去对胆碱酯酶的抑制作用。
1953年,Aldridge[25]根据水解酯酶与有机磷化合物的相互作用特点,将水解酯酶分为3类。其中,将含酰化半胱氨酸活性位点、并且能水解有机磷化合物的酯酶,归为A酯酶(EC 3.1.1 .2 ),主要是多种磷酸三酯酶(phosphotriesterase,PTE),如对氧磷酶等;将含有丝氨酸活性位点、并且可被有机磷化合物如对氧磷等所抑制的酯酶,归为B酯酶(EC 3.1.1.1),主要是脂族酯酶(aliphatic esterase,ALiE)和胆碱酯酶(acetylcholine esterase,AChE)等;而将活性不受有机磷化合物的抑制,也不能降解有机磷化合物的酯酶归为C酯酶(EC 3.1.1.6)。 1.2.1 磷酸三酯酶(PTE)的作用
有机磷酸酯以及硫代磷酸酯氧化脱硫形成的氧化物,在磷酸三酯酶如对氧磷酶(PON1)等的作用下发生水解,使得与P原子相连接的离去基团被羟基取代,形成两种或两种以上的无毒或低毒产物,从而可以随尿液排出体外或继续进行下一步代谢反应。如氧化毒死蜱在对氧磷酶的作用下,可水解为二乙基磷酸酯和三氯吡啶醇(图 1)。
磷酸三酯酶主要存在于哺乳动物、鱼、鸟、软体动物和细菌的多种生物组织中[25]。研究者在哺乳动物的血清和肝脏中发现了高活性的磷酸三酯酶[26]。关于哺乳动物血清和假单胞菌中的磷酸三酯酶在有机磷类化合物水解中的作用已有报道[25]。
由磷酸三酯酶催化的有机磷类化合物的水解反应,是使P原子和离去基团间的共价键断开而形成相应的水解产物。由于其水解产物的极性强于母体化合物,故难以在生物的脂肪体中积累,容易随尿液排出。此外,由于有机磷化合物的水解代谢物具有更低的磷酸化能力,所以对动物的毒性也更低。因此,由磷酸三酯酶催化的有机磷类化合物的水解也属于解毒代谢反应[23]。
通常,对磷酸三酯酶主要以其底物名称命名,如参与水解二异丙基氟磷(diisopropyl flurophosphate,DFP)、对氧磷及O-己基-O-2,5-二氯苯基磷酰胺酯(O-hexyl-O-2,5-dichloro phenyl phosphoramidate,HDCP)的磷酸三酯酶分别被命名为DFP酶、对氧磷酶(PON)和HDCP酶[26]。
在多种磷酸三酯酶中,对氧磷酶在有机磷类杀虫剂的生物水解和解毒代谢中发挥着重要作用。人体中的对氧磷酶家族共有3个成员——PON1、PON2和PON3。其中,参与有机磷类杀虫剂及其有毒氧化产物水解的主要是PON1。PON1不仅可以水解有机磷酸酯中的磷酸酯键,还可以催化硫代磷酸酯的脱硫氧化物的水解,从而对来自肝脏的有机磷杀虫剂氧化产物进行解毒代谢。如二嗪磷、毒死蜱、对硫磷经P450s氧化形成氧化二嗪磷、氧化毒死蜱及对氧磷后,可以继续被PON1水解,生成相应的水解代谢物二乙基磷酸酯、三氯吡啶醇、甲基嘧啶醇和对硝基苯酚[26],此代谢途径也被称为有机磷杀虫剂的P450-PON1解毒代谢途径[27]。
对氧磷酶PON1的基因在编码和启动子区域具有多态性。PON1的Q192R基因和C108T基因多态性分别影响着对氧磷酶的表达水平及其对不同底物的催化活性[14]。利用转基因动物进行的研究表明,对氧磷酶PON1的活性水平及其Q192R基因的多态性,在对一些有机磷类杀虫剂急性毒性的影响中发挥了关键作用[28]。 对氧磷酶在不同种类动物体内的活性有所不同:哺乳动物中以兔血清中的PON1活性为最高;昆虫中PON1的活性比哺乳动物的低;而鸟类的PON1活性很低[25]。
对氧磷酶等磷酸三酯酶对有机磷化合物的水解活性与二价阳离子和螯合剂的存在密切相关。阳离子主要作为磷酸三酯酶的活化剂或抑制剂而发挥作用,而螯合剂则是磷酸三酯酶的强抑制剂。其中,钙离子是与磷酸三酯酶活性密切相关的重要二价阳离子,其对人血清中对氧磷酶水解活性的发挥具有双重促进作用[29]:一方面,钙离子通过与对氧磷酶结合,使酶蛋白保持活性构象;另一方面,血清中的游离钙离子促进了有机磷杀虫剂的代谢物——二乙基磷酸酯残基从酶蛋白上释放进入血清中。然而,也有一些二价阳离子是人血清中对氧磷酶活性的抑制剂,这些阳离子通过取代磷酸三酯酶活性中心的钙离子而抑制了对氧磷酶的活性,因此人血清中对氧磷酶的活性可以被CdSO4、HgCl2及AgNO3所抑制。对氧磷酶通常可以被EDTA所抑制,但也有研究者根据对氧磷酶对EDTA的敏感性,将其分为了对EDTA敏感的和不敏感的两种[23]。
Sogorb等[30]研究了阳离子及螯合剂对其他生物中磷酸三酯酶活性的影响,发现:鸡血清中的HDCP酶对螯合剂不敏感;HDCP酶既不能被钙离子活化也不能被EDTA抑制,且软体动物和鸡肾脏中的DFP酶也是如此;但在鸡血清中,高浓度的铜离子能有效地催化HDCP的水解。 1.2.2 丝氨酸水解酯酶的作用
丝氨酸水解酯酶是含丝氨酸活性位点的酯酶,主要包括胆碱酯酶如乙酰胆碱酯酶AChE)和丁酰胆碱酯酶(BChE),以及脂族酯酶如羧酸酯酶(CarE)等。丝氨酸水解酯酶是一类B酯酶,其活性可以被有机磷化合物所抑制。 1.2.2.1 乙酰胆碱酯酶和丁酰胆碱酯酶与有机磷类杀虫剂的相互作用
有机磷化合物通过磷酸化而对乙酰胆碱酯酶等产生抑制作用,是该类化合物的主要毒性作用机制。
丁酰胆碱酯酶也被称为假胆碱酯酶或血清胆碱酯酶,其与有机磷化合物的相互作用值得关注。一方面,有机磷化合物能与丁酰胆碱酯酶结合而抑制其活性[31];另一方面,有机磷化合物也可以被视为丁酰胆碱酯酶的半底物,丁酰胆碱酯酶通过与化合物结合而形成酰基化酶中间体,进而促进了有机磷化合物的水解[9]。通常,丁酰胆碱酯酶受有机磷杀虫剂抑制的速率往往大于其对药剂的水解速率,但也有报道指出,在丁酰胆碱酯酶Gly117位点上发生的组氨酸突变,会大大增强其对有机磷类杀虫剂的水解能力[9]。
动物血清中丁酰胆碱酯酶的活性水平很高。丁酰胆碱酯酶作为有机磷类杀虫剂的次级靶标,当其与杀虫剂有效结合后,会导致杀虫剂分子不能再与其靶标乙酰胆碱酯酶结合,从而有助于对杀虫剂的解毒代谢。尽管一分子丁酰胆碱酯酶只能结合一分子的有机磷杀虫剂,但其在保护生物免受有机磷类杀虫剂毒害方面也发挥着重要作用[9]。 1.2.2.2 脂族酯酶与有机磷类杀虫剂的相互作用
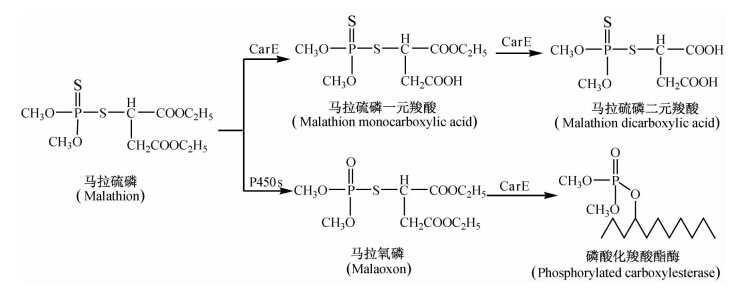
有机磷化合物与脂族酯酶的相互作用则较为复杂。一方面,脂族酯酶对一些有机磷类杀虫剂中的羧酸酯键具有一定的水解作用。如哺乳动物中的羧酸酯酶可以将马拉硫磷(malathion)分子末端的羧酸酯键水解,从而将马拉硫磷转化为马拉硫磷一元羧酸(malathion monocarboxylic acid)和马拉硫磷二元羧酸(malathion dicarboxylic acid)等代谢物[23]。另一方面,有机磷杀虫剂可对脂族酯酶产生抑制作用。如有机磷酸酯类杀虫剂可以直接与脂族酯酶中的羧酸酯酶共价结合,使羧酸酯酶活性中心的丝氨酸残基发生磷酸化而导致其失活;而硫代磷酸酯类杀虫剂则可在氧化脱硫形成相应的氧化物后,再与羧酸酯酶结合而使其失活[9]。这种有机磷类杀虫剂与脂族酯酶的结合作用,一方面可使脂族酯酶磷酸化而抑制其活性,另一方面脂族酯酶通过与有机磷杀虫剂及其代谢物结合,从而将杀虫剂及其代谢物与靶标隔离,导致有机磷类杀虫剂不再具有生物活性,这就是脂族酯酶对有机磷类杀虫剂所产生的封存隔离作用(sequestration)[9]。脂族酯酶与有机磷化合物的结合是按化学计量学的比例进行的。通常,一分子脂族酯酶只能结合并清除一分子的有机磷化合物,因此脂族酯酶对有机磷化合物的封存解毒效率远不及磷酸三酯酶的水解清除作用[29]。
脂族酯酶对有机磷杀虫剂的封存隔离作用是昆虫和高等动物对此类药剂进行解毒的途径之一[9]。在鱼体内,其羧酸酯酶对有机磷酸酯类杀虫剂的敏感性高于乙酰胆碱酯酶,因此,药剂会竞争性地首先与羧酸酯酶结合,从而有效地避免了 杀虫剂 对乙酰胆碱酯酶的抑制[9]。
羧酸酯酶在末端具有羧酸酯键的马拉硫磷等有机磷类化合物的代谢中发挥了多方面的作用。在哺乳动物体内,羧酸酯酶首先水解马拉硫磷的一个末端羧酸酯键,使其转化为马拉硫磷一元羧酸,继续水解则生成马拉硫磷二元羧酸[23](图 2)。由于马拉硫磷一元羧酸和二元羧酸都是乙酰胆碱酯酶的弱抑制剂,因此,羧酸酯酶催化马拉硫磷水解的反应属于解毒代谢反应[19]。此外,由于该类化合物分子中还含有可被氧化增毒的 PS 键,因此,在生物体内,由羧酸酯酶催化的马拉硫磷的水解反应,与由P450s催化的马拉硫磷氧化脱硫生成马拉氧磷的反应存在相互竞争关系[10,19]。然而,当马拉硫磷被氧化为马拉氧磷后,其末端的羧酸酯键就不能再被羧酸酯酶水解了,而马拉氧磷却可与羧酸酯酶结合而抑制其活性,同时,由于羧酸酯酶与马拉氧磷的定量结合与封存,也实现了对马拉氧磷的解毒作用[23](图 2)。
关于马拉硫磷的代谢途径,也存在与上述说法不同的观点。Chambers[26]报道,马拉硫磷在氧化脱硫形成马拉氧磷后,不但可以和羧酸酯酶共价结合,也可被羧酸酯酶水解生成马拉氧磷一元羧酸而解毒。
可见,羧酸酯酶不仅可以通过水解马拉硫磷等一些有机磷杀虫剂的末端羧酸酯键而使其解毒,而且可以通过对有机磷类杀虫剂及其代谢物的封存隔离作用而使其解毒。因此,羧酸酯酶活性的改变或个体间酶活性的差异,有可能使所形成的马拉氧磷的量增加,从而导致毒性增强。由于人体内含有此类羧酸酯酶,因此马拉硫磷对人的毒性较低。在哺乳动物中虽然存在着一些脂族酯酶,扮演着有机磷类杀虫剂“清除者”的角色,但是其清除能力非常有限。然而在抗有机磷类杀虫剂的蟑螂和苍蝇种群中,其抗性的产生则与脂族酯酶的过量表达有关,这些过量表达的脂族酯酶可通过与有机磷类杀虫剂结合而使其失活[a href="#R32">32]。
总之,与丝氨酸水解酯酶对有机磷类杀虫剂的清除作用相比,磷酸三酯酶的水解是更为有效的解毒代谢途径。 1.3 有机磷杀虫剂与还原型谷胱甘肽的轭合反应
有机磷类杀虫剂在生物体内除了可以发生氧化和水解代谢外,还可以进行II相的轭合代谢,目前研究最多的是此类杀虫剂与还原型谷胱甘肽(GSH)的轭合代谢反应。
谷胱甘肽硫转移酶(GSTs)是一类催化GSH与亲电子化合物轭合的解毒酶。GSTs同时参与了有机磷类杀虫剂的I相及II相代谢[15]。
GSTs通过催化GSH与有机磷杀虫剂的轭合,使杀虫剂发生了I相解毒代谢中的O-脱烷基和O-脱芳基两种代谢反应。其中,在O-脱烷基代谢反应中,GSH与杀虫剂的烷基部分发生轭合,而在其O-脱芳基反应中,GSH则与离去基团相结合(图 1)。由GSTs参与的有机磷杀虫剂的这两种代谢反应,均已在家蝇中得到研究证实[15]。
由GSTs参与的有机磷杀虫剂的II相代谢反应,是在硫代磷酸酯类杀虫剂被P450s氧化形成相应的氧化物(oxon)后,GSTs再催化GSH与有机磷杀虫剂的氧化物轭合,从而进行II相轭合代谢[15]。如针对毒死蜱的体外代谢研究发现,毒死蜱可产生多种代谢物,其中不仅包含GSH与毒死蜱的轭合物,还包含氧化毒死蜱断裂形成的TCP与GSH的轭合物(图 1)[15]。
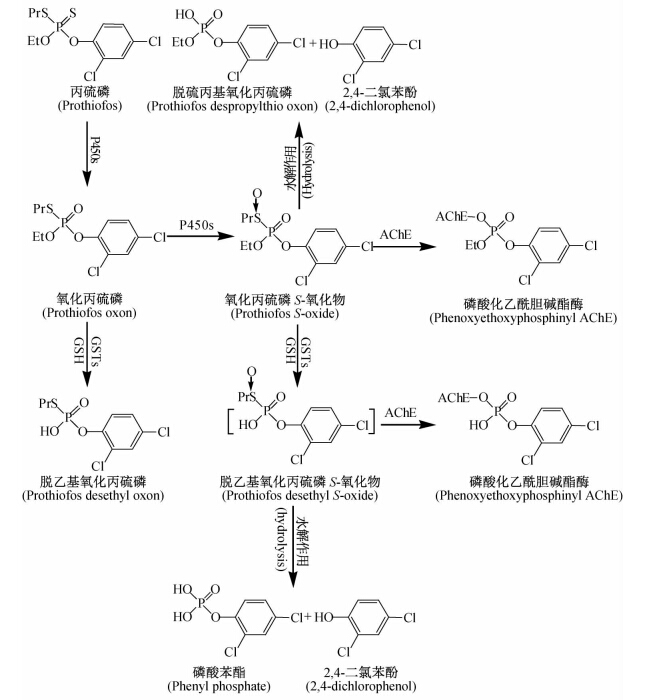
GSTs不仅在有机磷类杀虫剂的解毒代谢中发挥作用,其在丙硫磷(prothiofos)等有机磷杀虫剂的增毒代谢中也发挥了一定的作用[33]。丙硫磷与甲胺磷、丙溴磷(profenofos)及吡唑硫磷(pyraclofos)等结构类似,均属于S-烷基取代的硫代磷酸酯类杀虫剂,尽管它们也可以被氧化为相应的氧化物,但是这些氧化物并不能抑制乙酰胆碱酯酶,因而不具有杀虫活性,然而当这些氧化物被进一步氧化为相应的S-氧化物(oxon S-oxide)后,即能有效抑制乙酰胆碱酯酶,从而显示出杀虫活性[33]。因此,丙硫磷在P450s催化下,先被氧化为氧化丙硫磷,再进一步氧化形成氧化丙硫磷的S-氧化物(prothiofos oxon S-oxide)后,才显示出了杀虫活性(图 3)。Miyamoto等[33]研究发现,在GSTs催化下,GSH与氧化丙硫磷的S-氧化物上的乙基轭合后,生成了脱乙基的氧化丙硫磷S-氧化物(desethyl S-oxide),由于该代谢物具有抑制乙酰胆碱酯酶的活性,因而表现出了相应的杀虫活性(图 3)。
Kenneth等[34]研究发现,在GSTs的催化下,还原型谷胱甘肽与一些有机磷类杀虫剂是直接轭合,而不是与其代谢产物发生轭合反应,而这些有机磷杀虫剂的谷胱甘肽轭合物可以继续进行II相代谢反应。因此,许多有机磷类杀虫剂在GSTs催化下产生的代谢产物是半胱氨酸的乙酰衍生物,也被称为硫醚氨酸。在高等动物中,有机磷类杀虫剂的II相代谢通常是通过硫醚氨酸代谢途径进行的[34]。
综上所述,有机磷类杀虫剂在生物体内的代谢反应极为复杂,细胞色素P450酶系、黄素单加氧酶、磷酸三酯酶、丝氨酸水解酯酶及谷胱甘肽硫转移酶等均在有机磷类杀虫剂的转化与代谢中发挥着重要作用。有机磷类杀虫剂氧化性酯键断裂所生成的代谢产物,与水解酯酶催化生成的水解产物,有时是完全相同的(图 1)。有机磷类杀虫剂在生物体内发生的解毒代谢与增毒代谢反应的比例,不仅与化合物的分子结构特点有关,还与生物种类、性别、解毒代谢酶的活性及其所受外界及内部因素的诱导与抑制作用等密切相关。 2 昆虫对有机磷类杀虫剂的代谢抗性机制
由于有机磷类杀虫剂的长期以及不规范使用,已导致一些害虫对部分药剂产生了抗药性。研究表明,昆虫对有机磷类杀虫剂的抗药性机制主要有靶标抗性、穿透抗性及代谢抗性等。其中,昆虫对药剂代谢能力的增强是导致其代谢抗性产生的原因。掌握昆虫对有机磷类杀虫剂的代谢抗性机制,对于合理、有效地进行害虫的抗药性治理十分重要。 2.1 昆虫对有机磷类杀虫剂的代谢抗性与细胞色素P450酶系的关系
细胞色素P450酶系在有机磷类杀虫剂的氧化代谢中发挥着重要作用[35]。抗性昆虫中P450s基因的过量表达及P450s酶活性的增强,与昆虫对有机磷杀虫剂代谢能力的增强及抗性产生密切相关。
在已鉴定的昆虫P450s基因中,大多数昆虫的P450s基因属于微粒体CYP4、CYP6、CYP9、CYP28及CYP321家族和线粒体CYP12家族。一些昆虫对杀虫剂的抗药性与昆虫P450s基因的变化相关[36]。
昆虫经有机磷杀虫剂暴露后,其多种P450s基因被诱导而出现过量表达,导致了昆虫耐药性的产生[37,38]。Guo等[37]研究表明:采用辛硫磷处理家蚕Bombyxmori linnaeus后,其中肠和脂肪体中CYP6αe22和CYP9A21基因的表达水平有所增加,导致家蚕对辛硫磷产生了代谢抗性;将东亚飞蝗Locusta migratoria manilensis暴露于马拉硫磷,可诱导其CYP409A1和CYP408B1基因的表达,使其对马拉硫磷的敏感性降低[36]。意大利蜜蜂Apis mellifera体内P450s CYP9Q1、CYP9Q2和CYP9Q3等的过量表达,使其对香豆磷(coumaphos)产生了抗药性[39]。灰飞虱Laodelphax striatellus中3种P450s基因CYP6AY3v2、CYP306A2v2、CYP353D1v2和1种羧酸酯酶基因CE36的过量表达,导致了其对毒死蜱的代谢抗性[40]。
此外,昆虫P450s活性的增强也与其对有机磷类杀虫剂的抗性相关。在抗辛硫磷的家蝇品系体内,其P450s的O-脱甲基活性明显高于敏感品系[41]。
目前,有关昆虫P450s基因的过量表达以及P450s氧化活性增强与昆虫对有机磷类杀虫剂抗性关系的研究还相对较少,尚需进一步深入研究。 2.2 昆虫对有机磷类杀虫剂的代谢抗性与丝氨酸水解酯酶的关系
昆虫对有机磷类杀虫剂的代谢抗性与其丝氨酸水解酯酶的变化密切相关。其抗药性分子机制主要有两种:一种是丝氨酸水解酯酶基因的结构发生了改变,使酯酶原有的水解丝氨酸的活性降低或丧失,但同时却获得了水解有机磷杀虫剂的酶活性[11],从而导致了抗性的产生;另一种是丝氨酸水解酯酶通过在基因水平上的扩增或转录水平的上调而过量表达后,与杀虫剂分子以高亲和性结合,从而对有机磷杀虫剂产生封存隔离作用,使药剂难以到达其作用靶标而导致了抗性的产生[42]。 2.2.1 与丝氨酸水解酯酶突变相关的代谢抗性机制
研究发现,在对硫磷、对氧磷、二嗪磷及马拉硫磷等有机磷杀虫剂的一些抗性品系昆虫中,出现了羧酸酯酶活性低于其相应敏感品系的现象。Newcomb[43]和Campbell [44]认为这是由于有机磷抗性品系昆虫的脂族酯酶突变为磷酸酯酶后,其羧酸酯酶以降低自身活性为代价,从而表现出了对有机磷杀虫剂的水解能力,这就是所谓的“脂族酯酶突变”假说。羧酸酯酶活性降低最早是在抗有机磷杀虫剂的家蝇中发现的,随后在铜绿蝇Lucillia cuprina等对有机磷杀虫剂产生抗性的昆虫中也得到了证实[11]。目前在昆虫抗有机磷杀虫剂品系中主要发现了羧酸酯酶基因的两种突变。一种是在抗性铜绿蝇中发现的编码羧酸酯酶同工酶E3酯酶的LcαE7基因突变,导致酯酶发生了Gly137/Asp突变,该突变使得E3酯酶活性降低,同时使其对有机磷杀虫剂的水解活性升高[12]。由于家蝇羧酸酯酶的MdαE7基因与铜绿蝇LcαE7基因的氨基酸序列同源性为75%,因此二嗪磷抗性家蝇羧酸酯酶的MdαE7基因突变导致酯酶发生Gly137/Asp突变后,同样使其对有机磷类杀虫剂的水解能力得到了增强[12]。另一种酯酶基因突变发生在抗马拉硫磷的铜绿蝇中,发现其羧酸酯酶基因LcαE7突变也导致了1个氨基酸突变,即Trp251/Leu[12]。通过表达抗性铜绿蝇羧酸酯酶的LcαE7基因,并比较表达产物的动力学常数,发现Trp251/Leu突变降低了其脂族酯酶的活性,同时提高了其有机磷水解酶的活性。抗马拉硫磷家蝇与铜绿蝇品系中羧酸酯酶的Trp251/Ser或Trp251/Leu突变,使突变后的羧酸酯酶对二甲基取代的有机磷杀虫剂的水解能力超过了对二乙基取代的有机磷杀虫剂的水解能力[12]。此外,一种抗马拉硫磷的膜翅目寄生蜂的羧酸酯酶基因也发生了突变,并导致了Trp220/Gly氨基酸突变,而寄生蜂羧酸酯酶的Trp220/Gly突变与铜绿蝇羧酸酯酶Trp251/Leu突变的位置是相对应的[44]。
众多研究表明,羧酸酯酶137和251氨基酸位点的突变可能是昆虫对有机磷类杀虫剂产生代谢抗性的普遍机制。丝氨酸水解酯酶基因的突变导致了其催化中心的蛋白氧离子洞和酰基结合口袋的变化,从而改变了丝氨酸水解酯酶对有机磷杀虫剂和羧酸酯类化合物的水解特异性[43,45]。丝氨酸水解酯酶137位的甘氨酸突变位于其催化中心的氧阴离子洞,因而改变了水分子对其亲核攻击的方向,促进了水分子对四面体磷酸化丝氨酸的亲核攻击,使酯酶具有了对有机磷化合物的水解活性,从而使得昆虫对二嗪磷等一些二乙基取代的有机磷杀虫剂表现出了中等抗性[46]。丝氨酸水解酯酶251位的色氨酸突变位于其酰基结合口袋,该突变使酯酶具有了更大的空间,可以容纳具庞大酸根离子的底物,并可减少有机磷杀虫剂水解时磷原子周围转位的空间障碍[43]。丝氨酸水解酯酶251位的色氨酸突变,不仅使昆虫对马拉硫磷表现出了高水平的抗性,同时还使得昆虫对多种结构中不含羧酸酯键的有机磷杀虫剂表现出了中等水平的抗性[46]。
尽管丝氨酸水解酯酶的上述两种突变都能使昆虫对多种有机磷类杀虫剂产生抗性,但与Trp251/Leu突变相比,铜绿蝇酯酶E3基因的Gly137/Asp突变使得酯酶具有了更强的水解有机磷杀虫剂的活性,也使得昆虫对有机磷类杀虫剂产生了更高的抗性[45]。也有研究发现,多种昆虫中与酯酶基因251位色氨酸突变相对应的W271L突变,比昆虫中与酯酶基因Gly137位突变相对应的G151D突变更有效地影响了羧酸酯酶的底物特异性,因而使其具有了更强的水解有机磷杀虫剂的活性[47]。
需要指出的是,铜绿蝇的Gly137/Asp突变使其酯酶失去了羧酸酯酶活性,并且在 不存在有机磷杀虫剂的情况下,可造成昆虫的适合度代价(fitness cost),而Trp251/Leu突变对其羧酸酯酶活性影响较小,当不存在有机磷杀虫剂时,也不会引起昆虫的适合度代价[45]。 2.2.2 与丝氨酸水解酯酶基因扩增或表达量变化相关的代谢抗性机制
在抗有机磷类杀虫剂的昆虫品系中,由羧酸酯酶基因扩增或过量表达而引起的酯酶表达量增加,也是重要的代谢抗性机制。该抗性机制主要是由于过量表达的羧酸酯酶与有机磷杀虫剂发生了高亲和性的结合,从而对有机磷化合物分子产生了封存隔离作用,使得药剂不能到达作用靶标,从而导致昆虫对该类杀虫剂产生了抗药性[42]。这种抗性机制在尖音库蚊Culex pipiens、环跗库蚊Culex tarsalis、桃蚜Myxus persicae及白粉虱Trialeurodes vaporariorum等一些昆虫中已被报道[42,48,49]。
由羧酸酯酶介导的桃蚜对有机磷杀虫剂的代谢抗性,是由于抗性桃蚜中两种羧酸酯酶同工酶E4或FE4的过量表达所致[47]。虽然过量表达的E4或FE4两种同工酶对二甲基取代的有机磷类杀虫剂的水解活性仍比较低,水解速率很慢,但其可主要通过封存隔离有机磷杀虫剂而降低昆虫对药剂的敏感性。致倦库蚊Culex pipiens quinquefasciatus和褐飞虱Nilaparvata lugens对有机磷类杀虫剂产生抗性的原因即是由于基因扩增所致的羧酸酯酶过量表达,从而对杀虫剂产生了封存隔离作用[50]。在抗马拉硫磷的草盲蝽Lyygus pratensis种群中,其酯酶基因转录水平是敏感种群的5.1倍[51]。
麦二叉蚜Schizaphis grarainum对有机磷杀虫剂的抗性机制则比较复杂,不仅涉及基因扩增导致的羧酸酯酶过量表达而产生的封存隔离作用,同时还存在由羧酸酯酶多种同工酶表达变化所导致的抗性[52]。Zhu等[42]认为,麦二叉蚜中与芳香酯酶相似的酯酶的存在,导致了其对有机磷杀虫剂的抗性。
有研究表明,抗氧化乐果棉蚜Aphis gossypii Glover 种群中羧酸酯酶的表达量是敏感棉蚜种群的4.54倍[53]。也有报道,抗有机磷杀虫剂棉蚜是由于酯酶基因的突变及扩增而导致了抗性的产生[46,53]。而与有机磷杀虫剂抗性相关的羧酸酯酶变化的数量和质量机制,在棉蚜的马拉硫磷抗性种群中均存在[46]。
在其他昆虫中也发现了与酯酶基因扩增或表达量变化相关的对有机磷类杀虫剂的抗性机制。Maritza等[54]发现,苹果蠹蛾Laspeyresia pomonella对有机磷杀虫剂的抗性主要是由于高水平的羧酸酯酶活性及过量表达的羧酸酯酶同工酶所致。Chris[55]发现,尖音库蚊通过染色体II上分别编码α-酯酶的E3基因和 编码β-酯酶的E2基因的扩增,导致了其对有机磷杀虫剂的抗性。
由于马拉硫磷具有末端酯键这一独特结构,导致了昆虫对其的抗性机制也具有独有的特点。在抗马拉硫磷的昆虫品系中,其羧酸酯酶对马拉硫磷中羧酸酯键的水解活性显著高于敏感品系,并且所增加的羧酸酯酶活性可以被有机磷杀虫剂所抑制,尤其是能被磷酸三苯酯(triphenyl phosphate,TPP)所抑制,表明昆虫对马拉硫磷的抗性机制是以获得羧酸酯酶活性为基础的[39]。昆虫对马拉硫磷抗性分子机制的研究也表明,抗性品系家蝇和铜绿蝇中羧酸酯酶251位氨基酸位点发生了突变,增强了羧酸酯酶对马拉硫磷中羧酸酯键的水解能力[15]。 2.3 昆虫对有机磷杀虫剂的抗性与谷胱甘肽硫转移酶的关系
谷胱甘肽硫转移酶(GSTs)是一种与昆虫对杀虫剂代谢抗性相关的代谢酶,其也参与了昆虫对有机磷类杀虫剂的代谢。 研究表明,黄粉虱Dialeurodes citri的GSTs能催化GSH与有机磷杀虫剂结合[34];关于GSTs与黄粉甲Tenebrio molitor对甲基对硫磷和甲基对氧磷抗性关系的研究发现,由GSTs参与的昆虫对有机磷杀虫剂的抗性机制,实质是杀虫剂与GSTs的活性中心结合后再与GSH轭合[34]。Ku等[56]报道,GSTs参与了小菜蛾Plutella xyllostella对有机磷杀虫剂的代谢抗性。在有机磷杀虫剂抗性昆虫品系中,GSTs活性升高增强了昆虫对杀虫剂的解毒作用[57]。东亚飞蝗的GSTs5基因参与了其对马拉硫磷的代谢[58];而其GSTu5基因在对甲萘威和马拉硫磷的解毒代谢中发挥了重要作用,其GSTd1基因则与飞蝗对毒死蜱的抗性有关[59]。
GSTs表达量增加在昆虫对有机磷类杀虫剂的抗性中也具有一定的作用。 将灰飞虱暴露于亚致死剂量的毒死蜱时,会诱导其GSTe1和GSTs2基因表达量的上调[59]。 GSTD3 和GSTE6A基因型家蝇可以代谢甲基对硫磷、二嗪磷和林丹(lindane),而家蝇GSTs中MdGSTD3基因的过量表达与其对有机磷杀虫剂的抗性相关[60]。小菜蛾体内的GST3和GST4能够降解有机磷杀虫剂对氧磷、对硫磷和甲基对硫磷,而且其GST3中GSTE1基因的过量表达导致了小菜蛾对有机磷杀虫剂的抗性[61]。关于GSTs的过量表达与昆虫对有机磷杀虫剂代谢抗性之间的关系还有待进一步深入研究。 3 结论及展望
有机磷类化合物在生物体内可发生氧化、水解及轭合等多种代谢反应。细胞色素P450酶系、黄素单加氧酶、磷酸三酯酶、丝氨酸水解酯酶以及谷胱甘肽硫转移酶等在有机磷类杀虫剂的转化与代谢中均发挥着重要作用。针对有机磷类杀虫剂生物代谢的研究已逐渐从明确代谢路径和代谢产物,深入到了生物代谢酶的作用等生化及分子机制研究方面。
昆虫对有机磷类杀虫剂的代谢抗性与其代谢能力的改变密切相关。在已对有机磷类杀虫剂产生抗性的昆虫中,参与有机磷杀虫剂代谢的P450s、羧酸酯酶、GSTs等解毒酶的活性均发生了显著的变化。昆虫对有机磷杀虫剂抗性的分子机制,主要包括抗性昆虫中P450s基因的过量表达、羧酸酯酶的过量表达及基因突变、GSTs基因的过量表达等。
目前,关于昆虫对有机磷类杀虫剂的代谢抗性机制已进行了较为深入的研究,但对参与代谢抗性的昆虫解毒酶的表征研究还相对较少。今后可通过分析抗性和敏感品系昆虫解毒酶基因表达谱的差异,采用RNA干扰等技术,对参与有机磷杀虫剂代谢及代谢抗性昆虫的解毒酶的功能进行表征,以全面掌握昆虫对此类杀虫剂的代谢抗性机制,促进新型高选择性有机磷杀虫剂的研发,有效促进害虫对此类杀虫剂抗药性的治理。随着对环境友好型杀虫剂需求程度的不断提高,很多高毒的、生物选择性差的有机磷杀虫剂已逐渐退出市场。对于有机磷类农药尤其是有机磷杀虫剂的应用前景,正如Casida等[3]所指出的那样,只有提高新型有机磷杀虫剂的生物选择性,尤其是对人等哺乳动物的安全性,才能使其具有较好的发展前景。
| [1] | Milan J, Melita K, Dejan B, et al. Organophosphate induced delayed polyneuropathy in man: an overview[J]. Clin Neurol Neurosurg, 2011, 113(1): 7-10. |
| [2] | 中华人民共和国农业部公告第322号[Z]. 2003-12-30. The 322nd Announcement of the Ministry of Agriculture of the People's Republic of China[Z]. 2003-12-30.(in Chinese) |
| [3] | Casida J E, Kathleen A D. Anticholinesterase insecticide retrospective[J]. Chem-Biol Interact, 2013, 203(1): 221-225. |
| [4] | Ojo J O, Abduliah L, Evans J, et al. Exposure to an organophosphate pesticide, individually or in combination with other Gulf War agents, impairs synaptic integrity and neuronal differentiation, and is accompanied by subtle microvascular injury in a mouse model of Gulf War agent exposure[J]. Neuropathology, 2014, 34(2): 109-127. |
| [5] | Vismaya, Rajini P S. Oral exposure to the organophosphorus insecticide, monocrotophos induces intestinal dysfunction in rats[J]. Food Chem Toxicol, 2014, 71: 236-243. |
| [6] | Zhu Bin, Gong Yuxin, Liu Lei, et al. Toxic effects of triazophos on rare minnow(Gobiocypris rarus) embryos and larvae[J]. Chemosphere, 2014, 108: 46-54. |
| [7] | Forsyth C S, Chanbers J E. Activation and degradation of the phosphorothionate insecticides parathion and EPN by rat brain[J]. Biochem Pharmacol, 1989, 38(10): 1597-1603. |
| [8] | Burattif F M, Daniello A, Volpe M T, et al. Malathion bioactivation in the human liver: the contribution of different cytochrome P450 isoforms[J]. Drug Metab Dispos, 2005, 33(3): 295-302. |
| [9] | Costa L G. Current issues in organophosphate toxicology[J]. Clinica Chimica Acta, 2006, 366(1-2): 1-13. |
| [10] | 李劲彤, 杜先林. 有机磷杀虫剂的体内活化与解毒[J]. 中国工业医学杂志, 1999, 12(1): 53-55. Li Jintong, Du Xianlin. The activation and detoxification of organophosphate insecticides in vivo[J]. Chinese J Ind Med, 1999, 12(1): 53-55.(in Chinese) |
| [11] | Campbell P M, Trott J F, Claudianos C, et al. Biochemistry of esterases associated with organophosphate resistance in Lucilia cuprina with comparisons to putative orthologues in other Diptera[J]. Biochem Gene, 1997, 35(1-2): 17-40. |
| [12] | Robyn J R, Charles C, Peter M C, et al. Two major classes of target site insensitivity mutations confer resistance to organophosphate and carbamate insecticides[J]. Pestic Biochem Physiol, 2004, 79(3): 84-93. |
| [13] | 周斌芬, 唐振华, 高菊芳. 昆虫代谢抗性的研究进展[J]. 农药, 2008, 47(5): 313-316. Zhou Binfen, Tang Zhenhua, Gao Jufang. Advances in metabolic resistance to insecticides in insects[J]. Pesticedes, 2008, 47(5): 313-316.(in Chinese) |
| [14] | Costa L G, Toby B C, Clement E F. Paraoxonase(PON1): from toxicology to cardiovascular medicine[J]. Acta Biomed, 2005, 76(S2): 50-57. |
| [15] | Che-Mendoza A, Penilla R P, Rodríguez D A. Insecticide resistance and glutathione S-transferases in mosquitoes: a review[J]. African J Biotechnol, 2009, 8(8): 1386-1397. |
| [16] | Hodgson E. In vitro human phase I metabolism of xenobiotics I: pesticides and related compounds used in agriculture and public health[J]. J Biochem Mol Toxicol, 2003, 17(4): 201-206. |
| [17] | Furnes B, Schlenk D. Extrahepatic metabolism of carbamate and organophosphate thioether compounds by the flavin-containing monooxygenase and cytochrome P450 systems[J]. Drug Metab Dispos, 2005, 33(2): 214-218. |
| [18] | Lotti M, Moretto A. Organophosphate-induced delayed polyneuropathy[J]. Toxicol Rev, 2005, 24(1): 37-49. |
| [19] | Mizutani M, Ohta D. Diversification of P450 genes during land plant evolution[J]. Annu Rev Plant Biol, 2010, 61(1): 291-315. |
| [20] | Leoni C, Buratti F M, Testai E. Fenthion bioactivation by recombinant human CYPs and FMO[J]. Drug Metab Rev, 2006, 38: 100-101. |
| [21] | Krueger S K, Williams D E. Mammalian flavin-containing monooxygenases: structure/function, genetic polymorphisms and role in drug metabolism[J]. Pharmacol Ther, 2005, 106(3): 357-387. |
| [22] | Uno Y, Shimizu M, Yamazaki H. Molecular and functional characterization of flavin-containing monooxygenases in cynomolgus macaque[J]. Biochem Pharmacol, 2013, 85(12): 1837-1847. |
| [23] | Cashman J R, Perotti B Y, Berkman C E, et al. Pharmacokinetics and molecular detoxication[J]. Environ Health Persp, 1996, 104(S1): 23-40. |
| [24] | Usmani K A, Karoly E D, Hodgson E, et al. In vitro sulfoxidation of thioether compounds by human cytochrome P450 and flavin-containing monooxygenase isoforms with particular reference to the CYP2C subfamily[J]. Drug Metab Dispos, 2004, 32(3): 333-339. |
| [25] | Vilanova E, Sogorb M A. The role of phosphotriesterases in the detoxication of organophosphorus compounds[J]. Crit Rev Toxicol, 1999, 29(1): 21-57. |
| [26] | Chambers J E. PON1 multitasks to protect health[J]. Proc Natl Acad Sci USA, 2008, 105(35): 12639-12640. |
| [27] | Furlong C E. Genetic variability in the cytochrome P450-paraoxonase1(PON1) pathway for detoxication of organophosphorus compounds[J]. J Biochem Mol Toxicol, 2007, 21(4): 197-205. |
| [28] | Cole T B, Walter B J, Shih D M, et al. Toxicity of chlorpyrifos and chlorpyrifos oxon in a transgenic mouse model of the human paraoxonase(PON1) Q192R polymorphism[J]. Pharmacogen Genomics, 2005, 15(8): 589-598. |
| [29] | Sogorb M A, Vilanova E. Enzymes involved in the detoxification of organophosphorus, carbamate and pyrethroid insecticides through hydrolysis[J]. Toxicol Lett, 2002, 128(1-3): 215-228. |
| [30] | Sogorb M A, Diaz-Aiejo N, Vilanova E, et al. Effect of some metallic cations and organic-compounds on the O-hexyl O-2,5-dichlorophenyl phosphoramidate hydrolyzing activity in hen plasma[J]. Arch Toxicol, 1993, 67(6): 416-421. |
| [31] | Buratti F M, Leoni C, Testai E. The human metabolism of organophosphorothionate pesticides: consequences for toxicological risk assessment[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit, 2007, 2(1): 37-44. |
| [32] | Wheelock C E, Shan G M, Ottea J. Overview of carboxylesterases and their role in the metabolism of insecticides[J]. J Pestic Sci, 2005, 30(2): 75-83. |
| [33] | Miyamoto T, Mikawa T. Oxidative glutathione conjugation and its novel role in activation of the organophosphorus insecticide prothiofos[J]. Pestic Sci Soc Japan, 2005, 30(1): 31-38. |
| [34] | Kostaropoulos I, Papadopoulos A I, Metaxakis A, et al. The role of glutathione S-transferases in the detoxification of some organophosphorus insecticides in larvae and pupae of the yellow mealworm, Tenebrio molitor(Coleoptera: Tenebrionidae)[J]. Pest Manag Sci, 2001, 57(6): 501-508. |
| [35] | Zhou Xiaojie, Ma Caixia, Li Mei, et al. CYP9A 12 and CYP9A17 in the cotton bollworm, Helicoverpa armigera: sequence similarity, expression profile and xenobiotic response[J]. Pest Manag Sci, 2010, 66(1): 65-73. |
| [36] | Tang Tao, Zhao Chunqing, Feng Xiaoyun, et al. Knockdown of several components of cytochrome P450 enzyme systems by RNA interference enhances the susceptibility of Helicoverpa armigera to fenvalerate[J]. Pest Manag Sci, 2012, 68(11): 1501-1511. |
| [37] | Guo Yanqiong, Zhang Jianzhen, Yu Rongrong. Identification of two new cytochrome P450 genes and RNA interference to evaluate their roles in detoxification of commonly used insecticides in Locusta migratoria[J]. Chemosphere, 2012, 87(7): 709-717. |
| [38] | Wang Y H, Gu Z Y, Wang J M, et al. Changes in the activity and the expression of detoxification enzymes in silkworms(Bombyx mori) after phoxim feeding[J]. Pestic Biochem Physiol, 2013, 105(1): 13-17. |
| [39] | Mao Wenfu, Schuler M A, Berenbaum M R. CYP 9 Q-mediated detoxification of acaricides in the honey bee(Apis mellifera)[J]. Proc Natl Acad Sci USA, 2011, 108(31): 12657-12662. |
| [40] | Xu Lu, Wu Min, Han Zhaojun. Biochemical and molecular characterization and cross-resistance in field and laboratory chlorpyrifos-resistant strains of Laodelphax striatellus(Hemiptera: Delphacidae) from eastern China[J]. Pest Manag Sci, 2014, 70(7): 1118-1129. |
| [41] | 邱立红, 张文吉. 不同抗性水平家蝇对有机磷、拟除虫菊酯等药剂的交互抗性研究[J]. 中国农业大学学报, 1999, 4(3): 86-92. Qiu Lihong, Zhang Wenji. Study on cross-resistance to organophosphorus and pyrethroids in housefly strains possessing different level resistance to phoxim and deltamethrin[J]. J China Agric Univ, 1999, 4(3): 86-92.(in Chinese) |
| [42] | Zhu Kunyan, He Fengqin. Elevated esterases exhibiting arylesterase-like characteristics in an organophosphate resistant clone of the greenbug, Schizaphis graminum(Homoptera: Aphididae)[J]. Pestic Biochem Physiol, 2000, 67(3): 155-167. |
| [43] | Newcomb R D, Campbell P M, Ollis D L, et al. A single amino acid substitution converts a carboxylesterase to an organophosphorus hydrolase and confers insecticide resistance on a blowfly[J]. Proc Natl Acad Sci USA, 1997, 94(14): 7464-7468. |
| [44] | Campbell P M, Newcomb R D, Russell R J, et al. Two different amino acid substitutions in the ali-esterase, E3, confer alternative types of organophosphorus insecticide resistance in the sheep blowfly, Lucilia cuprina[J]. Insect Biochem Mol Biol, 1998, 28(3): 139-150. |
| [45] | Li Yongqiang, Farnsworth C A, Coppin CW, et al. Organophosphate and pyrethroid hydrolase activities of mutant esterases from the cotton bollworm Helicoverpa armigera[J]. PLOS ONE, 2013, 8(10): e77685. |
| [46] | Pan Yiou, Guo Hulin, Gao Xiwu. Carboxylesterase activity, cDNA sequence, and gene expression in malathion susceptible and resistant strains of the cotton aphid, Aphis gossypii[J]. Comp Biochem Physiol, Part B, 2009, 152(3): 266-270. |
| [47] | Cui Feng, Lin Zhe, Wang Hongsheng, et al. Two single mutations commonly cause qualitative change of nonspecific carboxylesterases in insects[J]. Insect Biochem Mol Biol, 2011, 41(1): 1-8. |
| [48] | Cui F, Qu H, Cong J. Do mosquitoes acquire organophosphate resistance by functional changes in carboxylesterases[J]. FASEB J, 2007, 21(13): 3584-3591. |
| [49] | Srigiriraju L, Semtner P J, Anderson T D, et al. Esterase-based resistance in the tobacco-adapted form of the green peach aphid, Myzus persicae(Sulzer)(hemiptera: Aphididae) in the eastern United States[J]. Arch Insect Biochem Physiol, 2009, 72(2): 105-123. |
| [50] | Small G J, Hemingway J. Molecular characterization of the amplied carboxylesterase gene associated with organophosphorus insecticide resistance in the brown plant hopper, Nilaparvata lugens[J]. Insect Mol Biol, 2000, 9(6): 647-653. |
| [51] | Zhu Yucheng, Gordon L S, Chen Mingshun. Enhanced esterase gene expression and activity in a malathion-resistant strain of the tarnished plant bug, Lygus lineolaris[J]. Insect Biochem Mol Biol, 2004, 34(11): 1175-1186. |
| [52] | Motoyana N, Kao L R, Lin P T, et al. Dual role of esterases in insecticide resistance in the green rice leafhopper[J]. Pestic Biochem Physiol, 1984, 21(2): 139-147. |
| [53] | Cao Chuanwang, Zhang Jing, Gao Xiwu, et al. Overexpression of carboxylesterase gene associated with organophosphorus insecticide resistance in cotton aphids, Aphis gossypii(Glover)[J]. Pestic Biochem Physiol, 2008, 90(3): 175-180. |
| [54] | Reyes M, Collange B, Rault M, et al. Combined detoxification mechanisms and target mutation fail to confer a high level of resistance to organophosphates in Cydia pomonella(L.)(Lepidoptera): Tortricidae[J]. Pest Biochem Physiol, 2011, 99(1): 25-32. |
| [55] | Bass C, Puinean A M, Zimmer C T, et al. The evolution of insecticide resistance in the peach potato aphid, Myzus persicae[J]. Insect Biochem Mol Biol, 2014, 51: 41-51. |
| [56] | Ku C C, Chiang F M, Hsin C Y, et al. Glutathione transferase isozymes involved in insecticide resistance of diamondback moth larvae[J]. Pestic Biochem Physiol, 1994, 50(3): 191-197. |
| [57] | Reidy G F, Rose H A, Viseton S, et al. Increased glutathione S-transferase activity and glutathione content in an insecticide-resistant strain of Tribolium castaneum(Herbst)[J]. Pestic Biochem Physiol, 1990, 36(3): 269-276. |
| [58] | Qin G H, Jia M, Liu T, et al. Characterization and functional analysis of four glutathione S-transferases from the migratory locust, Locusta migratoria[J]. PLoS ONE, 2013, 8(3): e58410. doi: 10.1371/journal.pone.0058410. |
| [59] | Zhou Wenwu, Li Xiwang, Quan Yinhua, et al. Identification and expression profiles of nine glutathione S-transferase genes from the important rice phloem sap-sucker and virus vector Laodelphax striatellus(Fallén)(Hemiptera: Delphacidae)[J]. Pest Manag Sci, 2012, 68(9): 1296-1305. |
| [60] | Fujioka K, Casida J E. Glutathione S-transferase conjugation of organophosphorus pesticides yields S-phospho-, S-aryl-, and S-alkylglutathione derivatives[J]. Chem Res Toxicol, 2007, 20(8): 1211-1217. |
| [61] | Lagadic L, Cuany A, Bergé J B, et al. Purification and partial characterization of glutathione S-transferase from insecticide-resistant and lindane-induced susceptible Spodoptera littoralis(Biosd) larvae[J]. Insect Biochem Physiol, 1993, 23(4): 467-474. |
 2015, Vol.
2015, Vol.