大蒜在生产中易受地下害虫为害[1],目前主要以有机磷类农药防治为主,该类农药具有高效、广谱、易分解,在人、畜体内一般不积累等特点,但施药量超标问题严重。
农药多残留分析主要有样品前处理和仪器检测分析两个方面,目前常用的样品前处理方法有溶剂萃取、固相萃取(SPE)、基质固相分散萃取(MSPD)和分散固相萃取法(QuEChERS)等,常用的检测器有气相色谱-火焰光度检测器(GC-FPD)、气相色谱-单级质谱检测器(GC-MS)和液相色谱-单级质谱检测器(HPLC-MS)等[2, 3, 4, 5, 6]。由于大蒜富含蒜氨酸类物质和活性酶,在样品制备过程中会产生有机硫化合物,基质背景复杂,易出现假阳性和假阴性,干扰基质检测结果[7, 8]。因此,大蒜样品的农药残留检测比较困难。马晓东等[8]采用溶剂萃取、层析柱净化、气相色谱-质谱检测的方法测定了大蒜中41种农药的残留量,发现基质干扰严重,其添加水平需高达5 mg/kg,无法满足检测要求(0.01~0.05 mg/kg)[7]。采用微波处理大蒜,可降低基质干扰,但对试验条件要求较苛刻,实际应用性不强[9, 10]。
传统的固相萃取法因具有回收率和富集倍数高、对样品净化相对彻底、前处理操作简单方便、对试验条件要求相对宽松等优点,已被大量用于农药残留检测的样品前处理[11, 12]。气相色谱-三重四极杆串联质谱(GC-MS/MS)的多反应监测技术(MRM)可大幅度降低基质背景和噪音,从而提高残留分析的准确性[13, 14, 15, 16]。 但目前,尚未见利用该方法同时测定大蒜中多种有机磷农药残留量的报道,鉴于此,笔者采用固相萃取技术对大蒜进行净化,采用GC-MS/MS的多反应监测模式检测,建立了大蒜中19种有机磷农药残留量的检测方法,旨在消除基质干扰严重的现象。
1 材料与方法 1.1 供试材料 1.1.1 植物样品大蒜样品购自海南海口超市。
1.1.2 主要仪器Trace GC Ultra 型气相色谱仪(美国Thermo 公司),带FPD 检测器和软件处理系统;Agilent 7890A 型气相色谱仪-Agilent 7000A 型三重四级杆串联质谱仪(美国Agilent 公司);Laborota 4000 真空旋转蒸发仪(德国Heidolph 公司);Sartorius 电子天平(1/1 000,德国赛多利斯天平有限公司);IKAT 18 均质器(德国IKA 公司);XW-80A 微型涡旋混合仪(上海沪西分析仪器厂有限公司);Carbon/NH2 固相萃取小柱(石墨化碳黑/氨基,500 mg/6 mL,美国Agilent 公司);Florisil 固相萃取小柱(1 000 mg/6 mL)和 N-Alumina 固相萃取小柱(2 000 mg/6 mL),德国CNW 公司; NH2 固相萃取小柱(500 mg/6 mL)和 C18固相萃取小柱(500 mg/6 mL),美国菲罗门公司。
1.1.3 药剂及试剂乙腈、丙酮和乙酸乙酯均为色谱纯(美国Tedia公司);乙酸、甲苯和氯化钠为分析纯(广州化学试剂厂);质量浓度均为1 000 mg/L 的19种有机磷农药(见表 1)标准溶液(天津农业部环境质量监督检验测试中心);试验用水为蒸馏水。
1.2 检测方法 1.2.1 样品制备将约5 kg大蒜样品去皮后放入食品料理机搅碎,混匀,按文献[17, 18]要求置于-20 ℃冰箱中保存,备用。
1.2.2 样品的提取及净化 大蒜样品于室温解冻后立刻准确称取25.00 g,加入50 mL 提取溶剂高速匀浆提取1 min。过滤转移至加有8 g氯化钠的100 mL具塞量筒中,收集滤液,振荡1 min 后静置30 min。准确移取 25.00 mL上清液至鸡心瓶中,在35 ℃水浴中旋蒸浓缩至近干,待净化。取5.0 mL V(乙腈)∶V(甲苯)=3∶1的混合溶液预淋洗Carbon/NH2柱,弃去淋洗液,再取6 mL该混合溶液分3次洗涤上述待净化样品,收集洗涤液加到固相萃取柱中,用20.0 mL V(乙腈)∶V(甲苯)=3∶1的混合溶液洗脱,收集洗脱液,在40 ℃水浴中旋蒸浓缩至近干,用正己烷定容至1.00 mL,待检测。
1.2.3 检测条件 1.2.3.1 气相色谱-串联质谱(GC-MS/MS)条件SLB-5 MS色谱柱(30 m×0.25 mm,0.25 μm)(美国 SUPELCO公司)。进样口温度240 ℃,恒流模式:流速1.0 mL/min;载气:He,99.999%;离子源温度:230 ℃;IE能量:70 ev;四极杆温度:150 ℃;质谱接口温度:280 ℃; 碰撞气流速:氮气1.5 mL/min,氦气2.25 mL/min;分析模式:多反应监测(MRM); 柱温采用程序升温:初始温度80 ℃,保持1 min;以20 ℃/min的速度升到200 ℃,保持 5 min; 以8 ℃/min的速度升到260 ℃;再以4 ℃/min的速度升到270 ℃。共运行22 min。进样体积为1 μL。
1.2.3.2 气相色谱-火焰光度检测器(GC-FPD)条件DB-17色谱柱(30 m×0.53 mm,1 μm)(美国 Agilent公司)。进样口温度240 ℃,恒流模式:流速7.0 mL/min;载气:氮气,99.999%;FPD温度:150 ℃;氢气 85 mL/min,空气110 mL/min;柱温采用程序升温:初始温度110 ℃,保持1 min;以35 ℃/min的速度升到250 ℃,保持 6 min; 以40 ℃/min的速度升到260 ℃,保持10 min。共运行21.25 min。 进样体积为1 μL。
1.2.4 结果计算按公式(1)计算:
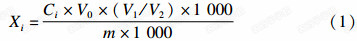
各农药单标准储备液的配制:各取1 mL 农药标准品,分别置于10 mL容量瓶中,用丙酮溶解并定容至刻度,配制成质量浓度为100 mg/L的单标准储备液。
混合标准工作溶液的配制:各取1.0 mL 上述单标准储备液于25 mL容量瓶中,用丙酮定容至刻度,配制成质量浓度为4.0 mg/L 的混合标准工作溶液。
基质校正标准工作溶液的配制:准确称取25.00 g空白大蒜样品各5份,按1.2.2节方法进行样品前处理后,分别加入0.05、0.1、0.2、0.5和1 mL上述混合标准工作溶液,用正己烷定容到5 mL,分别配制成质量浓度为 0.04、0.08、0.16、0.4和 0.8 mg/L的基质校正工作溶液。按照1.2.3节的GC-MS/MS条件,以待测物定量离子的峰面积y对质量浓度x (mg/L)作标准曲线,分别得到19种有机磷农药的线性方程及决定系数。
用正己烷稀释混合标准工作溶液,配制成质量浓度分别为0.04、0.08、0.16、0.4和0.8 mg/L的溶剂标准溶液,将该溶液与质量浓度相同的基质匹配标准溶液分别作标准工作曲线,测定5个添加水平均为0.05 mg/kg 的大蒜样品,计算19种有机磷农药的平均回收率,考察基质效应对测定结果的影响。
1.4 添加回收试验在大蒜空白样品中分别添加0.01、0.08、0.1和0.2 mg/kg的19种农药混合标准工作溶液,每个水平重复5次,按 1.2.2和1.2.3 节的前处理和检测条件,测定添加回收率及相对标准偏差(RSD)。
2 结果与分析 2.1 提取溶剂的选择在大蒜空白样品中添加0.08 mg/kg的19种有机磷农药混合标准工作溶液,分别考察了乙腈、V(乙腈)∶V(水)=2∶1、丙酮、乙酸乙酯、V(乙酸)∶V(乙酸乙酯)=1∶99和V(乙酸)∶V(乙腈)=1∶99 共6种提取溶剂对提取率的影响。结果发现:虽然丙酮毒性较小,但溶解有机磷农药的同时也能将其中的油脂、色素等杂质提取出来,为净化过程带来困难。用V(乙腈)∶V(水)=2:1、乙腈和乙酸乙酯作为提取溶剂时,乙酰甲胺磷的回收率较低;而以V(乙酸)∶V(乙酸乙酯)=1∶99和V(乙酸)∶V(乙腈)=1∶99 作为提取溶剂时,乙酰甲胺磷的回收率明显提高,且回收率基本相同。鉴于乙酸乙酯的毒性低于乙腈,故最终选用V(乙酸)∶V(乙酸乙酯)=1∶99作为提取溶剂(见图 1)。另外,从图 1中可以看出,大蒜基质十分复杂,采用传统的GC-FPD检测,基质干扰十分严重,前6 min很难对目标农药进行准确定量和定性分析。
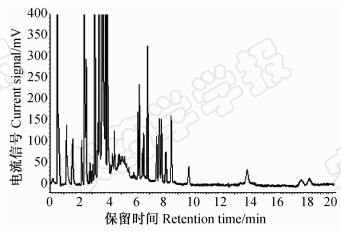 | 图 1 大蒜空白基质中各农药在0.08 mg/kg添加水平下的GC-FPD色谱图Fig. 1 GC-FPD chromatogram of blank garlic sample added pesticides at the level of 0.08 mg/kg |
比较了Florisil 固相萃取柱、C18柱、NH2柱、Carbon/NH2柱和N-Alumina固相萃取小柱对样品提取效果的影响。结果表明:N-Alumina固相萃取小柱能有效去除样品中的杂质,但对甲胺磷、氧乐果、乙酰甲胺磷和丙溴磷的回收率较低,可能是由于这4种农药极性较强,被吸附在固相萃取柱上难以被洗脱液洗脱;其他4种固相萃取柱对回收率结果影响差异不大,但由于Carbon/NH2柱具有更强的吸附色素等杂质的能力,并获得较好的回收率,因而本研究选用Carbon/NH2固相萃取小柱。
2.3 质谱条件的优化为了获得最佳的MRM质谱条件,将每种农药首先进行单级质谱全扫描,获得了19种有机磷农药的保留时间和最具代表性的母离子碎片,然后采用产物离子扫描方式通过优化碰撞能量将选择的母离子碎片击碎获得产物离子,结合文献[13, 14, 15, 16, 19],得到了较为理想的质谱条件和分离效果(见表 1)。
| 表 1 19种有机磷农药在MRM模式下的检测条件 Table 1 The determination condition of 19 organophosphorus pesticides in MRM mode |
从表 2可以看出:用以正己烷为溶剂的标准溶液测定的19种农药的平均添加回收率在88.0%~328%之间,而基质匹配标准溶液的在70.0%~118%之间。其中,甲胺磷、乙酰甲胺磷、氧乐果、甲基对硫磷、杀螟硫磷、对硫磷和水胺硫磷在正己烷标准溶液中的平均添加回收率在150%~328%之间。对质量浓度同为0.4 mg/L的正己烷配制的标准溶液与基质匹配标准溶液分别进行12次连续测定,求其峰面积响应的平均值。结果表明:甲胺磷、乙酰甲胺磷、氧乐果、甲基对硫磷、杀螟硫磷、对硫磷和水胺硫磷的基质匹配标准溶液的响应值明显比正己烷的高很多(见图 2),但这种影响在各目标农药之间存在差异。为了消除基质效应,对19种农药进行准确定量,采用基质校正工作曲线测定。
| 表 2 正己烷溶剂标准溶液和基质匹配标准溶液测定0.05 mg/kg大蒜添加样品的平均回收率(n=5) Table 2 Recoveries of 19 pesticides at the spiked level of 0.05 mg/kg in garlic used n-hexane solvent standard and the recoveries used matrix standard (n=5) |
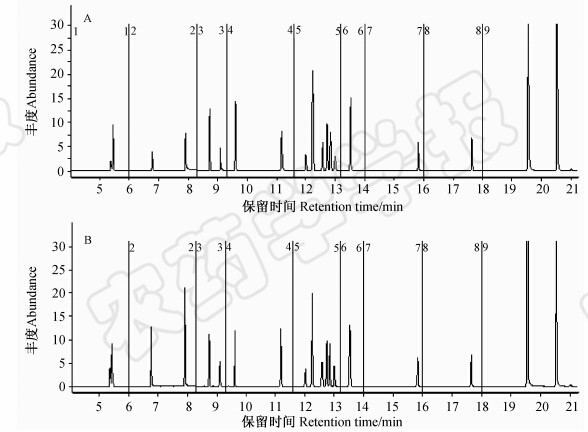 | 图 2 各农药正己烷(A)和基质(B)标准溶液质量浓度均为0.40 mg/L的MRM模式总离子流图(图中数字表示MRM的分段时间) Fig. 2 Total ion current chromatogram in MRM mode for the n-hexane (A) and matrix (B) standard solution of 0.4 mg/L for each pesticide (The numbers in the graph showed the segment time of MRM) |
有学者认为,气相色谱的基质增强效应是由于样品基质中的组分分子与目标分析物分子竞争位于进样口和柱头由金属离子、硅烷基及不挥发物质形成的活性位点,使目标分析物与活性位点的反应机会减少,更多分析物进入色谱柱造成的[14]。
2.5 方法的线性范围、定量限、准确度及精密度结果(见表 1)表明:在0.04~0.8 mg/L范围内,19种农药的线性关系良好。由图 3知19种农药的定量限(LOQ)均低于0.01 mg/kg(S/N>10)。
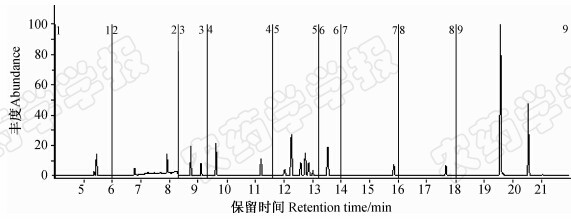 | 图 3 大蒜空白基质样品中添加19种农药(0.01 mg/kg)的MRM模式总离子流图(图中数字表示MRM的分段时间)Fig. 3 Total ion current chromatogram in MRM mode form garlic blank matrix spiked with analytes at 0.01 mg/kg (The numbers in the graph showed the segment time of MRM) |
由表 3看出:在0.01~0.2 mg/kg添加水平下,19种农药的平均回收率在68.0%~130%之间,RSD≤15.6%,说明本方法得到的数据稳定、可靠。
| 表 3 大蒜中添加19种农药的平均回收率及其相对标准偏差(n=5) Table 3 Average recoveries and RSDs of 19 pesticides spiked in the garlic matrixes for each pesticide (n=5) |
本研究运用固相萃取净化-气相色谱-三重四级杆串联质谱分析(SPE-GC-MS/MS),建立了同时测定大蒜中19种有机磷农药残留量的方法。样品以V(乙酸)∶V(乙酸乙酯)=1∶99 作为提取溶剂提高了不稳定农药乙酰甲胺磷的回收率,采用基质校正标准工作溶液对目标农药进行定量,消除了基质效应对测定结果的影响。样品前处理步骤条件较为宽松,且处理后采用GC-MS/MS多反应监测模式检测大蒜样品中19种农药均未发现干扰现象,解决了基质干扰问题。该方法在0.01~0.2 mg/kg添加水平下,19种农药的平均回收率在68.0%~130%之间,RSD≤15.6%,LOQ低于0.01 mg/kg,可实现大蒜中甲胺磷等19种有机磷农药残留的定性与定量检测。
| [1] | 郭永泽, 张玉婷, 刘磊, 等. 大蒜中多种农药残留测定的气相色谱-质谱联用技术研究[J]. 安徽农业科学, 2010, 38(8): 3870-3873. GUO Yongze, ZHANG Yuting, LIU Lei, et al. Determination of multiple pesticides residue in garlic by gas chromatography/mass spectrometry[J]. J Anhui Agric Sci, 2010, 38(8): 3870-3873. (in Chinese) |
| [2] | 薛平, 史惠娟, 杜利君, 等. 5种基质中19种有机磷农药残留的基质固相分散-气相色谱法测定[J]. 食品科学, 2010, 31(18): 227-231. XUE Ping, SHI Huijuan, DU Lijun, et al. Determination of organophosphorous pesticide residues by matrix solid-phase dispersion-gas chromatography[J]. Food Sci, 2010, 31(18): 227-231. (in Chinese) |
| [3] | 汤富彬, 陈宗懋, 罗逢健, 等. 固相萃取-气相色谱法检测茶叶中的有机磷农药残留量[J]. 分析试验室, 2007, 26(2): 43-46. TANG Fubin, CHEN Zongmao, LUO Pangjian, et al. Determination of organophosphorus pesticide residues in tea by solid-phase extraction-gas chromatography[J]. Chin J Anal Lab, 2007, 26(2): 43-46. (in Chinese) |
| [4] | 王江, 王辛, 梁晓聪, 等. 固相萃取-气相色谱法检测蔬菜中17种残留的有机磷农药[J]. 中国卫生检验杂志, 2008, 18(2): 255-305. WANG Jiang, WANG Xin, LIANG Xiaocong, et al. Simultaneous determination of 17 organophosphorous pesticide residues in vegetables and fruits by solid phase extraction (SPE) coupled with gas chromatography (GC)[J]. Chin J Health Lab Technol, 2008, 18(2): 255-305. (in Chinese) |
| [5] | 陈明, 梁春穗, 李少霞, 等. 蔬菜水果中有机磷农药残留测定的GC和GC-MS分析技术研究[J]. 中国卫生检验杂志, 2009, 19(1): 83-85. CHEN Ming, LIANG Chunhui, LI Shaoxia, et al. Determination of organophosphorous pesticide residues in vegetables and fruits by GC and GC/MS[J]. Chin J Health Lab Technol, 2009, 19(1): 83-85. (in Chinese) |
| [6] | STAJNBAHER D, ZUPANCIC-KRALJ L. Multiresidue method for determination of 90 pesticides in fresh fruits and vegetables using solid-phase extraction and gas chromatography-mass spectrometry[J]. J Chromatogr A, 2003, 1015(1-2): 185-198. |
| [7] | 苏建峰, 卢声宇, 陈晶, 等. 溶剂转移-气相色谱质谱法和选择洗脱-气相色谱法测定大蒜中289种农药多残留[J]. 色谱, 2011, 29(7): 643-655. SU Jianfeng, LU Shengyu, CHEN Jing, et al. Multi-residue determination of 289 pesticides in garlic by gas chromatography and gas chromatography/mass spectrometry[J]. Chin J Chromatogr, 2011, 29(7): 643-655. |
| [8] | 马晓东, 李重九. 大蒜中农药多残留分析方法研究[J]. 质谱学报, 2000, 21(3-4): 49-50. MA Xiaodong, LI Chongjiu. Study on multi-residue analysis of insecticides in garlic[J]. J Chin Mass Spectrom Soc, 2000, 21(3-4): 49-50. (in Chinese) |
| [9] | 王建华, 张艺兵, 汤志旭, 等. 微波处理-气相色谱法测定含硫蔬菜中的多类农药残留[J]. 分析测试学报, 2005, 24(1): 100-102. WANG Jianhua, ZHANG Yibing, TANG Zhixu, et al. Determination of pesticide residues in sulfur-containing vetetables using a microwave-assisted treatment and gas chromatographic method[J]. J Instrum Anal, 2005, 24(1): 100-102. (in Chinese) |
| [10] | 罗俊霞, 符建伟, 崔洁, 等. 不同的微波处理时间对蒜薹中9种含氯农药残留测定的影响[J]. 陕西农业科学, 2008, 54(5): 21-23. LUO Junxia, FU Jianwei, CUI Jie, et al. Determination of 9 organochlorine pesticides in young garlic shoot using a microwave-assisted treatment [J]. J Shaanxi Agr Sci, 2008, 54(5): 21-23. (in Chinese) |
| [11] | 吴芳华. 固相萃取新技术研究进展[J]. 分析测试技术与仪器, 2012, 18(2): 114-120. WU Fanghua. The progress of new technology research in solid phase extraction[J]. Anal Test Technol Instrum, 2012, 18(2): 114-120. (in Chinese) |
| [12] | 马娜, 陈玲, 熊飞. 固相萃取技术及其研究进展[J]. 上海环境科学, 2002, 21(3): 181-184. MA Na, CHEN Ling, XIONG Fei. Solid phase extraction technology and its study progress[J]. Shanghai Environ Sci, 2002, 21(3): 181-184. (in Chinese) |
| [13] | 王雯雯, 刘畅. 安捷伦7000三重串联四极杆气-质联用仪一次进样同时检测大葱中170 种农药残留[J]. 环境化学, 2011, 30(10): 1822-1827. WANG Wenwen, LIU Chang. Determination of 170 pesticides in onion by Agilent 7000 gas chromatography-triple quadrupole tandem mass spectrometry[J]. Chin J Environ Chem, 2011, 30(10): 1822-1827. (in Chinese) |
| [14] | VALERIA N, DANIELA D, CARMEN P, et al. Multi-residue method for the determination of organochlorine pesticides in fish feed based on a cleanup approach followed by gas chromatography-triple quadrupole tandem mass spectrometry[J]. J Chromatogr A, 2010, 1217(30): 4996-5003. |
| [15] | 佟玲, 李重九. 含硫蔬菜中50种农药多残留的气相色谱-串联质谱检测技术研究[J]. 分析测试学报, 2008, 27(9): 930-935. TONG Ling, LI Chongjiu. Determination of multi-residues of 50 pesticides in sulfur-containing vegetables by gas chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2008, 27(9): 930-935. (in Chinese) |
| [16] | 施家威, 李继革, 王玉飞, 等. 固相萃取-气相色谱/三重四极杆串联质谱分析蔬菜中43种农药残留[J]. 色谱, 2010, 28(12): 1137-1143. SHI Jiaowei, LI Jige, WANG Yufei, et al. Analysis of 43 pesticide residues in vegetables using solid-phase extraction and gas chromatography-triple quadrupole mass spectrometry[J]. Chin J Chromatogr, 2010, 28 (12): 1137-1143. (in Chinese) |
| [17] | NY/T 789—2004, 农药残留分析样本的采样方法[S]. 北京: 中国农业出版社, 2004. NY/T 789—2004, Guideline on sampling for pesticide residue analysis [S]. Beijing: China Agriculture Press. (in Chinese) |
| [18] | NY/T 762—2004, 蔬菜农药残留检测抽样规范[S]. 北京: 中华人民共和国农业部, 2004. NY/T 762—2004, The sampling standard for pesticide residue analysis in vegetables [S]. Beijing: Ministry of Agriculture of the People's Republic of China, 2004. (in Chinese) |
| [19] | 沈伟健, 余可垚, 桂茜雯, 等. 分散固相萃取-气相色谱-串联质谱法测定蔬菜中107种农药的残留量[J]. 色谱, 2009, 27(4): 391-400. SHEN Weijian, YU Keyao, GUI Qianwen, et al. Determination of 107 pesticide residues in vegetables using off-line dispersive solid-phase extraction and gas chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2009, 27(4): 391-400. (in Chinese) |
 2014, Vol. 16
2014, Vol. 16


