2. 北京市植物保护站, 北京 100029;
3. 北京市农业技术推广站, 北京 100029;
4. 北京北农种业有限公司, 北京 100029
2. Beijing Plant Protection Station, Beijing 100029, China;
3. Beijing Agro-Technology Extension Station, Beijing 100029, China;
4. Beijing Beinong Seed Co., Ltd., Beijing 100029, China
吡虫啉(imidacloprid)化学名称为1-(6-氯-3-吡啶基甲基)-N-硝基亚咪唑烷-2-基胺,是一种高效氯代烟碱类内吸广谱杀虫剂,作用于昆虫烟酸乙酰胆碱酯酶受体(nAChR)[1, 2],可干扰昆虫正常的神经传导功能,主要用于防治各类蚜虫、飞虱等刺吸式口器害虫,对鞘翅目、双翅目和鳞翅目中的多种害虫也有防效[3, 4],既可进行叶面和种子处理,也可进行土壤处理[5, 6]。
研究表明,叶面喷施吡虫啉,因风吹、日晒、雨淋而造成的农药流失和分解达60%~90%[7],既增加成本,又带来环境安全风险。为此,笔者研制了11.1%吡虫啉缓释片剂,采用根部施药方式,即在作物播种或移栽时施入土壤,药剂活性成分从缓释载体材料中缓慢释放,经作物根系吸收后向上运输到叶片,起到防治害虫的作用,并已用于蔬菜作物上防治白粉虱和蚜虫等害虫,其长期防效已得到初步验证[8]。
蚜虫(主要指瓜蚜)是西瓜的第一大害虫[9],它不仅从瓜秧中吸食大量汁液,还可分泌蜜露覆盖叶面,影响西瓜的光合作用和呼吸作用,导致产量降低[10, 11]。本研究先通过根部施用11.1%吡虫啉缓释片剂,调查了其对西瓜蚜虫的防治效果,然后分析了该制剂在西瓜果实、瓜秧和土壤中的残留及药剂的释放情况,以期为评价其应用效果和安全性提供依据。
1 材料与方法 1.1 供试药剂与试剂
吡虫啉(imidacloprid)标准品,纯度为99.5%,购于北京迪马欧泰科技发展中心。11.1%吡虫啉缓释片剂(sustained release tablets,简称SRT)由笔者自行研制和加工,缓释片剂直径0.5 cm,由吡虫啉、缓释剂、助剂和水搅拌均匀后压制而成,每片重0.18 g,含吡虫啉有效成分0.02 g。吡虫啉原药(technical material,TC),纯度95%,购于江苏扬农化工股份有限公司,与西瓜试验地耕层(20 cm)细土(过1 mm筛)按质量比1∶10混合作为对照。
甲醇、乙腈和二氯甲烷均为色谱纯;氯化钠为分析纯;试验用水为超纯水。
1.2 主要仪器LC2010A HT高效液相色谱仪(日本Shimadzu公司);MA30红外水分仪(德国Sartorius公司);N-1000旋转蒸发仪(Eyela日本东京理化器械株式会社);K600食物调理机(德国Braun公司);T18basic高速匀浆机(德国Ika公司);N-EVAP112氮吹仪(美国Organomation仪器有限公司)。
1.3 田间试验设计及其对西瓜蚜虫的防治效果采用随机区组设计,每处理重复3次。每小区8行,行长10.5 m,行距140 cm,株距70 cm,每行15株。
西瓜在温室育苗至2叶1心期移栽。移栽前整地覆膜,移栽时在膜上打孔,深度10 cm。将吡虫啉缓释片剂或混有原药的细土装入医用纱布袋(2012年)或孔径为0.043 mm的尼龙袋(2013年),放入移栽穴底部,每株施药量为0.08 g吡虫啉有效成分(4片/株),各处理施药量均为有效成分 780 g/hm2,然后移栽西瓜苗。
2012年田间试验地点为北京市农业技术推广站小汤山特菜大观园基地,试验地土壤为黏质壤土,设11.1%吡虫啉缓释片剂处理,以吡虫啉原药(TC)为对照。2012年5月7日移栽,分别于5月8日、5月12日、5月26日、6月30日畦灌1次。2013年田间试验地点为中国农业大学上庄试验站,试验地土壤为沙质壤土,设11.1%吡虫啉缓释片剂处理,以不施药作为空白对照。2013年5月12号移栽,全生育期未灌溉。其他管理同2012年。
蚜虫防治效果调查方法(2013):每小区随机选5株标记,从空白对照发生蚜虫开始,7 d调查1次植株上的活虫数,根据公式(1)计算防治效果。
防治效果/%=(空白对照区蚜虫数-处理区蚜虫数)/空白对照区蚜虫数×100(1)
1.4 样品的采集、提取及净化 1.4.1 样品采集 1.4.1.1 药剂释放率分别于施药后1、3、7、14、30、45、60和120 d在每小区随机选取5株西瓜植株,将埋在瓜秧根部的盛药网袋取出。
1.4.1.2 药剂在土壤中的分布1)2012年。水平方向:于施药后30 d在每小区随机选取3株西瓜植株,用直径3 cm的根钻沿垂直行向方向在植株两侧取样,每侧取6个点,距植株的距离分别为0~3、3~6、6~9、9~12、12~15和15~18 cm,取样深度0~15 cm,取样完毕后将两侧同距离的土样合并、混匀;垂直方向:用直径3 cm的根钻自放置药片位置(土表下10 cm)垂直向下取20 cm土柱,自上而下依次切取0~2、2~4、6~8、10~12、14~16和18~20 cm处的土壤。将每小区各取样株相同位置的土样合并、混匀,过1 mm筛,于-20 ℃冰箱中保存,备用。
2)2013年。于施药后30 d在每小区随机选取5株西瓜植株,取样方法与2012年的不同之处为根钻直径减小至2 cm,水平方向取样距离调整为0~2、2~4、4~6、8~10、12~14和16~18 cm。
1.4.1.3 药剂残留量动态分析1)土壤。试验于2013年进行,分别于施药后1、3、7、14、30、45、60和120 d在每小区随机选取5株西瓜植株,用直径为2 cm 的根钻取样。水平方向:取沿垂直行向方向距离植株两侧2~4 cm土壤,深度0~15 cm;垂直方向:取自放置药片位置(土表下10 cm)垂直向下距离施药点2~4 cm的土壤。
2)瓜秧。分别于施药后1、3、7、14、30、45、60和120 d在每小区随机选取5株西瓜植株。2012年取瓜秧基部0~30 cm的一段,2013年取第1~3节瓜秧。
3)西瓜果实。于2012和2013年西瓜采收期(施药后60 d)取样,每处理随机取5个以上西瓜,四分法处理,缩分得到250 g西瓜全果样品、250 g瓜瓤样品和250 g瓜皮样品,于-20 ℃冰箱中保存,备用。
1.4.2 样品的提取及净化参考文献[12, 13, 14, 15]的方法并进行了优化。
1.4.2.1 土壤样品的提取用红外水分仪测定土壤水分后称取土样20 g,加入5 g 氯化钠和40 mL乙腈振荡1 h,过滤;向滤液中加入5 g 氯化钠,摇匀后静置5 min;取上清液10 mL,于40 ℃水浴中旋蒸至近干,待净化。
1.4.2.2 瓜秧及西瓜果实样品的提取将样品用食物调理机打碎后称取20 g,加入5 g 氯化钠和40 mL 乙腈,用高速匀浆机匀浆3 min,静置5 min后过滤;向滤液中加入5 g 氯化钠,摇匀后静置5 min;取上清液10 mL,于40 ℃水浴中旋蒸至近干,待净化。
1.4.2.3 净化用4 mL V(二氯甲烷)∶V(甲醇)=99∶1的混合液预淋SampliQ NH2-SPE柱[500 mg,3 mL],淋洗液弃去;向旋蒸瓶中加入2 mL上述混合液溶解样品,将溶解液转入柱内,收集淋洗液;然后分别用上述混合液洗旋蒸瓶2次,每次2 mL,依次转入柱内,收集淋洗液;合并淋洗液,经氮吹仪吹干后用甲醇定容至2.5 mL;过0.45 μm滤膜,待测。
1.5 分析方法按照文献[16]的方法测定药剂释放率。吡虫啉缓释片剂在测定含量前先用研钵磨成粉。
1.5.1 高效液相色谱检测条件色谱柱为Shimadzu C18(250 mm×4.6 mm×5 μm),检测波长270 nm,流速0.8 mL/min,柱温30 ℃,进样量20 μL。流动相为甲醇(A)+水(B)+乙腈(C),采用梯度洗脱:0~8 min,45%A+55%B;8~12 min,45%A+25%B+30%C;12~16 min,45%A+55%B。保留时间6.6 min。
1.5.2 标准曲线绘制及添加回收试验准确称取吡虫啉标准品0.01 g(精确到0.000 1 g),用甲醇溶解,配制成1 000 mg/L的母液,再逐级稀释为0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10和25 mg/L的标准工作液。按1.5.1节的条件测定,以进样质量浓度(x,mg/L)为横坐标、色谱峰面积(y)为纵坐标绘制标准曲线。
分别对西瓜全果、瓜皮、瓜瓤、瓜秧和土壤进行0.05、0.5、5 mg/kg水平的吡虫啉添加回收试验,重复5次。
1.5.3 数据统计分析采用Excel 2010对试验数据进行处理和制表,用SAS (V8,SAS Institute Inc.,Cary,NC)进行统计分析。
2 结果与分析 2.1 方法的线性范围、检出限、准确度及精密度在0.01~25 mg/L范围内,吡虫啉的质量浓度(x,mg/L)与其峰面积(y)呈良好的线性关系,其线性回归方程为y=126 653x+5 383.5,相关系数r=0.999 9。
在本研究所选的样品前处理方法和检测条件下,吡虫啉的检出限(LOD)为0.01 mg/L,最小检出量为0.2 ng,在瓜秧、瓜皮、瓜瓤和西瓜全果中的最低检测浓度(LOQ)为0.05 mg/kg,在0.05、0.5和5 mg/kg添加水平下,回收率在76.6%~107.8%之间,相对标准偏差(RSD,n=5)在0.3%~7.8%之间。吡虫啉在土壤中的LOQ为0.01 mg/kg,在0.01、0.05和0.5 mg/kg添加水平下,回收率在81.2%~88.3%之间,RSD(n=5)在2.1%~6.7%之间。均达到农药残留检测的要求[17]。
2.2 吡虫啉缓释片剂对西瓜蚜虫的防治效果如表 1所示,空白对照在药后35 d的单株虫口数量达到150头/株,出现明显虫害。11.1%吡虫啉缓释片剂在药后35和42 d的单株虫口数量均显著低于对照。药后35 d的防治效果为67.9%,42 d的防治效果为83.3%。药后49 d,空白对照虫口数量由42 d的234头/株大幅下降至42头/株,虫害自然减轻。此时吡虫啉缓释片剂处理的虫口数量虽仍小于对照,但差异不显著。可见,吡虫啉缓释片剂一次性根部施用基本可以满足西瓜全生育期蚜虫防治的需要。
| 表 1 11.1%吡虫啉缓释片剂对西瓜蚜虫的防治效果(2013)Table 1 Control effect of imidacloprid SRT applied to roots on watermelon aphids(2013) |
2012年,自施药后开始,吡虫啉原药和缓释片剂中的有效成分基本匀速释放,原药释放率显著高于缓释片剂的。至施药后60 d,原药及缓释片剂的吡虫啉累积释放率分别为33%和15%;至施药后120 d,原药的累积释放率达到82%左右,而缓释片剂的累积释放率仅为45%(图 1)。
2013年,吡虫啉缓释片剂有效成分释放速率在药后1~14 d较快,之后的14~30 d较慢,30~60 d 时又较快,60 d时吡虫啉的累积释放率为32%,60 d以后释放速率变缓,药后120 d 累积释放率仅为36%(图 1)。
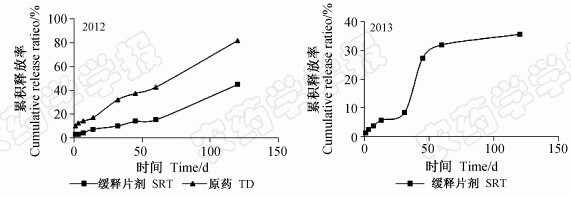 | 图 1 吡虫啉缓释片剂在田间的累积释放率Fig. 1 The cumulative release ratio of imidacloprid from SRT in field |
结果(见表 2)显示:2012年药后30 d缓释片剂和原药中的吡虫啉在土壤中均存在垂直方向的扩散,但缓释片剂中的扩散数量和距离远小于原药。缓释片剂自施药点向下快速下降,至6~8 cm处其含量已降至0.2 mg/kg,但在10~20 cm 范围内则随距离变化不大。而原药在土壤中大量扩散,距施药点18~20 cm处其含量仍达2.02 mg/kg,在各土层的分布数量较缓释片剂高10倍以上。
| 表 2 11.1%吡虫啉缓释片剂在土壤中的垂直分布Table 2 The vertical distribution of the active ingredient from imidacloprid SRT in soil |
2013年,药后30 d吡虫啉缓释片剂在土壤中垂直方向0~4 cm范围的分布数量较2012年减少很多,但总的分布也主要局限在0~8 cm范围内,8 cm以外的分布数量<0.15 mg/kg。
2.4.2水平分布从表 3结果可见:2012年药后30 d,吡虫啉缓释片剂在水平方向的扩散主要局限在0~6 cm内,6 cm以外的分布数量均在0.05 mg/kg以下,且随距离变化不大;原药在0~3 cm 范围内的水平分布比缓释片剂高1倍多,在3~9 cm内比缓释片剂高20倍以上,在9 cm以外也小于0.05 mg/kg。
| 表 3 11.1%吡虫啉缓释片剂土壤中的水平分布Table 3 The horizontal distribution of the active ingredient from imidacloprid SRT in soil |
2013年药后30 d,吡虫啉缓释片剂虽然在0~4 cm 内的水平分布数量不多(<0.5 mg/kg,远低于2012年),但分布范围较2012年有扩大趋势,如在16~18 cm其含量仍达0.11 mg/kg。
2.5 吡虫啉缓释片剂在不同样品中的残留动态分析 2.5.1 吡虫啉在土壤中的残留动态由图 2可知:施用11.1%吡虫啉缓释片剂(0.08 g有效成分/株)后,在施药点下方2~4 cm处和水平方向2~4 cm处的表层(0~15 cm)土壤中,吡虫啉残留量基本呈单峰曲线变化,峰值均出现在药后30 d,分别为1.91和0.10 mg/kg;水平方向的残留量均小于垂直方向的。
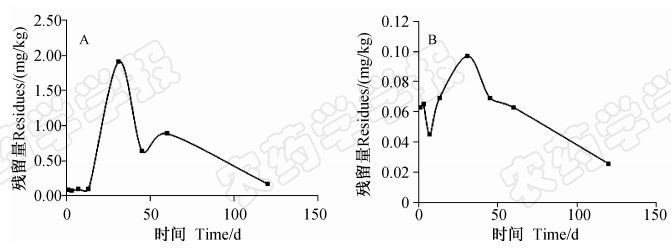 | 图 2 吡虫啉在土壤垂直(A)和水平(B)方向上的残留动态(2013)Fig. 2 The dynamic of imidacloprid residue in the soils 2-4 cm away from the application site of SRT in vertical direction (A) and 2-4 cm away in horizontal direction (B) (2013) |
2012年的分析结果见表 4。基部瓜秧(0~30 cm)中的吡虫啉含量于药后1、3、7、30、45和60 d均未检出;缓释片剂处理于药后14 d时的吡虫啉含量为0.86 mg/kg,原药处理于药后14 d时的含量为0.62 mg/kg,低于缓释片剂的,但未达到显著水平。
2013年,基部瓜秧(1~3节)中吡虫啉的含量变化(表 4)与2012年基本一致,缓释片剂处理于药后14 d时的吡虫啉含量为0.05 mg/kg,远低于2012年的。
| 表 4 吡虫啉在基部瓜秧中的含量变化Table 4 The changes of imidacloprid content in the base of watermelon plants after application |
2012和2013年,在经吡虫啉缓释片剂处理的西瓜全果、瓜皮和瓜瓤中均未检出吡虫啉,即其残留量均低于最低检测浓度(LOQ) 0.05 mg/kg。
3 结论与讨论日本肯定列表制度规定,吡虫啉在西瓜中的最大残留限量(MRL)为0.5 mg/kg,而食品法典委员会(CAC)规定,其在西瓜中的MRL为0.2 mg/kg。本研究结果显示,施用11.1%吡虫啉缓释片剂有效成分含量0.08 g/株后,其在西瓜果实中的残留量低于0.05 mg/kg,表明在西瓜移栽时根部穴施此有效剂量防治蚜虫,对收获期西瓜产品器官的食用是安全的。
缓释农药囊芯的释放过程一般为:1)环境中的水透过囊壁进入囊芯中;2)囊芯材料溶解于水中形成水溶液;3)囊芯水溶液由囊内的高浓度区扩散到囊外的不含或含很少量囊芯的水相中[18],因此缓释农药有效成分的释放主要依靠囊内外的药剂浓度差。在田间条件下提高土壤含水量,囊外的有效成分浓度降低,囊内外的浓度差随之增大,因此有利于有效成分的释放。本研究中,2012年分别于西瓜移栽后1、5、19和54 d浇水4次,吡虫啉缓释片剂释放速度相对均匀;而2013年仅在移栽时浇水1次,移栽后14~30 d土壤偏旱,因而释放速度很慢,移栽后30~60 d降雨充沛(200 mm左右),释放速度迅速加快。
基部瓜秧中吡虫啉含量在药后14 d达到高峰,可能是因为缓苗后根系快速生长,加大了对吡虫啉的吸收量;此后由于生长导致的稀释和降解作用,吡虫啉含量下降。缓释片剂的累积释放率虽然低于原药的,但其在药后14 d时瓜秧中吡虫啉的含量却高于原药的,表明缓释片剂的利用率得到提高。
农药在土壤中的淋溶迁移行为受很多因素的影响[19, 20]。Gerstl等[21]发现,甲草胺黏土聚合物控释剂在土壤中的淋溶深度小于其商品制剂;藻朊酸盐作为控释剂可减少敌草隆的垂直移动[22]。本研究中,西瓜根部穴施11.1%吡虫啉缓释片剂30 d后,吡虫啉在土壤中垂直方向的残留主要集中在施药点以下0~10 cm,而原药处理的残留则可达20 cm,说明缓释材料可能通过减缓吡虫啉的释放率而降低其在土壤中的移动性。
一般地,当降雨量大、强度大、历时长以及施药时间与降雨时间的间隔短时,农药的淋溶量就大;反之则小[23]。本研究中,施用吡虫啉缓释片剂,2013年其在土壤中垂直和水平方向的扩散数量比2012年减少很多,主要是由于2013年未进行灌溉、且西瓜生长期间的降雨量也少于2012年所致。土壤中吡虫啉残留量的高低是药剂释放、植株吸收和降解综合作用的结果。药后1~14 d,吡虫啉缓释片剂在土壤中释放较快,但却在土壤中的残留量很低(垂直方向低于0.01 mg/kg,水平方向低于0.07 mg/kg),这是由于此时植株对吡虫啉吸收量较多的缘故;药后30~45 d土壤中的吡虫啉残留量达到峰值(垂直方向1.91 mg/kg,水平方向0.10 mg/kg),这可能是因为此时缓释剂的释放速率仍较快,但植株对吡虫啉的吸收速率却减慢所致。
综上所述,根部穴施11.1%吡虫啉缓释片剂(0.08 g有效成分/株)基本可满足全程防治西瓜蚜虫的需要,而且在西瓜食用部分和施药点周围土壤中的吡虫啉残留量处于安全水平。但该缓释片剂吡虫啉的累积释放率较低,药后60 d(收获时)的释放率仅为15%~32%,药后120 d仍低于50%。因此,今后一方面在田间栽培管理中要保持适宜的土壤湿度,降水量不足时应及时灌溉,以加快药剂有效成分的释放;另一方面需改进吡虫啉缓释片剂的配方,提高其释放速率,从而在保证防治效果的前提下减少有效成分用量和对土壤环境的影响。
| [1] | LIU M Y, LANFORD J, CASIDA J E. Relevance of[3H]imidacloprid binding site in house fly head acetylcholine receptor to insecticidal activity of 2-nitromethylene and 2-nitroimino-imidazolidines[J]. Pestic Biochem Physiol, 1993, 46(3): 200-206. |
| [2] | NISHIMURA K, KANDA Y, OKAZAWA A, et al. Relationship between insecticide and neuronphysiological activities of imidacloprid and related compounds[J]. Pestic Biochem Physiol, 1994, 50(1): 51-59. |
| [3] | 王吉强, 高占林, 党志红, 等. 吡虫啉包衣对黄瓜瓜蚜的防治效果及包衣后药剂在植株体内的分布[J]. 农药学学报, 2008, 10(1): 87-91. WANG Jiqiang, GAO Zhanlin, DANG Zhihong, et al. Effect of cucumber seed coating with imidacloprid against Aphis gossypii and the pesticide's distribution in the plant[J]. Chin J Pestic Sci, 2008, 10(1): 87-91. (in Chinese) |
| [4] | 张国生, 侯广新. 烟碱类杀虫剂的应用、开发现状及展望[J]. 农药科学与管理, 2004, 25(3): 22-26. ZHANG Guosheng, HOU Guangxin. Present status of development and propect of nicotinoid insecticides[J]. Pestic Sci Admin, 2004, 25(3): 22-26. (in Chinese) |
| [5] | DETLEF W, KLAUS T. Chloronicotinyl insecticides: a success of the new chemistry[M]//YAMAMOTO I, CASIDA J E. Nicotinoid Insecticides and the Nicotinic Acetylcholine Receptor. Berlin Heidelberg, New York: Springer, 1999: 109-125. |
| [6] | MAIENFISCH P, HUERLIMANN H, RINDLISBACHER A, et al. The discovery of thiamethoxam: a second-generation neonicotinoid[J]. Pest Manag Sci, 2001, 57(2): 165-176. |
| [7] | 严锐, 赵华, 胡永琪. 农药控释技术研究进展[J]. 农药, 2006, 45(7): 437-439. YAN Rui, ZHAO Hua, HU Yongqi. Progress on pesticide controlled release technology.[J]. Agrochemicals, 2006, 45 (7): 437-439. (in Chinese) |
| [8] | 周春江, 李松林, 恽友兰, 等. 农药缓释技术研究及应用[J]. 作物杂志, 2005(1): 32-34. ZHOU Chunjiang, LI Songlin, YUN Youlan, et al. Research and application of pesticides release technology[J]. Crops, 2005(1): 32-34. (in Chinese) |
| [9] | 王少丽, 张友军, 徐宝云. 北京地区西瓜蚜虫的发生规律及药剂防治研究[J]. 中国植保导刊, 2012, 32(10): 44-46. WANG Shaoli, ZHANG Youjun, XU Baoyun. Occurrence and chemical control of watermelon aphids in Beijing[J]. China Plant Protection, 2012, 32(10): 44-46. (in Chinese) |
| [10] | 马兴华. 蚜虫对大棚西瓜的危害及其防治措施[J]. 中国瓜菜, 2011, 24(2): 52-53. MA Xinghua. Aphids on greenhouse watermelon hazards and control measures[J]. China Cucurbits and Vegetables, 2011, 24(2): 52-53. (in Chinese) |
| [11] | 方世凯, 陈崇森. 海南秋冬季西瓜甜瓜病毒病发生原因及防治对策[J]. 中国西瓜甜瓜, 2004(1): 36-38. FANG Shikai, CHEN Chongsen. Causes and countermeasures of watermelon virus disease in autumn and winter in Hainan.[J]. China Watermelon and Muskmelon, 2004(1): 36-38. (in Chinese) |
| [12] | CHEN Guoqiang, CAO Pengying, LIN Renjiang. A multi-residue method for fast determination of pesticides in tea by ultra performance liquid chromatography-electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure[J]. Food Chem, 2011, 125(4): 1406-1411. |
| [13] | THOMPSON T S, DIMOCK R, BRADBURY R W, et al. Pesticides in fresh potatoes sold in farmers' markets in Alberta, Canada[J]. Bull Environ Contam Toxicol, 2011, 87(5): 580-585. |
| [14] | SAMNANI P, VISHWAKARMA K, PANDEY S Y. Simple and sensitive method for determination of imidacloprid residue in aoil and water by HPLC[J]. Bull Environ Contam Toxicol, 2011, 86(5): 554-558. |
| [15] | 张月, 韩丙军, 林靖凌, 等. 液相色谱测定甘蓝中的吡虫啉[J]. 热带作物学报, 2010, 31(9): 1616-1620. ZHANG Yue, HAN Bingjun, LIN Jingling, et al. Determination of imidacloprid residue in cabbage by HPLC[J]. Chin J Trop Crops, 2010, 31(9): 1616-1620. (in Chinese) |
| [16] | GB 28126—2011, 吡虫啉原药[S]. 北京: 中华人民共和国国家质量监督检验检疫总局, 2011. GB 28126—2011, Imidacloprid technical material[S]. Beijing: General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, 2011. (in Chinese) |
| [17] | 李义强, 闫晓阳, 杨立强, 等. 不同剂型吡虫啉在烟叶和土壤中的残留及消解动态[J]. 农药学学报, 2013, 15(6): 679-685. LI Yiqiang, YAN Xiaoyang, YANG Liqiang, et al. Residue and dissipation for different formulations of imidacloprid in tobacco leaf and soil[J]. Chin J Pestic Sci, 2013, 15(6): 679-685. (in Chinese) |
| [18] | 汪宝卿, 李召虎, 杜凤沛, 等. 肥料和农药缓释/控释技术研究[J]. 应用化工, 2005, 34(9): 4-8. WANG Baoqing, LI Zhaohu, DU Fengpei, et al. Research of slow release controlled release technology on fertilizers and pesticides[J]. Applied Chemical Industry, 2005, 34(9): 4-8. (in Chinese) |
| [19] | 温志良, 莫大伦. 土壤污染研究现状与趋势[J]. 重庆环境科学, 2000, 22(3): 55-57. WEN Zhiliang, MO Dalun. Prensent sitution and trend of study on soil pollution[J]. Chongqing Environmental Science, 2000, 22(3): 55-57. (in Chinese) |
| [20] | REDOUDO M J, RUIZ M J, FONT G, et al. Dissipation and distribution of atrazine, simazine, chlorpyrifos, and tetradifon residues in citrus orchard soil[J]. Arch Environ Contam Toxicol, 1997, 32(4): 346-352. |
| [21] | GERSTL Z, NASSER A, MINGELGRIN U. Controlled release of pesticides into soils from clay-polymer formulations[J]. J Agric Food Chem, 1998, 46(9): 3797-3802. |
| [22] | FERNÁNDEZ-PÉREZ M, VILLAFRANCA-SÁNCHEZ M, GONZÁLEZ-PRADAS E, et al. Controlled release of diuron from an alginate-bentonite formulation: water release kinetics and soil mobility study[J]. J Agric Food Chem, 1999, 47(2): 791-798. |
| [23] | GHODRATI M, JURY W A. A field study of the effects of soil structure and irrigation method on preferential flow of pesticides in unsaturated soil[J]. J Contaminant Hydrol, 1992, 11(1/2): 101-125. |
 2014, Vol. 16
2014, Vol. 16


