2. 浙江农林大学 农业与食品科学学院, 浙江 临安 311300
2. School of Agriculture and Food Science, Zhejiang Agriculture and Forestry University, Lin'an 311300, Zhejiang Province, China
土壤真菌是土壤微生物的重要组成部分,参与动、植物残体的分解,是土壤中碳、氮循环不可缺少的动力,可通过参与稻田生态系统的物质循环和能量流动影响水稻的生长发育[1, 2, 3, 4, 5]。如木霉属真菌除对多种植物病害具有防治作用外,还可促进水稻种子萌发和苗期生长[6];曲霉属和青霉属可改善稻田土壤环境。农药施于稻田后可能干扰土壤微生物的生态平衡[7],其对土壤微生物的影响已成为评价其生态安全性的一个重要指标[8]。近年来,有关农药对土壤微生物的影响主要集中在旱作土壤方面[4]。与旱地相比,稻田环境可能更复杂,稻田土著真菌对于维持稻田生态平衡和土壤健康度非常重要。研究表明,甲磺隆可影响土壤微生物群落结构和多样性,且其影响随培养时间不同而异[8]。因此,研究稻田常用杀菌剂对稻田土壤中土著真菌群落的影响[9],具有十分重要的意义。
三唑酮、多菌灵、咪鲜胺和井冈霉素4种杀菌剂,具有特异性好、低毒、降解半衰期短等优点,已广泛用于防治稻瘟病、纹枯病、恶苗病等水稻病害[1]。迄今为止,全国农药企业已登记的三唑酮产品超过400个,多菌灵857个,咪鲜胺266个,井冈霉素312个[9, 10]。井冈霉素可对土壤中的微生物产生刺激作用[2]。目前,三唑酮、多菌灵和咪鲜胺对土壤中细菌的生态效应已有相关报道[1, 2, 11],但对土壤真菌生态效应的研究鲜有报道。此外,在实际应用中,常对农药进行混用以增加药效。有研究表明,m(多菌灵)∶m(咪鲜胺)=1∶1混配对防治水稻稻瘟病有一定的增效作用[3],但农药混配后对环境中非靶标土壤微生物生长的影响未见报道。
物种敏感性分布(Species Sensitivity Distributions,SSD)是20世纪70年代末兴起的一种生态风险评价方法。它基于不同物种对污染物敏感性的差异,以急性或慢性毒理数据为基础,构建系统分布模型,从而进行生态风险评价。与EC50相比,SSD法以简明、结果直观、生态意义明确等优点吸引了国际上诸多研究者以及政府部门对其原理、方法、假设、应用等方面不断进行探讨[12],其在生态毒理学,特别是在水生生态毒理学中的应用已成为研究的热点,但目前国内相关研究报道很少[13]。本研究通过室内模拟试验探讨了三唑酮、多菌灵、咪鲜胺和井冈霉素4种杀菌剂对稻田土著真菌的毒性效应,通过测定其对8种稻田土壤真菌的抑菌活性,建立了8种真菌对这4种杀菌剂的SSDs曲线,并探讨了多菌灵与咪鲜胺混用对部分真菌的抑菌活性。旨在明确常用杀菌剂对土壤真菌菌丝生长的影响及为其合理使用提供科学依据。 1 材料与方法 1.1 土壤样品制备
试验用土于2013年7月31日采自浙江省浙江大学诸暨试验基地稻田(江藻镇梓尚阁村,北纬29.71°,东经120.23°);采用五点法取样,去除带有杂草、枯叶的表层土壤,采集2~20 cm耕作层土样;剔除碎石等杂物,过筛后保存于4 ℃冰箱,备用,为降低该温度下某些真菌继续生长繁殖带来的影响,土样仅存15 d。 1.2 供试菌株的分离
供试菌株采用平板划线法[14]分离纯化。称取处理后的土样10 g于灭菌三角瓶中,加入90 mL灭菌水,充分振荡30 min;充分灼烧接种环后挑取菌悬液,采用三区划线法分离;将平板倒置于25 ℃恒温箱培养3~5 d;挑取单菌落到斜面培养基保存。必要时进行二次分离,直到分离的真菌纯化为止。
真菌出现频率/%=某一分离真菌的菌落数/所有分离真菌菌落数×100 1.3 供试药剂及主要仪器
基因组DNA快速抽提真菌试剂盒、SanPrep柱式DNA胶回收试剂盒(上海生工生物技术有限公司);98.5%三唑酮(triadimefon)原药(江苏剑牌农化有限公司);98%多菌灵(carbendazim)原药(江苏丰山集团有限公司);90%井冈霉素(jingangmycin)原药(浙江省桐庐汇丰生物化工有限公司);95%咪鲜胺(prochloraz)原药(绍兴天诺农化有限公司)。井冈霉素用无菌水配制成质量浓度为1 280 mg/L的母液,其他药剂均以丙酮为溶剂配制成质量浓度为1 000 mg/L的母液,备用。
ALD1244 PCR仪及GelDoc XR 凝胶成像系统(美国Bio-Rad公司);XT5107-IM250霉菌培养箱(杭州雪中炭恒温技术有限公司)。 1.4 供试培养基
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,蒸馏水1 000 mL,葡萄糖20 g,琼脂20 g。 1.5 供试菌株ITS序列的扩增
将纯化后的菌种置于PDA培养基上培养3~5 d,沿菌落边缘刮取菌丝于研钵中,常温下加入液氮研碎,采用真菌试剂盒提取真菌总DNA,经PCR扩增。引物采用ITS1:5′-TCCGTAGTGAACCTGCGG-3′和引物ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体系为:2×PCR Master 25 μL,DNA模板1 μL,上下游引物各2 μL,用无菌ddH2O补齐至50 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s、57 ℃退火30 s、72 ℃延伸30 s,35个循环;72 ℃延伸7 min。将PCR扩增产物进行琼脂糖凝胶电泳检测,采用DNA胶回收试剂盒回收PCR产物,送上海铂尚生物技术有限公司测序。与GenBank数据库(NCBI)比对。 1.6 药剂对土壤真菌的抑菌活性测定及敏感性曲线绘制
采用菌丝生长速率法[14],略有改进:试验设6个浓度处理,三唑酮为0.50、1.0、2.0、4.0、8.0和16 mg/L;多菌灵为0.10、0.20、0.40、0.80、1.6和3.2 mg/L;咪鲜胺为0.050、0.10、0.20、0.40、0.80和1.6 mg/L;井冈霉素为5、10、20、40、80和160 mg/L。每处理重复3次。将各浓度待测药剂按1 mL∶9 mL的比例与融化的PDA培养基混匀,倒入培养皿中制成带药平板。待培养基凝固后分别接入直径0.5 cm的供试菌饼。以丙酮为对照。当对照菌落大于5 cm但未长至全皿时,采用十字交叉法测量菌落直径。根据(1)式计算抑制率,求出每种药剂对土壤真菌菌丝生长的抑制中浓度(EC50值);采用(2)式Richards模型[13],以EC50对数值为横坐标,累积概率(按照8种真菌EC50值由小到大排序,每种真菌的序号数与自由度的比值即为该真菌的累积概率)为纵坐标,利用DPS 2012.01.01进行数学模型拟合,绘制SSDs曲线。

Richards数学模型函数的参数方程为:
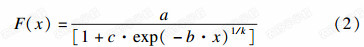
选择抑菌活性较强的咪鲜胺与多菌灵,以及对这两种药剂敏感性均较高的禾柄锈菌、黑曲霉和长枝木霉3种真菌,以咪鲜胺和多菌灵的EC50为基础,设V(多菌灵)∶ V(咪鲜胺)=10∶0、9∶1、4∶1、7∶3、3∶2、1∶1、2∶3、3∶7、1∶4、1∶9和0∶10共11个配比和1个丙酮对照,各配比分别设0.05、0.10、0.20、0.40、0.80和1.6 mg/L 6个处理,测定各混剂的EC50值。采用Wadley系数法[12],根据(3)和(4)式计算混剂的理论EC50及增效系数(SR)。SR >1.5为增效作用,1.5>SR>0.5为相加作用,SR<0.5为拮抗作用。
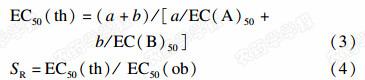
(3)和(4)式中,A、B为单剂,a、b为相应单剂在混剂中的体积比,ob为实测值,th为理论值。 2 结果与分析 2.1 土壤真菌的种类
根据ITS序列对稻田土壤中真菌类型进行了初步鉴定,出现频率较高的8种真菌(见表 1)分别为禾柄锈菌、炭疽菌、黑曲霉、尖镰孢菌、青霉、灰葡萄孢、深绿木霉和长枝木霉[15],其ITS区段5.8s rDNA序列长度在500~750 bp之间,于NCBI进行BLAST同源序列检索,各菌株的同源性均在98%以上。其中,青霉的出现频率为66.09%,是稻田土壤中的优势种群。
| 表 1 稻田土壤真菌菌株鉴定结果 Table 1 Identification of the fungal strains isolated from rice paddy field |
菌丝生长速率法测定结果表明:咪鲜胺对8种土壤真菌菌丝生长的抑制作用最强,多菌灵和三唑酮次之,井冈霉素对菌丝生长几乎不抑制。咪鲜胺对8种真菌的EC50值在0.091~3.1 mg/L之间;多菌灵和三唑酮的EC50值分别在0.15~1.8和0.57~8.5 mg/L之间;井冈霉素的EC50在12~94 mg/L之间(见表 2)。
| 表 2 4种杀菌剂对8种真菌的EC50值 Table 2 EC50value of four fungicides on eight fungimg/L |
根据EC50值,采用Richards模型分别构建8种土壤真菌对4种杀菌剂的SSDs曲线(图 1和图 2)。位于曲线最底端的物种对药剂敏感性最高,最顶端的最低。由图 1、图 2可见,对4种杀菌剂最敏感的物种分别是:禾柄锈菌(三唑酮)、黑曲霉(多菌灵)、长枝木霉(咪鲜胺)和青霉(井冈霉素);最不敏感的分别是:尖镰孢菌(三唑酮)、深绿木霉(多菌灵)、青霉(咪鲜胺)和黑曲霉(井冈霉素)。同属于曲霉科的青霉和黑曲霉,对三唑酮和多菌灵的敏感性均较高,且二者间差异不明显,但其对咪鲜胺和井冈霉素则表现出明显差异;另外,同属于肉座菌科的长枝木霉和深绿木霉对三唑酮的敏感性差异不明显,但对另外3种杀菌剂均表现出明显差异。此外,丛梗孢目的4种真菌(青霉、黑曲霉、灰葡萄孢、尖镰孢菌)和肉座菌科的长枝木霉和深绿木霉2种真菌在4种杀菌剂中的敏感性排序也不一致;三唑酮试验中深绿木霉敏感性高于长枝木霉,而多菌灵、咪鲜胺和井冈霉素试验的结果则相反。可见真菌对杀菌剂的敏感性存在显著的种间差异。
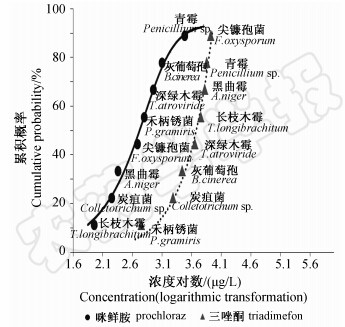 | 图 1 根据EC50值构建的8种稻田真菌 对三唑酮和咪鲜胺的SSDs曲线Fig. 1 SSDs curve of 8 species of fungi from rice paddy to triadimefon and prochloraz based on EC50 values |
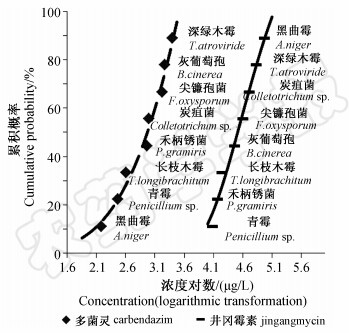 | 图 2 根据EC50值构建的8种稻田真菌 对井冈霉素和多菌灵的SSDs曲线Fig. 2 SSDs curve of 8 species of fungi from rice paddy to jingangmycin and carbendazim based on EC50 values |
由表 2可见,咪鲜胺与多菌灵对禾柄锈菌、黑曲霉和长枝木霉生长均表现出强烈的抑制作用,其EC50值均小于1 mg/L。禾柄锈菌是重要的植物病原菌,可引起小麦秆锈病;黑曲霉具腐生性;长枝木霉则是植物病害的生防菌。因此,采用这3种真菌研究农药混用对其生长的影响,有助于评价农药混用对环境微生物的生态风险。结果(表 3)表明:多菌灵与咪鲜胺混配对3种真菌均产生一定的相加作用。其中,V(多菌灵)∶ V(咪鲜胺)=7∶3、3∶2及1∶1 处理的增效系数明显高于其他配比。对禾柄锈菌而言,当V(多菌灵)∶ V(咪鲜胺)=3∶2 时,增效系数最大,为1.615,表现出增效作用,其他配比均表现为相加作用;V(多菌灵)∶ V(咪鲜胺)=1∶1 时对黑曲霉的增效系数最大,为1.039;而V(多菌灵)∶ V(咪鲜胺)=7∶3 则是长枝木霉的最大增效系数,为1.042。
| 表 3 多菌灵与咪鲜胺不同配比对3种真菌的毒力效应 Table 3 Toxicity of the mixture of carbendazim and prochloraz at different ratio to 3 fungi |
4种杀菌剂对8种常见土壤真菌的生长均具有一定的抑制作用,且随药剂浓度的升高,其抑制作用逐渐增强,其中,抑制作用最强的是咪鲜胺,多菌灵和三唑酮次之,井冈霉素最弱。这种现象的产生,可能是由于井冈霉素是从土壤中一种链霉菌代谢产物中提取分离出的,较人工合成的杀菌剂对环境微生物生态风险性小;此外,井冈霉素主要对丝核菌有活性[2],对其他真菌活性较低。
本研究从稻田土壤中分离得到8株真菌不仅包括重要的植物病原菌和腐生真菌,还含有重要的生防菌。4种杀菌剂虽对病原菌具有较高的抑菌活性,但对非靶标微生物的生长也产生了一定程度的抑制作用。尤其是具有强烈抑菌活性的咪鲜胺,对木霉属两种真菌的EC50值均低于1 mg/L,这表明其对部分重要的生防菌存在较高的生态风险。
另外,从多菌灵与咪鲜胺混用效果来看,当V(多菌灵)∶ V(咪鲜胺)=3∶2 时,对禾柄锈菌具有明显的增效作用,而对黑曲霉、长枝木霉表现出一定相加作用的配比分别为V(多菌灵)∶ V(咪鲜胺)=1∶1和7∶3。由此可见,通过不同类型杀菌剂复配,不仅可以提高药效,还可探究农药对环境微生物的生态风险。
SSDs曲线绘制常用的模型包括log-logistic和BurrⅢ模型[16, 17, 18, 19]。本研究应用DPS软件工具进行拟合模型优化,筛选出Richards数学模型用于拟合SSDs曲线,并获得较好的拟合效果,这也为SSDs曲线绘制增添了一种合适的数学拟合模型。
| [1] | LESSER M P, MAZEL C H, GORBUNOV M Y, et al. Discovery of system-biotic nitrogen-fixing cyanobacteria in corals[J]. Science, 2004, 305(5686): 997-1000. |
| [2] | 王家德, 钱海丰, 胡宝兰, 等. 井冈霉素对土壤可培养微生物的生态效应[J]. 农药, 2006, 45(11): 771-787. WANG Jiade, QIAN Haifeng, HU Baolan, et al. Ecological effects of jingangmycin on soil culturable microorganisms[J]. Agrochemicals, 2006, 45(11): 771-787. (in Chinese) |
| [3] | 刘铭. 甲霜灵与其他杀菌剂复配对烟草黑胫病菌联合毒力测定[J]. 安徽农业科学, 2011, 39(19): 11496-11498. LIU Ming. Combined toxicity test of complex preparations of metalaxyl and other fungicides against Phytophthora parasitica var. nicotianae[J]. J Anhui Agaric, 2011, 39(19): 11496-11498. (in Chinese) |
| [4] | 邓晓, 李勤奋. 辛硫磷对土壤微生物种群结构的影响[J]. 农药, 2007, 46(12): 817-819. DENG Xiao, LI Qinfen. Effect of phoxim on microbial community structure in soil[J]. Agrochemicals, 2007, 46(12): 817-819, 822. (in Chinese) |
| [5] | 高明, 周保同, 魏朝富, 等. 不同耕作方式对稻田土壤动物、土壤微生物及酶活性的影响研究[J]. 应用生态学报, 2004, 15(7): 1177-1181. GAO Ming, ZHOU Baotong, WEI Chaofu, et al. Effect of tillage system on soil animal, microorganism and enzyme activity in paddy field[J]. Chin J Appl Ecol, 2004, 15(7): 1177-1181. (in Chinese) |
| [6] | 梁志怀, 魏宝阳, 魏林, 等. 哈茨木霉在水稻体内的定殖及对水稻生理生化特性的影响[J]. 湖南农业科学, 2008(4): 51-53. LIANG Zhihuai, WEI Baoyang, WEI Lin, et al. Colonization of Trichoderma hazianum in rice and their effects on physiology and biochemistry of rice[J]. Hunan Agric Sci, 2008(4): 51-53. (in Chinese) |
| [7] | MARX M C, WOOD M, JARVIS S C. A microplate fluorimetric assay for the study of enzyme diversity in soils[J]. Soil Biol Biochem, 2001, 33(12-13): 1633-1640. |
| [8] | 姚斌, 徐建民, 尚鹤, 等. 甲磺隆污染土壤的微生物生态效应[J]. 农业环境科学学报, 2005, 24(3): 557-561. YAO Bin, XU Jianmin, SHANG He, et al. Ecological effect of metsulfuron-methyl on soil microbe[J]. J Agro-Environ Sci, 2005, 24(3): 557-561. (in Chinese) |
| [9] | 徐研, 马超, 胡亦俊, 等. 咪鲜胺生产现状与市场分析[J]. 农药, 2009, 48(8): 552-585. XU Yan, MA Chao, HU Yijun, et al. Analysis on present status of prochloraz production and its market[J]. Agrochemicals, 2009, 48(8): 552-585. (in Chinese) |
| [10] | 刘刚. 2013年第3季度新登记农药产品情况[J]. 农药市场信 息, 2013(27): 30-31. LIU Gang. The new registered pesticide products in the third quarter of 2013[J]. Pesticide Market News, 2013(27): 30-31. (in Chinese) |
| [11] | DERK R, KARNS J, SEXSTONE A. Detection of a methylcarbamate degradation gene in agricultural soils using PCR amplification of bacterial community DNA[J]. Commun Soil Sci Plant Anal, 2003, 34(3-4): 393-406. |
| [12] | VIGHI M, FINIZIO A, VILLA A. The evolution of environmental quality concept: from the US EPA red book to the European water framework directive[J]. Environ Sci Pollut Res, 2002, 13(1): 9-14. |
| [13] | 赵颖. 淡水鱼类对3种农药的敏感性分布(SSDs)初探[D]. 杭州:浙江大学, 2013. ZHAO Ying. Tentative exploration of sensitivity distribution (SSDs) on freshwater fish to 3 kinds of pesticides[D]. Hangzhou: Zhejiang University, 2013.(in Chinese) |
| [14] | 方中达. 植病研究方法. 第三版[M]. 北京: 中国农业出版社, 1998: 12. FANG Zhongda. Research Method for Plant Pathology. 3rd ed.[M]. Beijing: China Agriculture Press, 1998: 12. (in Chinese) |
| [15] | 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. WEI Jingchao. Manual Identification of Fungi[M]. Shanghai: Shanghai Science and Technology Press, 1979. (in Chinese) |
| [16] | GISI U, BINDER H, RIMBACH E. Synergistic interaction of fungicides with different modes of action[J]. Transactions of the British Mycological Society, 1985, 85(2): 229-306. |
| [17] | BALAKRISHNAN N, SALEH H M. Relations for moments of progressively type-Ⅱ Censored Order statistics from Log-Logistic distribution with applications to inference[J]. Commun Stat: Theor Methods, 2012, 55(10): 2775-2792. |
| [18] | 牛志广, 张宏伟, 辛志伟. 基于Log-logistic概率分布的近海水质组合预测方法研究[J]. 系统工程理论与实践, 2006, 26(5): 111-116. NIU Zhiguang, ZHANG Hongwei, XIN Zhiwei. Study on integrated prediction model of coastal water quality based on Log-logistic probability distribution[J]. Syst Eng—Theor Pract, 2006, 26(5): 111-116. (in Chinese) |
| [19] | JE T J, LEE K W, PARK S C, et al. Influence of tool deflection on micro channel pattern of 6: 4 brass with rectangular tool[J]. Trans Nonferrous Met Soc Chin, 2009, 19(S1): 164-170. |
 2014, Vol. 16
2014, Vol. 16


