灰葡萄孢Botrytis cinerea Pers.寄主范围广泛,可侵染200多种植物并引发灰霉病,除为害茄科、葫芦科蔬菜外,菜豆、韭菜及洋葱也均能受害。目前生产上主要采用化学农药防治灰霉病,但一些常用杀菌剂如苯丙咪唑类多菌灵、二甲酰亚胺类菌核净、苯胺基嘧啶类嘧霉胺、氨基甲酸酯类乙霉威等因过度频繁施用,灰葡萄孢对其已产生了严重的抗药性[1, 2, 3],同时由于交互抗药性的存在,该病菌对一些同类型的杀菌剂也产生了抗性,甚至对近年推广使用的甲氧基丙烯酸酯类杀菌剂也出现了抗性[4]。虽然灰葡萄孢对吡咯类杀菌剂咯菌腈及琥珀酸脱氢酶抑制剂啶酰菌胺在田间尚未出现抗性,但通过室内诱导已获得抗药性菌株[5, 6]。因此,开发新型杀菌剂用于灰霉病的防治及抗药性的治理已成为杀菌剂研发的方向之一。
磺酰胺类杀菌剂是2000年以来国际上报道的一类新型杀菌剂,现有氰霜唑(cyazofamid)、吲唑磺菌胺 (amisulbrom)、磺菌胺( flusulfamide)和甲磺菌胺(tolnifanide) 4个品种,研究表明,其对为害作物较严重的镰孢菌、丝核菌、疫霉菌及霜霉菌等具有很高的活性[7, 8, 9]。此外,一些对小麦赤霉病菌、黄瓜灰霉病菌及油菜菌核病菌等表现出较好活性的磺酰胺类化合物也相继被合成并报道[10, 11],但有关该类化合物对灰葡萄孢作用方式和作用机理的研究尚未见详细报道。本课题组前期合成了新型环烷基磺酰胺类化合物108,化学名称为N-(2,4,5-三氯苯基)-2-氧代环己烷基磺酰胺,结构式见Scheme 1[12]。初步研究发现,其对灰葡萄孢具有较强的活性[13]。为了进一步研究其对灰葡萄孢的作用方式和作用机理,笔者研究了磺酰胺类化合物108对灰葡萄孢生长发育及形态结构的影响。现将结果报道如下。
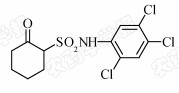 | Scheme 1 |
灰葡萄孢Botrytis cinerea Pers.,分离自番茄灰霉病病果。
95%环烷基磺酰胺类化合物N-(2,4,5-三氯苯基)-2-氧代环己烷基磺酰胺(以下简称化合物108),由沈阳农业大学农药合成室提供。用丙酮配制成10 000 μg/mL的母液备用。
日立台式TM-3000扫描电子显微镜;日立H-7650透射电子显微镜(加速电压80 kV)。 1.2 试验方法 1.2.1 化合物108对灰葡萄孢抑菌活性测定 1.2.1.1 化合物108对灰葡萄孢菌丝生长的影响
采用菌丝生长速率法[14]。将药剂与PDA培养基混匀,配制成质量浓度分别为2.50、5.00、10.00、20.00及40.00 μg/mL的PDA含药培养基平板。将预培养好的灰葡萄孢制成直径5 mm的菌饼,分别接种于含药剂的PDA平板中央,23 ℃下培养4 d。以不加药剂的PDA培养基为对照。每处理重复3次。计算化合物108对灰葡萄孢菌丝生长的EC50值及相关系数r。 1.2.1.2 化合物108对灰葡萄孢产孢量的影响
含药培养基配制方法同1.2.1.1节。将预培养好的灰葡萄孢制成直径5 mm的菌饼,分别接种于含0、1.25、5.00、20.00、40.00及80.00 μg/mL药剂的PDA平板中央,23 ℃黑暗培养至产孢,在产孢的菌落边缘打取5个直径5 mm的菌饼,用镊子取出放入1 mL的无菌水中冲洗,使孢子尽可能脱落。采用血球计数板记录不同处理浓度下灰葡萄孢的孢子数量[14]。 1.2.1.3 化合物108对灰葡萄孢孢子萌发的影响
用无菌水洗下灰葡萄孢孢子,并调节孢子浓度(4×10倍显微镜视野60~80个),配制孢子悬浮液。将孢子悬浮液与系列浓度药剂等体积混合,配成含0、6.25、12.50、25.00、50.00及100.00 μg/mL药剂的孢子悬浮液,分别取50 μL滴于凹玻片上,每处理重复3次,23 ℃黑暗保湿培养10 h,显微镜下观察孢子萌发情况[14]。 1.2.1.4 化合物108对灰葡萄孢菌核产量的影响
含药PDA平板的浓度与配制方法同1.2.1.1节。将灰葡萄孢接入含系列浓度药剂的PDA平板上,每处理重复3次,23 ℃培养25 d后,PDA培养基上的灰葡萄孢菌落会产生菌核,观察不同浓度药剂的PDA平板上灰葡萄孢菌核的形态,并用镊子取出菌核,称量其质量[14]。 1.2.1.5 化合物108对灰葡萄孢菌丝致病力的影响
在含系列药剂浓度0、2.50、5.00、10.00、20.00和40.00 μg/mL的PDA平板上培养的菌落边缘打取直径为5 mm的菌饼。用昆虫针束(4根小号昆虫针)轻度刺伤大小相近、部位相同的番茄叶片表面,将菌饼贴叶接种于刺伤的番茄叶片上,每处理接种10片叶,3次重复,用脱脂棉蘸水包住叶柄以保持湿度,3 d后测定番茄叶片病斑大小[15]。 1.2.2 化合物108对灰葡萄孢菌丝形态的影响
用于扫描电镜测定样品的加工参照康振生[16]的方法进行。将5×105 个/mL的孢子悬浮液100 μL接种于含化合物108质量浓度分别为0、20、40 μg/mL 的PD培养基中,于23 ℃、140 r/min下摇培各5次,分别于72、96和120 h取出菌丝,用PBS清洗后,放入质量分数为2.5%的戊二醛溶液中固定2 h;再次用PBS清洗,依次放入质量分数为40%、50%、60%、70%、80%和90%乙醇溶液中进行梯度脱水15 min。最后在纯乙酸正戊酯中置换处理25 min,置于30 ℃温箱内干燥、喷金。采用TM-3000扫描电镜观察,照相。 1.2.3 化合物108对灰葡萄孢菌丝超微结构的影响 菌丝培养方法同1.2.2节。用于透射电镜测定样品的加工参照康振生[16]的方法进行。取一定量培养好的菌丝,用2.5%的戊二醛固定2 h,先用蒸馏水清洗3次,再用1%的锇酸固定2 h,PBS(用二钾砷酸钠缓冲液配制)清洗2 h,依次于50%、70%酒精中脱水,每次30 min,再于80%、90%丙酮溶液中脱水各60 min,100%丙酮脱水3次,各10 min。采用EPON-812环氧树脂浸透过夜、包埋,于35、45、60 ℃各聚合24 h,用LKB-5-超薄切片仪切片。经醋酸双氧铀、醋酸铀与柠檬酸铅双重染色后用 H-7650透射电镜观察。
2 结果与分析 2.1 化合物108对灰葡萄孢的抑菌活性
化合物108对灰葡萄孢不同生育阶段均表现出较高的抑菌活性(见表 1)。其中对灰葡萄孢菌丝生长的抑制作用明显,EC50值仅为6.90 μg/mL;能强烈抑制灰葡萄孢孢子萌发和孢子产量,其EC50值分别为4.11和 4.70 μg/mL。
| 表 1 环烷基磺酰胺类化合物108对灰葡萄孢 不同发育阶段的影响 Table 1 Effects of cycloalkyl sulfonylureas compound 108 on different development stages of B. cinerea |
从表 2可以看出:随着药剂浓度的增大,菌核产量明显减少,同时发现菌核块变小,颜色变浅。当药剂质量浓度达20 μg/mL时,PDA平板上已无菌核产生;经化合物108处理后的灰葡萄孢菌丝的病斑长度减小,致病力下降,且药剂浓度越高,致病力越低。当药剂浓度达到40 μg/mL时,灰葡萄孢菌丝的病斑长度(致病力)显著低于对照。
| 表 2 化合物108对灰葡萄孢菌核产量及致病力的影响 Table 2 Effects of cycloalkyl sulfonylureas compound 108 on the sclerotia produced and pathogenicity of B. cinerea |
从图 1可以看出:未经化合物108处理的番茄灰葡萄孢菌丝表面光滑而饱满,伸展性好;而经40 μg/mL 的化合物108处理3 d的菌丝,大部分菌丝体出现了明显的塌陷,处理4 d后的菌丝已基本全部塌陷。
 | 图 1 扫描电镜下观察化合物108对灰葡萄孢菌丝形态的影响 Fig. 1 Mycelial morphology of B. cinerea after being treated by compound
108 under scanning electron microscopy
a.对照;b.20 μg/mL药剂处理3 d; c. 40 μg/mL药剂处理3 d; d. 40 μg/mL药剂处理4 d a. CK; b. Treatment for 3 d at 20 μg/mL; c. Treatment for 3 d at 40 μg/mL; d. Treatment for 4 d at 40 μg/mL |
未经化合物108处理的番茄灰葡萄孢菌丝切面形态规则,细胞结构完整,细胞壁边缘整齐、完整,厚薄均匀,细胞质内细胞器丰富,密度较大,细胞基质较密,可以清晰地看到线粒体、细胞核等(图 2,a);经化合物108处理的菌丝体部分细胞壁增厚、皱缩、分层,细胞基质变淡,内有未知内含物聚集,可见较多的泡状结构,细胞器大部分消失,部分线粒体被泡状结构挤于细胞膜边缘,但仍清晰可见(图 2,e、f)。
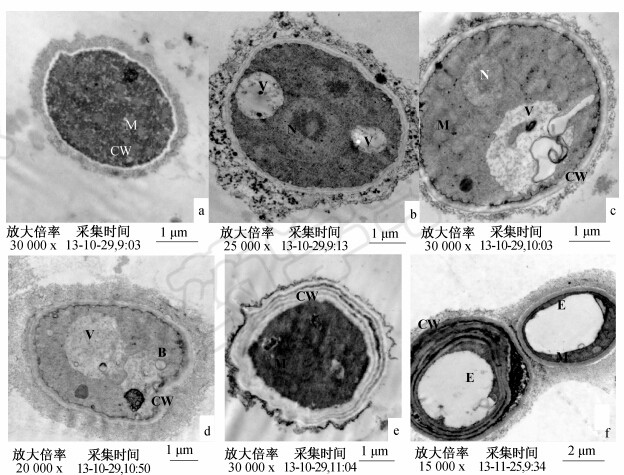 | 图 2 透射电镜下观察化合物108对灰葡萄孢菌丝形态的影响 Fig. 2 Mycelial ultrastructure of B. cinerea after being treated by compound 108
under transmission electron microscope
a.对照;b.20 μg/mL药剂处理3 d; c. 40 μg/mL药剂处理3 d; d. 40 μg/mL药剂处理4 d;
e.40 μg/mL药剂处理5 d; f. 40 μg/mL药剂处理6 d。M. 线粒体;N. 细胞核;B. 囊泡;E. 空腔;V. 无膜内含物;CW. 细胞壁。
a. CK; b. Treatment for 3 d at 20 μg/mL; c. Treatment for 3 d at 40 μg/mL; d. Treatment for 4 d at 40 μg/mL; e. Treatment for 5 d at 40 μg/mL; f. Treatment for 6 d at 40 μg/mL. M. Cell mitochondrion; N. Cell nucleus; B. Vesicle; E. Cavum; V. Un-membrane material; CW: Cell wall |
杀菌剂对病原菌菌丝形态的影响与其作用机理有着密切的联系。三唑类杀菌剂主要通过阻碍真菌麦角甾醇的生物合成而影响真菌细胞壁的形成[17],其对植物病原菌菌丝形态和超微结构的影响主要表现在使菌丝不规则肿胀,分枝明显增多,菌丝细胞壁不规则加厚,形成不均匀的隔膜等[18, 19]。黄青春等报道,烯酰吗啉能引起疫霉属真菌细胞壁物质大面积增生和畸形沉积[20]。Jiang 等研究发现乙磷铝主要影响马铃薯疫病菌吸器的形态,而对病菌细胞核及原生质没有影响[21]。口恶霜灵抑制了番茄晚疫病菌细胞核糖体的合成,可引起病菌细胞核的退化,细胞质中核糖体数量减少[22]。丙烷脒对番茄灰霉病菌菌丝形态的影响主要表现为使菌丝膨大,菌丝膈膜间距变短,菌丝线粒体体积膨大、数目增多,细胞核的结构发生变化[23]。本文报道的环烷基磺酰胺类化合物108对灰葡萄孢菌丝形态和超微结构的影响与其他杀菌剂均不同,其能导致灰葡萄孢菌菌丝萎缩、塌陷、变形,菌体细胞壁增厚、皱缩、分层,用该化合物处理菌体3 d后,菌体线粒体、细胞核仍完整,且清晰可见,由此可初步推断该化合物对菌丝体细胞核和线粒体结构和功能无影响。虽然从本研究结果还无法准确判断化合物108的第一作用位点,但从其对灰葡萄孢细胞壁形态的影响结果可推断该化合物是通过影响菌体物质合成而影响菌体生长的。
| [1] | FARETRA F, POLLASTRO S. Genetic basis of resistance to benzimidazole and dicarboximide fungicides in Botryotinia fuckeliana (Botrytis cinerea)[J]. Mycol Res, 1991, 95(8): 943-951. |
| [2] | POMMER E H, LORENZ G. Resistance of Botrytis cinerea Pers. to dicarboximide fungicides—a literature review[J]. Crop Prot, 1982, 1(2): 221-230. |
| [3] | CHAPELAND F, FRITZ R, LANEN C, et al. Inheritance and mechanisms of resistance to anilinopyrimidine fungicides in Botrytis cinerea ( Botryotinia fuckeliana)[J]. Pestic Biochem Phys, 1999, 64(2): 85-100. |
| [4] | JIANG J H, DING L S, THEMIS J. et al. Molecular characterization of field azoxystrobin-resistant isolates of Botrytis cinerea[J]. Pestic Biochem Phys, 2009, 93(2): 72-76. |
| [5] | De MICCOLIS ANGELINI R M, HABIB W, ROTOLO C, et al. Selection, characterization and genetic analysis of laboratory mutants of Botryotinia fuckeliana ( Botrytis cinerea) resistant to the fungicide boscalid[J]. Eur J Plant Pathol, 2010, 128(2): 185-199. |
| [6] | 纪军建, 张小风, 王文桥. 番茄灰霉病菌对咯菌腈的抗性诱变及抗药突变体的生物学特性[J]. 农药学学报, 2012, 14(5): 497-502. JI Junjian, ZHANG Xiaofeng, WANG Wenqiao. Induced mutation of Botrytis cinerea resistant to fludioxonil and biological characteristics of resistant mutants[J]. Chin J Pestic Sci, 2012, 14(5): 497-502. (in Chinese) |
| [7] | TANAKA S, KOCHI S, KUNITA H, et al. Biological mode of action of the fungicide, flusulfamide, against Plasmodiophora brassicae (clubroot)[J]. Eur J Plant Pathol, 1999, 105(6): 577-584. |
| [8] | MITANI S, ARAKI S, YAMAGUCHI T, et al. Antifungal activity of the novel fungicide cyazofamid against Phytophthora infestans and other plant pathogenic fungi in vitro[J]. Pestic Biochem Phys, 2001, 70(2): 92-99. |
| [9] | 张亦冰. 新颖杀菌剂——amisulbrom[J]. 世界农药, 2009, 31(1): 54. ZHANG Yibing. New fungicide—amisulbrom[J]. World Pesticides, 2009, 31(1): 54. (in Chinese) |
| [10] | 汪晓平, 王道全. N-取代-α-2-氧代环十二烷基磺酰胺的合成及其杀菌活性[J]. 高等学校化学学报, 1997, 18(6): 889-893. WANG Xiaoping, WANG Daoquan. Synthesis and fungicidal activity of 2-oxocyclododecylsulfonamides[J]. Chem J Chinese Univ, 1997, 18(6): 889-893. (in Chinese) |
| [11] | 杨红业, 闫晓静, 袁会珠, 等. 含氟2-氧代环己基磺酰胺的合成及杀菌活性[J]. 农药学学报, 2010, 12(4): 449-452. YANG Hongye, YAN Xiaojing, YUAN Huizhu, et al. Synthesis and fungicidal activity of 2-oxocyclohexylsulfonamides containing fluorine[J]. Chin J Pestic Sci, 2010, 12(4): 449-452. (in Chinese) |
| [12] | LI X H, PAN Q, CUI Z N, et al. Synthesis and fungicidal activity of N-(2, 4, 5-trichlorophenyl)-2-oxo-and 2-hydroxy-cycloalkylsulfonamides[J]. Lett Drug Des Discov, 2013, 10(4): 353-359 |
| [13] | 李兴海, 吴德财, 祁之秋, 等. 2-氧代和2-羟基环烷基磺酰胺对14种病原真菌的杀菌活性[J]. 农药学学报, 2011, 13(4): 423-426. LI Xinghai, WU Decai, QI Zhiqiu, et al. Fungicidal activity of 2-oxo and 2-hydroxycycloalkylsulfonamides against 14 fungus species[J]. Chin J Pestic Sci, 2011, 13(4): 423-426. (in Chinese) |
| [14] | 祁之秋, 王英姿, 李兴海, 等. 醚菌酯对番茄灰霉病菌的生物活性及其防病方式研究[J]. 中国植保导刊, 2008, 28(12): 5-7. QI Zhiqiu, WANG Yingzi, LI Xinghai, et al. Studies on the biological activity of Kresoxim-methyl against Botrytis cinerea and its control modes[J]. China Plant Protection, 2008, 28(12): 5-7. (in Chinese) |
| [15] | 李喜玲, 高智谋, 李艳梅, 等. 不同寄主来源的灰葡萄孢对番茄的致病力分化研究[J]. 菌物学报, 2008, 27(3): 343-350. LI Xiling, GAO Zhimou, LI Yanmei, et al. Differentiation of pathogenicity of Botrytis cinerea strains from different hosts to tomato[J]. Mycosystema, 2008, 27(3): 343-350. (in Chinese) |
| [16] | 康振生. 植物病原菌超微结构[M]. 北京: 中国科学技术出版社, 1996: 7-11. KANG Zhensheng. Ultrastructure of Phytopathogon[M]. Beijing: China Science and Technology Press, 1996: 7-11. |
| [17] | 陈茹梅, 李金玉, 康振生, 等. 戊唑醇对小麦纹枯菌超微结构的影响[J]. 菌物系统, 2000, 19(3): 389-395. CHEN Rumei, LI Jinyu, KANG Zhensheng, et al. Effects of tebuconazole on ultrastructural changes of Rhizoctonia cerealis[J]. Mycosystema, 2000, 19(3): 389-395. (in Chinese) |
| [18] | 康振生, 商鸿生, 井金学, 等. 内吸杀菌剂烯唑醇对小麦条锈菌和白粉菌发育影响的研究[J]. 植物病理学报, 1996, 26(2): 111-116. KANG Zhensheng, SHANG Hongsheng, JING Jinxue, et al. Effects of systemic fungicide Diniconazole on the development of stripe rust and powdery mildew on their host wheat[J]. Acta Phytopathologica Sinica, 1996, 26(2): 111-116. (in Chinese) |
| [19] | KANG Z S, HUANG L L, BUCHENAUER H. Ultrastructural and cytochemical studies of effects of the fungicide metconazole on Fusarium culmorum in vitro[J]. Zeitschrift FÜr Pflanzenkrankheiten und Pflanzenschutz, 2001, 108(4): 419-432. |
| [20] | 黄青春, 叶钟音. 烯酰吗啉(DMM)的特性及其作用机制[J]. 农药科学与管理, 2000, 21(5): 28-31. HUANG Qingchun, YE Zhongyin. Character and mode of action of dimethomorph[J]. Pestic Sci Admin, 2000, 21(5): 28-31. (in Chinese) |
| [21] | JIANG Y, GROSSMANN F. Subcellular alterations in phytophthora infestans infecting tomato leaves treated with Fosetyl-Al[J]. Pestic Biochem Phys, 1992, 44(3): 226-238. |
| [22] | JIANG Y. Effects of oxadixyl treatment on the ultrastructure of Phytophthora infestans infecting tomato leaves[J]. Pestic Sci, 1992, 35(2): 153-159. |
| [23] | 陈安良, 冯美杰, 冯俊涛, 等. 丙烷脒对灰霉病菌菌丝形态和超微结构的影响[J]. 中国农业科学, 2007, 40(3): 633-637. CHEN Anliang, FENG Meijie, FENG Juntao, et al. Effects of propamidine on mycelial morphology and ultrastructure of Botrytis cirerea[J]. Scientia Agricultura Sinica, 2007, 40(3): 633-637. (in Chinese) |
 2014, Vol. 16
2014, Vol. 16

