灭多威(methyomyl)是一种高毒性氨基甲酸酯类杀虫剂,能有效抑制害虫体内的乙酰胆碱酯酶(AChE)活性,造成害虫神经组织内乙酰胆碱的蓄积而导致中毒,从而有效控制棉花、蔬菜和烟草等植物上鳞翅目、同翅目、鞘翅目及其他螨类等害虫的为害[1]。随着灭多威在农业生产中的广泛应用,其给自然界的生物已造成了严重威胁。付秀娥等报道,无论是体内或体外试验,灭多威对日本青鳊、大型蚤等水生生物的AChE活性均表现出强烈的抑制作用[2]。尽管基因突变试验研究表明,氨基甲酸酯类杀虫剂的致突变作用很小,且灭多威在大鼠和兔等实验动物慢性饲喂测试中并未发现致畸、致突变、致癌作用[3, 4],也不能使大肠杆菌和中国仓鼠V79细胞染色体发生突变[5],但近期陆续有研究报道:灭多威在酵母回复突变试验中得到了阳性结果[6],其能显著地诱导蚕豆根细胞和小鼠生殖细胞染色体畸变[7, 8];通过染色体畸变、姊妹染色单体替换、微核实验等研究也发现,灭多威对人淋巴CHO-W8细胞存在明显的遗传毒性[9]。因此,阐明灭多威的遗传毒性对于评估其生物安全性和促进其在农业生产上的合理使用具有重要意义。本文拟选用果蝇胚胎S2细胞和人肝癌HepG2细胞为研究对象,通过分析灭多威对细胞活力、DNA损伤、磷酸化组蛋白(γH2AX)表达规律以及细胞凋亡等的影响,探明灭多威潜在的遗传毒性特征,旨在为更好地发挥灭多威的实用价值提供基础试验依据。 1 材料与方法 1.1 供试细胞株
果蝇胚胎S2细胞系(Drosophila Schneider 2 cell lines,以下简称S2)和人肝癌HepG2细胞系(Human hepatocellular carcinoma cell lines,简称HepG2)均购自中国科学院细胞研究所,由本实验室长期保存并用于实验研究。S2细胞:采用Schneider′sDrosophila昆虫培养基(Gibco公司,美国),于28 ℃恒温培养;HepG2细胞:采用Dulbecco′s Modified Eagle′s Medium(DMEM)高糖培养基(HyClone公司,美国),于37 ℃的CO2恒温培养箱中培养。上述两种培养基中均添加质量分数为10%的胎牛血清和1%的青霉素-链霉素溶液。 1.2 试剂
1%的青霉素-链霉素溶液、PBS、胎牛血清均购自美国HyClone公司;胰蛋白酶购自美国Gibco公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、多聚甲醛和牛血清白蛋白(BSA),均购自美国Biosharp公司;Triton X-100、碘化丙啶(PI)、4′,6-二脒基-2-苯基吲哚(DAPI)、96.7%的灭多威原药和甲基硝基亚硝基胍(MNNG),均购自美国Sigma公司;低熔点琼脂糖购自美国Life Science公司;兔γH2AX单克隆抗体,购自中国百奇生物科技(苏州)有限公司;Alexa Fluor 488购于美国Jackson Immuno Research公司;乙二胺四乙酸二钠(EDTA-2Na)等其他试剂均为市售分析纯。试验前,先将灭多威原药和MNNG分别溶解于DMSO中,配制成1.0×104 μg/mL 的母液,储存于棕色瓶中,于4 ℃下保存。用细胞培养基稀释后供试。 1.3 细胞活力测定
采用MTT法[10]。分别取100 μL密度为1×106个/mL并处于对数生长期的S2和HepG2细胞悬液,接种于96孔细胞培养板中,恒温培养,待细胞长至约70%汇合度(confluence)时,加入经细胞培养基稀释的灭多威溶液。HepG2细胞处理中灭多威的浓度为12、16、20、24、和28 mmol/L,S2细胞处理中灭多威的浓度为6、8、10、12和14 mmol/L。以等体积培养基处理为阴性对照,等体积20 μmol/L的MNNG处理作为阳性对照。试验设3次重复。药物处理24 h后,向每孔中加入20 μL MTT,分别置于28 ℃和37 ℃恒温培养箱中孵育4 h。去除培养基,加入150 μL DMSO溶解蓝紫色结晶甲瓒(Formazan)沉淀,使用MultiSkan FC 酶标仪(美国Thermo Scientific公司)在波长 493和630 nm处测定吸光度值,计算各处理中供试细胞的活力。 1.4 彗星电泳
采用Cotelle等[11]和Kassie等[12]的方法进行单细胞凝胶电泳。取2 mL密度为1×106个/mL并处于对数生长期的细胞悬液,接种于6孔细胞培养板中,待细胞生长至约80%汇合度时,加入经细胞培养基稀释的灭多威药液。HepG2细胞处理中灭多威的浓度为12、16、18和20 mmol/L,S2细胞处理中灭多威的浓度为6、8、10和12 mmol/L。以等体积的培养基处理为阴性对照,等体积20 μmol/L的MNNG处理为阳性对照。设3次重复。处理 24 h 后,取细胞悬浮液离心(1 000×g,5 min),弃去上清液。用PBS洗涤细胞2次,再用PBS重悬细胞,并将细胞密度调整到1×105个/mL,用于彗星电泳。以质量分数为0.8%的琼脂糖溶液为第1层凝胶,1%低熔点琼脂糖溶液为第2层凝胶,细胞悬液与1%低熔点琼脂糖凝胶溶液的混合体积比为1∶3。使用碱性电泳缓冲液(NaOH 12.0 g、Na2EDTA 0.37 g,ddH2O 1 000 mL,pH 13)在20 V、300 mA下电泳10 min,再用中和缓冲液(Na2EDTA 48.46 g,ddH2O 1 000 mL,pH 7.5)中和3次,最后用ddH2O洗涤3次,滴加 30 μL PI(2 μg/mL)于胶片上,盖上盖玻片,置于倒置荧光显微镜200倍下观察,每处理选取10~20个视野,分别观察约200个细胞并拍照。采用CASP软件分析彗星细胞的尾长、尾部DNA百分比(%)和尾矩。 1.5 γH2AX免疫荧光印迹
采用Halicka等[13]的方法但略作改进。取经药物处理24 h后的细胞悬液,去除培养基,用PBST洗涤细胞3次,向每孔中加入2.0 mL 质量分数为4%的多聚甲醛溶液,置于4 ℃下避光固定15 min;用PBST洗涤细胞2次,向每孔中加入1.0 mL 1%的Triton-X100溶液,作用30 min后再用PBST洗涤细胞2次;最后向每孔中加入600 μL BSA(5%),封闭1 h;之后再向每孔中加入600 μL兔γH2AX单克隆抗体溶液,于37 ℃孵育2 h。用PBST洗涤细胞3次,再加入600 μL的Alexa Fluor 488标记兔抗,置于37 ℃下避光孵育1 h后,用PBST洗涤细胞3次,然后向每孔中加入200 μL DAPI染液(2 μg/mL),染色30 min。在荧光显微镜400倍下观察,每处理取10~20个视野,分别观察约200个细胞并采集图像。以具有4个荧光焦点以上的细胞为阳性细胞进行统计,计算阳性细胞百分率(%)。 1.6 数据统计
使用SPSS16.0软件进行数据分析,数据表示为平均值±标准差(SD)。采用单因素方差分析(Newman-Keuls multiple检验)和ANOVA方差分析检验各处理组与空白对照组之间的差异。其中P<0.05表示差异显著,P<0.01表示差异极显著。 2 结果与分析 2.1 灭多威对S2和HepG2细胞活力的影响
结果(图 1)表明:经灭多威处理24 h后,S2和HepG2细胞活力均随灭多威浓度的递增呈下降趋势。在6 mmol/L的灭多威作用下,S2细胞活力与对照差异显著(P<0.05),而在8、10、12和14 mmol/L 的灭多威作用下,S2细胞活力与对照差异极显著(P<0.01);同样,经12和16 mmol/L灭多威作用的HepG2细胞活力与对照差异显著(P<0.05),而经20、24和28 mmol/L灭多威作用的HepG2细胞活力与对照组差异极显著(P<0.01)。经统计,灭多威对S2和HepG2细胞的IC50值分别为10.3 和19.7 mmol/L。
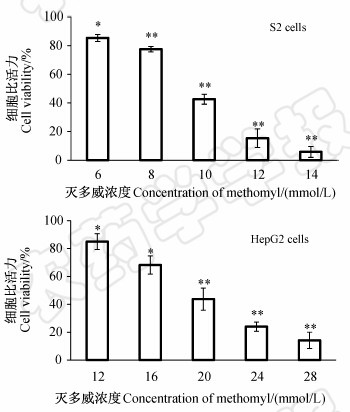 | 图 1 灭多威对S2和HepG2细胞的毒性 Fig. 1 Cytotocixity of methomyl against S2
and HepG2 cells
*表示P<0.05水平上的差异显著性,
** 表示P<0.01水平上的差异显著性。
* Significant difference at P<0.05 level, ** significant difference at P<0.01 level. |
随着灭多威浓度的增加,S2和HepG2细胞彗星尾部长度增加,尾面积逐渐增大,同时彗星细胞百分比也逐渐增加(见图 2)。20 μmol/L MNNG处理组中彗星细胞,与对照差异极显著(P<0.01)。经6、8、10和12 mmol/L灭多威处理的S2细胞中彗星细胞分别为69%、83%、87%和91%;而经12、16、20和24 mmol/L灭多威处理的HepG2细胞中彗星细胞分别为32%、50%、62%和 81%。经统计,灭多威能够极显著地引起S2和HepG2细胞产生彗星现象(P<0.01)。
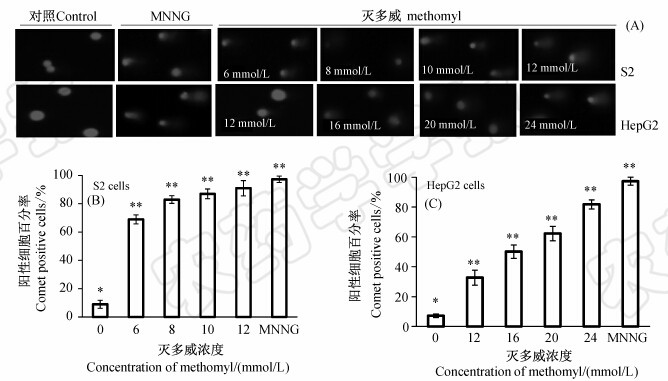 | 图 2 供试细胞经灭多威处理后的彗星图像(A)以及S2(B)和HepG2(C)的阳性细胞百分率 Fig. 2 Percent comet positive cells of S2 and HepG2 cells after exposed to methomyl
*表示P<0.05水平上的差异显著性,** 表示P<0.01水平上的差异显著性。 * Significant difference at P<0.05 level,** significant difference at P<0.01 level. |
彗星细胞的尾长、尾部DNA百分比(%)和尾矩的统计结果见表 1。6 mmol/L灭多威处理的S2细胞尾长和尾矩与对照相比无显著差异,而尾部DNA含量存在显著性差异(P<0.05)。8、10和12 mmol/L灭多威作用的S2细胞尾长、尾部DNA和尾矩均随灭多威浓度增加呈上升趋势,并与对照呈极显著差异(P<0.01)。经12 mmol/L 灭多威处理的HepG2细胞尾长和尾矩与对照无显著差异,而尾部DNA含量也呈显著性差异(P<0.05)。当灭多威浓度升高时,HepG2细胞尾长、尾部DNA和尾矩均呈上升趋势,并与对照呈极显著差异(P<0.01)。
| 表 1 彗星电泳检测灭多威诱导HepG2和S2细胞的DNA损伤 Table 1 DNA damage of S2 and HepG2 cells caused by methomyl by using comet assays |
灭多威能引起S2和HepG2细胞出现显著的组蛋白磷酸化现象。图 3显示,用12和 24 mmol/L 灭多威分别处理S2和HepG2细胞24 h后,细胞中γH2AX荧光焦点显著增加,表明灭多威诱导了S2和HepG2细胞中DNA的双链损伤。
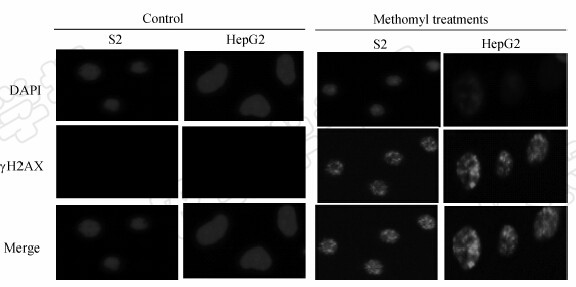 | 图 3 经灭多威处理24 h后的S2和HepG2细胞中形成的γH2AX荧光焦点Fig. 3 γH2AX foci in S2 and HepG2 cells after exposed to methomyl for 24 h |
阳性细胞统计结果(图 4)显示,对照组和MNNG处理组中,S2和HepG2细胞的阳性细胞百分率之间差异极显著(P<0.01)。6和 8 mmol/L灭多威处理的S2细胞中阳性细胞百分率分别为25.4%和44.7%,与对照差异显著(P<0.05)。10和12 mmol/L 灭多威处理的S2细胞中阳性细胞百分率分别为80.5%和90.0%,与对照差异极显著(P<0.01)。12和16 mmol/L灭多威处理的HepG2细胞中阳性细胞百分率分别为32.9%和58.3%,与对照差异显著(P<0.05)。20和 24 mmol/L灭多威处理的HepG2细胞中阳性细胞百分率分别为70.4%和88.6%,与对照差异极显著(P<0.01)。
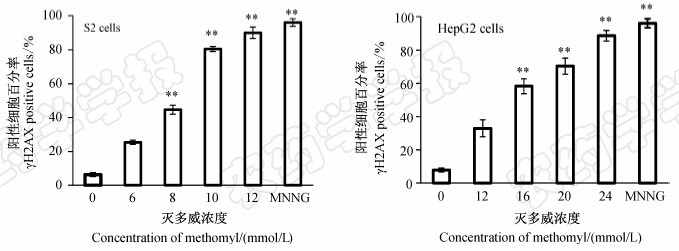 | 图 4 经灭多威处理24 h后S2和HepG2细胞中阳性细胞百分率 Fig. 4 Percent positive cells of S2 and HepG2 cells after exposed to methomyl
*表示P<0.05水平上的差异显著性,** 表示P<0.01水平上的差异显著性。 * Significant difference at P<0.05 level,** significant difference at P<0.01 level. |
我国是一个农药生产和使用大国,农药对作物增产有显著贡献,但有些农药特别是残留期长的化学农药则可能会污染环境,影响非靶标生物的生长和繁殖[14]。灭多威是氨基甲酸酯类杀虫剂中常用的农药品种,可通过食物、职业接触和居住环境接触等途径被人体吸收。采用传统的遗传毒理学方法如:Ames试验、染色体畸变试验和微核试验等研究表明,灭多威可能作用于遗传物质而影响生物体的健康,对昆虫和高等动物都具有一定的遗传毒性[7, 8, 9]。目前,灭多威对高等动物基因毒性机制的研究报道较少[15]。
本研究表明,灭多威对果蝇胚胎S2和人肝癌HepG2细胞活力的抑制作用具有浓度效应关系,即细胞活力均随灭多威浓度的递增而逐渐下降。彗星电泳图谱清晰地显示,在单细胞水平上灭多威对S2和HepG2双链DNA具有强烈的损伤作用,尤其10和12 mmol/L的灭多威对S2细胞DNA损伤的诱导作用显著强于20 μmol/L MNNG的作用。众所周知,MNNG可直接与DNA作用而改变姐妹染色单体,诱发细胞染色体异常和点突变以及细胞死亡,是一种化学诱变剂和致癌剂。本研究结果表明,灭多威可诱导果蝇S2细胞中DNA断裂,同时对高等动物DNA也具有潜在的高毒性,其诱导DNA损伤的发生机制有待进一步研究。
近年来,γH2AX在高等动物细胞DNA损伤和修复应激反应中的作用逐渐引起人们的重视[13, 14]。当细胞中双链DNA发生损伤后,细胞内的H2AX蛋白SQE结构域中的139位Ser残基会被迅速磷酸化,并在DNA损伤位点上形成修复焦点[16, 17]。本研究结果表明,灭多威处理能使S2和HepG2细胞中出现显著的组蛋白磷酸化现象,且处理细胞中阳性细胞百分率与对照相比差异显著(P<0.05)。说明S2和HepG2细胞DNA对灭多威的毒性都具有高度的敏感性。
综合表明,灭多威能抑制S2和HepG2细胞活力,并诱导DNA 损伤而造成细胞凋亡。灭多威作为使用广泛的高效杀虫剂,长时间暴露会对人类具有诱发基因疾病的可能。
| [1] | BOLOGNESI C, PELUSO M, DEGAN P, et al. Genotoxic effects of the carbamate insecticide, methyomyl. Ⅱ. In vivo studies with pure compound and the technical formulation, "Lannate 25"[J]. Environ Mol Mutagen, 1994, 24(3): 235-242. |
| [2] | 付秀娥, 曾阳, 付荣恕. 灭多威对日本青鳉和大型溞乙酰胆碱酯酶的效应研究[J]. 安徽农业科学, 2012, 40(10): 5950-5952. FU Xiu'e, ZENG Yang, FU Rongshu. Effects of methomyl on acetylcholinesterases (AChE) activity in Oryzias latipes and Daphnia magna[J]. J Anhui Agric Sci, 2012, 40(10): 5950-5952. |
| [3] | WANG T C, CHIOU C M, CHANG Y L. Genetic toxicity of N-methyl carbamate insecticides and their N-nitroso derivatives[J]. Mutagenesis, 1998, 13(4): 405-408. |
| [4] | MORIYA M, OHTA T, WATANABE K, et al. Further mutagenicity studies on pesticides in bacterial reversion assay systems[J]. Mutat Res, 1983, 116(3-4): 185-216. |
| [5] | KAPLAN A M, SHERMAN H. Toxicity studies with methyl N-{[(methylamino)carbonyl]oxy}-ethanimidothioate[J]. Toxicol Appl Pharmacol, 1977, 40(1): 1-17. |
| [6] | GUERZONI M E, DEL CUPOLO L, PONTI I. Mutagenic activity of pesticides[J]. Riv Sci Tecnol Alimenti Nutr Um, 1976, 6(3): 161-165. |
| [7] | HEMAVATHY K C, KRISHNAMURTHY N B. Evaluation of lannate 20, a carbamate pesticide in the germ cells of male mice[J]. Environ Res, 1987, 42(2): 362-365. |
| [8] | LIN C M, WEI L Y, WANG T C. The delayed genotoxic effect of N-nitroso N-propoxur insecticide in mammalian cells[J]. Food Chem Toxicol, 2007, 45(6): 928-934. |
| [9] | CALDERON-SEGURA M E, GOMEZ-ARROYO S, MOLINA-ALÜAREZ B, et al. Metabolic activation of herbicide products by Vicia faba detected in human peripheral lymphocytes using alkaline single cell gel electrophoresis[J]. Toxicol In Vitro, 2007, 21(6): 1143-1154. |
| [10] | MOSMAN T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1-2): 55-63. |
| [11] | COTELLE S, FÉRARD J F. Comet assay in genetic ecotoxicology: a review[J]. Environ Mol Mutagen, 1999, 34(4): 246-255. |
| [12] | KASSIE F, PARZEFALL W, KNASMULLER S. Single cell gel electrophoresis assay: a new technique for human biomonitoring studies[J]. Mutat Res, 2000, 463(1): 13-31. |
| [13] | HALICKA H D, HUANG X, TRAGANOS F, et al. Histone H2AX phosphorylation after cell irradiation with UV-B relationship to cell cycle phase and induction of apoptosis[J]. Cell Cycle, 2005, 4(2): 339-345. |
| [14] | BRADSHAW P S, STAVROPOULOS D J, MEYN M S. Human telomeric protein TRF2 associates with genomic double-strand breaks as an early response to DNA damage[J]. Nat Genet, 2005, 37(2): 193-197. |
| [15] | XIANG Guanggang, LI Diqiu, YUAN Jianzhong, et al. Carbamate insecticide methomyl confers cytotoxicity through DNA damage induction[J]. Food Chem Toxicol, 2013, 53: 352-358. |
| [16] | CRUPTON M J, COLLINS A R. Are environmental electromagnetic fields genotoxic?[J]. DNA Repair, 2004, 3(10): 1385-1387. |
| [17] | CELESTE A, PETESRNE S, ROMANIEKO P J, et al. Genomic instability in mice lacking histone H2AX[J]. Science, 2002, 296(5569): 922-927. |
 2014, Vol. 16
2014, Vol. 16


