2. 新乡医学院 生命科学技术学院, 河南 新乡 453003
2. College of Life Science and Technology, Xinxiang Medical University, Xinxiang 453003, He'nan Province, China
农用微生物杀菌剂是微生物农药的一种类型,目前对其并没有统一和明晰的概念。杨丽荣等[1]认为,农用微生物杀菌剂是指由微生物或其代谢产物加工而成的、具有抑制植物病害功能的生物活性物质。笔者认为,农用微生物杀菌剂应仅指可用于控制作物病害、以活体微生物为主要成分的制剂,而以代谢产物为主要成分的则应归为生物化学农药或生物源农药。随着世界各国政府和民众对食品中农药残留问题的关注,农用微生物杀菌剂的发展越来越快,市场份额逐年增多[2]。农用微生物杀菌剂的研制一般需经历“生防菌筛选→生防机理及安全性研究→生防菌大量制备→生防菌剂型化→制剂田间防效验证→生产工艺放大→生产线建设→田间药效试验→质量标准制定→农药登记→生产批准证→制剂商业化”的过程,其中剂型研究是生防菌能否从实验室走向田间的关键步骤之一,对于农用微生物杀菌剂的产业化具有重要意义。然而,由于商业上的技术保护等原因,有关剂型研究的细节或策略较少被报道,因而不利于农用微生物杀菌剂的发展。本文拟就农用微生物杀菌剂剂型的功能、种类、性质以及制剂生产和贮存条件、田间环境条件对其性质及防效的影响等多个方面进行系统的评述,并对其存在的问题及未来发展趋势进行分析,以期为相关研究提供参考。 1 农用微生物杀菌剂剂型的定义及功能
剂型是农药有效成分的最终使用形式或状态,起着保护、稀释或缓释有效成分,优化使用效果以及扩大使用范围等作用。由于农用微生物杀菌剂的主要成分生防菌是活体生物,在剂型加工过程中容易失活,且其主要成分本身是不溶于水的颗粒,具有疏水性,导致制剂的物理性质如润湿性、悬浮率等难以得到提高,因此农用微生物杀菌剂的剂型加工明显难于化学农药。另一方面,由于生防菌在环境中容易失活,导致其防效极不稳定,因而在剂型加工以及田间应用过程中需要采取一定的保护措施。然而,与生物防治的其他研究领域(如生防机理、生防菌筛选、生防菌培养等)相比,有关剂型的研究相对较薄弱,严重阻碍了农用微生物杀菌剂在植物病害防治中的推广和应用。 2 农用微生物杀菌剂的主要剂型
根据物理形态,可将农用微生物杀菌剂分为固态制剂[包括粉剂(DP)、颗粒剂(GR)、水分散粒剂(WG)和可湿性粉剂(WP)等]和液态制剂[主要为水剂(AS)和悬浮剂(SC)];根据用药对象,则可分为种子处理剂、土壤处理剂和叶部喷雾制剂等。笔者就我国已登记的农用微生物杀菌剂的剂型种类(截至2014年2月有效的单剂)[3]进行了统计分析(图 1),发现其中可湿性粉剂占绝大多数(82%),水剂为6%,粉剂、水分散粒剂、悬浮剂和颗粒剂各占3%,即可湿性粉剂是我国目前农用微生物杀菌剂的主要剂型。
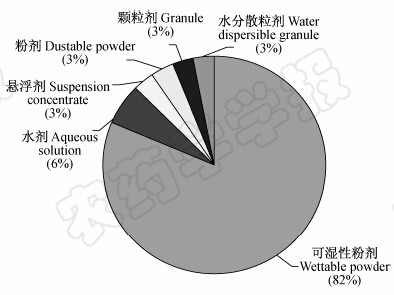 | 图 1 已在中国取得登记的农用微生物杀菌剂剂型种类(截至2014年2月) Fig. 1 Microbial pesticide formulation types which were registered for plant disease control in China before Feb. 2014 |
已在美国环保署登记的农用微生物杀菌剂剂型种类(截至2014年2月有效的单剂)[4]的统计分析结果见图 2,其中悬浮剂所占的比例最高(37%),可湿性粉剂次之(26%),颗粒剂占21%,粉剂占16%,表明悬浮剂是美国农用微生物杀菌剂的主要剂型。
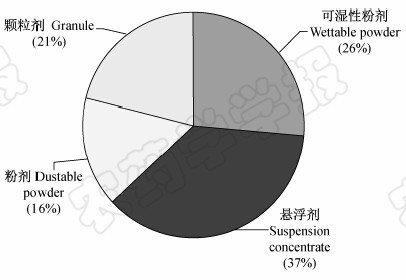 | 图 2 已在美国环保署登记的农用微生物杀菌剂 剂型种类(截至2014年2月) Fig. 2 Microbial pesticide formulation types which were registered for plant disease control by USA Environmental Protection Agency(EPA) before Feb. 2014 |
对比中美两国农用微生物杀菌剂剂型种类可知,中国农用微生物杀菌剂的剂型种类单一,主要为可湿性粉剂,其他剂型较少,比例相差悬殊;而美国农用微生物杀菌剂的剂型种类较丰富,悬浮剂、可湿性粉剂和颗粒剂占的比例均较高。因此我国亟待加强农用微生物杀菌剂剂型的相关基础研究,拓宽剂型种类和应用范围,并通过新剂型研发和原有剂型优化技术,提高微生物杀菌剂的防治效果,降低其生产成本。 2.1 悬浮剂
悬浮剂(suspension concentrate,SC)是由菌体悬浮液或发酵液加入助剂(防沉降剂、pH稳定剂和防腐剂等)直接制备而得的剂型,由于省去了干燥脱水过程,因此生产成本较低。悬浮剂目前存在的最大问题是生防菌存活期较短,无法满足实际应用的需要。Melin等[5]和Trivedi等[6]的研究结果表明,悬浮剂中活菌的存活期明显低于干燥后的固态制剂。这是因为制剂中较高的水分含量不利于生防菌的休眠,同时还容易引起生防菌的二次生长或杂菌污染。微生物杀菌悬浮剂的进一步发展需依赖于对生防菌生理代谢特点的深入了解,目前,悬浮剂研究是农用微生物杀菌剂剂型研究的难点,一旦理论和技术方面有所突破,货架期过短的问题得以解决,低廉的制造成本必然会使悬浮剂成为最具竞争力的剂型。此外,现有农用微生物杀菌悬浮剂产品均为水悬浮剂,应加强对油悬浮剂(以植物油为主)的研究。 2.2 粉剂
粉剂(dustable powder,DP)是指无需经过兑水而可直接使用的剂型,其制备过程一般包括菌体悬浮液和载体混合、晾干[7](不需要经过喷雾干燥和粉碎),在无杂菌条件下制备则不需要经过干燥[8]。粉剂所用的载体包括高岭土、硅藻土、滑石粉和碳酸钙等,其中用滑石粉作为载体的报道较多[9, 10, 11]。Vidhyasekaran等[12]的研究表明,采用滑石粉制备的农用微生物杀菌剂粉剂贮存6个月后,其生防菌株(Fluorescent pseudomonad Pf1和Pf2)仍具有较高的存活力,而高岭土制剂中活菌的存活力很低,表明滑石粉更适用于这2株荧光假单胞菌粉剂的制备。粉剂虽然使用方便且制备成本较低,但由于其容易飘移导致环境污染,因此实际应用范围并不广。 2.3 可湿性粉剂
可湿性粉剂(wettable powder,WP)是指由原粉、填料(载体)和助剂(表面活性剂、润湿剂、分散剂、紫外光保护剂、稳定剂和营养助剂等)混合组成,并经粉碎而制成的一种粉状制剂。与粉剂相比,其有效成分含量较高、粒径更小、更易润湿、可分散于水中供喷雾使用。尽管可湿性粉剂生产过程中粉尘污染较大,但由于其加工成本低、制作过程简单,因此仍是我国目前农用微生物杀菌剂的主要剂型。
可湿性粉剂的主要缺点是加工及使用过程中粉尘较大,易污染环境,对制剂生产操作人员或农药使用人员的健康有潜在威胁。加工过程的污染可以通过密封性能良好的自动化生产线解决,而使用时的粉尘危害可通过采用水溶性包装材料加以避免。因此,如果选用更好的加工条件和包装材料,可湿性粉剂仍将在市场中占有较大比例。
目前国内外有关微生物农药可湿性粉剂制备的主要研究概况见表 1。多数研究者采用离心或过滤的方法收集生防菌,制成悬浮液后再与载体和助剂等组分混合制备可湿性粉剂[13, 14, 15]。然而,由于许多生防菌在培养过程中都会产生一些对植物病虫害有抑制作用的物质[16, 17, 18],如果仅收集活菌,则可能会造成活性成分的流失[19]。鉴于此,一些研究者将包括生防菌在内的发酵液作为剂型化研究的对象,用于可湿性粉剂的制备[20, 21],从而可以有效利用发酵液中的活性物质,起到提高制剂防效的作用。 2.4 颗粒剂
颗粒剂(granulars,GR)是由原药、助剂和载体制成的粒状制剂,具有持效期长、用量少、使用方便、易贮存和使用时无粉尘飘移等优点。颗粒剂按粒径大小可分为大粒剂(macrogranule,2 000~6 000 μm)、细粒剂(fine granule,300~2 500 μm)和微粒剂(microgranule,100~600 μm)。由于粒径较大,颗粒剂不能用于叶部喷施,主要用于土壤施用(穴施或垄施)。以多粘类芽孢杆菌HY96-2及其代谢产物为主要成分,笔者所在课题组与上海泽元海洋生物技术有限公司合作首创的新型农用微生物杀菌剂——107 CFU/g多粘类芽孢杆菌细粒剂(“康蕾”牌商标,原商品名:康地蕾得)[30, 31]对素有“植物癌症”之称的细菌性病害植物青枯病具有良好的防效[32, 33, 34],并可明显促进植物的生长;对植物枯萎病等危害严重的真菌性土传病害也具有较好的防治效果,如对黄瓜枯萎病的防效可达57.08%~73.48%[35],对百合枯萎病的防效为55.08%~68.32%[36]。
| 表 1 农用微生物杀菌剂可湿性粉剂的主要成分及制备方式 Table 1 Main ingredient and preparation type of microbial pesticide wettable powder |
颗粒剂所用的载体主要为植物性农业副产品,如稻壳粉等,干燥过程采用简单的晾干或气流干燥等方式,生产成本较低。但由于粒径较大,颗粒剂不能用于喷雾防治植物叶部病害,仅适用于土传病害的防治,因而限制了其应用范围和发展。 2.5 水分散粒剂
水分散粒剂(water dispersible granules,简称WG或WDG),是一种可在水中迅速分散的剂型,包装和使用方便、无需溶剂、无粉尘污染、有效成分含量高,已成为当今农药剂型发展的一个重要方向。张敏[37]在木霉菌可湿性粉剂的基础上,通过挤压造粒法制备了水分散粒剂,润湿时间和悬浮率分别可达到22 s和82.75%,制剂性能良好。牛赡光等[38]制备了一种枯草芽孢杆菌水分散粒剂,其对田间棉花枯萎病的防效达到60%以上。尽管水分散粒剂是农药剂型发展的一个良好方向,但由于其加工成本较高,市场竞争力差,因此在农用微生物杀菌剂中所占的比例不大。今后应重点开发具有良好崩解分散性能的助剂,并简化水分散粒剂的制备过程,如研究开发将生防菌发酵液、载体及助剂混合后通过一步干燥即可制得水分散粒剂的新工艺。
同一种生防菌在理论上可以被加工成多种剂型,但在实际生产中应根据微生物的生理特性、使用方式和目的的不同,选择合理、适当的剂型[39]。药剂使用方式主要包括飞机施药、地面喷施、拌种、穴施和灌根等;使用目的有速效性和持效性,速效性需考虑剂型的内吸性,持效性则要考虑其缓释性能[39]。此外,由于农用微生物杀菌剂剂型研究的最终目标是制剂的商品化,因此,在选择剂型时还必须考虑加工成本及其在市场上的竞争力,否则,即使是性能优良的剂型,在应用推广中也会遇到诸多困难。 3 农用微生物杀菌剂的主要性质
农用微生物杀菌剂的性质主要包括生物性质和物理性质。生物性质包括生防菌的含量、芽孢率及活力等,良好的生物性质是农用微生物杀菌剂高效防治作物病害的重要基础。物理性质则因剂型种类不同而有所差异。对悬浮剂而言,包括悬浮稳定性、结块性和倾倒性等;对可湿性粉剂而言,包括润湿性、分散性、结块(团)性和悬浮率等;对水分散粒剂,则包括崩解性、粒径和悬浮率;等等。物理性质主要与农药使用时的方便程度及药液的均匀程度等有关。农用微生物杀菌剂的生物性质和物理性质对产品功效及市场接受程度均有很大影响,是产品质量控制的主要指标。由于物理性质涉及因素太多,且随剂型不同要求也有所不同,故本文主要讨论农用微生物杀菌剂的生物性质,对其物理性质不作讨论。 3.1 活菌数
具有一定数量的活体个数是生防菌在环境中定殖和生长的基础,因此,活菌数是农用微生物杀菌剂的一项重要质量指标。测定活菌数的方法很多(表 2),最常用的是传统的平板菌落计数法。平板菌落计数法具有技术简单、容易操作、不需要使用高级仪器等优点,缺点是耗时、工作量大且误差较大。此外,由于活菌之间团聚以及载体吸附等原因,导致可湿性粉剂等固体剂型中附着在载体上的活菌难以被全部解析至水中。针对这一问题,陈振民等[40]发明了一种新的微生物农药活菌计数方法:以生理盐水和吐温-水溶液作为制剂的稀释液,通过超声振荡和均质器挤压方法促使活菌从载体上解析并分散,逐级稀释后再采用平板菌落计数法测定制剂中的活菌数。随着基因和分子探针技术的发展,ATP荧光法、定量PCR法和酶法等逐渐被用于微生物活菌数测定,这些方法的优点是测定时间短、测定误差较小,缺点是费用昂贵。
| 表 2 几种常用活菌计数方法比较 Table 2 Comparison of live microbial organism counting method |
活菌数是农用微生物杀菌剂生产过程中测定频率最高的一项指标,倘若荧光探针标记等方法能够代替传统的平板菌落计数法,则高通量和高精度的活菌数检测目的将得以实现,对农用微生物杀菌剂生产过程中活菌质量控制具有重要的促进作用。 3.2 防效
在害虫生防制剂生产过程中,常用生防微生物的“毒力”作为其质量控制指标,表征生防微生物侵染及致死害虫的能力。生防微生物对害虫的致死能力不仅与其数量有关,还与其侵染能力、寄生能力、繁殖能力以及产毒素能力等相关,因此“毒力”可综合反映生防制剂的杀虫潜力。在农用微生物杀菌剂质量控制过程中,一般用“活菌数”作为质量控制指标。生防微生物的杀菌效果除与其数量相关外,还与其在田间环境中的存活能力、在植物体内的定殖能力、营养空间竞争能力、抑菌能力以及诱导能力等多种因素有关,单纯用活菌数评价农用微生物杀菌剂的防治潜力不够准确。因此,如何更准确地评价农用微生物杀菌剂的防效,并将其作为一个质量控制指标应用于生产过程的检测,是值得相关科研工作者重视的问题。尽管每一种农用微生物杀菌剂都有其相应的盆栽模型,但由于其测定时间长,重复性差,不宜大规模、常态化使用,因此发展微型、快速、稳定可靠、标准化的防效测定模型也非常重要,对生防微生物产品的质量控制将具有较大的推动作用。 4 生产条件对农用微生物杀菌剂性质的影响
生产条件如生防菌培养和剂型化过程都可能对农用微生物杀菌剂的性质产生很大影响。许多非芽孢类微生物对制剂加工条件(如高温)很敏感,在高温条件下,其活力会急剧下降。因此,如何提高生防菌对不良加工条件的耐受力是一项很有意义的研究工作。Usall等[47]的研究表明,在生防菌培养过程中,提高培养温度或利用氯化钠调节培养液的渗透压,都可提高生防菌对干燥过程的耐受力。该结果对其他生防菌尤其是非芽孢类生防细菌制剂的研制具有重要参考价值。
生防菌培养好后,还需经过干燥、粉碎或加入表面活性剂等其他一些加工程序方可成为制剂。有研究者研究了喷雾干燥过程中进风口温度、出风口温度以及不同雾化器对生防菌活力的影响,发现其中出风口温度的影响较大[48];笔者所在课题组研究了粉碎和添加表面活性剂对多粘类芽孢杆菌的影响,发现气流粉碎方式对活菌数影响不大,但不同表面活性剂与生防菌的相容性存在很大差别[49]。这些结果可为其他农用微生物制剂加工提供参考。 5 贮存条件对农用微生物杀菌剂性质的影响
与化学农药相比,农用微生物杀菌剂的一个主要劣势是贮存稳定性较差,货架期短。在农用微生物杀菌剂贮存稳定性方面,各国目前均未有具体的规定。Burges等[50]认为,微生物农药的货架期应不小于18个月,但其并未对货架期进行准确的定义,即并未界定活菌损失多少时为货架期。在货架期测定方面,加速贮存试验可在较短时间内对化学农药的货架稳定性进行考察,近年来,这种方法在微生物制剂研究领域已有报道。如Abe等[51]和Lalloo等[52]的研究结果表明,生防菌的存活与制剂含水量、温度及时间之间具有一定的关系,据此建立模型则可以预测生防菌在特定条件下的存活率或半衰期。通过Lalloo建立的模型,预测室温中蜡样芽孢杆菌Bacillus cereus的半衰期为5年,与试验测定值相近。除温度以外,Hernndez等[53]的研究还表明,真空保存更有利于生防菌微变冢村氏菌Tsukamurella paurometabola C-924的存活。以上研究结果表明,对一些不稳定的革兰氏阴性菌或酵母菌,应尽量选择相对低温、低含水量及真空状态进行保存。由于芽孢杆菌的芽孢对不利环境有极强的抵抗力,因此芽孢杆菌的保存相对比较容易。上述报道为预测农用微生物杀菌剂的货架期提供了很好的参考。 6 田间环境条件对农用微生物杀菌剂防效的影响
农用微生物杀菌剂的防治效果不仅与生防菌的活菌数、活力及剂型种类、生产条件和贮存条件有关,跟田间使用时的环境条件也有很大关系,生防菌在田间环境中的定殖、生长很容易受到紫外光辐射、化学农药、水分、pH和营养状况等因素的影响。田间环境中的紫外光辐射对生防菌具有很强的杀伤力[54, 55]。研究表明,有些染料可以减轻紫外光对生防微生物的损伤[56, 57, 58],因此可用作农用微生物制剂的紫外光保护剂。但紫外光保护剂的保护作用有限,而且其本身对植物和动物具有潜在危害。将生防微生物制成微囊也可以保护其免受紫外光损伤[59],但制剂成本的增加不利于产品的推广和商业化,而且微囊仅适用于微生物杀虫剂,不适用于微生物杀菌剂,因为囊壁的包覆作用会减少生防菌与病原菌接触的机会。有研究表明,微生物中的黑色素可减弱紫外光辐射的危害[60, 61],通过基因工程构建表达黑色素的苏云金芽孢杆菌,发现其对紫外光的抵抗能力明显强于野生菌株[62]。因此,从自然界或微生物自身寻求天然的“紫外光保护助剂”应是较为长远的策略。笔者所在课题组研究发现,生防菌多粘类芽孢杆菌胞外多糖对该菌具有紫外光保护和热保护功能[63],该结果为进一步研究开发天然“紫外光保护助剂”奠定了基础。
化学农药是另一种对农用微生物杀菌剂防效具有重要影响的田间因素,但却常常被农药使用者忽略。对于任何一种病害,作物种植者都不会仅使用某一类农药,相关知识的欠缺和急于治疗作物病害的心情使得他们通常也不会考虑菌药混用对生防菌的影响,因此在实际生产中,农用微生物杀菌剂在很多情况下会不可避免地与化学农药发生客观上的混用,这种状况在我国可能更为普遍。有研究表明,化学农药对农用微生物杀菌剂的防效存在不利影响[64]。针对这种情况,一是需要注意确保实验室的平板拮抗(化学农药对生防菌的拮抗)试验结果与田间试验结果的一致性——在很大程度上,实验室的平板试验不能代替田间试验;二是要加强对农药使用者的专业技术培训,使他们充分认识到农药不当混用的危害。当然,并非所有的化学农药均对生防菌有害,有些化学农药不仅无害,甚至还可以提高生防菌的防效,起到协同抗病的作用,如井冈霉素对蜡质芽孢杆菌抑制作用很弱[65],将两者混配后对稻曲病具有很好的防效[66]。因此,对化学农药与农用微生物杀菌剂的相容性还需进行广泛深入的研究,尤其是有关田间药效试验方面的研究亟待加强。
在农用微生物杀菌剂制备过程中,生防菌一般在营养丰富及环境适宜的条件下生长,然而,当产品应用于田间时,植物表面或根部的水分、pH、盐度和营养状况等很可能并不适合该生防菌的生长,因此,改变这些条件或通过“训练”提高生防菌的适应能力可提高其防治效果。Khan等[67]报道,向制剂中添加糖蜜作为营养成分,可提高生防菌枯草芽孢杆菌 Bacillus subtilis 在田间环境中的定殖能力。Verhaar等[68]报道,向制剂中添加花生油可提高生防菌蜡蚧轮枝菌Verticillium lecanii对叶片表面湿度的依赖性,并提高其对黄瓜灰霉病的防治效果。还有些生防菌在高盐、高渗透压的生长条件下会积累一些抗渗透压物质,如海藻糖和氨基酸等,从而提高生防菌在干燥或低相对湿度下对叶部病害或采后果实病害的防治能力[69, 70]。然而,目前尚未见通过对生防菌的“训练”提高其在土壤中存活能力和生防效果的报道,而这方面研究对提高微生物杀菌剂防治作物土传病害的药效具有重要意义。 7 总结与展望
目前,我国农用微生物杀菌剂的主要剂型为可湿性粉剂,今后应大力发展水分散粒剂和悬浮剂等环保剂型,尤其是以植物油或水为介质的液态制剂,以实现降低成本且对环境友好的目的。
农用微生物杀菌剂剂型加工存在的主要问题是缺乏统一和标准化的质量控制体系,不重视生防菌培养技术、培养液特性(特别是表面张力、黏度、流变学特性、活性化合物含量、生防菌状态等)、生防菌与载体及其他助剂的生物相容性、培养液与载体及助剂的混合过程、加工工艺优化等应用基础研究,导致剂型研究的新颖性不强,产品价格偏高并且田间应用后适应能力差。今后应在加强上述研究的同时,加强相关质量控制体系的建立,如采用一定的模型准确评价制剂的防效,而不是简单用活菌数评价;重视基础性研究,如生防菌在植物油或水中的休眠状态、复苏能力、活性化合物及生防菌在载体中的吸附和解析特性等,为其液态或其他剂型的开发奠定基础;深入研究田间不同环境因素对制剂中生防菌定殖和防效的影响规律,综合考虑防治对象的发病规律、栽培技术、土壤特性、使用成本及微生物杀菌剂的产品特性,开发出简单实用的田间应用技术,以使微生物制剂的田间防效更加稳定。
| [1] | 杨丽荣, 全鑫, 刘玉霞, 等. 农用微生物杀菌剂研究进展[J]. 河南农业科学, 2009(9): 131-134. YANG Lirong, QUAN Xin, LIU Yuxia, et al. Research progress of agricultural microbial pesticides[J]. J Henan Agric Sci, 2009(9): 131-134. (in Chinese) |
| [2] | 邱德文. 生物农药研究进展与未来展望[J]. 植物保护, 2013, 39(5): 81-89. QIU Dewen. Research progress and prospect of bio-pesticides[J]. Plant Prot, 2013, 39(5): 81-89. (in Chinese) |
| [3] | 中华人民共和国农业部农药检定所. 中国农药信息网有效成分查询[DB/OL].[2014-2-27]. http://www.chinapesticide.gov.cn/ The People's Republic of China Ministry of Agriculture Pesticide Verification. The effective components query on Chinese pesticide information network[DB/OL].[2014-2-27]. http://www.chinapesticide.gov.cn/ (in Chinese) |
| [4] | United States Environmental Protection Agency. Office of pesticide programs[DB/OL].[2014-2-27]. http://www.epa.gov/pesticides/biopesticides/ingredients/ |
| [5] | MELIN P, HÅKANSSON S, SCHNÜRER J. Optimisation and comparison of liquid and dry formulations of the biocontrol yeast Pichia anomala J121[J]. Appl Microbiol Biotechnol, 2007, 73(5): 1008-1016. |
| [6] | TRIVEDI P, PANDEY A. Plant growth promotion abilities and formulation of Bacillus megaterium strain B 388 (MTCC6521) isolated from a temperate Himalayan location[J]. Indian J Microbiol, 2008, 48(3): 342-347. |
| [7] | SRINIVASAN K, MATHIVANAN N. Biological control of sunflower necrosis virus disease with powder and liquid formulations of plant growth promoting microbial consortia under field conditions[J]. Biol Control, 2009, 51(3): 395-402. |
| [8] | SALLAM N, ABD ELRAZIK A A, HASSAN M, et al. Powder formulations of Bacillus subtilis, Trichoderma spp and Coniothyrium minitans for biocontrol of onion white rot[J]. Arch Phytopathol Plant Prot, 2009, 42(2): 142-147. |
| [9] | NAYAKA S C, SHANKAR A C U, REDDY M S, et al. Control of Fusarium verticillioides, cause of ear rot of maize, by Pseudomonas fluorescens[J]. Pest Manag Sci, 2009, 65(7): 769-775. |
| [10] | ARDAKANI S S, HEYDARI A, KHORASANI N, et al. Development of new bioformulations of Pseudomonas fluorescens and evaluation of these products against damping-off of conton seedlings[J]. J Plant Pathol, 2010, 92(1): 83-88. |
| [11] | RAJAPPAN K, VIDHYASEKARAN P, SETHURAMAN K, et al. Development of powder and capsule formulations of Pseudomonas fluorescens strain Pf-1 for control of banana wilt[J]. Zeitschrift Fur Pflanzenkrankheiten Und Pflanzenschutz, 2002, 109(1): 80-87. |
| [12] | VIDHYASEKARAN P, SETHURAMAN K, RAJAPPAN K, et al. Powder formulations of Pseudomonas fluorescens to control pigeonpea wilt[J]. Biol Control, 1997, 8(3): 166-171. |
| [13] | JAYARAJ J, RADHAKRISHNAN N V, KANNAN R, et al. Development of new formulations of Bacillus subtilis for management of tomato damping-off caused by Pythium aphanidermatum[J]. Biocontrol Sci Technol, 2005, 15(1): 55-65. |
| [14] | JAYARAJ J, PARTHASARATHI T, RADHAKRISHNAN N V. Characterization of a Pseudomonas fluorescens strain from tomato rhizosphere and its use for integrated management of tomato damping-off[J]. Biocontrol, 2007, 52(5): 683-702. |
| [15] | BORA T, ÖZAKTAN H, GÖRE E, et al. Biological control of Fusarium oxysporum f. sp melonis by wettable powder formulations of the two strains of Pseudomonas putida [J]. J Phytopathol, 2004, 152(8-9): 471-475. |
| [16] | DAS K, MUKHERJEE A K. Assessment of mosquito larvicidal potency of cyclic lipopeptides produced by Bacillus subtilis strains[J]. Acta Tropica, 2006, 97(2): 168-173. |
| [17] | LI S, JOCHUM C C, YU F, et al. An antibiotic complex from Lysobacter enzymogenes strain C 3: antimicrobial activity and role in plant disease control[J]. Phytopathology, 2008, 98(6): 695-701. |
| [18] | KIM Y S, KIM H M, CHANG C, et al. Biological evaluation of neopeptins isolated from a Streptomyces strain[J]. Pest Manag Sci, 2007, 63(12): 1208-1214. |
| [19] | 李青, 吴继星, 谢天健, 等. 苏云金芽孢杆菌GC-91发酵上清液的增效作用[J]. 中国生物防治, 1997, 13(4): 166-168. LI Qing, WU Jixing, XIE Tianjian, et al. Synergism of Bacillus thuringiensis GC-91 fermentation supernatant[J]. Chinese J Biol Control, 1997, 13(4): 166-168. (in Chinese) |
| [20] | 王敏, 杨秀荣, 骆健美, 等. 防治土传病害的枯草芽孢杆菌制剂及其制备方法: CN, 200810153180.1[P]. 2008-11-21. WANG Min, YANG Xiurong, LUO Jianmei, et al. Bacillus subtilis preparation and its preparing method of controlling soil borne disease: CN, 200810153180.1[P]. 2008-11-21. (in Chinese) |
| [21] | 杨华, 纪明山, 李广旭, 等. 防治苹果轮纹病的微生物农药: CN, 101578998.3[P]. 2009-06-16. YANG Hua, JI Mingshan, LI Guangxu, et al. Control of apple ring rot of microbial pesticides: CN, 101578998.3[P]. 2009-06-16. (in Chinese) |
| [22] | 辛玉成. 一种枯草芽孢杆菌菌株、制法、制剂及应用: CN, 98124889.6[P]. 1998-12-03. XIN Yucheng. A Bacillus subtilis strain, preparation method, formulation and application: CN, 98124889.6[P]. 1998-12-03. (in Chinese) |
| [23] | 张敏, 彭化贤, 邓新平, 等. 5亿活孢子/克木霉菌可湿性粉剂的研制[J]. 西南农业学报, 2008, 21(3): 675-679. ZHANG Min, PENG Huaxian, DENG Xinping, et al. Research on the wettable powder of Trichoderma spp. with each gram 500 million living conidia[J]. Southwest China J Agric Sci, 2008, 21(3): 675-679. (in Chinese) |
| [24] | CHIOU A L, WU W S. Formulation of Bacillus amyloliquefaciens B190 for control of lily grey mould (Botrytis elliptica)[J]. J Phytopathol, 2003, 151(1): 13-18. |
| [25] | 姬广海, 张世光, 魏兰芳, 等. 一种防治植物细菌病害的生物制剂及其应用: CN, 200510011078[P]. 2005-10-21. JI Guanghai, ZHANG Shiguang, WEI Lanfang, et al. Biological preparation for preventing bacterial plant diseases and its application: CN, 200510011078[P]. 2005-10-21. (in Chinese) |
| [26] | GUIJARRO B, MELGAREJO P, TORRES R, et al. Effects of different biological formulations of Penicillium frequentans on brown rot of peaches[J]. Biol Control, 2007, 42(1): 86-96. |
| [27] | LEE J P, LEE S W, KIM C S, et al. Evaluation of formulations of Bacillus licheniformis for the biological control of tomato gray mold caused by Botrytis cinerea[J]. Biol Control, 2006, 37(3): 329-337. |
| [28] | 马平, 李社增, 陈新华, 等. 防治棉花黄萎病的菌株及其菌剂的制备方法: CN, 200310109619.8[P]. 2003-10-17. MA Ping, LI Shezheng, CHEN Xinhua, et al. Biological control of cotton Verticillium wilt strains and preparation methods: CN, 200310109619.8[P]. 2003-10-17 (in Chinese) |
| [29] | 王勇, 王万立, 刘春艳, 等. 生防绿色木霉菌可湿性粉剂的研究[C]//第四届全国绿色环保农药新技术、新产品交流会暨第三届生物农药研讨会论文集. 北京: 中国植物保护学会生物入侵分会, 2006: 252-255. WANG Yong, WANG Wanli, LIU Chunyan, et al. Study of Trichoderma viride wettable powder[C]//The fourth national pesticide green new technology, new product and the third biological pesticides seminar. Beijing: The Sub-Society for Biological Invasions, China Society of Plant Protection, 2006: 252-255. (in Chinese) |
| [30] | 李元广, 王伟, 沈国敏, 等. 防治植物细菌性青枯病的微生物制剂和方法及其用途: CN, 02151019[P]. 2002-12-04. LI Yuanguang, WANG Wei, SHEN Guomin, et al. Control of bacterial wilt plant microbial preparation and method and its use: CN, 02151019[P]. 2002-12-04. (in Chinese) |
| [31] | 魏鸿刚, 李淑兰. 防治作物青枯病和枯萎病的微生物农药——0.1亿cfu/g多粘类芽孢杆菌细粒剂[J]. 世界农药, 2008, 30(1): 52-53. WEI Honggang, LI Shulan. Microbial pesticide to control the plant bacterial wilt and blight — 107 cfu/g Paenibacillus polymyxa fine granule[J]. World Pest, 2008, 30(1): 52-53. (in Chinese) |
| [32] | 罗小华, 肖明徽, 胡德广, 等. 生物农药——康地蕾得防治青枯病初报[J]. 江西植保, 2006, 29(1): 38-40. LUO Xiaohua, XIAO Minghui, HU Deguang, et al. Effect of biological pesticide—kangdileide on bacterial wilt[J]. Jiangxi Plant Prot, 2006, 29(1): 38-40. (in Chinese) |
| [33] | 李畅方, 罗时华, 何强, 等. 康地蕾得防治番茄青枯病药效试验[J]. 广东农业科学, 2003(6): 38-39. LI Changfang, LUO Shihua, HE Qiang, et al. Control of tomato bacterial wilt with kangdileide[J]. Guangdong Agric Sci, 2003(6): 38-39. (in Chinese) |
| [34] | 刘高松, 孙鹏, 任鸿雁, 等. 康地蕾得防治烟草青枯病田间药效试验[J]. 现代农业科技, 2009(20): 165-173. LIU Gaosong, SUN Peng, REN Hongyan, et al. Control experiment of Kangdileide against tobacco bacterial wilt[J]. Modern Agric Sci Technol, 2009(20): 165-173. (in Chinese) |
| [35] | 赵新海, 钟丽娟, 徐冲, 等. 康地蕾得对黄瓜枯萎病的室内毒力测定及田间防效试验[J]. 农药, 2008, 47(9): 696-698. ZHAO Xinhai, ZHONG Lijuan, XU Chong, et al. Toxicological test and field efficiency trials of kangdeleide against Cucumber fusarium wilt[J]. Agrochemicals, 2008, 47(9): 696-698. (in Chinese) |
| [36] | 赵新海, 钟丽娟, 徐冲, 等. 康地蕾得对百合镰刀菌枯萎病的室内毒力测定及防治试验[J]. 安徽农业科学, 2008, 36(22): 9613-9614. ZHAO Xinhai, ZHONG Lijuan, XU Chong, et al. Toxicity test in room and control experiment of kangdeleide against lily Fusarium wilt[J]. J Anhui Agric Sci, 2008, 36(22): 9613-9614. (in Chinese) |
| [37] | 张敏. 5亿活孢子/克木霉菌水分散粒剂的研制[D]. 重庆: 西南大学, 2008. ZHANG Min. Research on the water dispersible granules of trichoderma with each gram 500 million living conidia[D]. Chongqing: Southwest University, 2008. (in Chinese) |
| [38] | 牛赡光, 周峰, 王清海, 等. 一种枯草芽孢杆菌Bs-03可湿性粉剂和水分散粒剂: CN, 201010108073.4[P]. 2010-02-10. NIU Shanguang, ZHOU Feng, WANG Qinghai, et al. A Bacillus subtilis Bs-03 wettable powder and a water dispersible granule: CN, 201010108073.4[P]. 2010-02-10. (in Chinese) |
| [39] | 朱昌雄, 丁振华, 蒋细良, 等. 微生物农药剂型研究发展趋势[J]. 现代化工, 2003, 23(3): 4-8. ZHU Changxiong, DING Zhenhua, JIANG Xiliang, et al. Research and development trends of microbial pesticide formulations[J]. Modern Chem Ind, 2003, 23(3): 4-8. (in Chinese) |
| [40] | 陈振民, 李青, 刘华梅, 等. 5千亿活芽胞/克枯草芽胞杆菌原粉活芽胞数的检测方法: CN, 200910062965[P]. 2009-07-03. CHEN Zhenmin, LI Qing, LIU Huamei, et al. The live spores number detection method of Bacillus subtilis technical powder: CN, 200910062965[P]. 2009-07-03 (in Chinese) |
| [41] | ABADIAS M, TEIXID N, USALL J, et al. Survival of the postharvest biocontrol yeast Candida sake CPA-1 after dehydration by spray-drying[J]. Bio Sci Technol, 2005, 15(8): 835-846. |
| [42] | COMAS-RIU J, VIVES-REGO J. Cytometric monitoring of growth, sporogenesis and spore cell sorting in Paenibacillus polymyxa (formerly Bacillus polymyxa)[J]. J Appl Microbiol, 2002, 92(3): 475-481. |
| [43] | LUO J P, LIU X H, TIAN Q, et al. Disposable bioluminescence-based biosensor for detection of bacterial count in food[J]. Anal Biochem, 2009, 394(1): 1-6. |
| [44] | DELGADO-VISCOGLIOSI P, SOLIGNAC L, DELATTRE J M. Viability PCR, a culture-independent method for rapid and selective quantification of viable Legionella pneumophila cells in environmental water samples[J]. Appl Environ Microbiol, 2009, 75(11): 3502-3512. |
| [45] | 曹凤明. 芽孢杆菌PCR鉴定方法的建立和应用[D]. 北京: 中国农业科学院, 2007. CAO Fengming. Establishment and application of PCR identification method for Bacillus bacteria[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007. (in Chinese) |
| [46] | 李岳桦. 一种定量分析双歧杆菌的新方法[D]. 郑州: 河南农业大学, 2008. LI Yuehua. New method for quantitative analysis of Bifidobacterium[D]. Zhengzhou: Henan Agriculture University, 2008. (in Chinese) |
| [47] | USALL J, TEIXIDO N, ABADIAS M, et al. Improving formulation of biocontrol agents manipulating production process[C]//Postharvest Pathology, Plant Pathology in the 21st Century. Vol. 2. Netherlands: Springer, 2010: 149-169. |
| [48] | PRABAKARAN G, HOTI S L. Optimization of spray-drying conditions for the large-scale preparation of Bacillus thuringiensis var. israelensis after downstream processing[J]. Biotechnol Bioengin, 2008, 100(1): 103-107. |
| [49] | LIU Zhenhua, WEI Honggang, LI Yuanguang, et al. Effects of milling and surfactants on suspensibility and spore viability in Paenibacillus polymyxa powder formulations[J]. Biocontrol Sci Technol, 2011, 21(9): 1103-1116. |
| [50] | BURGES H D. Formulation of Microbial Biopesticides[M]. Dordrecht: Kluwer Academic Publishers, 1998: 98-99. |
| [51] | ABE F, MIYAUCHI H, UCHIJIMA A, et al. Effects of storage temperature and water activity on the survival of bifidobacteria in powder form[J]. Int J Dairy Technol, 2009, 62(2): 234-239. |
| [52] | LALLOO R, MAHARAJH D, GORGENS J, et al. A downstream process for production of a viable and stable Bacillus cereus aquaculture biological agent[J]. Appl Microbiol Biotechnol, 2010, 86(2): 499-508. |
| [53] | HERNÁNDEZ A, WEEKERS F, MENA J, et al. Culture and spray-drying of Tsukamurella paurometabola C-924: stability of formulated powders[J]. Biotechnol Lett, 2007, 29(11): 1723-1728. |
| [54] | VILLAMIZAR L, ESPINEL C, COTES A M. Effect of ultraviolet radiation on the insecticidal activity of a Spodoptera frugiperda (Lepidoptera: Noctuidae) nucleopolyhedrovirus[J]. Revista Colombiana De Entomologia, 2009, 35(2): 116-121. |
| [55] | MANASHEROB R, BEN D E, WANG X Q, et al. Protection from UV-B damage of mosquito larvicidal toxins from Bacillus thuringiensis subsp. israelensis expressed in anabaena PCC7120[J]. Current Microbiol, 2002, 45(3): 217-220. |
| [56] | HADAPAD A B, HIRE R S, VIJAYALAKSHMI N, et al. UV protectants for the biopesticide based on Bacillus sphaericus Neide and their role in protecting the binary toxins from UV radiation[J]. J Invertebr Pathol, 2009, 100(3): 147-152. |
| [57] | INGLIS G D, GOETTEL M S, JOHNSON D L. Influence of ultraviolet-light protectants on persistence of the entomopathogenic fungus, Beauveria bassiana[J]. Biol Control, 1995, 5(4): 581-590. |
| [58] | COHEN E, JOSEPH T. Photostabilization of Beauveria bassiana conidia using anionic dyes[J]. Appl Clay Sci, 2009, 42(3-4): 569-574. |
| [59] | VILLAMIZAR L, BARRERA G, COTES A M, et al. Eudragit S100 microparticles containing Spodoptera frugiperda nucleopolyehedrovirus: physicochemical characterization, photostability and in vitro virus release[J]. J Microencapsul, 2010, 27(4): 314-324. |
| [60] | CHEN Y H, DENG Y Y, WANG J H, et al. Characterization of melanin produced by a wild-type strain of Bacillus thuringiensis[J]. J Gene Appl Microbiol, 2004, 50(4): 183-188. |
| [61] | WAN X, LIU H M, LIAO Y, et al. Isolation of a novel strain of aeromonas media producing high levels of DOPA-melanin and assessment of the photoprotective role of the melanin in bioinsecticide applications[J]. J Appl Microbiol, 2007, 103(6): 2533-2541. |
| [62] | ZHANG J T, YAN J P, ZHENG D S, et al. Expression of mel gene improves the UV resistance of Bacillus thuringiensis[J]. J Appl Microbiol, 2008, 105(1): 151-157. |
| [63] | 刘振华, 魏鸿刚, 李元广, 等. 多粘类芽胞杆菌胞外多糖在微生物农药剂型中的功能研究[J]. 农药学学报, 2011, 13(6): 603 -607. LIU Zhenhua, WEI Honggang, LI Yuanguang, et al. Function of polysaccharides from Paenibacillus polymyxa in microbial pesticide formulation[J]. Chin J Pest Sci, 2011, 13(6): 603-607. (in Chinese) |
| [64] | KROPP B R, DARROW H. The effect of surfactants and some herbicides on teliospore viability in Puccinia thlaspeos (Schub.)[J]. Crop Prot, 2006, 25(4): 369-374. |
| [65] | 严清平, 袁善奎, 朱春雨, 等. 井冈霉素对3种生防芽孢杆菌的生长抑制活性[J]. 农药科学与管理, 2009, 30(5): 39-44. YAN Qingping, YUAN Shankui, ZHU Chunyu, et al. Effects of Jinggangmycin on 3 species of Bacillus [J]. Pest Sci Adm, 2009, 30(5): 39-44. (in Chinese) |
| [66] | 胡定汉, 龚德祥, 罗文辉, 等. 10%井冈霉素蜡质芽孢杆菌防治稻曲病试验[J]. 湖北植保, 2009(3): 46-47. HU Dinghan, GONG Dexiang, LUO Wenhui, et al. Effects of 10% Jinggangmycin and Bacillus cereus on rice false smut[J]. Hubei Plant Prot, 2009(3): 46-47. (in Chinese) |
| [67] | KHAN M R, MAJID S, MOHIDIN F A, et al. A new bioprocess to produce low cost powder formulations of biocontrol bacteria and fungi to control fusarial wilt and root-knot nematode of pulses[J]. Biol Control, 2011, 59(2): 130-140. |
| [68] | VERHAAR M A, HIJWEGEN T, ZADOKS J C. Improvement of the efficacy of Verticillium lecanii used in biocontrol of Sphaerotheca fuliginea by addition of oil formulations[J]. Biol Control, 1999, 44(1): 73-87. |
| [69] | BONATERRA A, CABREFIGA J, CAMPS J, et al. Increasing survival and efficacy of a bacterial biocontrol agent of fire blight of rosaceous plants by means of osmoadaptation[J]. FEMS Microbiol Ecol, 2007, 61(1): 185-195. |
| [70] | BONATERRA A, CAMPS J, MONTESINOS E. Osmotically induced trehalose and glycine betaine accumulation improves tolerance to desiccation, survival and efficacy of the postharvest biocontrol agent Pantoea agglomerans EPS125[J]. FEMS Microbiol Lett, 2005, 250(1): 1-8. |
| [71] | BONATERRA A, CAMPS J, MONTESINOS E. Osmotically induced trehalose and glycine betaine accumulation improves tolerance to desiccation, survival and efficacy of the postharvest biocontrol agent Pantoea agglomerans EPS125[J]. FEMS Microbiol Lett, 2005, 250(1): 1-8. |
 2014, Vol. 16
2014, Vol. 16


