复方陆朴微乳剂是湖北省药用植物研发中心研制的新型植物源农药,对菜青虫、小菜蛾、亚洲玉米螟、棉铃虫等多种农作物害虫均具有良好的杀灭及趋避作用,尤其是针对烟草赤星病的防治效果显著[1]。该方融入了传统中药厚朴中具抗病毒、抑菌活性的厚朴酚(magnolol)与和厚朴酚(honokiol)等活性成分(结构式见Scheme 1),经提取、纯化、组方配制成微乳剂[2],并与商陆、苍耳子等中药中有效成分联用以发挥协同增效作用[3],具有杀虫、抗病毒、抑菌和激素调节等活性[4];其工艺稳定可行。为更全面、有效地控制该微乳剂的内在质量,本研究建立了高效液相色谱法(HPLC)测定复方陆朴微乳剂中厚朴酚与和厚朴酚含量的方法,旨在为该制剂的质量标准的建立提供科学依据。
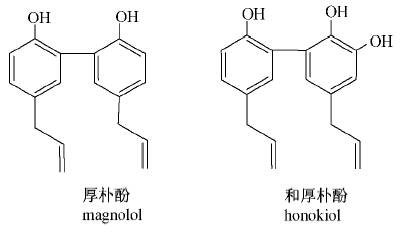 | Scheme 1 |
DIONEX Ultimate 3000分析型液相色谱仪(戴安中国有限公司),Starsorius BSI型分析天平(北京赛多利斯天平有限公司),KQ-250E型超声波清洗器(昆山市超声仪器有限公司);厚朴酚(magnolol)与和厚朴酚(honokiol)标准品(中国药品生物制品检定所,批号分别为:0729-200107、0730-9204,纯度均大于98%),复方陆朴微乳剂(湖北省药用植物研发中心自制,批号分别为:100903、100914、100921、100924、100929,以厚朴酚与和厚朴酚总量计不得少于3.14 mg/mL),陆朴微乳剂阴性对照微乳(湖北省药用植物研发中心自制),甲醇为色谱纯,其他试剂均为分析纯,水为三蒸水。
1.2 方法 1.2.1 色谱条件ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:0.5%磷酸(A)-甲醇(B)溶液;流速0.7 mL/min;柱温30 ℃;检测波长294 nm,进样量10 μL,理论板数按厚朴酚峰计算应不低于3 800。梯度洗脱程序见表 1。
| 表 1 流动相梯度洗脱程序 Table 1 Gradient elution program of mobile phase |
分别准确称取厚朴酚标准品0.37 mg、和厚朴酚标准品0.76 mg,置于2只10 mL容量瓶中;分别加入甲醇溶解、定容,配制成质量浓度为0.037 mg/mL的厚朴酚及0.076 mg/mL的和厚朴酚标准储备溶液,再用甲醇稀释成质量浓度分别为0.074、0.148、0.296、0.370、0.518 μg/mL的厚朴酚系列标准溶液及0.152、0.304、0.608、0.760、1.064 μg/mL的和厚朴酚系列标准溶液。
1.2.2.2 供试品溶液的制备分别量取4 mL各批号的复方陆朴微乳剂加入50 mL具塞锥形瓶中,于85 ℃水浴下蒸干溶剂后,加入25 mL甲醇密塞、摇匀后称重;超声处理30 min,冷却至室温后称重并用甲醇补足超声处理过程损失的质量,过滤;准确量取5 mL滤液于25 mL 容量瓶中,用甲醇稀释并定容至刻度,密塞、摇匀,配制成供试品溶液,临用前以0.45 μm微孔滤膜过滤,备用。
1.2.2.3 阴性对照溶液的制备按确定的处方和工艺[5],将微乳剂制成不含厚朴提取物的微乳剂,参照1.2.2.2节供试品溶液的制备方法,配制阴性对照溶液。
1.2.3 系统适用性试验分别准确量取10 μL供试品溶液、阴性对照溶液、0.296 μg/mL厚朴酚标准溶液及0.608 μg/mL和厚朴酚标准溶液,按1.2.1节的色谱条件分析。
1.2.4 方法学考察 1.2.4.1 标准曲线的绘制分别准确量取厚朴酚0.074~0.518 μg/mL、和厚朴酚0.152~1.064 μg/mL系列溶液,按1.2.1节的色谱条件分析,分别以厚朴酚、和厚朴酚的质量浓度为横坐标、以相应的峰面积为纵坐标绘制标准曲线。
1.2.4.2 进样精密度试验分别准确量取10 μL厚朴酚与和厚朴酚标准溶液,按1.2.1节的色谱条件分析,重复6次,记录厚朴酚与和厚朴酚的峰面积。
1.2.4.3 稳定性试验取同一供试品溶液,按1.2.1节色谱条件分析,分别于0、3、6、9、12、24 h进样测定,计算厚朴酚与和厚朴酚峰面积的相对标准偏差(RSD)。
1.2.4.4 重现性试验取同一批号样品5份,每份4 mL,参照1.2.2.2节供试品溶液的制备,依次配制供试品5份,准确量取10 μL,按1.2.1节的色谱条件测定,分别计算厚朴酚与和厚朴酚含量的RSD。
1.2.4.5 添加回收试验准确量取已知含量的样品6份,分别添加厚朴酚标准储备溶液(0.037 mg/mL)与和厚朴酚标准储备溶液(0.076 mg/mL),添加水平依次为:0.05、0.5和1 mg/mL,参照1.2.2.2节制备供试品溶液6份,按1.2.1节的色谱条件测定,每个水平重复测定3次,计算厚朴酚与和厚朴酚的添加回收率。
1.2.5 样品中厚朴酚与和厚朴酚含量的测定
分别称取各批号陆朴微乳剂,参照1.2.2.2节制备各供试品溶液,按照1.2.1节的色谱条件测定,每批样品平行测定3份,取其平均值。
2 结果与分析
结果表明:厚朴酚峰与和厚朴酚峰与其相邻峰分离度良好、无其他杂质峰干扰,阴性对照微乳剂对厚朴酚与和厚朴酚色谱峰的分离无干扰。典型图谱见图 1。
2.2 检测方法的评价 2.2.1 线性关系将标准系列溶液每个浓度分别进样3次,取峰面积的平均值作为纵坐标,以标准品的质量浓度为横坐标绘制标准曲线,分别得厚朴酚、和厚朴酚回归方程: y=41.713 6x+0.458 0,r=0.999 7; y=52.135 8x+0.055,r=0.999 8。试验结果表明:厚朴酚在0.074~0.518 μg/mL、和厚朴酚在0.152~1.064μg/mL范围内呈良好的线性关系。
2.2.2 稳定性试验经计算厚朴酚与和厚朴酚峰面积的RSD分别为1.97%和1.20%,表明供试品溶液在24 h内稳定。
2.2.3 重现性试验厚朴酚与和厚朴酚含量的RSD分别为0.98%和0.98%,表明该测定方法重现性良好。
2.2.4 方法的准确度与精密度、检测限与定量限
进样精密度的试验结果表明,厚朴酚与和厚朴酚峰面积的RSD分别为1.23%和0.85%,表明仪器精密度良好。
添加回收结果(见表 2)表明:复方陆朴微乳剂中厚朴酚与和厚朴酚的平均添加回收率分别为98.8%~100.2%(RSD=0.7%~1.0%)和98.5~99.5%(RSD=0.9%~1.1%),均符合含量测定的要求。
| 表 2 添加回收试验结果 (n=6) Table 2 Recovery test results(n=6) |
 | 图 1 标准品、阴性对照品及供试品溶液的HPLC色谱图 Fig. 1 The HPLC chromatograms of standard solution and negative control solution and test solution
1.和厚朴酚(honokiol); 2.厚朴酚(magnolol)。
a. 和厚朴酚标准品溶液(0.608 μg/mL);b. 厚朴酚标准品溶液(0.296 μg/mL); c. 复方陆朴微乳剂供试品溶液;d. 复方陆朴微乳剂阴性对照溶液。 a. honokiol standard solution(0.608 μg/mL);b. magnolol standard solution(0.296 μg/mL); c. The test solution of Lupo compound microemulsion formulation; d. The negative control solution of Lupo compound microemulsion formulation. |
在所选定的检测条件下,仪器对厚朴酚、和厚朴酚的最小检出量(LOD)分别为3.80和2.47 ng;在复方陆朴微乳剂中厚朴酚与和厚朴酚的最低检测浓度(LOQ)分别为12.67×10-3 mg/mL和8.22×10-3 mg/mL。
2.3 样品中厚朴酚与和厚朴酚含量结果(见表 3)表明:5个不同批次的复方陆朴微乳剂中厚朴酚、和厚朴酚的含量(质量浓度)范围分别为 2.518 4~2.919 6和1.128 2~1.175 2 mg/mL,各批次中两者总含量均大于3.14 mg/mL;相同工艺条件下制得的不同批次的复方陆朴微乳剂中厚朴酚与和厚朴酚平均含量存在一定差别,可能是不同批次的厚朴原料产地来源不同所致。
2.4 样品前处理条件的选择厚朴酚与和厚朴酚均为木质素类酚酸性化合物,结构上互为同分异构体,两者峰分离时的保留时间较接近,且复方陆朴微乳剂组成中含有农乳A(苯乙烯基苯基聚氧乙烯醚)、苍耳子(含大量油脂类成分)、DBS-Ca(十二烷基苯磺酸钙)等。其中,农乳A、DBS-Ca均为亲水亲油型的表面活性剂,与苍耳子油中的脂溶性杂质共同干扰厚朴酚与和厚朴酚的分离是影响本试验准确定量的主要因素之一。试验中先后采用了甲醇、乙酸乙酯和石油醚等不同溶剂进行超声提取,发现采用乙酸乙酯超声提取时提取效率低,色谱图中峰个数较少,目标成分厚朴酚与和厚朴酚的色谱峰面积、峰高均较小,影响定量结果的准确性;而采用石油醚超声提取时虽然色谱图的峰个数较多,但许多脂溶性杂质被同时提取出来,干扰厚朴酚与和厚朴酚色谱峰分离,严重影响定量结果的准确性;采用甲醇超声处理,色谱峰中目标成分及其相邻峰完全达到基线分离,杂质峰对复方中厚朴酚与和厚朴酚的含量测定无干扰,故最终选用甲醇作为提取溶剂采用超声提取法来制备供试品溶液。
2.5 色谱条件的优化 2.5.1 检测波长的选择预试验以供试品在 200~400 nm范围内进行波长扫描,发现供试品在 294 nm波长处有最大吸收,与《中国药典》(2010版一部)中厚朴酚含量测定所推荐检测波长一致,该波长处其他杂质峰峰干扰少、基线平稳且各色谱峰峰形对称、分离度较好,故选择294 nm为复方陆朴微乳剂中厚朴酚与和厚朴酚含量的检测波长。
| 表 3 不同批次复方陆朴微乳剂中厚朴酚与和厚朴酚的含量(质量浓度) Table 3 Contents of magnolol and honokiol in Lupo compound ME |
在测定厚朴酚、和厚朴酚含量时,在文献[6, 7, 8]中,其流动相均采用甲醇-水系统,在本研究的预试验中,以甲醇-水、乙腈-水和0.5%磷酸-乙腈为流动相对供试品进行了洗脱效果考察,发现由甲醇-水等度洗脱时,洗脱时间虽可降至40 min,但各色谱峰的保留时间集中在15~30 min之间,目标成分峰难以辨认;用乙腈-水系统进行等度洗脱时分离效果也较差,且洗脱时间较长;0.5%磷酸-乙腈等流动相体系色谱峰仍有大部分未达到基线分离。
结合文献[9, 10],采用甲醇-水梯度洗脱以改善分离度,发现目标成分峰与相邻峰基本分开,但存在一定程度的拖尾和基线漂移,厚朴酚与和厚朴酚化学结构极其近似,为改善分离度,同时降低流动相的流速(由原来的1.0 mL/min降至0.70 mL/min)和柱温(由原来的35 ℃调整为30 ℃),并减缓梯度变化的速度,以及在流动相中加入了少量缓冲盐。结果表明:厚朴酚与和厚朴酚色谱峰峰形对称、基线平稳、峰分离度良好,故最终选择0.5%磷酸-甲醇梯度洗脱。 3 结论
建立了采用HPLC测定陆朴微乳剂中厚朴酚与和厚朴酚含量的方法。微乳剂样品经85 ℃水浴除去溶剂后,采用甲醇溶解,超声处理30 min、过滤,取滤液进行含量测定。该方法简便、快速、准确、灵敏,可作为复方陆朴微乳剂中厚朴酚与和厚朴酚含量测定的方法。同时,本研究在复方中含大量乳化剂、助乳化剂和脂溶性成分等基质干扰的条件下,以0.5%磷酸-甲醇作为流动相梯度洗脱的分离效果较好。本研究结果可为某些乳剂剂型中同时存在乳化剂和脂溶性成分干扰测定结果的情况下,如何选择适宜的流动相提供方法参考和借鉴。
| [1] | 卢金清,王琴,何冬黎,等.两种植物源农药对烟草赤星病的药效试验[J].湖北农业科学, 2011, 50(6): 1155-1157. LU Jinqing, WANG Qin, HE Dongli, et al. Control effects of two types of botanical pesticide against Aternata[J]. Hubei Agric Sci, 2011, 50(6):1155-1157. (in Chinese) |
| [2] | 冯瑾,李继遥,周学东,等.厚朴活性成分对致龋菌生长和产酸影响的体外研究[J].四川大学学报: 医学版, 2007, 38(3): 456-458. FENG Jin, LI Jiyao, ZHOU Xuedong, et al. Effects of the active compounds of M. officinalison on cariogenic bacteria[J]. J Sichuan Univ: Med Sci Ed, 2007, 38(3): 456-458.(in Chinese) |
| [3] | 周琼,魏美才,欧晓明,等.苍耳叶活性组分对害虫的拒食和忌避作用及其化学成分[J].植物资源与环境学报, 2009, 18(1): 74-79. ZHOU Qiong, WEI Meicai, OU Xiaoming, et al. Antifeedant and deterrent effect of active fractions in Xanthium sibiricum leaf against insect pests and its chemical component[J]. J Plant Res Environ, 2009, 18(1): 74-79. (in Chinese) |
| [4] | 张勇,唐方.厚朴酚药理作用的最新研究进展[J].中国中药杂志, 2012, 37(23): 3526-3530. ZHANG Yong, TANG Fang. Advance in latest studies on pharmacological effects of magnolol[J]. China Journal of Chinese Materia Medica, 2012, 37(23): 3526-3530. (in Chinese) |
| [5] | 卢金清,许家琦,何冬黎,等.植物源农药16%赤菌宁微乳剂的研制[J].湖北农业科学, 2012, 51(4): 727-730. LU Jinqing, XU Jiaqi, HE Dongli, et al. Preparation of the botanical pesticide 16% Chijunning microemulsion[J]. Hubei Agric Sci, 2012, 51(4): 727-730. (in Chinese) |
| [6] | 陈玉秀. HPLC测定整肠正气丸中和厚朴酚及厚朴酚的含量[J].中国现代中药,2013, 15(5): 410-412. CHEN Yuxiu. Determination of honokiol and magnolol in Zheng Chang Zheng Qi pills by HPLC[J]. Modern Chinese Medicine, 2013, 15(5): 410-412. (in Chinese) |
| [7] | 宋卫中,周伟,丁平.高效液相色谱法测定保济丸中厚朴酚gn 和厚朴酚的含量[J]. 河南大学学报:医学版, 2013, 32(4): 254-257. SONG Weizhong, ZHOU Wei, DING Ping, et al. The assay of magnolol and honokiol in Baojiwan medicinal materials[J]. J He nan Univ: Med Sci, 2013, 32(4): 254-257. (in Chinese) |
| [8] | 艾路,邱落,杜菁,等.高效液相色谱法测定调胃舒肝丸中厚朴酚、和厚朴酚的含量[J].中国实验方剂学杂志, 2010, 16(14): 87-88. AI Lu, QIU Luo, DU Jing, et al. The assay of magnolol and honokiol in Tiaoweishuganwan medicinal materials[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2010, 16(14): 87-88. (in Chinese) |
| [9] | 李丽,刘元艳,耿立冬,等. HPLC梯度洗脱法测定防风中4种主要成分含量[J].中国中药杂志, 2006, 31(3): 194-196. LI Li, LIU Yuanyan, GENG Lidong, et al. Determination of four components in root of Saposhnikovia divaricata by HPLC gradient elution[J]. China Journal of Chinese Materia Medica, 2006, 31(3): 194-196. (in Chinese) |
| [10] | 卢化,朱丽,何雪峰,等.多波长RP-HPLC测定烧伤灵软膏中绿原酸、厚朴酚与和厚朴酚的含量[J].湖北中医杂志, 2010, 32(12): 72-74. LU Hua, ZHU Li, HE Xuefeng, et al. Multi-wavelength RP-HPLC determination of chlorogenic acid, content magnolol and honokiol in Shaoshangling ointment[J]. Hubei Journal of Traditional Chinese Medicine, 2010, 32(12): 72-74. (in Chinese) |
 2014, Vol.16
2014, Vol.16 


