虫生真菌在维护生态环境及持续控制害虫方面所起的作用正越来越受到人们的关注[1]。白僵菌属Beauveria Vuill.是世界最常见的土壤虫生真菌[2],可用作生物杀虫剂以控制多种害虫,目前已记载的白僵菌属能寄生15个目149科共700余种昆虫和螨类[3,4,5],其中球孢白僵菌B.bassiana和布氏白僵菌B.brongniartii是应用最多的2种。近年来有研究发现,白僵菌对植物线虫也具有活性[6]。 刘丹丹等[7]报道了球孢白僵菌发酵液的杀线虫活性及有效成分的分离纯化。陈增齐等[8]研究了球孢白僵菌发酵液对番茄根结线虫病的控制效果及对防御酶活性的影响。 目前有关球孢白僵菌杀虫机理的研究报道较多,如寄生虫体[9]、产生蛋白酶和几丁质酶等水解酶[10]、菌丝在血腔中生长并产生毒素使昆虫致病[11]等等,但尚未见关于其对线虫致病机理的研究报道。
本实验室前期研究显示,多株白僵菌都对植物线虫具有毒性,并发现一种白僵菌的伴生菌也对根结线虫等有着很高的生物活性 [12,13];白僵菌菌株Snf907发酵液对甘薯茎线虫Ditylenchus destructor行为有显著的抑制作用[14],并从其发酵液中分离纯化出了杀线虫活性物质[10]。已有的一系列研究明确了白僵菌对植物线虫具有潜在的生防效果,但是其对植物线虫的作用机理是否与对昆虫的一致尚不清楚。因此,为了明确白僵菌对植物线虫的作用机理,本研究利用前期筛选获得的高毒力菌株Snef23发酵后的次生代谢产物,测定了其对南方根结线虫运动能力、体内糖和蛋白质含量以及酶活性等多项生理生化指标的影响,以期探明球孢白僵菌杀线虫的作用机理,为杀虫真菌的研究利用及生物杀线虫剂的研发奠定理论基础。
1 材料与方法 1.1 供试材料南方根结线虫Meloidogyne incognita采自辽宁省铁岭市李千户镇营盘村蔬菜大棚,以2龄幼虫(J2)供试:温室内用感病番茄(品种为L402)单卵块繁殖,挑取卵囊,以0.5% 次氯酸钠处理 3 min后用无菌水冲洗3次,于25 ℃培养箱孵化[15]。孵出的J2用蒸馏水配成浓度为2×104 条/mL的J2悬浮液,备用。
球孢白僵菌Snef23次生代谢产物制备:该菌种保存于沈阳农业大学北方线虫研究所。Snef23发酵液通过乙酸乙酯有机溶剂萃取,减压蒸馏去除有机溶剂后经0.22 μm醋酸纤维滤膜过滤,真空冷冻干燥制成固体粉末。试验时用无菌水分别配成5、15 和25 μg/mL 3个系列质量浓度,于4 ℃冰箱储存备用。
JPSJ-605溶氧测定仪及 DDSJ-308A 电导率仪,上海雷磁仪器厂;Model 680型酶标仪,美国Bio-Rad公司;NANODROP1000紫外分光光度计,NanoDrop科技公司。 1.2 线虫活动频率测定及中毒症状观察
将30条J2放入不同浓度梯度Snef23代谢产物中,处理时间分别为0.5、1、3、6、12和24 h。用清水洗涤J2后镜检观察30 s内线虫的运动次数,以每条线虫完成1个波长运动为1次运动,计算线虫的活动频率[16]。以无菌水处理为对照。于Olympus体式解剖镜和光学显微镜下观察线虫的中毒症状。 1.3 线虫呼吸强度及体液渗漏测定
参考白春明等的方法[17]。呼吸强度测定采用溶氧测定仪进行。取配制好的J2悬浮液,分别加入5、15和25 μg/mL的Snef23次生代谢产物,处理 0.5、1、3、6、12和24 h后,测定各处理J2悬浮液中线虫的呼吸强度:实际吸氧量/(mg/L)=相应对照溶液溶解氧量-线虫悬浮液溶解氧量。体液渗漏测定处理方法同上,采用电导率仪测定各处理J2悬浮液的电导率:实际电导率/(μS/cm)=线虫悬浮液电导率-相应对照溶液电导率。以不含J2悬浮液的相应处理为对照。 1.4 线虫乙酰胆碱酯酶活性、总糖及可溶性蛋白含量测定 1.4.1 线虫预处理
分别采用5、15和25 μg/mL的Snef23次生代谢产物处理J2,处理时间为6、12和24 h,于12 000 r/min下离心20 min后,收集相同处理的J2虫体,转入1.5 mL离心管中,每管20 mg,用液氮速冻,保存于-80℃超低温冰箱。以无菌水处理为对照,每个处理重复3次。
1.4.2 总糖含量测定采用蒽酮比色法[18]。将预处理后的J2置于1.5 mL离心管中,加入20 μL蒸馏水和少许石英砂,冰浴研磨成匀浆,其余按步骤加蒽酮试剂处理后用酶标仪于620 nm下测定OD值。线虫体内含糖量/(μg/mg)=[从标准曲线中查到的糖含量/(μg/mL)×样品稀释量/mL]/线虫质量/mg。
1.4.3 可溶性蛋白含量测定参考杜海林等的方法[19],通过Bradford 标准曲线法绘制标准曲线。将预处理后的线虫置于1.5 mL离心管中,加入20 μL PBS缓冲液和少许石英砂,冰浴研磨成匀浆,用 80 μL PBS缓冲液分2次冲洗研磨棒。加入200 μL 染色剂,振荡混匀后静置5 min,采用紫外分光光度计于595 nm下测定OD值。线虫体内蛋白质含量/(μg/mg)=[从标准曲线中查到的蛋白质含量/(μg/mL)×样品稀释量/mL]/线虫质量/mg。
1.4.4 乙酰胆碱酯酶活性测定参考Ellman等和阎爱华等的方法[20,21]。取供试线虫,加入磷酸缓冲液和少许石英砂,冰浴研磨至匀浆,冰浴静置10 min,上清液即为酶液。按顺序将缓冲液及底物碘代乙酰胆碱加入酶液中,于25 ℃水浴锅中恒温5 min。 取 0.5 mL 酶液,迅速摇匀后立即置于20 ℃水浴锅中保温 30 min。加入1 mg/mL的毒扁豆碱0.5 mL,振荡均匀后加入0.1 mL DTNB显色剂,于412 nm下测定OD值,每处理重复3次。乙酰胆碱酯酶比活力单位为μmol/(mg pro.·min)。
1.5 数据处理所得数据经SPSS 17.0软件和Excel软件进行统计处理,用Duncan氏新复极差法进行差异显著性分析(P=0.05)。 2 结果与分析 2.1 线虫中毒症状观察
光学显微镜观察发现,经球孢白僵菌Snef23次生代谢产物处理后,南方根结线虫J2虫体形态发生了明显的变化,与自然死亡的虫体形态有较大差异。对照无菌水处理的线虫死亡后虫体呈僵直状态,体内物质无异常;而白僵菌代谢产物处理后中毒死亡虫体肠道内有球状或棒状空泡,内壁缢缩现象明显(图 1)。
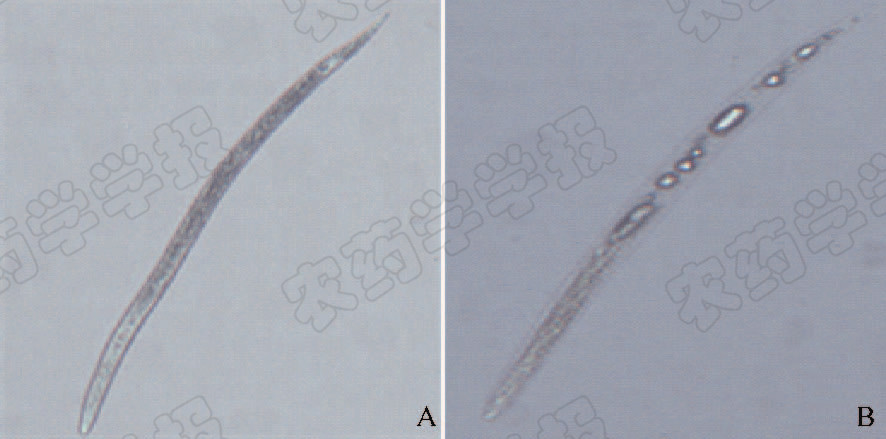 |
A.自然死亡;B.Snef23次生代谢产物处理中毒死亡 A. Natural death; B. Death caused by poisoning of Snef23 secondary metabolites 图 1 南方根结线虫J2死亡状态(×400) Fig. 1 The symptom of dead M.incognita J2(×400) |
球孢白僵菌Snef23次生代谢产物能够显著抑制南方根结线虫J2的活动频率(图 2)。与对照相比,随白僵菌代谢产物浓度增加和处理时间延长,J2的活动频率显著下降,高浓度(25 μg/mL)处理组线虫基本不活动(仅在0.5 和6 h时有微弱活动)。随处理时间延长,线虫活动被抑制程度愈加明显,但在6 h时线虫的活动频率明显增加,之后又下降。而对照组线虫活动频率基本稳定。
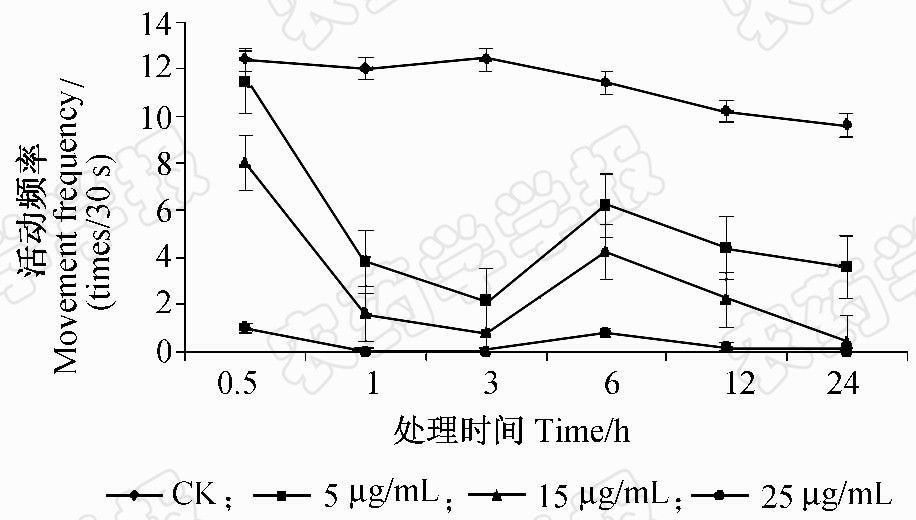 |
图 2 Snef23次生代谢产物对南方根结线虫J2 活动频率的影响Fig. 2 Effect of Snef23 secondary metabolites on movement frequency of M.incognita J2 |
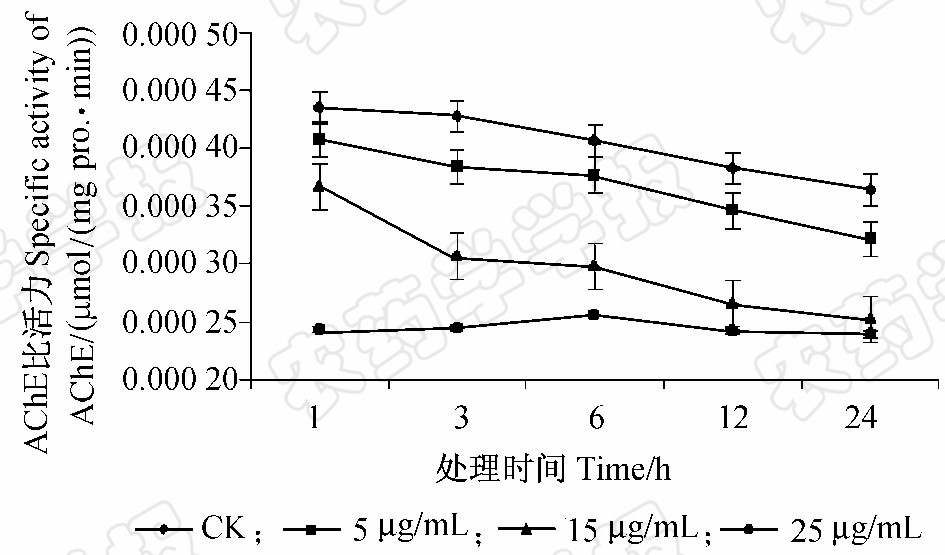 |
图 3 Snef23次生代谢产物对南方根结线虫 乙酰胆碱酯酶活性的影响Fig. 3 Effect of Snef23 secondary metabolites on AChE activity of M.incognita J2 |
线虫没有呼吸系统,主要靠体表与外界进行气体交换,因此通过测定溶液中氧气含量变化来计算其吸氧量。结果(图 4)表明,Snef23次生代谢产物对南方根结线虫J2的呼吸具有强烈的抑制作用,且随着处理浓度升高和时间的推移,J2的吸氧率降低越明显,即呼吸作用受到的抑制越强,其中高浓度(25 μg/mL)下的抑制作用最强,处理24 h 后线虫即停止了呼吸作用。而对照组线虫呼吸一直比较平稳。
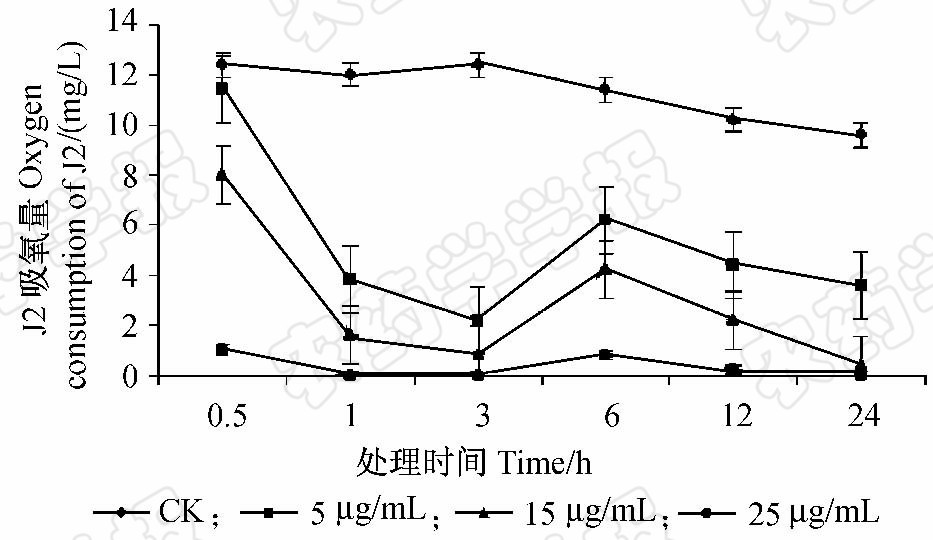 |
图 4 Snef23次生代谢产物对南方根结线虫J2 呼吸作用的影响Fig. 4 Effect of Snef23 secondary metabolites on respiration of M.incognita J2 |
由于显微观察到死亡线虫体内出现空泡现象,因此通过电导率法测定了线虫的体液渗漏情况。结果发现,随着Snef23次生代谢产物浓度升高,J2的电导率显著增加。其中,高浓度(25 μg/mL)处理时的电导率值最大,显著高于对照组;15 μg/mL处理次之;低浓度(5 μg/mL)处理组前期J2的电导率升高不明显,但6 h后开始大幅度上升,与对照相比差异显著(图 5)。表明Snef23代谢产物可破坏南方根结线虫体壁的渗透性,从而显著增加了线虫的体液渗漏。
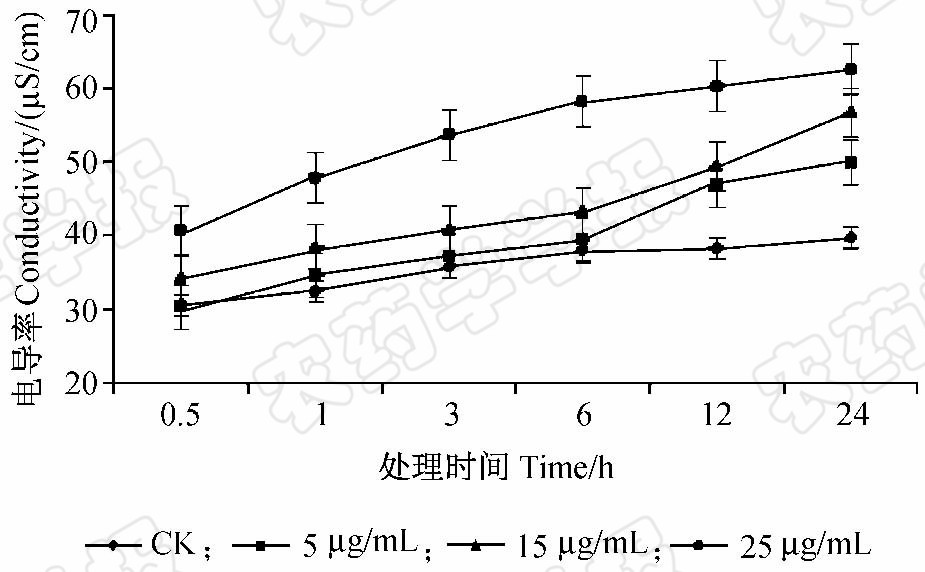 |
图 5 Snef23次生代谢产物对南方根结线虫J2 体液渗漏的影响Fig. 5 Effect of Snef23 secondary metabolites on fluid leakage from M.incognita J2 body |
研究表明,经Snef23次生代谢产物处理后,南方根结线虫J2体内总糖含量显著低于对照,且随着处理浓度的增大和时间推移,总糖含量减少越明显(图 6)。说明Snef23次生代谢产物可破坏线虫体内糖的代谢,使糖的积累受到严重抑制;而对照组线虫体内糖含量随时间推移呈缓慢上升趋势,糖代谢表现正常。
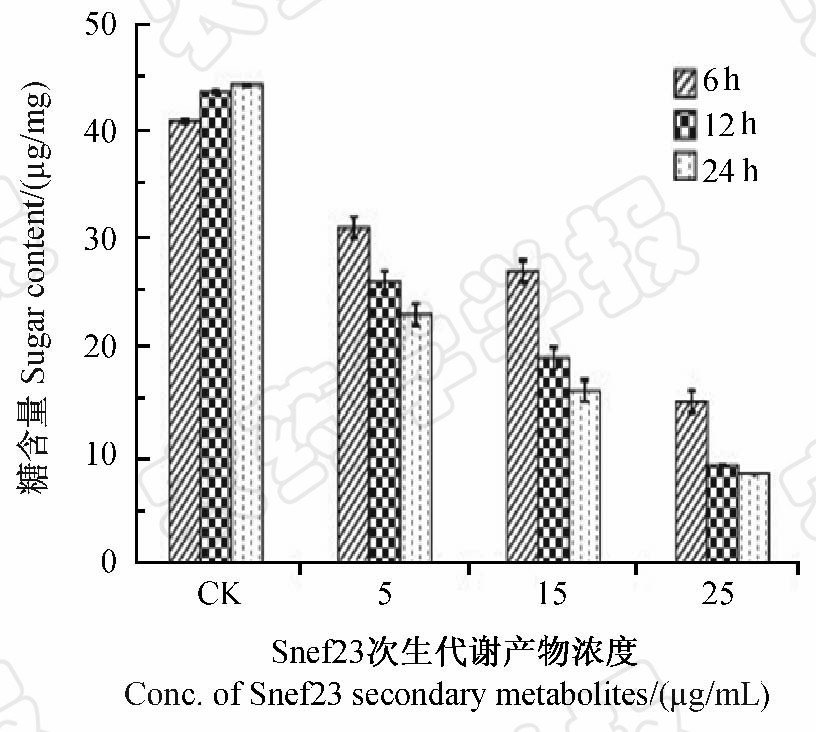 |
图 6 Snef23次生代谢产物对南方根结线虫J2 体内糖含量的影响Fig. 6 Effect of Snef23 secondary metabolites on sugar content of M.incognita J2 |
经Snef23次生代谢产物处理后,南方根结线虫J2体内可溶性蛋白含量显著低于对照,且随着处理浓度增大和时间推移,蛋白质含量减少越明显(图 7),其变化趋势与糖含量变化趋势一致;而对照组J2体内蛋白质含量随时间推移呈缓慢上升趋势,表明其蛋白质代谢未受到干扰。
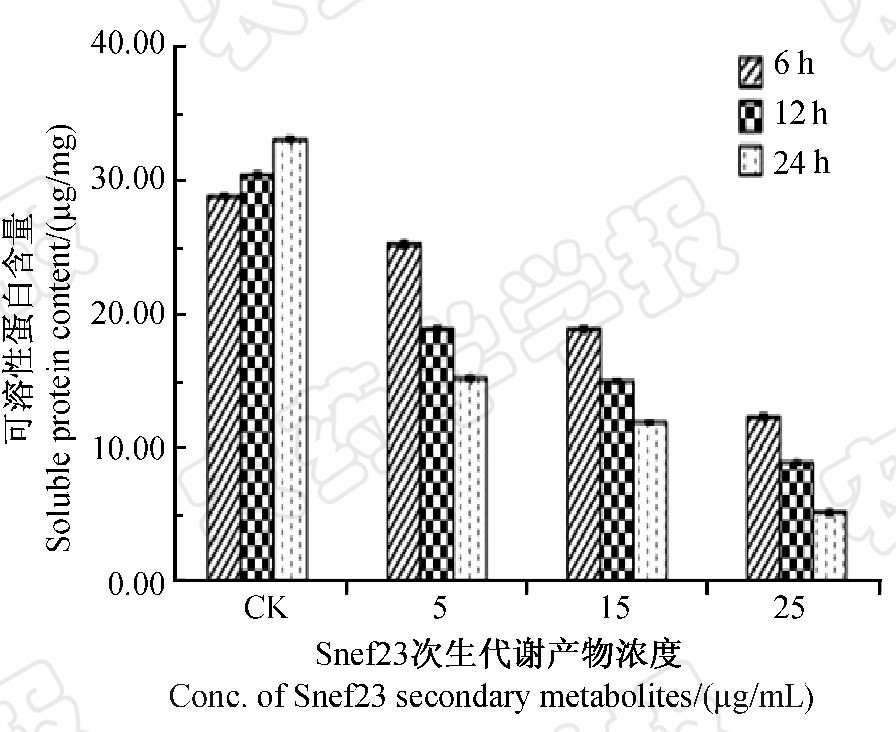 |
图 7 Snef23次生代谢产物对南方根结线虫J2 体内可溶性蛋白含量的影响Fig. 7 Effect of Snef23 secondary metabolites on soluble protein content of M.incognita J2 |
研究表明,球孢白僵菌Snef23次生代谢产物可抑制南方根结线虫J2的活动能力,且随着处理浓度增大和时间延长,抑制效果更明显,同时线虫乙酰胆碱酯酶的活性也受到了明显的抑制作用。刘霆等研究发现,随白僵菌Snf907代谢产物浓度增大和时间延长,其对甘薯茎线虫运动的抑制效果越明显[14]。杨秀娟等的研究表明,合欢叶、黄菊花和万寿菊叶的乙醇提取物对南方根结线虫乙酰胆碱酯酶活力有抑制作用[22]。在鳞翅目昆虫中,使编码乙酰胆碱酯酶的ace1基因发生突变,可有效降低其乙酰胆碱酯酶对抑制剂的敏感性,从而提高昆虫的抗药性[23]。当秀丽线虫Caenorhabditis elegans接触到毒死蜱后,其乙酰胆碱酯酶受到抑制,并且诱导了虫体胁迫相关基因的表达,导致线虫发育迟缓[24]。也有研究显示,白僵菌对昆虫体内乙酰胆碱酯酶活性的抑制会使昆虫无法进行正常的神经传递,影响其运动,进而丧失躲避不良环境的能力[23]。本研究也证明,球孢白僵菌代谢产物能够抑制植物线虫的乙酰胆碱酯酶活性,造成其神经系统紊乱,同时也抑制了南方根结线虫的运动能力。
氧气含量会影响线虫的存活,缺氧可大大降低土壤中线虫的种群数量[25]。本研究发现,白僵菌Snef23次生代谢产物对南方根结线虫J2的呼吸有强抑制作用,且处理浓度越高,线虫吸氧量越低,高浓度处理24 h后甚至会使J2的呼吸作用停止。白春明等的研究表明,无机化合物(碳酸氢铵、硫酸铜和氯化铁)可抑制线虫呼吸,且使其体液出现渗漏[17]。本研究中,Snef23次生代谢产物处理也可增强线虫的体液渗漏,说明线虫体内渗透压因受到白僵菌次生代谢产物的刺激而改变,导致虫体体壁透过性增大,体内物质外渗流失,从而使得受毒害死亡线虫虫体出现空泡化现象。但具体是何种代谢物质导致线虫死亡,以及代谢产物中活性成分的组成及化学结构等还有待进一步研究。
昆虫体内蛋白质代谢紊乱会降低其抗药性,也会降低昆虫的存活能力[23]。外界胁迫作用下,昆虫正常的蛋白质合成系统关闭,空间构象及功能发生变化,终止了蛋白质的正常合成[26,27]。本研究发现,随着白僵菌Snef23次生代谢产物处理浓度增大和时间推移,南方根结线虫J2体内总糖含量和可溶性蛋白含量均显著降低,表明线虫体内糖和蛋白质等物质的代谢受到了严重干扰,同时酶活性降低,导致细胞及组织正常的生理功能和防御能力被损害,使得线虫因生存能力降低而死亡。有研究显示,在逆境胁迫下,海藻糖可生成葡萄糖以保证线虫度过不良环境[28],说明糖代谢对线虫的存活至关重要。
本研究从线虫主要生理生化指标入手,明确了球孢白僵菌Snef23代谢产物通过抑制南方根结线虫J2的运动能力、呼吸作用和乙酰胆碱酯酶活性,造成其行为和神经系统紊乱,影响线虫正常的运动;同时通过干扰线虫体内糖和蛋白质的代谢,以及增加虫体内容物的渗漏,使其生存能力下降、生理代谢活动受到严重干扰,从而起到毒杀植物线虫的作用。但是,关于球孢白僵菌次生代谢产物中有效杀线虫活性成分的结构,以及影响线虫代谢的分子机制等问题还有待于进一步深入研究,以便更有效地开发利用这一宝贵的生防资源。
| [1] | 王成树. 虫生真菌研究与应用的发展与机遇:2012 年虫生真菌专刊序言[J]. 菌物学报, 2012, 31(3): 305-306. WANG Chengshu. Advances and challenges in investigation and application of entomopathogenic fungi:preface to the 2012 special issue on entomopathogenic fungi[J]. .Mycosystema, 2012, 31(3): 305-306. (in Chinese) |
| [2] | REHNER S A, BUCKLEY E P. Isolation and characterization of microsatellite loci from the entomopathogenic fungus .Beauveria bassiana (Ascomycota: Hypocreales)[J]. .Mol Ecol Notes, 2003,3(3): 409-411. |
| [3] | HOU Chengxiang, QIN Guangxing, LIU Ting, et al.. Differential gene expression in silkworm in response to .Beauveria bassiana infection[J].. Gene, 2011, 484(1): 35-41. |
| [4] | 李增智, 黄勃, 陈名君, 等. 分子时代的白僵菌研究[J]. 菌物学报, 2011, 30(6): 823-835. LI Zengzhi, HUANG Bo, CHEN Mingjun, et al.. Studies on the genus .Beauveria in molecular era[J]. .Mycosystema, 2011, 30(6): 823-835.(in Chinese) |
| [5] | PU Xiaoying, FENG Mingguang, SHI Chunhua. Impact of three application methods on the field efficacy of a .Beauveria bassiana-based mycoinsecticide against the false-eye leafhopper, .Empoasca vitis(Homoptera: Cicadellidae) in the tea canopy[J].. Crop Prot, 2005, 24(2): 167-175. |
| [6] | LIU T, WANG L, DUAN Y X, et al.. Nematicidal activity of culture filtrate of .Beauveria bassiana against .Meloidogyne hapla[J]. .World J Microbiol Biotech, 2008, 24(1): 113-118. |
| [7] | 刘丹丹, 段玉玺, 陈立杰. Snf907-76 发酵液杀线虫活性测定及活性物质分离纯化[J]. 农药, 2007, 46(9): 644-646. LIU Dandan, DUAN Yuxi, CHEN Lijie. Determine nematicidal of ferment liquid of Snf907-76 and isolation and purification nematocide[J]..Arochemicals, 2007,46(9): 644-646.(in Chinese) |
| [8] | 陈增齐, 段玉玺, 陈立杰, 等. 球孢白僵菌 Snf907 发酵液对番茄根结线虫病的控病效果及防御酶活性影响[J]. 农药, 2009, 48(4): 304-306 CHENG Zengqi, DUAN Yuxi, CHEN Lijie, et al.. Effects of fermentation liquid of .Beauveria bassiana Snf907 on defense enzymes activity against. Meloidogyne incognita[J]. .Agrochemicals, 2009, 48(4):304-330.(in Chinese) |
| [9] | ADANE K, MOORE D, ARCHER S A. Preliminary studies on the use of .Beauveria bassiana to control .Sitophilus zeamais (Coleoptera: Curculionidae) in the laboratory[J]. .J Stored Prod Res, 1996, 32(2): 105-113. |
| [10] | CAMPOS R A, ARRUDA W, BOLDO J T, et al.. .Boophilus microplus infection by .Beauveria amorpha and .Beauveria bassiana: SEM analysis and regulation of subtilisin-like proteases and chitinases[J]. .Curr Microbiol, 2005, 50(5): 257-261. |
| [11] | CHAMLEY A K. Fungal pathogens of insects: cuticle degrading enzymes and toxins[J]. .Adv Bot Res, 2003, 40: 241-321. |
| [12] | 陈立杰, 刘彬, 段玉玺, 等. 白僵菌发酵液对不同种类线虫生物活性的影响[J]. 沈阳农业大学学报, 2008, 39(3): 305-308. CHEN Lijie, LIU Bin, DUAN Yuxi, et al.. Effect of fermentation filtrate of .Beauveria on bio-activities of different nematodes[J]. .J Shenyang Agric Univ, 2008, 39(3): 305-308. (in Chinese) |
| [13] | 赵迪, 刘彬, 李玲玉, 等. 白僵菌及其伴生菌发酵液对线虫的毒力研究[J]. 农药学学报, 2013,15(2): 178-182. ZHAO Di, LIU Bin, LI Lingyu,. et al. Nematicidal activity of .Beauveria bassiana and the accompanying fungi using fermentation filtrate[J]..Chin J Pestic Sci, 2013, 15(2): 178-182.(in Chinese) |
| [14] | 刘霆, 王莉, 段玉玺, 等. Snf907 真菌代谢物对甘薯茎线虫活性的影响[J]. 河南农业科学, 2007(6): 63-65. LIU Ting, WANG Li, DUAN Yuxi,. et al. Effects of Snf907 fungus metabolites on the juvenile mortality and movement of .Ditylenchus destructor[J]. .J Henan Agric Sci, 2007(6):63-65. (in Chinese) |
| [15] | 陈立杰, 陈越, 张国栋, 等. 辽宁省大型真菌浸提液及发酵液对线虫的毒力作用 [J]. 中国生物防治, 2010, 26(4): 467-473. CHEN Lijie, CHEN Yue, ZHANG Guodong,. et al. Nematicidal activity of extraction and fermentation filtrate of .Basidiomycetes collected in Liaoning province, China[J]. .Chin J Biol Control, 2010, 26(4): 467-473. (in Chinese) |
| [16] | TSALIK E L, HOBERT O. Functional mapping of neurons that control locomotory behavior in .Caenorhabditis elegans[J].. J Neurobiol, 2003,56(2):178-197. |
| [17] | 白春明, 段玉玺, 陈立杰, 等. 无机化合物对南方根结线虫作用方式的研究[J]. 植物保护, 2011, 37(1): 74-78. BAI Chunming, DUAN Yuxi, CHEN Lijie, et al.. The modes of action of inorganic compounds to .Meloidogyne incognita[J]. .Plant Prot, 2011, 37(1): 74-78. (in Chinese) |
| [18] | 仵均祥, 袁锋, 苏丽. 麦红吸浆虫幼虫滞育期间糖类物质变化[J]. 昆虫学报, 2004, 47(2): 178-183. WU Junxiang, YUAN Feng, SU Li. Change of carbohydrate contents in larvae of the wheat midge, .Sitodiplosis mosellana (Gehin) during mature and diapause stage[J]..Acta Entomologica Sinica, 2004, 47(2): 178-183. (in Chinese) |
| [19] | 杜海林, 诸葛洪祥, 梁幼生, 等. 青蒿琥酯抗日本血吸虫童虫和成虫作用的研究[J]. 国际医学寄生虫病杂志, 2010,37(4): 205-211. DU Hailin, ZHUGE Hongxiang, LIANG Yousheng, et al.. Study of the effects of artesunate on juvenile and adult .Schistosoma japonicum[J]..Int J Med Parasit Dis, 2010, 37(4): 205-211. (in Chinese) |
| [20] | ELLMAN G L, COURTNEY K D, FEATHERSTONE R M. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. .Biochem Pharmacol, 1961, 7(2): 88-95. |
| [21] | 阎爱华, 任晓亚, 李宁, 等. 昆虫病原线虫侵染对光肩星天牛3种解毒酶活性的影响[J]. 河北农业科学, 2012, 16(10): 78-80. YAN Aihua, REN Xiaoya, LI Ning, et al.. Changes of three kinds of detoxification enzymes activities in .Anoplophora glabripennis infected by entomopathogenetic nematodes[J]. .J Hebei Agric Sci, 2012, 16(10): 78-80. (in Chinese) |
| [22] | 杨秀娟, 何玉仙, 陈庆河, 等. 3 种植物乙醇提取物对南方根结线虫卵囊酯酶活力影响及其成分预分析[J]. 生物技术通报, 2006(增刊1): 476-479. YANG Xiujuan, HE Yuxian,CHEN Qinghe, et al.. Effects on activity of carboxylesterase(CarE) and acetylcholinesterase(AChE) in .Meloidogyne incognita Egg-mass and advance analysis on chemistry material of 3 plant ethanol extracts[J]. .Biotechnol Bull, 2006 (Suppl.1): 476-479. (in Chinese) |
| [23] | WANG J, WANG B, XIE Y, et al.. Functional study on the mutations in the silkworm(.Bombyx mori) acetylcholinesterase type 1 gene .(ace1) and its recombinant proteins[J]. .Mol Biol Rep, 2014, 41(1): 429-437. |
| [24] | ROH J Y, CHOI J. Ecotoxicological evaluation of chlorpyrifos exposure on the nematode .Caenorhabditis elegans [J]. .Ecotoxicol Environ Saf, 2008, 71(2): 483-489. |
| [25] | 刘维志. 植物病原线虫学[M]. 北京:中国农业出版社,2000: 93-99. LIU Weizhi. Plant Pathogenic Nematology [M]. Beijing: China Agriculture Press,2000:93-99.(in Chinese) |
| [26] | 杜尧, 马春森, 赵清华, 等. 高温对昆虫影响的生理生化作用机理研究进展[J]. 生态学报, 2007, 27(4): 1565-1572. DU Yao, MA Chunsen,ZHAO Qinghua, et al.. Effects of heat stress on physiological and biochemical mechanisms of insects: a literature review[J]. .Acta Ecologica Sinica,. 2007, 27(4): 1565-1572.(in Chinese) |
| [27] | STANLEY K, FENTON B. A member of the .Hsp60 gene family from the peach potato aphid, .Myzus persicae (Sulzer.) [J].. Insect Mol Biol, 2000, 9(2): 211-215. |
| [28] | PELLERONE F I, ARCHER S K, BEHM C A, et al.. Trehalose metabolism genes in .Caenorhabditis elegans and filarial nematodes[J]. .Int J Parasitol, 2003, 33(11): 1195-1206. |
 2014, Vol. 16
2014, Vol. 16


