开发高效、安全、低残留、使用方便的生物源绿色农药是现代农药科研发展的必然趋势。申嗪霉素(Shenqinmycin)是上海交通大学许煜泉教授团队和上海农乐生物制品有限公司利用植物根际促生假单胞菌代谢产物研发得到的一种新型微生物源绿色农药,2011年获得农药登记证,能有效防治水稻纹枯病、西瓜枯萎病和甜椒疫病。申嗪霉素的研发历时16 a 之久,先后发表了40多篇中英文研究论文,但目前尚未见系统综述申嗪霉素研发的进展及其应用概况的相关文献。本文拟首先介绍申嗪霉素产生菌的分离和发现,综述申嗪霉素合成机理和调控网络的最新研究进展,在此基础上,详细介绍申嗪霉素高产菌株的构建及申嗪霉素的产业化和应用,探讨其作用机理及存在的问题,以期为下一步申嗪霉素生物合成机理研究、遗传和代谢改造以及推广应用提供理论依据和借鉴。
 | 图 1 假单胞菌M18的抑菌效果和吩嗪-1-羧酸的化学结构 Fig. 1 Antifungal effects of Pseudomonas sp. M18 and chemical structure of PCA 图片均来自吴大强等[3]。 A. 申嗪霉素产生菌M18抑制甜瓜蔓枯病菌菌丝生长;B. 申嗪霉素的化学结构;C. 甜瓜蔓枯病发病初期植株;D. M18菌株悬浮液涂抹可以治愈发病初期的蔓枯病。 The pictures in this figure were originally from Wu et al. [3]. A. Inhibition of the growth of Mycosphaerella melonis mycelium by Pseudomonas sp. M18; B. Chemical structure of phenazine-1-carboxylic acid; C. A melon plant showing initial disease symptom by M. melonis; D. Recovered melon plant by spraying M18 cell culture suspension. |
1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,简称ACC)是植物激素乙烯的合成前体,许多植物根际土壤细菌均可产生ACC脱氨酶,以将植物根际分泌物中的ACC分解为氨和α-丁酮酸,从而为细菌生长提供必需的氮源和碳源[1]。根据这种植物与土壤微生物之间相互依赖的生态关系,上海交通大学许煜泉教授团队[2] 首先将采自上海郊区的甜瓜根际土壤样品悬浮于绿脓荧光素测定用液体培养基(PAF)中,以富集其中的假单胞菌;再将其转到以ACC为唯一氮源的基本培养基(ADF)上进一步筛选,获得了具有AAC脱氨酶活性的菌株;将筛选到的菌株接种至马铃薯葡萄糖琼脂培养基(PDA)平板上,测定其对黄瓜枯萎病菌的抑菌活性,从中筛选出了1株具有强烈抑菌活性的菌株,命名为M18(图 1A)。将M18菌株悬浮液涂抹在初发蔓枯病的甜瓜植株上,能有效治愈蔓枯病。比较图 1C和图 1D可以发现,感染甜瓜蔓枯病的甜瓜叶片变黄,而经M18涂抹治愈的甜瓜叶片又恢复绿色。
尽管M18菌株和铜绿假单胞菌PAO1的16s rRNA基因序列相似度高达99.0%,但由于二者的表型在许多方面存在差异,故将M18菌株暂命名为荧光假单胞菌M18生防株(Pseudomonas sp. M18)[2]。最近,吴大强等[3]利用第二代高通量测序技术,完成了M18菌株的全基因组测序:该基因组由一条长为6 327 754个碱基的环状染色体构成,已初步注释鉴定了其中5 684个蛋白质编码基因和80个RNA基因;与其他已测序的铜绿假单胞菌基因组(PAO1、PA14、LESB58)一样,M18菌株基因组中也包含一个共同的核心基因组,占该基因组全部基因的90%以上;全基因组比对分析、进化树分析和COG基因分类比较分析结果均表明,M18菌株确实属于铜绿假单胞菌,故将其进一步定名为铜绿假单胞菌M18生防株(Pseudomonas aeruginosa strain M18)[3]。
M18菌株在PPM(pigment production medium)液体培养基中培养48 h后可产生多种代谢物,其中之一经鉴定为吩嗪-1-羧酸(phenazine-1-carboxylic acid,简称PCA)[2](图 1B)。PCA是许多植物根际假单胞菌均可产生的一种重要次生代谢产物[4],结构比较稳定,具有广谱的抗菌活性,对人畜和环境无害,是研发绿色农药的理想候选化合物。之后PCA由沈阳化工研究院定名为申嗪霉素:“申”源于上海的简称,“嗪”源于其化学名称吩嗪。申嗪霉素也可通过化学方法合成,但合成效率很低,且在合成过程中需用到有毒的合成前体和催化剂[5],因此不符合现代绿色农药的生产要求。微生物发酵是目前农用抗生素生产的常用方法,有效且环保,但由于M18野生型菌株申嗪霉素的发酵效价仅为0.2 g/L,远达不到大规模工业化生产的要求,因此,相关团队开展了申嗪霉素生物合成机理及其调控机理的研究,并在此基础上对M18菌株进行遗传和代谢改造,以期提高其发酵效价。
A. M18基因组包含2个高度同源的申嗪霉素合成基因簇;B. 申嗪霉素生物合成总途径;C. 申嗪霉素合成基因簇编码蛋白参与的合成步骤。DHAP: 3-脱氧阿拉伯庚酮糖酸-7-磷酸; ADIC: 2-氨基脱氧分支酸; DHHA: 2,3-二氢-3-羟基邻氨基苯甲酸; Enol: 烯醇; 5-hydro-PCA: 5-氢-吩嗪-1-羧酸; 5,10-dihydro-PCA: 5,10-二氢-吩嗪-1-羧酸; PCA: 吩嗪-1-羧酸。图 2C参考了Pierson Ⅲ等[6],略有改动。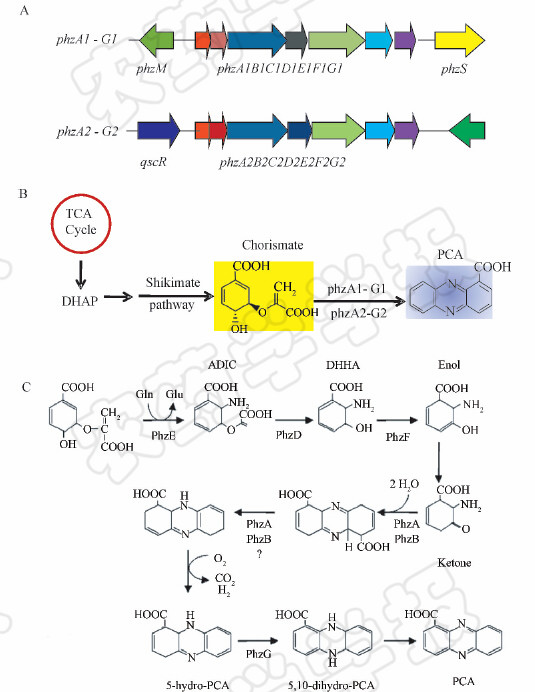 | 图 2 申嗪霉素生物合成基因簇及生物合成机理 Fig. 2 The phz gene clusters and the biosynthetic mechanism of Shenqinmycin in Pseudomonas sp. M18 A. M18 contains two highly homologous phz clusters; B. Proposed biosynthetic pathway for Shenqinmycin; C. Putative biosynthetic roles of enzymes encoded by phz cluster in Shenqinmycin biosynthesis. DHAP:3-deoxy-D-arabinoheptulosonate-7-phosphate; ADIC:2-amino-2-deoxychorismate; DHHA:trans-2,3-dihydro-3-hydroxyanthranilate; PCA: phenazine-1-carboxylic acid. Fig. 2C was originally from Pierson Ⅲ et al[6] with modification. |
莽草酸途径的终产物分支酸是申嗪霉素生物合成的前体;从分支酸到申嗪霉素的转化,由申嗪霉素合成基因簇phzABCDEFG(简称phzA-G)编码的7种酶(PhzA、PhzB、PhzC、PhzD、PhzE、PhzF和PhzG)协作完成(图 2A~2B)[6]。phzC编码3-脱氧阿拉伯庚酮糖酸-7-磷酸(DHAP)合酶,在莽草酸合成途径中催化4-磷酸赤藓糖(E4P)和磷酸烯醇式丙酮酸(PEP)形成DHAP,从而使代谢流转向申嗪霉素的合成;phzE编码甲酸酯合酶,负责将分支酸转变成2-氨基脱氧分支酸(ADIC),随后,ADIC通过PhzD转变为2,3-二氢-3-羟基邻氨基苯甲酸(DHHA);PhzF、PhzA、PhzB通过形成醇、酮等步骤进一步将DHHA转化为5-氢-吩嗪-1-羧酸;PhzG是一种FMN-吡哆胺氧化酶,催化底物形成 5,10-二氢-吩嗪-1-羧酸,再通过还原性电子穿梭形成吩嗪-1-羧酸(PCA)(图 2C)[6,7]。
M18基因组编码2个高度同源的申嗪霉素合成基因簇:phzA1B1C1D1E1F1G1(简称phzA1-G1)和phzA2B2C2D2E2F2G2(简称phzA2-G2)(图 2A),它们位于M18基因组上不同的位点,大小分别为6 280 bp和6 274 bp。李雅乾等[8]的研究结果显示:在细菌生长过程中phzA2-G2的表达量较低,其所合成的申嗪霉素仅作为一种信号分子诱导phzA1-G1的表达,促使M18大量产生申嗪霉素。即M18菌株通过2个基因簇之间这种独特的诱导机制,形成一个级联放大系统,在生长后期或在特定的外界环境刺激下大量产生申嗪霉素。
双组分信号传导系统(two-component signaling system,简称TCS)是广泛存在于细菌中的信号传导系统。铜绿假单胞菌基因组共包含60多个TCS蛋白,其中对于GacS/GacA这一双组分调控系统已研究得相对较为清楚:GacS是一个信号感应蛋白,由跨膜结构域、HAMP结构域、组氨酸激酶结构域(HK)、信号接收结构域(REC)和1个组氨酸磷酸转移结构域(HPT)组成,GacS感应到环境信号后,可通过磷酸化接力(phosphorelay)方式将信号传递到细胞质中的GacA;GacA是一种应答调节蛋白(response regulator,RR),由1个REC结构域和1个DNA结合功能域组成[9]。在M18菌株中,GacA促进phzA1-G1的表达,但抑制phzA2-G2的表达[10],综合2个基因簇的表达结果,认为GacS/GacA可抑制申嗪霉素的生物合成,因为在gacA缺失突变体中,申嗪霉素的产量比野生型M18菌株提高了近30倍[11]。
微生物群体感应(quorum sensing,简称QS)是指细菌通过感应胞外信号分子的浓度来感知群体密度变化,并调控自身基因表达的一种群体行为。在M18中,申嗪霉素的大量合成始于细菌生长对数期的后期,严格地受群体感应系统的调控。M18基因组包含3套群体感应系统:lasI/lasR、rhlI/rhlR和 PQS(Pseudomonas quinolone signal)系统。其中,LasI和RhlI分别合成群体感应信号分子3-oxo-C12-HSL 和C4-HSL。LasR可抑制申嗪霉素合成基因簇的表达[12],lasR被敲除的突变体生长比野生型快,其申嗪霉素的产量比野生型M18提高2~3倍[13]。RhlR正调控申嗪霉素合成基因簇的表达,敲除rhlR的突变体几乎不产生申嗪霉素[14]。PQS信号则通过转录因子PqsR促进申嗪霉素合成基因簇的表达[15]。
M18菌株作为一株源自甜瓜根际的生防菌,土壤中复杂多变的环境条件,如温度、pH值、含氧量、离子浓度、磷酸盐浓度以及可利用的碳、氮源等,都可作为一种信号调控其phz基因簇的表达,进而控制申嗪霉素的合成。吴大强等[3]分析了不同温度下M18菌株的转录组,发现563个基因的表达受温度的调控,占基因组中全部编码基因数的9.9%。在28 ℃下,有158个基因的表达上调;在37 ℃下,有207个基因的表达上调,温控转录组差异率达64.8%;显示M18菌株在遭遇环境变化时,可能采取上调更多基因的方式以适应新的环境条件。黄娇芳等[16]发现,M18菌株在28~42 ℃条件下均能生长,在28 ℃下产生的吩嗪类物质主要是申嗪霉素,而在37 ℃下产生的吩嗪类物质则主要是绿脓菌素(5-甲基-1-羟基吩嗪,PYO),这主要是因为37 ℃环境温度可诱导phzM大量表达,将申嗪霉素转化为了PYO。
在假单胞菌中,小的RNA也是一类重要的转录后调控因子。RsmY/ RsmZ是M18菌株中的小RNA分子,敲除rsmY基因后申嗪霉素的产量可大幅提高[17]。RmsA是小RNA RsmY/RsmZ 的结合蛋白,在28 ℃的PPM培养基中,rmsA被敲除的突变菌株的生长略微变慢,且申嗪霉素的产量仅为野生型的一半。进一步分析发现,RmsA对2个基因簇有着不同的调控作用,即RmsA可抑制phz1基因簇的表达,促进phz2基因簇的表达[18]。Hfq是一类非常保守的小RNA伴侣蛋白,其与小RNA结合后能促进目标mRNA的稳定或者降解。在M18菌株中,Hfq直接结合在phzM 基因mRNA富含AU的5’-非编码区,抑制phzM的表达,阻遏申嗪霉素向PYO的转化[19]。最近在铜绿假单胞菌中还发现了另一类小RNA phrS,其可通过正调控转录因子pqsR的表达,促进PYO的产生[20]。
为了提高申嗪霉素的发酵效价,上海交通大学相关研究团队就发酵条件优化和遗传改造2个方面进行了系统深入的研究工作:一方面,通过反复补料分批培养[21]、响应面发酵成分优化[22]以及分批发酵和连续发酵[23]等方法,确立了适宜申嗪霉素生产的最佳培养基和培养条件;另一方面,基于申嗪霉素合成和调控机理的研究结果,先后对M18野生菌株进行了多代遗传改造。首先,Li等[24]利用同源重组法敲除gacA基因后得到突变体M18G,可将申嗪霉素的产量提高到2.0 g/L;在此基础上,苏静江等[25]进一步敲除了M18G突变体中的qscR基因,获得了双突变体M18GQ,其申嗪霉素的产量可达到4.0 g/L;周泉等[26]在M18GQ菌株中,利用质粒pME6032过量表达phzA1-G1基因簇的方法,可使申嗪霉素的产量提高到6.3 g/L。最近,Du等[27]通过无痕敲除技术,敲除了phzM、 phzS和phzA1-G1基因簇上游的5’-非翻译区,得到3-突变体M18MSU1,其发酵条件经优化后,申嗪霉素的产量可高达4.7 g/L。2009年,上海交通大学将可生产申嗪霉素的高产工程菌株成功转让给上海农乐生物制品有限公司,后者利用该高产工程菌株先后完成小试、中试及大罐生产,并进行了大罐生产工艺、培养基配方的优化。为了避免在提取申嗪霉素过程中使用有毒的有机溶剂氯仿,上海农乐生物制品有限公司还研究出了申嗪霉素水相提取新工艺,降低了生产成本,提高了清洁生产水平和环保等级[28];同时,采用超细研磨法及特定助剂,研制出了水基化环保剂型——1%申嗪霉素悬浮剂,其悬浮率可达90%以上,10 μm以下的颗粒比例达95%以上,具有粒度细、附着力强、分散性好等特点[29]。目前,该公司在上海市奉贤星火开发区设立生物农药产业化基地,已经规模化生产申嗪霉素。
1%申嗪霉素悬浮剂大鼠急性经口喂食的半致死剂量(LD50)大于5 g/kg体重,属低毒农药[30]。1%申嗪霉素悬浮剂对大鼠、家兔等动物无毒或低毒,对鱼、蜜蜂、鹌鹑和家蚕等4种环境生物低毒或无毒,但对大型蚤为中毒[30]。申嗪霉素可被环境中的微生物降解,在土壤中的半衰期为8.0~8.7 d。申嗪霉素发酵生产所用培养基的主要成分为黄豆粉和玉米粉,发酵后的废液可回收,因此,不会对环境造成污染。
M18本身也是一株生防菌株,将其接种到上海市浦东锦园园艺温室大棚的黄瓜苗上,可有效防治黄瓜枯萎病和霜霉病[31];但在大田试验中,大规模喷洒M18细菌悬浮液对黄瓜枯萎病和霜霉病的防治效果却不佳,这可能与M18菌株不能在植物表面有效定殖有关。M18菌株属于铜绿假单胞菌,是一种潜在的人类条件致病菌,不宜扩散到环境中,因此,利用M18菌株的代谢产物防治植物病害成为首选。许煜泉教授团队首先选择在上海郊区的经济作物上开展申嗪霉素的防病试验,结果表明:1%申嗪霉素悬浮剂能有效防治黄瓜枯萎病[31]、甜瓜蔓枯病[32]和辣椒疫病[33]。2008—2010年间,农业部全国农业技术推广服务中心分别在上海、湖南、湖北、安徽、江苏和福建等地水稻主产区开展了1%申嗪霉素悬浮剂防治水稻纹枯病的大田试验,结果显示:1%申嗪霉素悬浮剂对水稻纹枯病的防治效果与当前使用的主导农药井冈霉素相当,但申嗪霉素的有效成分用量只有井冈霉素的五分之一[34]。与井冈霉素相比,申嗪霉素的防治范围更广,不仅能防治水稻纹枯病,还能防治西瓜枯萎病和甜椒疫病。2011年3月,申嗪霉素原药及其1%悬浮剂获得中国农业部农药登记证(编号:PD20110314、PD20110315)。
申嗪霉素属于芳香杂环族吩嗪类化合物,该类化合物具有抗菌、抗肿瘤和抗寄生虫活性[7]。其抗菌活性至少有2方面的机理:一是此类化合物在病原菌细胞内被还原的过程中会产生有毒的超氧离子和过氧化氢,能够氧化谷胱甘肽和转铁蛋白,产生高细胞毒性的羟自由基[35]; 二是由于吩嗪类化合物能够被NADH还原,成为电子传递的中间体,扰乱了细胞内正常的氧化还原稳态(NADH/NAD+比率等),影响能量的产生,从而抑制微生物的生长[36]。目前有关申嗪霉素更深入的抗菌作用机理尚不明确,上海交通大学正与国内多所大学合作,对申嗪霉素的抗菌作用机理进行深入研究。
申嗪霉素是我国自主研发的又一个微生物源绿色农药,具有安全、环保、高效和广谱等特点,具有广阔的应用前景。与我国目前防治水稻纹枯病的主导农药井冈霉素相比,申嗪霉素生产的发酵效价偏低,致使其生产成本偏高,从而影响了其推广应用,因此,提高生产申嗪霉素的发酵效价,降低其生产成本势在必行。笔者等正尝试运用最新的分子生物学和组学技术研究方法,全面探索申嗪霉素生物合成的机理和调控网络,对M18菌株进行遗传和代谢改造,以提高申嗪霉素生产的发酵效价。此外,有关申嗪霉素的施药方法及其与其他农药的复配技术等也正在研究中,以便进一步拓宽其防治对象和应用范围。
| [1] | GLICK B R,KARATUROVIC D M,NEWELL P C. A novel procedure for rapid isolation of plant growth promoting Pseudomonads [J]. Canadian J Microbiol,1995,41(6): 533-536. |
| [2] | HU Hongbo,XU Yuquan,CHEN Feng,et al. Isolation and characterization of a new Fluorescent strain that produces both phenazine 1-carboxylic acid and pyoluteorin[J]. J Microbiol Biotech,2005,15(1): 86-90. |
| [3] | WU Daqiang,YE Jing, OU Hongyu,et al. Genomic analysis and temperature-dependent transcriptome profiles of the rhizosphere originating strain Pseudomonas aeruginosa M18[J]. BMC Genomics,2011,12(1): 438. |
| [4] | THOMASHOW L S,WELLER D M,BONSALL R F,et al. Production of the antibiotic phenazine-1-carboxylic acid by Fluorescent Pseudomonas species in the rhizosphere of wheat [J]. Appl Environ Microbiol,1990,56(4): 908-912. |
| [5] | 欧进国,陆蕴华. 滤色试剂——吩嗪-1-羧酸的制备[J].化学试剂,1982,4(1):41-43. OU Jinguo, LU Yunhua. Preparation of filter reagent:Phenazine-1-carboxylic acid[J].Chemical Reagents,1982,4(1):41-43. (in Chinese) |
| [6] | PIERSON III L S,PIERSON E A. Metabolism and function of phenazines in bacteria: impacts on the behavior of bacteria in the environment and biotechnological processes[J]. Appl Microbiol Biotechnol,2010,86(6): 1659-1670. |
| [7] | MAVRODI D V,BLANKENFELDT W,THOMASHOW L S. Phenazine compounds in Fluorescent Pseudomonas spp. biosynthesis and regulation[J]. Annu Rev Phytopathol,2006,44: 417-445. |
| [8] | LI Yaqian,DU Xiling,LU Zhijohn,et al. Regulatory feedback Loop of two phz Gene Clusters through 5'-Untranslated regions in Pseudomonas sp. M18[J]. PloS ONE,2011,6(4): e19413. |
| [9] | JIMENEZ P N,KOCH G,THOMPSONA J A,et al. The multiple signaling systems regulating virulence in Pseudomonas aeruginosa [J]. Microbiol Mol Biol R,2012,76(1): 46-65. |
| [10] | 汤湘雍,严安,黄显清,等. 假单胞菌株 M18 gacA 基因对 BHL 和 HHL 合成正调控及对 PCA 合成负调控无相关性[J]. 微生物学报,2006,46(3): 478-481. TANG Xiangyong,YAN An,HUANG Xianqing,et al. Negative regulation on PCA production is not correlated with positive regulation on BHL and HHL synthesis by gacA in Pseudomonas sp.M18[J]. Acta Microbiologica Sinica,2006,46(3): 478-481.(in Chinese) |
| [11] | GE Heyi,HUANG Xianqing,WANG Sulian,et al. Phenazine-1-carboxylic acid is negatively regulated and pyoluteorin positively regulated by gacA in Pseudomonas sp. M18[J]. FEMS Microbiol Lett,2006,237(1): 41-47. |
| [12] | LU Jishun,HUANG Xianqing,ZHANG Mingyue,et al. The distinct quorum sensing hierarchy of las and rhl in Pseudomonas sp. M18[J]. Current Microbiol,2009,59(6): 621-627. |
| [13] | CHEN Yun,WANG Xiaolei,HUANG Xianqing,et al. Las-like quorum-sensing system negatively regulates both pyoluteorin and phenazine-1-carboxylic acid production in Pseudomonas sp. M18[J]. Science in China Series C: Life Sciences,2008,51(2): 174-181. |
| [14] | BRINT J M,OHMAN D E. Synthesis of multiple exoproducts in Pseudomonas aeruginosa is under the control of RhlR-RhlI, another set of regulators in strain PAO1 with homology to the autoinducer-responsive LuxR-LuxI family[J]. J Bacteriol, 1995,177(24): 7155-7163. |
| [15] | DUBERN J F,DIGGLE S P. Quorum sensing by 2-alkyl-4-quinolones in Pseudomonas aeruginosa and other bacterial species[J]. Molecular Biosystems, 2008,4(9): 882-888. |
| [16] | HUANG Jiaofang,XU Yuquan,ZHANG Hongyan,et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18[J]. Appl Environ Microbiol,2009,75(20): 6568-6580. |
| [17] | 贾艳梅,任斌,许煜泉. 铜绿假单胞菌M18 rsmY突变株的构建及其对 PCA 和 Plt 的区别性调控[J]. 微生物学通报, 2012,39(8): 1051-1058. JIA Yanmei,REN Bin,XU Yuquan. Construction of Pseudomonas aeruginosa M18 rsmY mutant and its different regulation on PCA and Plt biosynthesis[J]. Microbiol China,2012,39(8): 1051-1058.(in Chinese) |
| [18] | REN Bin,SHEN Huifeng,LU Zhijohn,et al. The phzA 2-G2 transcript exhibits direct RsmA-Mediated activation in Pseudomonas aeruginosa M18[J]. PloS ONE, 2014,9(2): e89653. |
| [19] | WANG Guohao,HUANG Xianqing,LI Sainan,et al. The RNA chaperone Hfq regulates antibiotic biosynthesis in the rhizobacterium Pseudomonas aeruginosa M18[J]. J Bacteriol,2012,194(10): 2443-2457. |
| [20] | SONNLEITNER E, GONZALEZ N, DOMENIGG T S,et al. The small RNA PhrS stimulates synthesis of the Pseudomonas aeruginosa quinolone signal[J]. Mol Microbiol,2011,80(4): 868-885. |
| [21] | 张云,胡洪波,彭华松,等. 产 PCA 基因工程菌 M18G 反复补料分批培养研究[J]. 工业微生物,2007,37(2): 16-20. ZHANG Yun,HU Hongbo,PENG Huasong,et al. Repeated fed-batch culture condition for PCA production by genetic engineering strain M18G[J]. Ind Microbiol,2007,37(2): 16-20.(in Chinese) |
| [22] | 张锋华,许煜泉,张雪洪. 采用响应面分析法优化吩嗪-1-羧酸的发酵条件[J]. 现代农药,2007,6(2): 15-18. ZHANG Fenghua,XU Yuquan,ZHANG Xuehong. Process optimization phenazine-1-carboxylic acid fermentation by response surface analysis[J]. Modern Agrochem,2007,6(2): 15-18.(in Chinese) |
| [23] | LI Yaqian,JIANG Haixia,DU Xiling,et al. Enhancement of phenazine-1-carboxylic acid production using batch and fed-batch culture of gacA inactivated Pseudomonas sp. M18G[J]. Bioresour Technol,2010,101(10): 3649-3656. |
| [24] | LI Yaqian,JIANG Haixia, XU Yuquan,et al. Optimization of nutrient components for enhanced phenazine-1-carboxylic acid production by gacA-inactivated Pseudomonas sp. M18G using response surface method[J]. Appl Microbiol Biotechnol,2008,77(6): 1207-1217. |
| [25] | SU Jinjiang,ZHOU Quan,ZHANG Hongyan,et al. Medium optimization for phenazine-1-carboxylic acid production by a gacA qscR double mutant of Pseudomonas sp. M18 using response surface methodology[J]. Bioresour Technol,2010,101(11): 4089-4095. |
| [26] | ZHOU Quan,SU Jinjiang,JIANG Haixia,et al. Optimization of phenazine-1-carboxylic acid production by a gacA/qscR-inactivated Pseudomonas sp. M18GQ harboring pME6032Phz using response surface methodology[J]. Appl Microbiol Biotechnol,2010,86(6):1761-1773. |
| [27] | DU Xilin,LI Yaqian,ZHOU Wanping,et al. Phenazine-1-carboxylic acid production in a chromosomally non-scar triple-deleted mutant Pseudomonas aeruginosa using statistical experimental designs to optimize yield[J]. Appl Microbiol Biotechnol,2013,97(17):7767-7778. |
| [28] | 沈丽娟. 高效、广谱、安全生物杀菌剂:申嗪霉素[J].世界农药,2011,33(3): 58-58. SHEN Lijuan. Highly efficient, broad-spectrum, safe biopesticide:Shenqinmycin[J].World Pestic, 2011,33(3): 58-58. (in Chinese) |
| [29] | 温广月,张穗,张红艳,等. 新型微生物源农药申嗪霉素对水稻纹枯病菌的毒力测定及田间药效[J].植物保护,2008,34(4): 143-145. WEN Guangyue, ZHANG Sui, ZHANG Hongyan, et al. Toxicity tests and field control effects of novel microbial pesticide Shenqinmycin against Rhizoctorzia solani[J]. Plant Protection,2008,34(4): 143-145.(in Chinese) |
| [30] | 许煜泉. 绿色微生物源抗菌剂申嗪霉素 (M18)[J]. 精细与专用化学品,2005,12(20): 8-9. XU Yuquan. Green microorganism based antimicrobial:Shenqinmycin(M18)[J]. Fine and Specialty Chemicals,2004,12(5):8-9.(in Chinese) |
| [31] | 许煜泉,唐玮宁,郑有丽,等. 筛选假单胞菌株 M18 防治大棚黄瓜枯萎病害[J]. 上海交通大学学报, 1999.33(2): 210-213. XU Yuquan,TANG Weining,ZHENG Youli, et al. Screening of pseudomonas M18 and its biological control of cucumber wilt disease under commercial greenhouse[J]. J Shanghai Jiaotong Univ, 1999.33(2): 210-213.(in Chinese) |
| [32] | 祝新德,冯镇泰,许煜泉,等. 荧光假单胞菌株 M18 防治甜瓜蔓枯病害[J]. 上海交通大学学报,2001,35(7): 1062-1065. ZHU Xinde,FENG Zhengtai,XU Yuquan,et al. Biocontroling of melon gummy stem blight(Mycosphaeralla melonis) using Pseudomonas fluorecens M18[J]. J Shanghai Jiaotong Univ,2001, 35(7): 1062-1065.(in Chinese) |
| [33] | 刘刚.申嗪霉素获准转入正式登记[J]. 农药市场信息,2011(9):30-30. LIU Gang. Shenqinmycin was approved for registration[J]. Pesticide Market News,2011(9):30-30. (in Chinese) |
| [34] | 陈海霞,杜兴彬,张穗,等. 申嗪霉素对水稻纹枯病的田间防效分析[J]. 上海农业学报,2012,28(2): 69-71. CHEN Haixia,DU Xingbin,ZHANG Sui,et al. Field efficacy of Shengqingmycin on rice sheath blight(Rhizoctonia solani)[J]. Acta Agriculturae Shanghai,2012,28(2): 69-71.(in Chinese) |
| [35] | BLOEMBERG GV,LUGTENBERG BJ. Phenazines and their role in biocontrol by Pseudomonas bacteria[J]. New Phytologist,2003,157(3): 503-523. |
| [36] | PRICE-WHELAN A,DIETRICH LE,NEWMAN DK. Pyocyanin alters redox homeostasis and carbon flux through central metabolic pathways in Pseudomonas aeruginosa PA14[J]. J Bacteriol,2007,189(17): 6372-6381. |
 2014, Vol.16
2014, Vol.16 


