2. 海洋学院, 浙江 宁波 315211
2. School of Marine Science, Ningbo University, Ningbo 315211, Zhejiang Province, China
大黄鱼是中国传统水产养殖业中重要的水产品,具有较高的经济价值。2010年,中国大黄鱼养殖达到5.6万网箱,年产量8.6万t,直接产值约65亿元[1]。随着养殖规模的不断扩大,放养密度的不断提高,以及滥用渔药、给药方式不当等因素的影响,导致养殖海区环境污染和大黄鱼病害频发,药效甚差,从而使养殖大黄鱼的发病率和死亡率呈逐年提高趋势[2]。目前渔场所用的渔药如氟苯尼考、土霉素等均为粉剂或液剂,给药时主要采用拌入饲料或将药物涂抹在饲料表面,存在药物易散失、用药计量不准、过量使用等问题,不仅降低了药效,还污染了养殖水环境[3, 4]。尤其是采用网箱养殖的,因水域是流动和公用的,只要一家使用了禁用药物,邻近养殖户的鱼就会受到污染。Yanong等[5, 6]研究认为,通过在饲料表面涂药的给药方式,会有50%~80%的药物散入水中而未被鱼类吸收,药效很低。
淀粉是一种廉价易得的农产品,广泛应用于食品包装领域;壳聚糖来自于水产品,通过甲壳素脱乙酰处理获得;明胶是一种变性蛋白质,通过胶原降解获得。这些可生物降解的多糖和蛋白质,对环境友好,已广泛用作食品包装或膜剂的制备材料[7, 8, 9]。氟苯尼考(florfenicol),[R-(R*,S*)]-2,2-二氯-N-[1(氟甲基)-2-羟基-2-[4-(甲基磺酰)苯基]乙基]-乙酰胺,是一种广谱抗菌药,对多种革兰氏阳性菌和阴性菌有效[10, 11, 12]。溶藻弧菌是流行性病原微生物的一种,可引起流行性弧菌病,导致大黄鱼群集性死亡[13]。本课题组前期开发了一种以生物可降解的聚乳酸为载体、将氟苯尼考均匀分散于载体中的颗粒状药丸,撒入海水中能保持丸药形状,且药物成分在海水中不释放或微量释放,明显减少了药物的散失,同时也达到了可计量给药的目的,经网箱养殖的大黄鱼口服给药试验证明,生物可降解基材对鱼类无毒害、对水环境无污染,可用于养殖鱼类的病害防治[14]。但由于大黄鱼体内消化系统环境为偏酸性,不利于聚乳酸水解反应的发生。为此,本研究对载体进行了改进,采用降解性的生物大分子淀粉、壳聚糖和明胶等取代聚乳酸为基材制作载体,以氟苯尼考为载药对象,制成新型颗粒状药丸。以大黄鱼养殖中常见的溶藻弧菌为考察对象,检测所制药丸的抑菌能力。在此基础上,以口服方式对网箱养殖的大黄鱼用药,提取大黄鱼的血液、肝脏和肌肉等组织对鱼体内的药动学和药物残留等进行分析,旨在为养殖鱼类病害防治中科学用药及环境保护提供一种新型的给药方式。
1 材料与方法 1.1 药剂及试剂99.2%氟苯尼考(florfenicol)标准品(中国兽医药品监察所);50%氟苯尼考粉剂(先灵葆雅动物保健公司,美国);食用玉米淀粉(山东青岛恒顺福副食品公司);壳聚糖、明胶、乙酸(≥99.5%)、乙酸乙酯(AR)和乙腈(色谱级),均购自国药集团化学有限公司;CAP-D5内标,中国兽医药品监察所提供;经肝素钠处理过的真空采血管,购自天津生物化学制药有限公司。
1.2 主要仪器BS200S-WE1电子天平(德国Sartorius公司);DW-40L92立式低温冰箱(青岛海尔公司);Freeze Zone 2.5冷冻干燥机(美国Labconco公司);C-MAG HS7磁力搅拌器(德国IKA公司);BUCHI R-210旋转蒸发仪(瑞士);S-3400N扫描电子显微镜和E-1010溅射离子泵(日本日立公司);安捷伦1100液相色谱系统(带紫外检测器,美国安捷伦公司);Oasis HLB C18固相萃取柱(150 mm×4.6 mm,5 μm);96孔细胞培养板(Corning In.,USA)。
1.3 试验用鱼及培养基大黄鱼,每条重约500g,于浙江省宁波市象山黄避岙海湾养殖基地1.5 m×1 m×2 m的网箱中饲养,养殖环境为自然海水(水温25 ℃±2 ℃,盐度2.8%,pH 7.9)。
细菌培养基购自青岛希望生物技术有限公司,将培养基用海水稀释,制成质量分数为50%的胶状溶液,经121 ℃高压蒸汽处理后,备用。 1.4 药丸和载体的制备
按表 1的组成配比,将食用玉米淀粉用蒸馏水溶解,于80 ℃水浴加热,待其完全糊化后加入体积分数为0.2%的乙酸,混合均匀后加入壳聚糖,继续加热待壳聚糖完全溶解后,再加入明胶,混合均匀后降温至60 ℃,加入50%氟苯尼考粉剂,搅拌至完全呈胶状均相后趁热倒入细胞培养板中,继续降温至30 ℃静置1 h,待其冷却后放入-40 ℃冰箱内冷冻5 h,取出放入冷冻干燥机中干燥24 h,制得每粒重约0.1 g(氟苯尼考含量5 mg)的淡黄色小颗粒状药丸(图 1),备用。以同样步骤但不加氟苯尼考制得载体。
| 表 1 氟苯尼考药丸的组成成分 Table 1 The ratios of antibiotic florfenicol pill |
 | 图 1 氟苯尼考抗菌药丸的外观(a)及浸入水中的吸水膨胀情况(b) Fig. 1 Overview of antibiotic florfenicol pills dry (a) and absortion (b) in water |
采用扫描电镜观察所制备的载体和氟苯尼考药丸的内部结构。将样品于液氮中淬断,暴露其横截面和纵截面,利用溅射离子泵对其截面喷金,然后在扫描电子显微镜下观察药丸的横截面和纵截面。
1.6 载体和药丸吸水性能测定将所制备的载体和药丸分别浸入水中,记录不同浸水时间(0.5、3、6、12、24和48 h)载体和药丸的质量,按(1)式计算吸水率。
吸水率/%=mn/m0×100(1)
其中,m0为样品的初始质量,mn为样品吸水不同时间后的质量。每个处理重复3次,结果以平均值±标准偏差 (SD) 表示。通过不同样品达到最大吸水率所需的时间判断吸水速率高低。 1.7 载体和药丸体外抑菌试验
按1.4节的方法和步骤制备载体和药丸的胶状溶液(不造粒和干燥);将接种溶藻弧菌(接菌量为1×107 CFU/mL)的细菌培养基平铺于培养皿中,厚约1 mm,每皿插入直径为5 mm 的4根杯碟管;用移液枪分别吸取载体和药丸溶液各0.1 mL,分别滴入杯碟管内,将培养皿盖好后放入培养箱中于28 ℃培养24 h后取出,观察抑菌圈大小及透明度,判断样品的抑菌能力。用体积分数为0.2%的乙酸水溶液将氟苯尼考标准品分别配制成质量浓度为64、128、256和512 μg/mL的氟苯尼考溶液作为对照。以相同条件下的细菌培养基作为参比。 1.8 载体和药丸的体内毒性及药动学检测 1.8.1 载体的毒性检测
取健康大黄鱼18条,分成3组,每组6条,其中2组分别口服所制备的载体100粒/条和200粒/条,另一组不服载体作为对照。7 d后观察大黄鱼的生活状况。 1.8.2 样品的提取与净化
设分别口服所制备的氟苯尼考药丸为P2、P3、P6和P3’(见表 1)共4个处理,每个处理60条鱼,每条口服1粒(按10 mg/kg鱼体重为药量依据),分别于喂药后1、2、4、8、12、24、48、72、96、120、168和240 h随机取5条,取其血液、肝脏和肌肉立即进行样品的提取。肝脏和肌肉样本于-20 ℃环境中贮藏,备用。血液样本经肝素钠抗凝处理后,于4 ℃、5 000 r/min条件下离心5 min,取上层血浆,置于-20 ℃条件下贮藏,备用。
将肝脏和肌肉组织匀浆,将血液样品振荡混匀。分别准确称取5 g样品于50 mL离心管中,先加入0.1 mL质量浓度为10 ng/mL的CAP-D5内标溶液,涡漩振荡混匀,再加入25 mL乙酸乙酯,振荡15 min,于4 000 r/min下离心5 min,吸取上清液,在40 ℃真空条件下旋转蒸发至近干,然后用3 mL蒸馏水溶解,再加入3 mL正己烷,涡旋振荡20 s后转移至10 mL玻璃离心管中,于4 000 r/min下离心5 min,弃去正己烷层,取水相过固相萃取柱。萃取柱先后用3 mL 体积分数为10%的甲醇水溶液和6 mL甲醇淋洗,加入1 mLV(乙腈)∶V(水)=35∶65的混合溶液洗脱。收集洗脱液并以氮气吹干,涡旋30 s,经0.22 μm滤膜过滤,得待测液。
另设试验用大黄鱼10条,以不服药丸为空白对照组,其他饲养条件同处理组,用于观测养殖条件对鱼的意外影响,不作样品提取和检测。 1.8.3 液相色谱-串联质谱检测条件 Oasis HLB C18固相萃取柱(150 mm×4.6 mm,5 μm),流动相为V(乙腈)∶V(水)=35∶65的混合溶液,进样量为20 μL,检测波长为223 nm,流速1 mL/min,燃烧室温度40 ℃。 1.9 标准溶液的配制及标准曲线的绘制
用N,N-二甲基甲酰胺(DMF)将氟苯尼考标准品分别配成2、5、10、50、100、200 ng/mL的系列标准工作溶液,通过液相色谱-串联质谱测定(DMF不影响其吸收),以氟苯尼考质量浓度为横坐标,以吸收值为纵坐标,绘制标准曲线,r≥0.998。 1.10 数据处理
数据分析采用3P97软件(中国),隔室模型为最佳模式。
2 结果与分析 2.1 载体的筛选本研究考察了m(淀粉)∶m(壳聚糖)∶m(明胶)=3∶4∶0(C1)、4∶3∶0(C2)、4∶3∶1(C3)、4∶3∶2(C4)、4∶3∶3(C5)、4∶3∶4(C6)、4∶3∶8(C7)7种基材不同配比对所制备的载体吸水性能的影响。结果表明:随明胶含量增加,载体的吸水率呈下降趋势。如C1和C2(不含明胶)显示出最高的吸水率,分别在3和6 h时达到最大值,随后载体因吸水膨胀导致分散;随明胶含量的增加,C3~C7吸水速率呈下降趋势,最大吸水率也明显下降,但载体硬度和韧度增加,如C7吸水48 h后仍保持球形形状。根据载体的吸水特性,选择有代表性的C2(不含明胶)、C3(明胶含量较低)和C6(明胶含量较高)3种载体,分别加入质量分数为10%和20%的氟苯尼考制成颗粒状药丸,并对这些药丸在大黄鱼体内的行为进行检测。 2.2 药丸的结构及吸水性
扫描电镜观察结果(图 2)显示:药丸内部呈多孔结构,孔与孔之间明显连通,且在氟苯尼考添加前后,载体内部孔隙结构变化不明显。以C3为例,孔径大小约为200 μm,层叠分布于载体内部,如此多孔结构有利于药物在其中的均匀分布。在C3中加入10%的氟苯尼考后(P3,图 2 A2和B2),其内部孔隙结构仍与C3相似。表明氟苯尼考能够均匀地分布于载体内部,没有明显改变载体的内部孔隙结构。
 |
图 2 扫描电镜观察的载体C3和药丸P3的结构
Fig. 2. Structures of sample C3 and P3
observed under SEM
A1:C3 纵截面(×100);A2:P3纵截面(×100);
B1:C3横截面(×100); B2:P3横截面(×200)
A1: Middle section of C3(×100); A2: Middle section of P3(×100); B1: Cross-section of C3(×100); B2: Cross-section of P3(×200) |
表 2显示了药丸的吸水情况。由于载体组分如淀粉、壳聚糖和明胶均具有良好的亲水性,制成多孔状的载体后也显示出了很好的可湿润性,所有药丸均具有较高的吸水率和吸水速率。其中,P2(不含明胶)吸水率和吸水速率最高,在6 h时达到最大值,随后因载体吸水膨胀导致分散。P3和P6,随着明胶含量的增加,吸水速率呈下降趋势,最大吸水率(48 h)也明显下降,但载体硬度和韧度增加;对于P3和P3’,因为P3’的氟苯尼考含量高,相应地吸水率有所下降(氟苯尼考不亲水)。
| 表 2 不同浸水时间药丸吸水率的变化 Table 2 The water uptake of pills as a function of time(mean±SD) |
图 3表明:各载体的抑菌圈较小,透明度差,表明其对溶藻弧菌的抗菌活性不明显,而P2、P3、P3’和 P6则抑菌圈较大,透明度较高,表现出较强的抗菌活性,其中P3’的抑菌圈最大,抗菌活性最强;药丸的抑菌能力主要与氟苯尼考的含量有关,而且氟苯尼考分布于载体内部后其抑菌性能得到了保持。
 |
图 3 样品抑菌试验
Fig. 3.
Bacteriostasis test of samples
a0:空白对照; C1~C7:不同配比的载体溶液;b1~b4:
质量浓度分别为64、 128、256 和 512μg/mL 的氟
苯尼考溶液; P2、P3、P3’和P6:药丸溶液。
a0: Blank; C1-C7: The carrier solution;b1-b4: florfenicol solution with concentration of 64,128,256,512μg/mL, respectively; P2,P3,P3’ and P6: The pill solution. |
载体毒性试验结果表明:各处理组和对照组大黄鱼的生活、体征相同,没有出现生长不良或死亡的现象,表明载体成分对大黄鱼安全、无毒性作用。
以P3为例,由图 4可知:经大黄鱼口服1 h后,药丸在鱼胃内仍保持较完整形状(图 4a,圆圈);12 h后已观察不到药丸的存在,说明药丸已经降解(图 4b)。
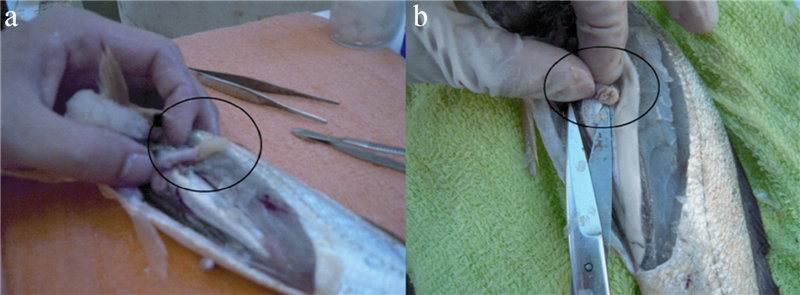 | 图 4 口服药丸P3 1h (a) 和12 h (b)后鱼肚解剖情况 Fig.4 Overview of fish stomach after it was fed by P3 pills for 1h (a) and 12 h (b) |
通常情况下,药物在血液和肝脏中的浓度要高于肌肉中的。本研究结果(见图 5)表明:大黄鱼口服药丸2~4 h后,血液和肝脏中的药物浓度达到最高,为4~6 μg/mL;4~8 h后肌肉中达到最高,cmax为2~4 μg/mL,这一结果与对罗非鱼的研究结果一致[8]。P2、 P3和P6处理的cmax高低顺序为血液>肝脏>肌肉;样品P3’的cmax高低顺序为肝脏>血液>肌肉,分析其原因可能是P3’中氟苯尼考的含量较高(是其他样品的2倍),在鱼体内更易在肝脏富集,与秦方锦等[15]的研究结果一致。李思源等[16]报道,氟苯尼考对大黄鱼养殖中常出现的8种弧菌属细菌的最小抑菌浓度在0.39~0.78 μg/mL。本研究中,大黄鱼口服药丸24 h内血液中氟苯尼考的质量浓度保持在1.0μg/mL以上,这一浓度可有效抑制溶藻弧菌或其他弧菌属的感染;96 h后,大黄鱼体内的氟苯尼考含量已达到药物残留标准以下,表明所制备的药丸在96 h后药物残留可以消解,这与直接口服氟苯尼考液剂的结果一致[15]。
由于明胶是高分子量的多肽,由27%甘氨酸、25%羟脯氨酸和脯氨酸组成[17]。明胶和淀粉主链上的OH-可以与壳聚糖的NH4+形成分子间氢键,进而形成空间互穿网络结构,使颗粒的内部结构更加紧凑[18, 19, 20],提高了三元复合载体在水中的稳定性。虽然增加明胶的添加量会使载体的吸水性能有所下降,但药丸吸水后的强度相对较高,易保持药丸形状。与P6和P3’相比,P2和P3的强度均较弱,浸入水中易溶胀直至分散,当被鱼吞食后,药物在组织中的释放较快,导致其消解速率也相对较快(图 5 a,b);而P6经大黄鱼口服96 h后,残留量较高(图 5 c),但120 h后,已检测不到药物的残留。P3’的载药量虽然高于其他样品1倍,但在口服96 h后在大黄鱼体内的残留量与其他处理间差异不显著(图 5 d)。
 |
图 5 氟苯尼考在大黄鱼体内不同组织的含量分析
Fig. 5. Florfenicol concentrations as a function of feeding time
注:a~d分别对应于P2、P3、P6和P3’处理。 Note: Pseudosciaena crocea was orally fed by treatment of P2 (a),P3 (b),P6 (c) and P3’ (d),respectively. |
结果表明:大黄鱼血液、肝脏和肌肉中的药液浓度符合一级吸收二室开放模型。由表 3和表 4可知:大黄鱼口服氟苯尼考药丸后,在其体内以较小的吸收速率被完全吸收,并在血液、肝脏和肌肉中被缓慢消解。
从表 4的 P3药代动力学参数可得,消除相半衰期(t1/2β):血液>肝脏>肌肉,符合氟苯尼考在鱼组织中浓度最大的分布趋势。曲线下的面积(AUC)代表药物吸收程度并决定其生物利用度,本研究血液中AUC 值为103 μg/(mL·h),比肝脏和肌肉中的都高,表明药物浓度越高,其被消解所需时间越长。这与Lane等给羊静脉注射氟苯尼考的结果一致[21]。
| 表 3 氟苯尼考在大黄鱼主要组织中的药代动力学方程(以P2、P3处理为例) Table 3 Pharmacokinetics equations of florfenicol in main tissues of Pseudosciaena crocea(P2,P3) |
| 表 4 氟苯尼考在大黄鱼体内药代动力学参数(以P3为例) Table 4 Pharmacokinetic parameters of florfenicol in Pseudosciaena crocea(P3) |
在前期研究的基础上,本研究对载体进行了改进,以生物大分子淀粉、壳聚糖和明胶的三元复合物为载体,将氟苯尼考均匀分散于其中,制备了氟苯尼考药丸。结果表明,药丸内部结构呈现均匀分布孔隙、孔与孔之间相互连通,有利于氟苯尼考的均匀分布和流通释放;用不同配比的载体制备的药丸均有较好的亲水性和较高的吸水率;药丸的抑菌能力与氟苯尼考的含量成正相关,虽然载体本身不具抑菌性,但也并未削弱药丸的抑菌能力。
通过对大黄鱼的血液、肝脏和肌肉中氟苯尼考含量的分析发现,在载体的包裹下,药丸中的氟苯尼考被鱼体吸收的速度比口服氟苯尼考溶液的稍慢。其在血液与肝脏中达最大浓度的速度比在肌肉中的快,且浓度也高于肌肉中的。经药代动力学分析其符合一级吸收二室开放模型。本研究所制备的氟苯尼考药丸及给药方式,可定量给药并避免散失,可避免或降低因用药过量而引起的养殖水环境的污染,具有广阔的应用前景。
| [1] | 高滢. 养殖大黄鱼的出口竞争力分析[J]. 中国农学通报, 2012, 28(20): 113-117. GAO Ying. Analysis on the export competitiveness of China's cultured large yellow croaker[J]. Chin Agric Sci Bull, 2012, 28(20): 113-117. (in Chinese) |
| [2] | 胡慧子, 任淑华, 高健. 我国大黄鱼网箱养殖污染与治理的经济学分析[J]. 上海农业学报, 2011, 27(3): 98-102. HU Huizi, REN Shuhua, GAO Jian. Economic analysis on pollution and countermeasures of large yellow croaker (Pseudosciaena crocea) marine cage culture[J]. Acta Agric Shanghai, 2011, 27(3): 98-102. (in Chinese) |
| [3] | 杨先乐, 郑宗林. 我国渔药使用现状、存在的问题及对策[J]. 上海水产大学学报, 2007, 16(4): 374-380. YANG Xianle, ZHENG Zonglin. The application status and strategy of fishery medicine in China[J]. J Shanghai Fish Univ, 2007, 16(4): 374-380. (in Chinese) |
| [4] | 王民权, 房文红, 杨先乐. 我国渔药面临的困惑、对策及展望[J]. 科学养鱼, 2006, 12(1): 1-2. WANG Minquan, FANG Wenhong, YANG Xianle. Confusions, strategies and prospects in our fishery medicine[J]. Sci Fish Farm, 2006, 12(1): 1-2. (in Chinese) |
| [5] | YANONG R P E, CURTIS E W, SIMMONS R, et al. Pharmacokinetic studies of florfenicol in koi carp and threespot gourami Trichogaster trichopterus after oral and intramuscular treatment[J]. J Aquat Anim Health, 2005, 17(2): 129-137. |
| [6] | SUN Y X, ZHAO H Y, SHAN Q, et al. Tissue distribution and elimination of florfenicol in crucian carp (Carasius auratus cuvieri) after a single dose intramuscular or oral administration[J]. Aquaculture, 2010, 309(1-4): 82-85. |
| [7] | KARNNET S, POTIYARAJ P, PIMPAN V. Preparation and properties of biodegradable stearic acid-modified gelatin films[J]. Polym Degrad Stab, 2005, 90(1): 106-110. |
| [8] | FENG J B, JIA X P, LI L D. Tissue distribution and elimination of florfenicol in tilapia (Oreochromis niloticus x O-caureus) after a single oral administration in freshwater and seawater at 28 ℃[J]. Aquaculture, 2008, 276: 29-35. |
| [9] | ZHONG Q P, XIA W S. Physicochemical properties of edible and preservative films from chitosan/cassava starch/gelatin blend plasticized with glycerol[J]. Food Technol Biotechnol, 2008, 46(3): 262-269. |
| [10] | LOBELL R D, VARMA K J, JOHNSON J C, et al. Pharmacokinetics of florfenicol following intravenous and intramuscular doses to cattle[J]. J Vet Pharm Therap, 1994, 17(4): 253-258. |
| [11] | SYRIOPOULOU V P, HARDING A L, GOLDMANN D A, et al. In vitro antibacterial activity of fluorinated analogs of chloramphenicol and thiamphenicol[J]. Antimicro Agent Chemother, 1981, 19(2): 294-297. |
| [12] | SOBAC S, PAAPE M J, FILEP R, et al. florfenicol pharmacokinetics in lactating cows after intravenous, intramuscular and intramammary administration[J]. J Vet Pharm Therap, 1995, 18(6): 413-417. |
| [13] | UEDA Y, SUENAGA I. In vitro antibacterial activity of florfenicol against Actinobacillus pleuropneumoniae [J]. J Vet Med Sci, 1995, 57(2): 363-364. |
| [14] | 陈哲昕, 竺亚斌, 徐鑫, 等. 渔用氟苯尼考缓释药丸的制备及性能测定[J]. 农药学学报, 2011, 13(5): 94-99. CHEN Zhexin, ZHU Yabin, XU Xin, et al. Manufacture and characteristics of antibiotic florfenicol pill with slow-releasing property[J]. Chin J Pest Sci, 2011, 13(5): 94-99. (in Chinese) |
| [15] | 秦方锦, 金珊, 邢晨光, 等. 氟苯尼考在大黄鱼体内的药动学及组织分布研究[J]. 水生态学杂志, 2010, 3(1): 102-106. QIN Fangjin, JIN Shan, XING Chenguang, et al. Pharmacokinetics and tissue distribution of florfenicol in large yellow croakers, Pseudosciaena crocea [J]. Chin J Hydroeco, 2010, 3(1): 102-106. (in Chinese) |
| [16] | 李思源, 邢晨光, 李凯, 等. 氟苯尼考对大黄鱼的急性毒性及体外抑菌试验[J]. 水生态学杂志, 2010, 3(3): 132-136. LI Siyuan, XING Chenguang, LI Kai, et al. Experimental study on inhibiting bacteria in vitro and acute toxicity of florfenicol to Pseudosciaena crocea[J]. Chin J Hydroeco, 2010, 3(3): 132-136. (in Chinese) |
| [17] | NADIAH N, AINI M. Biodegradable biocomposite starch based films blended with chitosan and gelatin []. Pahang: University Malaysia Pahang, 2010. |
| [18] | EASTOE J E. The amino acid composition of mammalian collagen and gelatin[J]. Biochem J, 1955, 61(4): 589-600. |
| [19] | XU Y X, KIM K M, HANNA M A, et al. Chitosan-starch composite film: Preparation and characterization[J]. Industrial Crops Prod, 2005, 21(2): 185-192. |
| [20] | MILLER K S, KROCHTA J M. Oxygen and aroma barrier properties of edible films: A review[J]. Trends Food Sci Technol, 1997, 8(7): 228-237. |
| [21] | LANE V M, WETZLICH S, CLIFFORD A, et al. Intravenous and subcutaneous pharmacokinetics of florfenicol in sheep[J]. J Vet Pharm Therap, 2004, 27(4): 191-196. |
 2014, Vol. 16
2014, Vol. 16


