2. 河北农业大学 真菌毒素与植物分子病理学实验室, 河北 保定 071001
2. The Lab of Mycotoxin and Molecular Plant Pathogen, Agricultural University of Hebei, Baoding 071001, Hebei Province, China
磺酰脲类药剂是最先由美国杜邦公司研制开发的高效、低毒、广谱型乙酰乳酸合成酶抑制剂类除草剂,是目前使用量最大的化学除草剂[1, 2]。随着其大规模使用,该类除草剂的农药残留及杂草抗药性问题已日益突出[3, 4, 5, 6]。目前有关磺酰脲类除草剂在水和土壤环境中降解行为的研究备受关注,尤其是其水解和微生物降解等方面[7, 8]。烟嘧磺隆具有活性高、杀草谱广、田间使用量低等特性,是目前磺酰脲类除草剂中应用最广泛的苗后茎叶处理剂之一[9]。由于烟嘧磺隆在土壤中较易移动,因此很容易对土壤及地下水造成污染,影响生态环境及人体健康[10, 11, 12, 13]。
目前有关微生物降解化学农药的研究已受到广泛关注。Ma等[14]从受氯嘧磺隆污染的土壤中分离到了一株假单胞菌降解菌株LW3,其在7 d内对氯嘧磺隆的降解率为81.0%。 Joshi等[15] 在1985年即从土壤中分离得到3种可降解氯磺隆的微生物,分别是黑曲霉、浅灰链霉菌和青霉,并通过研究证实黑曲霉和青霉的作用位点为磺酰脲桥,可使氯磺隆发生水解,其水解产物为相应的磺酰脲和杂环。沈东升等[16]以甲磺隆作为惟一碳源,筛选分离到了真菌、细菌和放线菌等共30多种具有降解活性的菌株。近年来,烟嘧磺隆的微生物降解也逐渐成为了研究热点。Zhang 等[17]从工业废水处理池中分离出了1株可降解烟嘧磺隆的细菌——粘质沙雷氏菌N80,其96 h内对烟嘧磺隆的降解率为93.6%,Song 等[18]从以烟嘧磺隆为惟一氮源的污泥中分离得到1株真菌黄曲霉菌株LZM1,该菌株将烟嘧磺隆完全降解的时间为5 d。张小林等[19]于2013年从被烟嘧磺隆污染的人工湿地土壤中分离得到1株能够降解烟嘧磺隆的细菌Klebsiella sp.,在35 ℃、初始pH 7.0的条件下培养10 d,其对烟嘧磺隆的降解率为99.4%。张国民等[20]从长期使用烟嘧磺隆的玉米田土壤中分离到1株能高效降解烟嘧磺隆的光合细菌J5-2菌株,经鉴定其为红假单胞菌Rhodopseudomonas sp.,菌株J5-2能耐受1 600 mg/L 的烟嘧磺隆,在pH 7.0、30 ℃下培养7 d,其对400 mg/L烟嘧磺隆的降解率为32.2%。本研究从烟嘧磺隆生产厂家的污水处理池中筛选得到1株高效降解菌株,进而研究了其可能的降解机制,探讨了微生物降解磺酰脲类除草剂的生物化学过程,以期为该类除草剂的微生物降解研究提供参考。
1 材料与方法 1.1 供试材料 1.1.1 主要仪器SW-CJ-1D超净工作台(苏州苏洁净化设备有限公司);JAC-150超声波清洗机(山东济宁奥波超声电气有限公司);Agilent 1200高效液相色谱仪(美国安捷伦公司);YM100A高压蒸汽灭菌器(上海岛韩实业有限公司);SHP-150A生化培养箱(常州恒德仪器制造有限公司);Centrifuge 5415D高速台式离心机(Eppendorf公司);KL 512型氮吹仪(北京康林科技有限责任公司)。 1.1.2 药剂及试剂
95%烟嘧磺隆(nicosulfuron)原药(山东京博农化有限公司提供);30%双氧水,0.3%的肌酸,甲醇、乙腈为色谱纯,二氯甲烷为分析纯。 1.1.3 污水样品
来自某烟嘧磺隆生产厂家的污水处理池。 1.1.4 培养基
富集培养基(g/L):蛋白胨 10,磷酸二氢钾 1,氯化钠 1,葡萄糖 1,pH 7.0;基础培养基(g/L):磷酸二氢钾 0.5,磷酸氢二钾 0.5,氯化钠 0.5,硫酸镁 0.5,pH 7.0;LB 培养基(g/L):胰蛋白胨 10,氯化钠 10,酵母提取物 5,pH 7.0。 1.2 菌株驯化及分离鉴定
将烟嘧磺隆原药添加至供试水样中,使其质量浓度为100 mg/L,于30 ℃、150 r/min下恒温振荡培养7 d。另取5 mL供试水样加入到50 mL含200 mg/L 烟嘧磺隆的富集培养基中,相同条件下培养7 d。如此重复4次,逐级提高烟嘧磺隆浓度,使其质量浓度分别为250、300、350及400 mg/L。将第4次驯化处理后含有丰富菌液的培养基均匀涂布到烟嘧磺隆质量浓度为400 mg/L的LB平板上,于30 ℃下培养8~16 h后观察,将能产生透明圈的菌落分离出来,在LB平板上纯化培养,进行菌种的保存。将该菌株命名为ND1。
通过生理生化指标及分子生物学技术对菌株进行鉴定。形态学观察及生理生化指标测定参照周德庆等[3]的方法;采用细菌通用引物27F和1492R对其16S rDNA序列进行扩增并测序,将测序结果用BLAST软件进行比对并通过MEGA构建系统发育树。鉴定完毕的菌株送中国微生物菌种保藏管理委员会普通微生物中心保藏。
1.3 菌株ND1对烟嘧磺隆的降解效率及降解产物研究将ND1菌株接种于LB平板上,30 ℃条件下培养3 d,通过血球计数板计数,用无菌水配成1×108 CFU/mL 的菌悬液。用无菌水溶解、稀释烟嘧磺隆原药,配成1 000 mg/L的母液。将配制好的母液添加至基础培养基中,使烟嘧磺隆的终质量浓度为200 mg/L。向50 mL该含药培养基中接种1 mL 1×108 CFU/mL的ND1菌悬液,以不接菌的含药培养基为对照,重复3次,置于30 ℃、150 r/min下培养4 d。取培养4 d后的菌株发酵液,用等体积的二氯甲烷萃取3次。弃水相,合并有机相,经无水硫酸钠脱水后减压浓缩至2 mL,氮吹至干,用甲醇定容至5 mL,采用高效液相色谱(HPLC)法[21, 22]检测烟嘧磺隆的质量浓度,按公式(1)计算其降解率。同时在培养过程中对菌体生长量进行检测。以未接菌的培养基为对照,采用紫外分光光度计在600 nm波长下测定菌液的吸光度(OD600),以培养时间为横坐标,OD600为纵坐标,得到其生长速率曲线。
烟嘧磺隆降解率/%= [(对照组烟嘧磺隆质量浓度-处理组烟嘧磺隆质量浓度)]/对照组烟嘧磺隆质量浓度×100 (1)
HPLC检测条件:Agilent 1200LC高效液相色谱仪;Zorbax Eclipse XDB-C18色谱柱(125 mm×4.0 mm,5 μm);柱温30 ℃;检测波长240 nm;流量1.0 mL/min;流动相V(乙睛)∶V(水)∶V(冰乙酸)=30∶70∶0.05;进样量2 μL。
采用高效液相色谱-串联质谱(HPLC-MS/MS)法对其降解产物进行测定。
HPLC检测条件:Hypersil GOLDTM C18色谱柱(150 mm×2.1 mm,5μm);流量200.0 mL/min;检测波长240 nm;梯度洗脱,流动相[V(乙睛)∶V(水)∶V(冰乙酸)]:0.00~7.00 min,15∶85∶0.05;7.00~10.00 min,10∶90∶0.05;10.00~15.00 min,10∶90∶0.05;15.00 min后,15∶85∶0.05。
MS检测条件:EI离子源,电子轰击电压 15 eV,m/z扫描范围100~400,离子源温度350 ℃。
1.4 烟嘧磺隆降解率与菌株生长速率之间的关系将1 mL浓度为1×108 CFU/mL的ND1菌悬液接种于50 mL含有200 mg/L烟嘧磺隆的基础培养基中,于30 ℃、150 r/min下培养4 d,每隔12 h取样测定菌体生长量及烟嘧磺隆质量浓度,以不接菌的、含200 mg/L烟嘧磺隆的基础培养基为空白对照,计算烟嘧磺隆的降解率和菌体生长速率。
1.5 菌株ND1降解烟嘧磺隆的影响因素研究 1.5.1 烟嘧磺隆初始浓度对降解率的影响将1 mL浓度为1×108 CFU/mL的ND1菌悬液分别接种于50 mL烟嘧磺隆质量浓度分别为50、100、200、400和800 mg/L的基础培养基中,于30 ℃、150 r/min 下培养3 d,计算其降解率,每处理设3次重复。 1.5.2 不同培养温度对降解率的影响
将1 mL浓度为1×108 CFU/mL的ND1菌悬液接种于50 mL含有200 mg/L烟嘧磺隆的基础培养基中,分别于15、20、25、30、35和40 ℃,150 r/min下振荡培养3 d,计算其降解率,每处理设3次重复。 1.5.3 不同接种量对降解率的影响
向烟嘧磺隆质量浓度为200 mg/L的基础培养基中分别接种1 mL浓度为1×105、1×106、1×107、1×108及1×109 CFU/mL的ND1菌悬液,于30 ℃、150 r/min下振荡培养3 d,计算其降解率,重复3次。
2 结果与分析 2.1 降解菌株的分离鉴定及生理生化特性
通过对污水样品中的微生物进行分离,经初筛及多次复筛得到了1株可高效降解烟嘧磺隆的菌株ND1,该菌株能在3 d内将200 mg/L的烟嘧磺隆完全降解。在LB固体培养基上培养,其菌落呈圆形,边缘不整齐,乳白色,不透明,表面粗糙有褶皱,无光泽。革兰氏染色呈阳性,芽孢为椭圆形,VP反应、淀粉水解、硝酸盐还原、柠檬酸盐利用及明胶液化试验均为阳性,苯丙酸脱氨酶试验、M.R.试验、尿酶试验及丙酸盐利用试验均为阴性,可以在含6.5% 氯化钠的LB培养基中生长。
对ND1的16S rDNA进行扩增并测序,将测序结果进行BLAST比对分析(图 1),发现ND1菌株与枯草芽孢杆菌高度同源(同源性达99%),结合生理生化特征及形态学观察结果,初步鉴定其为枯草芽孢杆菌Bacillus subtilis。目前该菌株已交由中国微生物菌种保藏管理委员会普通微生物中心保藏(菌种保藏编号:CGMCC No.8437)。
 | 图 1 ND1菌株16S rDNA聚类分析 Fig. 1 Cluster analysis of 16S rDNA of strain ND1 |
结果(图 2)表明,烟嘧磺隆降解和菌株生长之间存在负相关关系。最初菌株生长处于延迟期,其OD600值平稳上升,此时其对烟嘧磺隆的降解也较少;当菌株进入对数生长期后,OD600值上升较快,此时菌株生长旺盛,烟嘧磺隆的降解率随之升高;当菌株处于稳定生长期时,其OD600值趋于平稳,烟嘧磺隆的降解率也在短暂升高之后即趋于平稳,此时其降解率达到最大值(98%);随后菌株生长进入衰亡期,烟嘧磺隆的降解率不再发生明显变化。
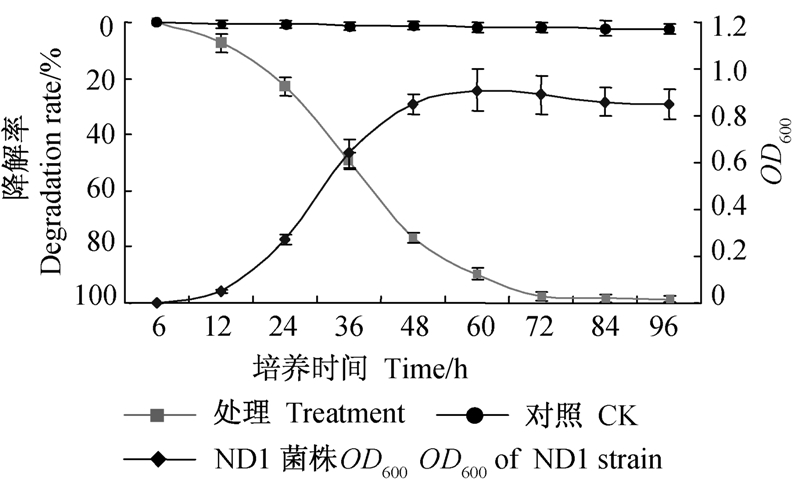 | 图 2 烟嘧磺隆降解率与ND1菌株生长速率关系曲线 Fig. 2 Curves of nicosulfuron degradation rate and the ND1 growth rate |
结果(图 3)表明,烟嘧磺隆初始浓度对ND1菌株的降解作用影响较大。该菌株对初始质量浓度为100、200和400 mg/L烟嘧磺隆的降解能力明显高于对50 mg/L烟嘧磺隆的降解能力;其中,烟嘧磺隆初始质量浓度为200 mg/L时降解率最高,为96%;但当烟嘧磺隆初始质量浓度升高至800 mg/L,该菌株对烟嘧磺隆的降解率反而降低到67.3%。其原因可能是由于该菌株可利用烟嘧磺隆作为碳源,当烟嘧磺隆浓度较低时,菌株可利用的烟嘧磺隆量相对较少,不利于其生长,因此对烟嘧磺隆的降解率也相对较低;随着烟嘧磺隆浓度升高,菌株可利用的烟嘧磺隆量增多,有利于其生长,菌含量因此增多,对烟嘧磺隆的降解率也随之增加;在达到最适降解浓度时,培养基中所含的烟嘧磺隆可为菌株提供足够的碳源,同时不会对菌体产生明显的毒性,此时菌株对烟嘧磺隆的降解率最高;而当烟嘧磺隆浓度进一步提高,菌体量已不足以利用所有的烟嘧磺隆,部分菌株可能还会受到烟嘧磺隆毒性的负面影响,因此降解率开始下降。该结果表明,ND1菌株对烟嘧磺隆的降解效果与药剂初始浓度间存在一定的相关性。
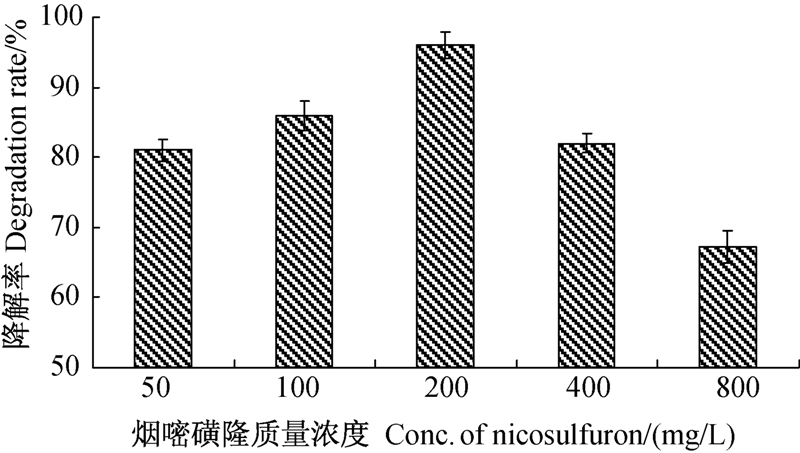 | 图 3 烟嘧磺隆不同初始浓度对ND1菌株降解作用的影响 Fig. 3 Effect of different concentrations of nicosulfuron on the degradation of strain ND1 |
结果(图 4)表明,菌株ND1对烟嘧磺隆的降解作用受温度影响较大。培养温度为15 ℃时,菌株对烟嘧磺隆的降解率仅为37.4%;35 ℃时,降解率达到最高值98.9%;当温度继续升高至40 ℃,烟嘧磺隆的降解率反而下降至86.5%。研究表明,温度过低或过高均不利于该菌株对烟嘧磺隆的降解,其最适降解温度为35 ℃左右。
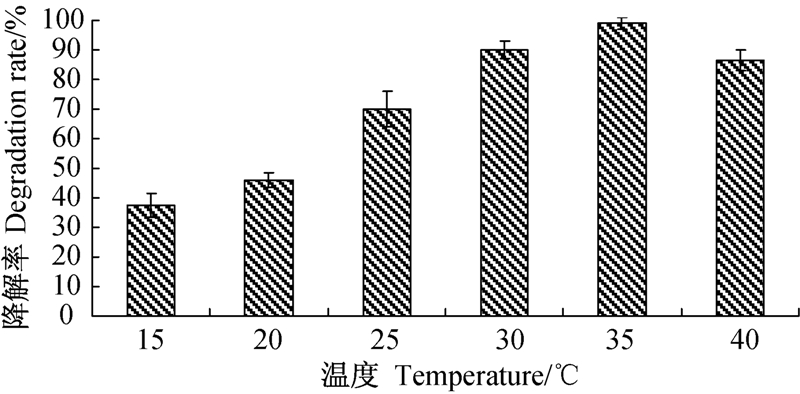 | 图 4 不同培养温度对 ND1菌株降解烟嘧磺隆的影响 Fig. 4 Effects of different temperatures on the degradation of strain ND1 |
结果(图 5)表明,ND1菌株接种量对烟嘧磺隆降解的影响也十分显著,在1×105~1×108 CFU/mL范围内,随接种量的增大降解率明显增加。其中当接种量为1×105~1×106 CFU/mL时,烟嘧磺隆的降解率增幅较大;当接种量为1×108 CFU/mL时降解率达到最大值(95.6%);之后随接种量增大,烟嘧磺隆的降解率开始下降。因此,ND1菌株降解烟嘧磺隆的最适接种量为1×108 CFU/mL左右。
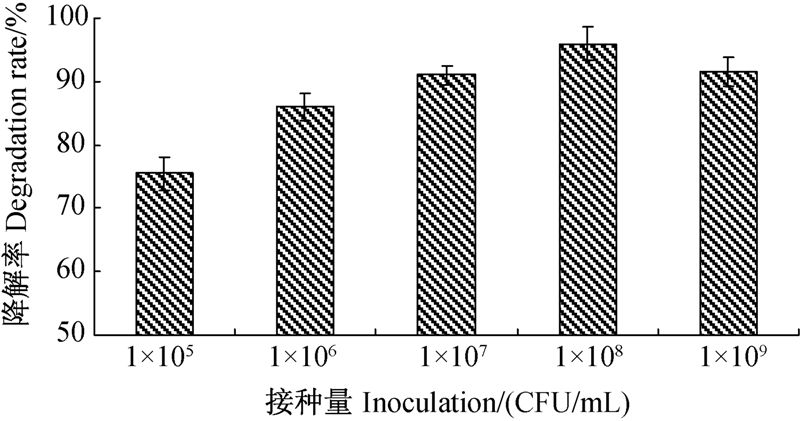 | 图 5 不同接种量对ND1菌株降解烟嘧磺隆的影响 Fig. 5 Effects of diferent inoculations on the degradation of strain ND1 |
通过HPLC-MS/MS方法对其降解产物进行分析,总粒子流图见图 6。从中可看出,烟嘧磺隆的降解共产生了2个主要成分,其中成分1的碎片离子为m/z 155.94,色谱保留时间为4.51 min,成分2的碎片离子为m/z 274.15,保留时间11.54 min,经质谱鉴定,这2种降解产物分别为2-氨基-4,6-二甲氧基嘧啶(C6H9N3O2,成分1)和磺酰胺(C9H11N3O5S,成分2),其MS谱图见图 7。其中,成分1:E/MS,m/z:155.94[M·+1]+,140.01,124.01,122.86,112.10,100.02,98.02,92.02,82.01,70.09,68.01,58.02,57.08;成分2:E/MS,m/z:274.15[M·+1]+,256.20,230.14,212.17,202.24,142.78,105.99,101.66,88.33,87.80,84.77,71.04,69.98,56.99。降解反应方程式见图 8。
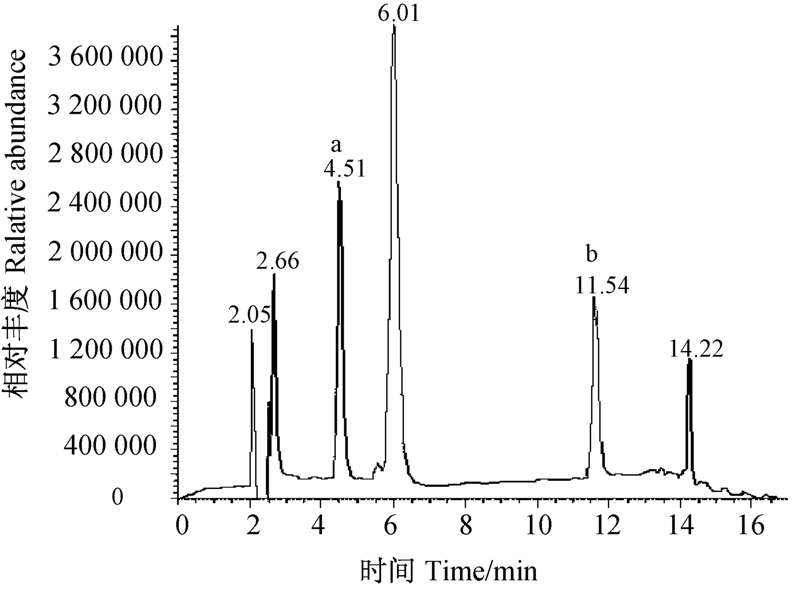 | 图 6 高效液相色谱-质谱联用仪检测烟嘧 磺隆降解的总粒子流图 Fig. 6. Diagram of total ion chromatography detected by HPLC-MS a.成分1 Component 1; b.成分2 Component 2 |
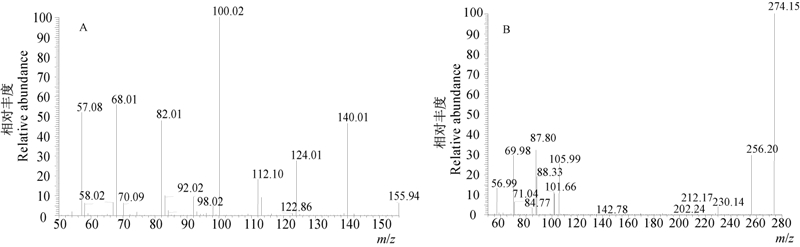 | 图 7 烟嘧磺隆降解产物质谱图 Fig. 7. Mass spectra of component 1 and component 2 A.成分1 Component 1; B.成分2 Component 2 |
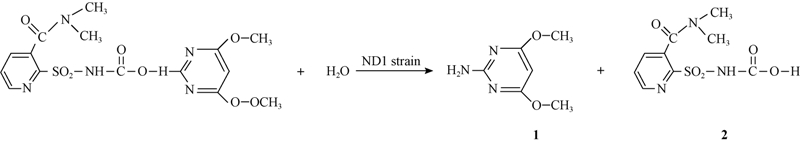 | 图 8 降解反应方程式 Fig. 8 Degradation reaction equation |
本研究从烟嘧磺隆生产厂家污水处理池中分离得到1株可高效降解烟嘧磺隆的枯草芽孢杆菌菌株ND1,其可在3 d内将200 mg/L的烟嘧磺隆完全降解,降解活性较高,有较好的研究开发价值。与本研究中ND1菌株对烟嘧磺隆的降解能力相比,张小林等[19]分离得到的细菌Klebsiella sp.及Song 等[18]从污泥中分离出的黄曲霉LZM1菌株的降解时间均较长,表明本研究所获ND1菌株的降解能力相对较强。其原因可能是由于菌株来源于污染程度不同的介质,因而其对烟嘧磺隆的耐受性不同。本研究中菌株来源于烟嘧磺隆生产厂家的污水处理池,其烟嘧磺隆含量较高,菌株易驯化,因此降解效率更高。
菌株ND1降解烟嘧磺隆的可能作用方式为其所产生的代谢产物作用于烟嘧磺隆的磺酰脲键,使桥键发生断裂而产生代谢产物2-氨基- 4,6-二甲氧基嘧啶和磺酰胺。至于所产生的2种降解产物是否具有副作用以及如何进一步降解,尚需进一步深入研究。本研究中,菌株ND1在35 ℃、接种量为1×108 CFU/mL、烟嘧磺隆初始质量浓度为200 mg/L条件下降解率最高。当烟嘧磺隆初始质量浓度为50 mg/L时,菌株ND1对其的降解率有所降低,即该菌株对烟嘧磺隆的最佳降解浓度与环境中的实际残留值有一定差距。因此对该菌株进一步进行优化、培养,使其能够在实际应用中发挥最大作用将是下一步研究的重点。
| [1] | POFELIS S, LE H, GRANT W F. The development of sulfonylurea herbicide-resistant birdsfoot trefoil (Lotus corniculatus) plants from in vitro selection[J]. Theor Appl Genet, 1992, 83(4): 480-488. |
| [2] | LAROSSA R A, SCHLOSS J V. The sulfonylurea herbicide sulfometuron methyl is an extremely potent and selective inhibitor of acetolactate synthase in Salmonella typhimurium[J]. J Biol Chem, 1984, 259(14): 8753-8757. |
| [3] | RATHINASABAPATHI B, KING J. Herbicide resistance in Datura innoxia: kinetic characterization of acetolactate synthase from wild-type and sulfonylurea-resistant cell variants[J]. Plant Physiol, 1991, 96(1): 255-261. |
| [4] | SAARI L L, COTTERMAN J C, PRIMIANI M M. Mechanism of sulfonylurea herbicide resistance in the broadleaf weed, Kochia scoparia[J]. Plant Physiol, 1990, 93(1): 55-61. |
| [5] | LEE K Y, TOWNSEND J, TEPPERMAN J, et al. The molecular basis of sulfonylurea herbicide resistance in tobacco[J]. EMBO J, 1988, 7(5): 1241-1248. |
| [6] | TRANEL P J, WRIGHT T R. Resistance of weeds to ALS-inhibiting herbicides: what have we learned?[J]. Weed Sci, 2002, 50(6): 700-712. |
| [7] | BICHET-HEBE I, POURCHER A M, SUTRA L, et al. Detection of a whitening fluorescent agent as an indicator of white paper biodegradation: a new approach to study the kinetics of cellulose hydrolysis by mixed cultures[J]. J Microbiol Methods, 1999, 37(2): 101-109. |
| [8] | XU J, LI X S, XU Y J, et al. Biodegradation of pyrazosulfuron-ethyl by three strains of bacteria isolated from contaminated soils[J]. Chemosphere, 2009, 74(5): 682-687. |
| [9] | SABADIE J. Nicosulfuron: alcoholysis, chemical hydrolysis, and degradation on various minerals[J]. J Agric Food Chem, 2002, 50(3): 526-531. |
| [10] | 金劲松, 王玉平, 程小虎, 等. 烟嘧磺隆OF防除玉米田杂草的效果及安全性[J]. 杂草科学, 2009(4): 54-55. JIN Jinsong, WANG Yuping, CHENG Xiaohu, et al. Control effect and security of nicosulfuron of against weeds in corn field[J]. Weed Sci, 2009(4): 54-55. (in Chinese) |
| [11] | 张伟, 王进军, 张忠明, 等. 烟嘧磺隆在土壤中的吸附及与土壤性质的相关性研究[J]. 农药学学报, 2006, 8(3): 265-271. ZHANG Wei, WANG Jinjun, ZHANG Zhongming, et al. Adsorption of nicosulfuron on soilsand its correlation with soil properties[J]. Chin J Pestic Sci, 2006, 8(3): 265-271. (in Chinese) |
| [12] | 武菊英, MATHIASSEN S, KUDSK P. 杂草种类、叶龄及药后降水时间对烟嘧磺隆药效的影响[J]. 农药学学报, 2003, 5(1): 77-81. WU Juying, MATHIASSEN S, KUDSK P. The influence of weed species, leaf stage and rainfastness on the performance of nicosulfuron[J]. Chin J Pestic Sci, 2003, 5(1): 77-81. (in Chinese) |
| [13] | 徐建民, 黄昌勇, 安曼, 等. 磺酰脲类除草剂对土壤质量生物学指标的影响[J]. 中国环境科学, 2000, 20(6): 491-494. XU Jianmin, HUANG Changyong, AN Man, et al. Effect of sulfonylurea herbicides on biological indicators characterizing the soil quality[J]. China Environ Sci, 2000, 20(6): 491-494. (in Chinese) |
| [14] | MA J P, WANG Z, LU P, et al. Biodegradation of the sulfonylurea herbicide chlorimuron-ethyl by the strain Pseudomonas sp. LW3[J]. FEMS Microbiol Lett, 2009, 296(2): 203-209. |
| [15] | JOSHI M M, BROWN H M, ROMESSER J A. Degradation of chlorsulfuron by soil microorganisms[J]. Weed Sci, 1985, 33(6): 888-893. |
| [16] | 沈东升, 方程冉, 周旭辉. 土壤中降解甲磺隆除草剂的微生物的分离与筛选[J]. 上海交通大学学报: 农业科学版, 2002, 20(3): 186-189. SHEN Dongsheng, FANG Chengran, ZHOU Xuhui. Isolation and selection of microorganism degrading metsulturon-methyl herbicide in soil[J]. J Shanghai Jiaotong Univ: Agric Sci, 2002, 20(3): 186-189. (in Chinese) |
| [17] | ZHANG H, MU W, HOU Z, et al. Biodegradation of nicosulfuron by the bacterium Serratia marcescens N80[J]. J Environ Sci Health B, 2012,47(3): 153-160. |
| [18] | SONG J L, GU J G, ZHAI Y, et al. Biodegradation of nicosulfuron by a Talaromyces flavus LZM1[J]. Bioresour Tech, 2013, 140: 243-248. |
| [19] | 张小林, 李咏梅, 袁志文. 微生物-化学水解联合作用下烟嘧磺隆的降解[J]. 环境科学, 2013, 34(7): 2889-2893. ZHANG Xiaolin, LI Yongmei, YUAN Zhiwen. Degradation of nicosulfuron by combination effects of microorganisms and chemical hydrolysis[J]. Environ Sci, 2013, 34(7): 2889-2893. (in Chinese) |
| [20] | 张国民, 张松柏, 刘勇, 等. 一株降解烟嘧磺隆光合细菌的分离鉴定及降解特性研究[J]. 环境污染与防治, 2011, 33(5): 18-26. ZHANG Guomin, ZHANG Songbai, LIU Yong, et al. Isolation and identification of a nicosulfuron degrading strain J5-2 and its degradation characteristics[J]. Environ Pollut Control, 2011, 33(5): 18-26. (in Chinese) |
| [21] | POLATI S, BOTTARO M, FRASCAROLO P, et al. HPLC-UV and HPLC-MSn multiresidue determination of amidosulfuron, azimsulfuron, nicosulfuron, rimsulfuron, thifensulfuron methyl, tribenuron methyl and azoxystrobin in surface waters[J]. Analyt Chim Acta, 2006, 579(2): 146-151. |
| [22] | ZHOU Q X, WANG W D, XIAO J P. Preconcentration and determination of nicosulfuron, thifensulfuron-methyl and metsulfuron-methyl in water samples using carbon nanotubes packed cartridge in combination with high performance liquid chromatography[J]. Analyt Chim Acta, 2006, 559(2): 200-206. |
 2014, Vol. 16
2014, Vol. 16


