机体的氧化系统通常处于动态平衡中,但在农药、电辐射、环境持久性污染物及某些特定药物的刺激下,会诱导其氧化应激效应[1]。氧化应激效应研究是农药水生毒理学研究的重要内容[2],其中酶类抗氧化物质含量及活性是评价农药对生物抗氧化系统毒性效应的重要指标,如超氧化物歧化酶(Cu/Zn-SOD,Mn-SOD)[3, 4]、过氧化氢酶(CAT)[3, 5]及谷胱甘肽过氧化物酶(GSH-Px)[4]等。同时有研究表明,氧化损伤与脂质过氧化产物丙二醛(MDA)的积累[4,6-7]有关。
螺虫乙酯(spirotetramat)是2008年由拜耳作物科学公司开发的一种季酮酸类衍生物杀虫剂,是迄今发现的惟一双向内吸性广谱杀虫剂[8]。其作用机制主要是抑制昆虫体内乙酰辅酶A羧化酶(ACCase)活性,从而干扰脂肪的生物合成。目前国内外对螺虫乙酯的研究主要集中在合成工艺[9]、药效[10, 11]及毒性效应[12, 13]等方面。研究显示,螺虫乙酯对西方静走螨Galendromus occidental、桃蚜Myzus persicae等靶标生物若虫的毒性比对成虫的强,其对成虫的毒性主要是影响产卵及卵的孵化[14, 15]。有关螺虫乙酯对非靶标生物影响的研究很少,Agbohessi等[16]研究发现,螺虫乙酯对非洲鲶鱼胚胎的急性毒性LC50值为8.44 mg/L,属中等毒性,同时发现其能使非洲鲶鱼胚胎发育延迟,并可干扰幼鱼的游动平衡。迄今为止尚未见针对螺虫乙酯对水生生物毒性效应的其他相关研究报道。笔者采用“半静态法”[17],研究了螺虫乙酯对斑马鱼的急性毒性及对氧化应激的影响,旨在探索螺虫乙酯对水生生物的毒性效应。
1 材料与方法 1.1 试验动物
受试斑马鱼Danio rerio平均体长(3.28±0.14)cm,平均体重(0.37±0.04)g(鱼龄>7个月)。购于浙江省杭州市花鸟市场,根据体型、体色等区别,将雌、雄鱼分别饲养于独立的养殖单元(20 L立架形玻璃水槽,由上海海圣水族设备厂生产),水温(25±1.0) ℃,光照与黑暗周期为14 h/10 h,每日早晚各喂食一次丰年虫Eubranchipus vernalis。驯养7 d后,随机选取健康活泼的雌性斑马鱼供试,以尽量减少除药物本身以外其他因素如性别差异等对试验结果的影响。
1.2 试剂及主要仪器98.7%的螺虫乙酯(spirotetramat)原药(由拜耳作物科学公司提供);UNIQ-10柱式Trizol总RNA抽提试剂盒,M-MuLV第一链cDNA合成试剂盒,荧光定量(SYBR Green I)PCR试剂盒以及相关引物均购于上海生工生物股份有限公司;过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD分型)测试盒,丙二醛(MDA)含量测试盒及总蛋白定量测试盒(考马斯亮蓝法)均购于南京建成生物工程研究所。
LEGEND MICRO 21R冷冻离心机及1510全波段酶标仪(美国赛默飞世尔科技公司);SX716溶解氧仪(上海三信仪表厂);AL-204电子天平及S20 pH计(梅特勒托利多仪器有限公司);AB SteponePlusTM荧光定量PCR仪(美国应用生物系统公司);GBM 350 RE手持式高速匀质器(罗伯特·博世有限公司);2720型96孔PCR扩增仪(美国应用生物系统公司);单道可调量程移液器(德国艾本德股份公司)等。
1.3 试验方法 1.3.1 急性毒性试验采用“半静态法”[17]。螺虫乙酯原药用丙酮溶解并配制成9 700、8 200、7 000、5 900 和5 000 mg/L的母液,分别加入到各处理组中,使得水中螺虫乙酯的最终质量浓度分别为9.7、8.2、7.0、5.9和5.0 mg/L,以[V(丙酮)∶ V (曝气自来水)=1∶1 000]的处理为空白对照。每处理设3个重复,每个重复2 L水,10条斑马鱼。每24 h更换1次药液[18]。试验用水均为曝气24 h以上的自来水,水温(25±1.0) ℃,pH 7.0±0.5,试验期间不喂食。每24 h观察、记录斑马鱼的中毒症状和死亡情况,计算各处理组24、48、72和96 h的死亡率。结果用DPS数据统计软件处理,求出LC50值和95%置信区间[19]。
1.3.2 28 d染毒试验及样品收集采用“半静态法”[17]。螺虫乙酯原药用丙酮溶解并配制成1 800、360和36 mg/L的母液,分别加入到各处理组,使得水中螺虫乙酯的最终质量浓度分别为1 800、360和36 μg/L,以[V(丙酮)∶V (曝气自来水)=1∶1 000]的处理为空白对照。每处理设3个重复,每个重复3 L水,15条斑马鱼。每24 h更换1/3药液。每天连续曝气4 h(溶解氧浓度≥8.0 mg/L),早晚各喂食1次丰年虫。其余同1.3.1节。染毒28 d后解剖斑马鱼,将肌肉组织用液氮处理,存于-80 ℃冰箱,待氧化应激反应相关酶活性及基因表达量检测。
1.3.3 基因表达量测定 1.3.3.1 总RNA提取及cDNA合成采用UNIQ-10柱式Trizol总RNA抽提试剂盒提取斑马鱼肌肉组织中的总RNA,并按照M-MuLV第一链cDNA合成试剂盒反转录合成cDNA。
1.3.3.2 RT-PCR检测基因表达量扩增反应体系总体积为25 μL,其中含Hotstart Fluo-PCR mix 12.5 μL,F-prime和R-prime(引物序列[4]见表 1)各1.25 μL,模板cDNA 1.0 μL,ddH2O 9.0 μL。93 ℃预变性2 min,然后以93 ℃ 5 s、55 ℃ 20 s和72 ℃ 20 s的循环反应35个循环。
1.3.4 酶活性测定根据酶活性测定试剂盒标注的方法,用0.86%的生理盐水在冰上制备得到质量分数分别为1%和10%的斑马鱼肌肉组织匀浆液,离心后取上清液,用于测定CAT、GSH-Px、Cu/Zn-SOD和Mn-SOD活性及 MDA 含量。CAT 活力单位定义为1 U/g prot,GSH-Px、Cu/Zn-SOD和Mn-SOD活力单位定义为 1 U/mg prot,MDA含量单位为μmol/g prot。采用考马斯亮蓝法[20]测定样品中总蛋白的浓度。
1.4 数据处理通过2-ΔΔC\-T法[21]计算基因的相对表达量。以β-actin为内参基因,以空白对照组(CK)为参比基因计算目标基因的相对表达量[式(1)]。
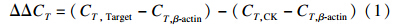
式中,CT为每个PCR反应管内荧光信号达到设定阈值所经历的循环数;Target表示农药处理组。
运用DPS数据处理软件进行单因素方差分析,采用LSD检验法比较对照组和试验组的组间差异,其中P<0.05 表示差异显著,P<0.01为差异极显著。结果采用平均值±标准差表示。
2 结果与分析 2.1 急性毒性
测得螺虫乙酯对雌性斑马鱼的LC50值分别为9.61 mg/L(72 h)和7.21 mg/L(96 h),95%置信限区间分别为8.69~12.07和6.91~7.56 mg/L。该结果与Agbohessi等[16]测得的螺虫乙酯对非洲鲶鱼胚胎的96 h-LC50值(8.44 mg/L)接近。根据GB/T 21281—2007《危险化学品鱼类急性毒性分级试验方法》[22]中鱼类96 h急性毒性的分级标准,螺虫乙酯对雌性斑马鱼属于中等毒性。其96 h-LC50值拟合曲线如图 1所示。
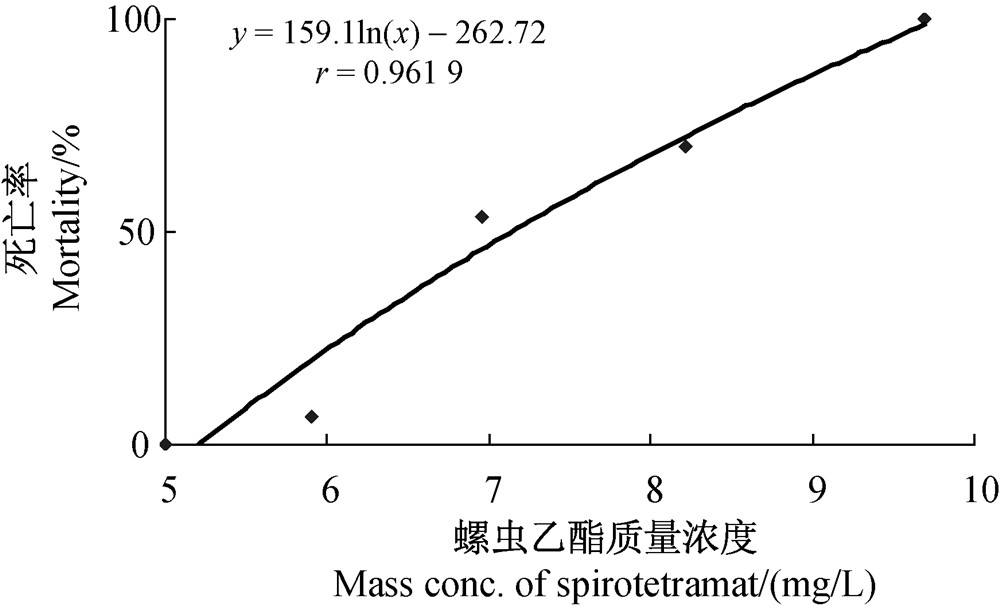 | 图 1 96 h-LC50拟合曲线Fig. 1 Fitted curve of 96 h-LC50 |
2.2 螺虫乙酯对斑马鱼肌肉组织的氧化应激效应
28 d染毒试验期间,所有供试鱼均未出现死亡、病害、行为异常等可观测到的异常现象。
2.2.1 对MDA含量的影响MDA是生物膜内多种不饱和脂肪酸过氧化反应后的产物[23],其含量高低可反映生物体内的氧化压力水平,MDA含量越高,表明氧化压力越大[24]。螺虫乙酯对斑马鱼肌肉组织中MDA含量的影响见图 2。与空白对照组相比,36 μg/L螺虫乙酯处理组中MDA的含量极显著升高,说明螺虫乙酯诱导了斑马鱼肌肉组织中细胞的脂质过氧化反应;但随着处理浓度增加,MDA的含量呈下降趋势,当水中螺虫乙酯质量浓度达到1 800 μg/L时,斑马鱼肌肉肌肉组织中MDA的含量与对照组差异不显著。
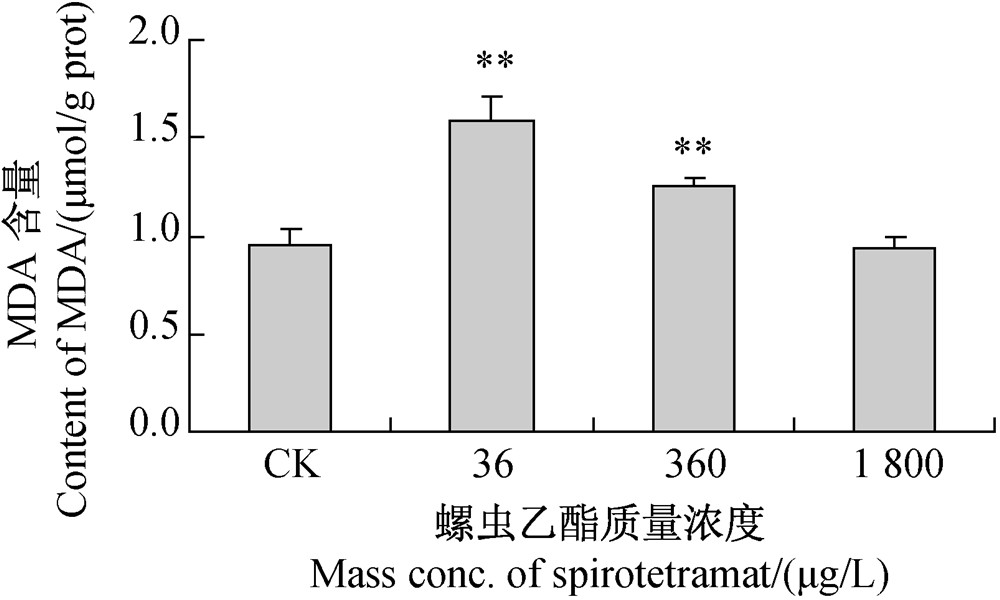 | 注:**表示与空白对照组相比差异极显著(P<0.01)。 Note: ** Represents statistically significant difference when compared with the control at P<0.01.图 2 不同浓度螺虫乙酯对斑马鱼肌肉组织中MDA含量的影响Fig. 2 Effect of various concentrations of spirotetramat on MDA contents in zebrafish muscle tissue |
2.2.2 对氧化应激系统相关酶的影响
超氧化物歧化酶(SOD)是一类抗氧化酶,其催化O-2·发生歧化反应,分解为H2O2和 O2[25]。Cu/Zn-SOD和Mn-SOD是其中较常见的2种类型,Cu/Zn-SOD主要存在于细胞质中,Mn-SOD则主要存在于真核细胞的线粒体和原核生物中。
图 3中结果表明,与空白对照组相比,不同浓度螺虫乙酯对斑马鱼肌肉组织中Cu/Zn-SOD活性水平及Cu/Zn-Sod基因相对表达量均无明显影响,说明在本试验条件下,Cu/Zn-SOD可能未参与机体的抗氧化作用。
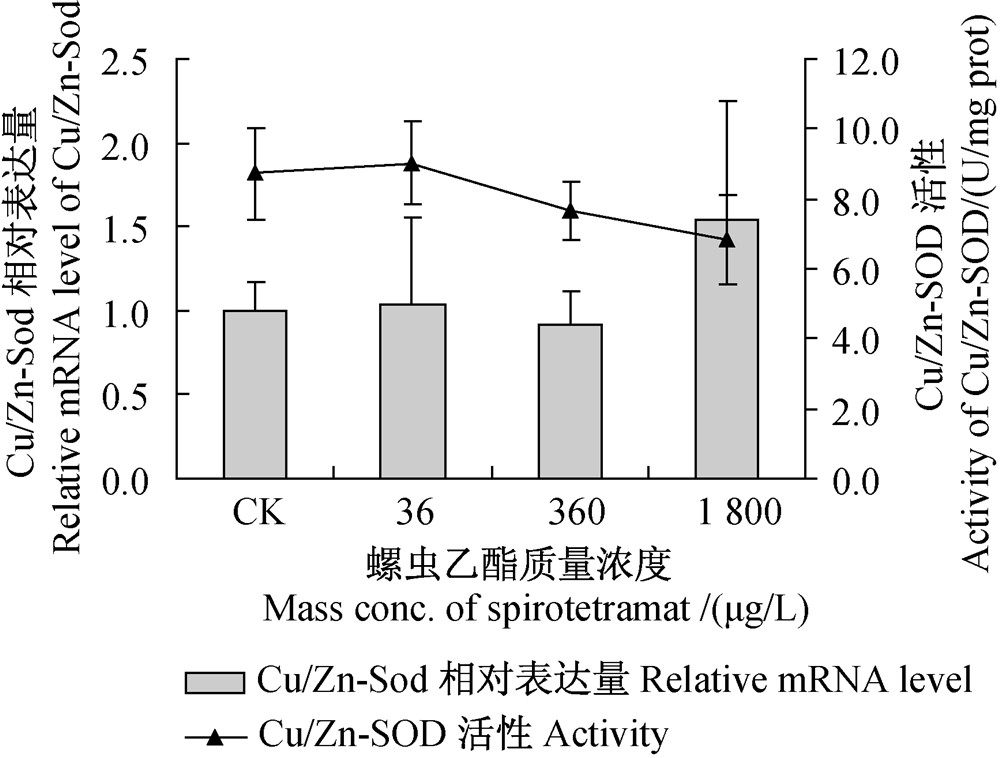 | 图 3 不同浓度螺虫乙酯对斑马鱼肌肉组织中Cu/Zn-SOD活性及Cu/Zn-Sod相对表达量的影响Fig. 3 Effect of various concentrations of spirotetramat on Cu/Zn-SOD activity and relative Cu/Zn-Sod mRNA expression level in zebrafish muscle tissue |
经不同浓度螺虫乙酯处理后,雌性斑马鱼肌肉组织中Mn-SOD活性及Mn-Sod相对表达量均呈现先上升后下降的变化趋势(图 4)。总体而言,各处理均显著提高了Mn-Sod的相对表达量,但对其酶活性水平则无明显影响。
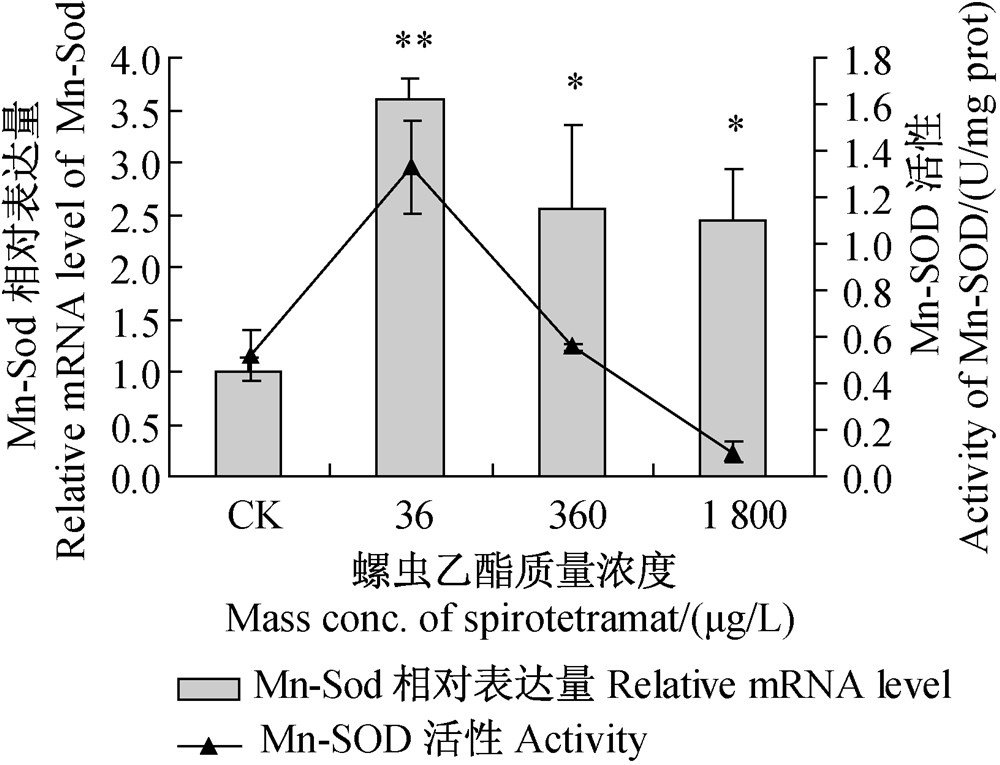 | 图 4 不同浓度螺虫乙酯对斑马鱼肌肉组织中Mn-SOD活性及Mn-Sod相对表达量的影响Fig. 4 Effect of various concentrations of spirotetramat on Mn-SOD activity and relative Mn-Sod mRNA expression level in zebrafish muscle tissue |
过氧化物酶体系中的CAT可催化H2O2进一步分解为H2O和 O2,与SOD构成机体抗氧化的第一道屏障[26]。螺虫乙酯对斑马鱼肌肉组织中CAT活性及Cat相对表达量的影响见图 5。与空白对照组相比,CAT活性随螺虫乙酯处理浓度的增大而升高,表现出一定的剂量-效应关系。较低浓度的螺虫乙酯可显著提高Cat在肌肉组织中的相对表达量,但当其质量浓度达到1 800 μg/L时,Cat的相对表达量则明显降低。值得注意的是,1 800 μg/L螺虫乙酯处理组CAT活性和Cat相对表达量变化趋势截然相反,该结果与莠去津处理雌性斑马鱼肝脏和卵巢后的情况类似[4]。分析可能是由于基因的相对表达量始终处于动态变化中,试验中检测到的Cat相对表达量仅能反映特定时间点下的情况,而酶的活性水平则更多地受蛋白翻译水平的影响[4],暗示CAT的活性可能受蛋白翻译水平的控制而非基因表达水平。
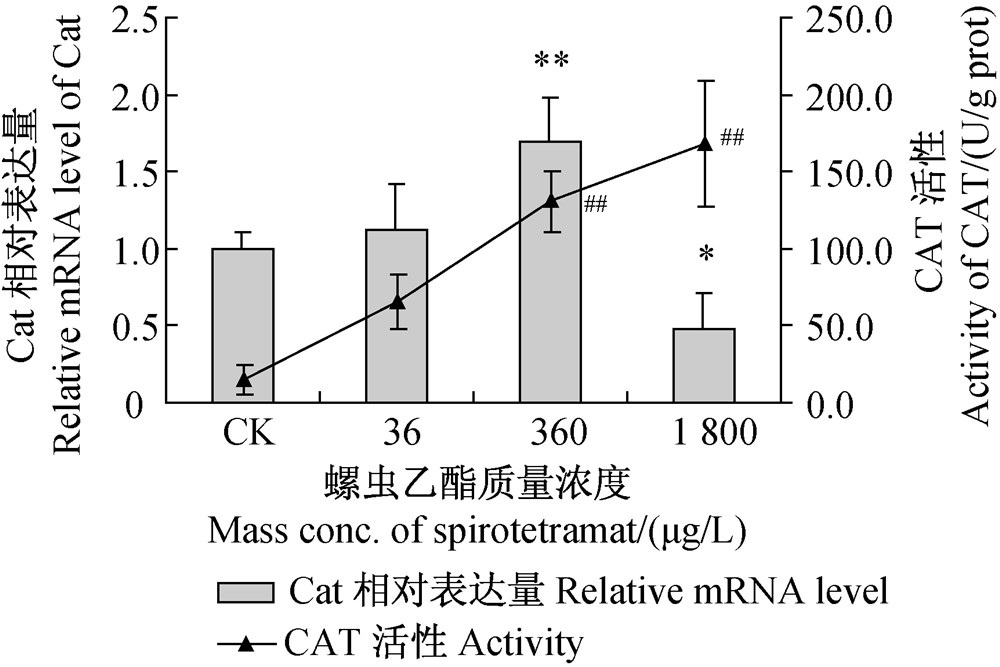 | 注:*和#分别表示基因相对表达量和酶活性与空白对照组相比差异显著(P<0.05);** 和## 表示差异极显著(P<0.01)。 Note:The asterisk and pound sign represent statistically significant difference among activities and relative mRNA levels respectively,when compared with the control, *and # at P<0.05; ** and ## at P<0.01. 图 5 不同浓度螺虫乙酯对斑马鱼肌肉组织中CAT活性及Cat相对表达量的影响Fig. 5 Effect of various concentrations of spirotetramat on CAT activity and relative Cat mRNA expression level in zebrafish muscle tissue |
GSH-Px也是一种抗氧化酶,其功能是移除细胞内的H2O2,但只起辅助作用。经不同浓度螺虫乙酯处理后,斑马鱼肌肉组织中Gpx表达量及GSH-Px活性的变化大致相同,均随着螺虫乙酯处理浓度的升高呈现先升高后降低的趋势(图 6)。与空白对照组相比,360 μg/L螺虫乙酯处理组Gpx的相对表达量差异极显著,36和360 μg/L处理组GSH-Px活性显著升高;而1 800 μg/L处理组GSH-Px活性及Gpx相对表达量与对照均无明显差异。
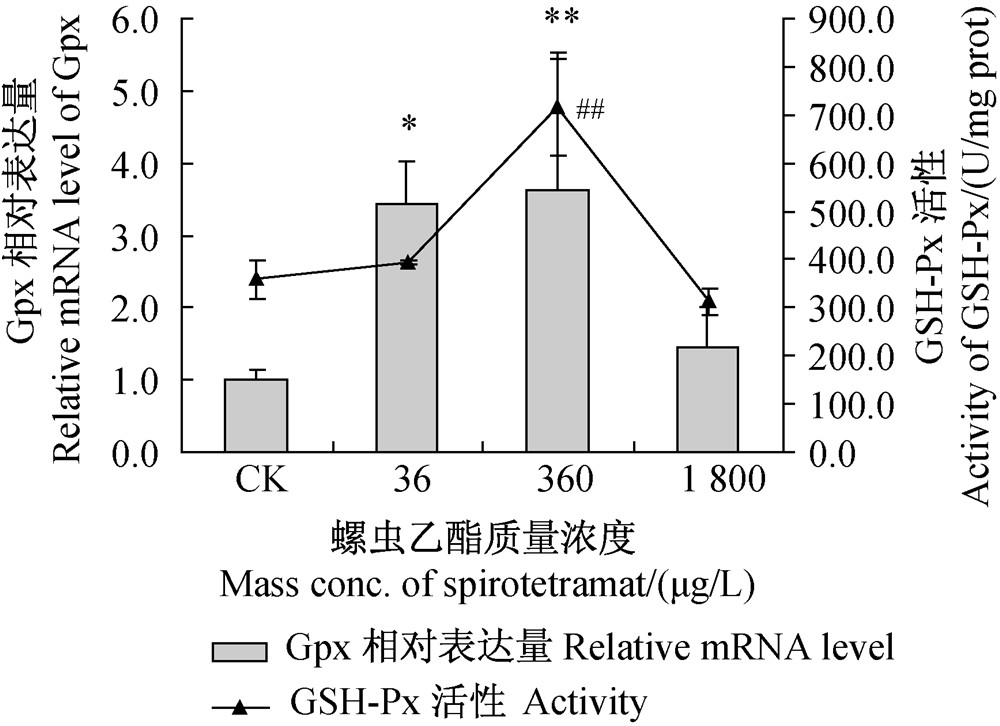 | 注:*和#分别表示基因相对表达量和酶活性与空白对照组相比差异显著(P<0.05);** 和## 表示差异极显著(P<0.01)。 Note:The asterisk and pound sign represent statistically significant difference among activities and relative mRNA levels respectively,when compared with the control, *and # at P<0.05; ** and ## at P<0.01.图 6 不同浓度螺虫乙酯对斑马鱼肌肉组织中GSH-Px活性及Gpx相对表达量的影响Fig. 6 Effect of various concentrations of spirotetramat on GSH-Px activity and relative Gpx mRNA expression level in zebrafish muscle tissue |
3 结论与讨论
活性氧簇(ROS)是生物体内分子氧(O2)被还原过程中的一系列性质活泼、氧化性强的含氧物质,在需氧生物体内必不可少。正常情况下ROS在生物体内保持动态平衡,即其产生和消除处于平衡状态。当生物体遭受外界不利因素的影响时,会通过改变细胞内SOD、CAT和GSH-Px等抗氧化酶的活性或其基因的表达量,以提高机体清除ROS的能力,减少氧化损害[27]。但当组织中ROS浓度不断升高,超出机体的抗氧化能力时即会诱导氧化应激效应的产生,其危害包括DNA的氧化损伤、脂质过氧化、蛋白质和单糖的氧化等[28, 29, 30, 31]。本研究结果显示,36 μg/L螺虫乙酯处理组斑马鱼肌肉组织中MDA的含量极显著高于空白对照组,达对照的1.5倍,推测螺虫乙酯对斑马鱼机体产生了一定的氧化压力;但随着处理浓度升高,MDA含量呈下降趋势,1 800 μg/L处理组MDA含量与对照组没有明显差异(图 2)。这可能是由于CAT发挥了抗氧化作用(图 4),随着螺虫乙酯浓度的增加,CAT的活性逐步上升,增强了机体对H2O2的清除能力,减少了组织中ROS的浓度,从而导致MDA的含量下降。此外,经一定浓度的螺虫乙酯处理后,雌性斑马鱼肌肉组织中MDA的含量极显著升高,并可引起CAT、GSH-Px和Mn-SOD等抗氧化酶活性及其基因相对表达量发生变化,表明螺虫乙酯能够诱导雌性斑马鱼肌肉组织的氧化应激效应,并可能引起机体的氧化损伤。但由于机体中基因表达水平处于动态变化中,本研究仅检测了其中某个时间点的表达量变化情况,因此并不能全面反映螺虫乙酯对上述抗氧化酶系统中相关基因相对表达量的影响。下一步应对基因的表达量进行动态检测,研究不同浓度螺虫乙酯处理对基因表达的动态影响,以探究MDA变化的准确机制。
| [1] | PARK E J, JO H J, JUNG J. Combined effects of pH, hardness and dissolved organic carbon on acute metal toxicity to Daphnia magna[J]. J Ind Eng Chem, 2009, 15(1): 82-85. |
| [2] | 杨楠, 杨柳. 我国水污染现状及防治对策[J]. 四川环境, 1997, 16(3): 52-55. YANG Nan, YANG Liu. Present water pollution status and its control countermeasures[J]. Sichuan Environ, 1997, 16(3): 52-55. (in Chinese) |
| [3] | SHI Xiangguo, GU Aihua, JI Guixiang, et al. Developmental toxicity of cypermethrin in embryo-larval stages of zebrafish[J]. Chemosphere, 2011, 85(6): 1010-1016. |
| [4] | JIN Yuanxiang, ZHANG Xiangxiang, SHU Linjun, et al. Oxidative stress response and gene expression with atrazine exposure in adult female zebrafish (Danio rerio)[J]. Chemosphere, 2010, 78(7): 846-852. |
| [5] | COELHO S, OLIVEIRA R, PEREIRA S, et al. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels[J]. Aquat Toxicol, 2011, 103(3-4): 191-198. |
| [6] | RICHETTI S K, ROSEMBERG D B, VENTURA-LIMA J, et al. Acetylcholinesterase activity and antioxidant capacity of zebrafish brain is altered by heavy metal exposure[J]. Neuro Toxicology, 2011, 32(1): 116-122. |
| [7] | VOQUEZ O M, VALENTINE H L, AMARNATH K, et al. Copper accumulation and lipid oxidation precede inflammation and myelin lesions in N,N-diethyldithiocarbamate peripheral myelinopathy[J]. Toxicol Appl Pharmacol, 2008, 229(1): 77-85. |
| [8] | 叶萱. 具新颖作用机制杀虫杀螨剂——螺虫乙酯[J]. 世界农药, 2011, 33(5): 54-55. YE Xuan. A novel insecticidal acaricide:spirotetramat[J]. World Pestic, 2011, 33(5): 54-55. (in Chinese) |
| [9] | WANG Zongchen, XU Bingrong, CHENG Jingli, et al. Synthesis and crystal structure of 2-oxo-3-phenyl-1-oxaspiro[4.5]dec-3-en-4-yl 4-chlorobenzoate[J]. Chin J Struct Chem, 2011, 30(11): 1675-1679. |
| [10] | 谢文, 吴青君, 徐宝云, 等. 螺虫乙酯对烟粉虱的防治效果评价[J]. 中国蔬菜, 2011(14): 69-73. XIE Wen, WU Qingjun, XU Baoyun, et al. Evaluation on the effect of spirotetramat on controlling Bemisia tabaci[J]. Chin Veget, 2011(14): 69-73. (in Chinese) |
| [11] | KAY I R, HERRON G A. Evaluation of existing and new insecticides including spirotetramat and pyridalyl to control Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae) on peppers in Queensland[J]. Aust J Entomol, 2010, 49(2): 175-181. |
| [12] | LEFEBVRE M, BOSTANIAN N J, THISTLEWOOD H M A, et al. A laboratory assessment of the toxic attributes of six 'reduced risk insecticides' on Galendromus occidentalis (Acari: Phytoseiidae)[J]. Chemosphere, 2011, 84(1): 25-30. |
| [13] | MOSCARDINI V F, GONTIJO P D C, CARVALHO G A, et al. Toxicity and sublethal effects of seven insecticides to eggs of the flower bug Orius insidiosus (Say) (Hemiptera: Anthocoridae)[J]. Chemosphere, 2013, 92(5): 490-496. |
| [14] | BEERS E H, SCHMIDT R A. Impacts of orchard pesticides on Galendromus occidental is: lethal and sublethal effects[J]. Crop Prot, 2014, 56: 16-24. |
| [15] | BRÜCK E, ELBERT A, FISCHER R, et al. Movento®, an innovative ambimobile insecticide for sucking insect pest control in agriculture: biological profile and field performance[J]. Crop Prot, 2009, 28(10): 838-844. |
| [16] | AGBOHESSI P T, IMOROU TOKO I, HOUNDJI A, et al. Acute toxicity of agricultural pesticides to embryo-larval and juvenile African catfish Clarias gariepinus[J]. Arch Environ Contam Toxicol, 2013, 64(4): 692-700. |
| [17] | 阎雷生. 国家环境保护局化学品测试准则[M]. 北京: 化学工业出版社, 1990. YAN Leisheng. NEPA Guidelines for Testing of Chemicals[M]. Beijing: Chemical Industry Press, 1990. (in Chinese) |
| [18] | ZHAO Xuesong, WANG Shutao, WU Yuan, et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish[J]. Aquat Toxicol, 2013, 136-137: 49-59. |
| [19] | 唐启义. DPS数据处理系统: 实验设计、统计分析及数据挖掘[M]. 北京: 科学出版社, 2010. TANG Qiyi. DPS Data Processing System: Experimental Design, Statistical Analysis and Data Mining[M]. Beijing: Science Press, 2010. (in Chinese) |
| [20] | 郭颖娜, 孙卫. 蛋白质含量测定方法的比较[J]. 河北化工, 2008, 31(4): 36-37. GUO Yingna, SUN Wei. Comparison of method in determination of protein content[J]. Hebei Chemical Industry, 2008, 31(4): 36-37. (in Chinese) |
| [21] | KENNETH LIVAK J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 -△△C\-T method[J]. Methods, 2001, 25(4): 402-408. |
| [22] | GBT 21281—2007. 危险化学品鱼类急性毒性分级试验方法[S]. 北京: 中国质检出版社, 2008. GBT 21281—2007. Test method of fish acute toxicity for dangerous chemical products[S]. Beijing: China Zhijian Publishing House, 2008. (in Chinese) |
| [23] | DRAPER H H, SQUIRES E J, MAHMOOCH H, et al. A comparative evaluation of thiobarbituric acid methods for the determination of malondialdehyde in biological materials[J]. Free Radical Biol Med, 1993, 15(4): 353-363. |
| [24] | 熊道文, 方涛, 陈旭东, 等. 纳米材料对斑马鱼的氧化损伤及应激效应研究[J]. 环境科学, 2010, 31(5): 1320-1327. XIONG Daowen, FANG Tao, CHEN Xudong, et al. Oxidative stress effects and damage of nanoscale TiO2 and ZnO on zebrafish[J]. Environ Sci, 2010, 31(5): 1320-1327. (in Chinese) |
| [25] | KUMAR O, SUGENDRAN K, VIJAYARAGHAVAN R. Oxidative stress associated hepatic and renal toxicity induced by ricin in mice[J]. Toxicology, 2003, 41(3): 333-338. |
| [26] | DAOUD A, SAUD A, SUDHIR K, et al. Oxidative stress and genotoxic effect of zinc oxide nanoparticles in freshwater snail Lymnaea luteola L.[J]. Aquat Toxicol, 2012, 124-125: 83-90. |
| [27] | MOREL Y, BAROUKI R. Repression of gene expression by oxidative stress[J]. Biochem J, 1999, 342(3): 481-496. |
| [28] | VALAVNIDIS A, VLAHOGIANNIl T, DASSENAKIS M, et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants[J]. Ecotoxicol Environ Saf, 2006, 64 (2): 178-189. |
| [29] | LIU Yang, WANG Jianshe, WEI Yanhong, et al. Induction of time-dependent oxidative stress and related transcriptional effects of perfluorododecanoic acid in zebrafish liver[J]. Aquat Toxicol, 2008, 89 (4): 242-250. |
| [30] | LUSHCHAK V I. Environmentally induced oxidative stress in aquatic animals[J]. Aquatic Toxicology, 2010, 101(1): 13-30. |
| [31] | DA ROSA C E, KURADOMI R Y, ALMEIDA D V, et al. GH overexpression modifies muscle expression of anti-oxidant enzymes and increases spinal curvature of old zebrafish[J]. Experimental Gerontology, 2010, 45(6): 449-456. |
 2014, Vol. 16
2014, Vol. 16


