小麦纹枯病(wheat sharp eyespot)又称小麦尖眼点病,主要是由禾谷丝核菌Rhizoctonia cerealis Van der Hoeven引起的一种土传真菌病害,该病在世界主要小麦产区均有发生[ 1,2 ]。近年来,小麦纹枯病在我国呈现明显北移趋势,对北方冬麦区危害日益严重,已成为冬小麦优质高产的严重障碍之一[ 3,4 ]。虽然已初步获得稳定的小麦纹枯病抗源,但尚无较好的抗病品种应用于生产[ 5,6 ]。目前我国对该病的防治主要是采用三唑类杀菌剂拌种或喷施井冈霉素。由于长期大量使用单一或同类杀菌剂,小麦纹枯病菌已出现对药剂敏感性降低现象或产生了不同程度的抗药性,化学防治效果明显下降[ 7,8,9 ]。
噻呋酰胺(trifluzamide),化学名称为2′,6′-二溴-2-甲基-4′-三氟甲氧基-4-三氟甲基-1,3-噻二唑-5-羟酰苯胺,是由孟山都公司研制、陶氏益农公司开发的一种兼具保护和治疗作用的内吸性杀菌剂,可防治多种作物病害,特别是对担子菌门丝核菌属真菌引起的病害有很好的防治效果。目前,该药剂在我国登记主要用于防治水稻纹枯病[ 10 ]。噻呋酰胺的主要作用机理是抑制病原菌三羧酸循环中的琥珀酸脱氢酶[ 11 ]。关于噻呋酰胺防治小麦纹枯病的研究较少,仅有国内3篇文献报道该药剂对小麦纹枯病的防效优于井冈霉素或三唑类药剂[ 12, 13, 14 ]。有关小麦纹枯病菌对噻呋酰胺的抗药性风险尚未见报道。
本研究旨在建立小麦纹枯病菌对噻呋酰胺的敏感基线,探究实验室条件下小麦纹枯病菌对噻呋酰胺产生抗药性突变的可能性及所获抗药性突变体的生物学性状,以评估小麦纹枯病菌对噻呋酰胺的抗药性风险,为小麦纹枯病的科学防治提供理论依据。
1 材料与方法 1.1 供试材料
药剂:97%噻呋酰胺(trifluzamide)原药,上海江莱化学科技有限公司;95%三唑酮(triadimefon)原药,山东大成农药工业股份公司;60%井冈霉素(jinggangmycin)原药,浙江钱江生物化学股份有限公司;97%戊唑醇(tebuconazole)原药和96.5%丙环唑(propiconazole)原药,山东华阳科技股份有限公司;95%咯菌腈(fludioxonil)原药和95%多菌灵(carbendazim)原药,由农业部农药检定所提供。
菌株:2011—2013年,从山东淮坊、河南鹤壁和河北邯郸等市冬麦田采集小麦纹枯病株,采用组织分离法分离病原菌,将感病组织长出的菌丝进行单菌丝顶端分离纯化后转入马铃薯蔗糖琼脂(PSA)培养基上,于4 ℃冰箱中保存。分离获得的166株小麦纹枯病菌,经细胞核染色和菌丝融合群测定均为禾谷丝核菌R. cerealis,且同属于AGD菌丝融合群。
小麦品种:石新828(冀审麦2005004)和良星99(国审麦2006016)均为感纹枯病品种,分别由河北省石家庄市小麦新品种新技术研究所和山东省德州市良星种子研究所选育。
培养基:PSA固体培养基(马铃薯200 g,蔗糖20 g,琼脂粉15 g,蒸馏水1 000 mL);PS液体培养基(马铃薯200 g,蔗糖20 g,蒸馏水1 000 mL);WA培养基(琼脂粉 10 g,蒸馏水1 000 mL)。
1.2 研究方法 1.2.1 小麦纹枯病菌对噻呋酰胺的敏感性测定采用菌丝生长速率法[ 15 ]。将各原药先溶于少量丙酮,再用0.1%的吐温-80无菌水配成500 μg/mL的母液,继而稀释成10、5、2.5、1、0.5、0.25、0.1和0.05 μg/mL系列浓度后,与PSA培养基按体积比1∶9 的比例混合,制成最终含农药量分别为1、0.5、0.25、0.1、0.05、0.025、0.01和0.005 μg/mL的PSA平板。以加同体积无菌水的PSA平板为对照。
用打孔器在PSA平板上培养4 d的各供试菌株边缘打取直径为5 mm的菌饼,菌丝面向下接种到含不同浓度药剂的平板上,每皿接种1个菌饼,每处理浓度3次重复,于25 ℃黑暗条件下倒置培养4 d后,采用十字交叉法测量各处理菌落直径(cm)。按(1)式计算各处理对菌丝生长的抑制率(%),并建立毒力回归方程,得到有效抑制中浓度(EC50)值。

根据小麦纹枯病菌对噻呋酰胺的敏感性,从邯郸(HD)、邢台(XT)、石家庄(SJ)、保定(BD)和淮坊(WF) 5个麦区采集的菌株中,各随机选取3株相对敏感的纹枯病菌菌株,参考1.2.1节方法,将各菌株分别接种到含噻呋酰胺质量浓度分别为0.3、0.2、0.15、0.1、0.08和0.06 μg/mL的PSA平板上,以不含药剂的平板作对照。每处理3次重复,于25 ℃下黑暗倒置培养4 d后,根据培养基上菌丝的生长情况,确定噻呋酰胺对所选亲本菌株的最低抑制质量浓度(MIC)值。
1.2.2.2 药剂连续选择驯化将随机选取的15株小麦纹枯病菌敏感菌株(作为各菌株的亲本菌株)在PSA平板上、25 ℃黑暗培养4 d后,于菌落边缘打取直径为5 mm的菌饼,菌丝面朝下转接于含0.01 μg/mL噻呋酰胺的PSA平板上,3 d后将该平板上生长相对较快的菌落再转移至含有相同剂量噻呋酰胺的PSA平板上。每菌株接种24皿,每皿5块。之后每隔3 d 转接1次,并逐渐增加噻呋酰胺的质量浓度,直至抗药性突变体能够在含最低抑制质量浓度(MIC,0.15 μg/mL)噻呋酰胺的PSA平板上较好地生长为止。在显微镜下切取单细胞菌丝进行纯化。以各亲本菌株为对照,分别按(2)和(3)式计算各抗药性突变体的抗药性水平和药剂驯化突变频率[ 16 ]。

方法①:参照赵卫松等的方法[ 17 ]进行,但为提高抗药性突变体紫外线诱导的成功率,改变了紫外线照射时间和照射距离。将1.2.2.2节中随机选取的15株小麦纹枯病菌敏感菌株在25 ℃下培养4 d,制成直径5 mm 的菌饼,接入PSA平板上,置于已预热15 min的紫外灯(20 W,254 nm)下方垂直距离20 cm 处,分别照射20、40、60、80、120和180 s,之后置于黑暗条件下培养40 min(降低光修复)。切取约8 mm×8 mm的菌丝块于红外灯(220 V,15 W)下接种于含噻呋酰胺(MIC)的PSA平板上,每菌株接种24皿,每皿5块。用Parafilm封口膜封口后,置于25 ℃、黑暗条件下培养。以未经紫外诱导的各亲本菌株作对照。 3 d后每天观察纹枯病菌各菌株菌丝块的生长状况,当菌株在含药平板上长出不规则的扇形角变后,再将角变区菌丝转接至WA培养基上,显微镜下切取单细胞菌丝进行纯化。将纯化后的菌丝再转接到含MIC噻呋酰胺的PSA平板上,能较好生长的菌株即为抗药性突变体,统计突变菌株数量并标记。以各纹枯病菌亲本为对照,按照(2)式测定并计算抗药性突变体的抗药性水平,并按(4)式计算抗药性突变频率。
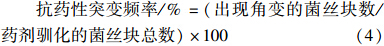
方法②:参考崔晓岚等的方法[ 18 ]。将15 株小麦纹枯病菌菌株在PSA平板上于25 ℃下黑暗培养4 d后,置于紫外灯(20 W,254 nm)下方垂直距离20 cm处,分别照射 5、10、15、20和30 min,并于黑暗条件下放置45 min。随后打取直径5 mm的菌饼,菌丝面朝下转接于含MIC噻呋酰胺的PSA平板上。每亲本菌株接种24皿,每皿6个菌饼,于25 ℃、黑暗条件下倒置培养。待产生扇形角变区后按照本节方法测定其抗药性水平,按(4)式计算抗药性突变频率。
1.2.3 抗药性突变体与其亲本菌株的主要生物学性状测定 1.2.3.1 抗药性突变体生长速率及菌核形成将抗药性突变体及其亲本菌株在PSA培养基上于25 ℃下黑暗培养4 d后,在靠近菌落边缘处打取直径5 mm的菌饼,接种到未含药的PSA培养基平板上,各菌株接种4皿,于相同条件下培养。每间隔24 h测定一次菌落直径,计算各皿菌落的平均直径,比较抗药性突变体与其亲本菌株菌丝生长速率的差异。继续培养21 d后记录每平皿上抗药性突变体和亲本菌株形成菌核的数量。将各菌株菌核拣出后在80 ℃烘箱烘干至恒重,称取每平皿菌核干重[ 19 ]。
分别将抗药性突变体及其亲本菌株接入到100 mL PS 液体培养基中,每瓶接5个菌饼,振荡培养(25 ℃,120 r/min)7 d,菌丝经布氏漏斗过滤后于80 ℃烘箱内烘干,称量菌丝干重[ 21 ]。各菌株重复3瓶。
1.2.3.2 抗药性突变体的致病力采用温室苗期麦粒接种法[ 22 ]测定抗药性突变体的致病力。将小麦籽粒煮熟后装入100 mL三角瓶中,每瓶40 g,高压灭菌(121 ℃,2 h)并冷却后,分别接入活化的纹枯病菌亲本菌株及抗药性突变体,每瓶接种5个菌饼。置于25 ℃培养箱中培养,每天振摇1次,以使病菌在籽粒上生长均匀并防止结块,14 d后得到小麦纹枯病菌接种体。
预接种的小麦种子先用1%的次氯酸钠表面消毒1 min,再用无菌水冲洗5次,置于25 ℃培养箱中保温催芽,露白后播入装有1 kg灭菌土(120 ℃,2 h)的营养钵中,每钵15粒,周围撒入8 g小麦纹枯病菌接种体,其后表面覆盖一层2 cm厚灭菌土。设无接种病菌载体为对照。每个菌株在小麦品种石新828和良星99上的接种处理均设3次重复,每菌种每重复接种3钵。将营养钵置于18~25 ℃温室内培养(光照/黑暗=14 h/10 h),28 d后参考汪敏等的分级标准调查纹枯病发病情况[ 22 ],按(5)式计算病情指数。小麦纹枯病苗期病情分级标准[ 22 ]:0级,无症状;1级,外层叶鞘变褐或有明显的纹枯病斑,但病斑直径小于叶鞘周长的1/2;3级,外层叶鞘有明显的纹枯病斑,病斑直径大于叶鞘周长的1/2,但内层叶鞘无症状;5级,内层叶鞘变褐或有明显的纹枯病斑,但病斑直径小于叶鞘周长的1/2;7级,内层叶鞘有明显的纹枯病斑,病斑直径大于叶鞘周长的1/2,但不死苗;9级,死苗。

将所获各抗药性突变体和各亲本菌株在不含噻呋酰胺的PSA平板上依次继代培养16代,原始亲本菌株记为F0代,按菌丝生长速率法分别测定其F0、F4、F8、F12及F16代对噻呋酰胺的敏感性。
1.2.3.4 噻呋酰胺与不同杀菌剂之间的交互抗性按菌丝生长速率法分别测定所获抗噻呋酰胺突变体及其亲本菌株对噻呋酰胺、三唑酮、井冈霉素、戊唑醇、咯菌腈、丙环唑和多菌灵的敏感性。多菌灵原药先用0.1 mol/L的盐酸溶液溶解,其他原药先溶于少量丙酮,然后分别配制系列浓度药液并制成含不同原药质量浓度的PSA平板。将噻呋酰胺对纹枯病菌抗噻呋酰胺突变体及亲本菌株的EC50值作为x 轴,其他6种药剂对抗噻呋酰胺突变体及亲本菌株的EC50值为y轴,分别进行线性回归分析,求出线性回归方程 y=bx + a,根据决定系数(R2)及P值,分析噻呋酰胺与其他药剂之间的交互抗性关系[ 23 ]。
1.2.4 数据处理采用DPS v6.55版软件的Duncan氏新复极差法对试验数据进行差异显著性分析。
2 结果与分析 2.1 小麦纹枯病菌对噻呋酰胺敏感基线的建立
噻呋酰胺对采自河北、河南和山东的166株小麦纹枯病菌的平均EC50值为(0.072±0.022)μg/mL,最大值和最小值分别为 0.140和0.030 μg/mL,前者仅是后者的4.68倍。所有纹枯病菌菌株对噻呋酰胺的敏感性频率呈连续单峰曲线分布(图 1),未出现敏感性明显下降的病原菌亚群体,总体接近正态分布,因此可将该群体的平均EC50值(0.072 μg/mL±0.022 μg/mL)作为小麦纹枯病菌对噻呋酰胺的敏感基线。
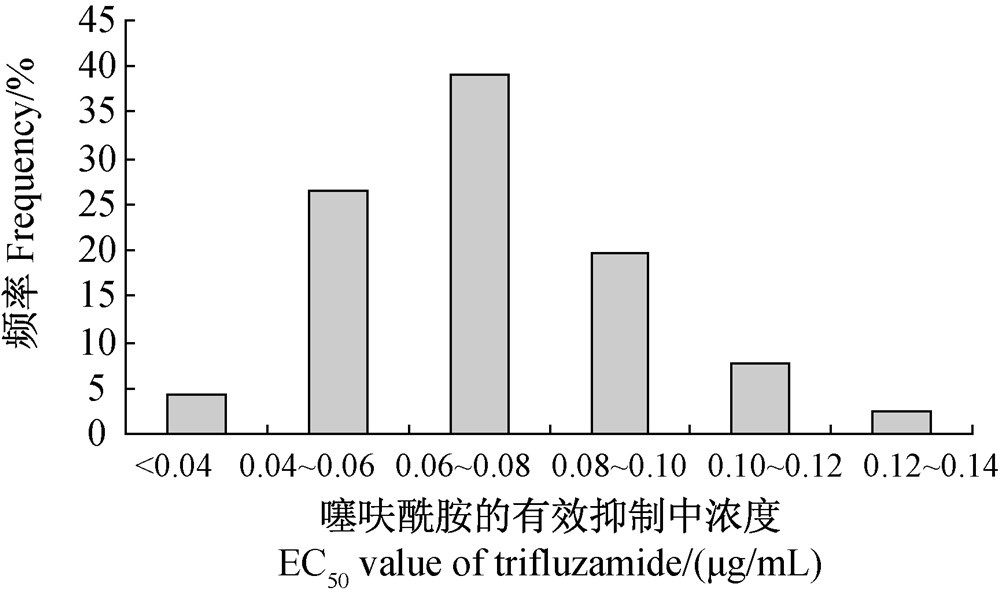 | 图 1 166株小麦纹枯病菌对噻呋酰胺的敏感性频率分布Fig. 1 Baseline sensitivity distribution of 166 isolates of R. cerealis to trifluzamide |
2.2 不同地区小麦纹枯病菌对噻呋酰胺的敏感性差异
在供试的166株小麦纹枯病菌菌株中,河北邯郸菌株间的EC50最大值和最小值分别为0.034和0.140 μg/mL,差异倍数最大,为4.18倍;其次是山东淮坊,菌株间的EC50最大值和最小值相差3.79倍;其他地区菌株间的EC50值差异倍数在2.45~3.49倍之间。但在9个地区中,所有菌株的平均EC50值在0.060~0.077 μg/mL之间,地区间小麦纹枯病菌菌株对噻呋酰胺的敏感性无显著差异(表 1)。
| 表 1 不同地区小麦纹枯病菌对噻呋酰胺的敏感性Table 1 Sensitivity of R. cerealis isolates collected from different regions to trifluzamide |
通过紫外照射方法对随机选取的15株小麦纹枯病菌菌株进行诱导后,仅以亲本菌株BD18、HD7-7、HD14和XT14共获得了5株抗药性突变体,突变频率为1.26%;突变体分别编号为BD18-4U、BD18-9U、HD7-7U、HD14-2U和XT14-4U,抗药性水平为5.5~18.9倍(表 2)。但是,采用药剂驯化法诱导纹枯病菌对噻呋酰胺的抗药性菌株,驯化15代后,15株亲本菌株均未能获得抗噻呋酰胺的突变体。
| 表 2 小麦纹枯病菌抗药性突变体对噻呋酰胺的抗药性水平Table 2 Resistance level of the resistant mutants of R. cerealis to trifluzamide |
由小麦纹枯病菌抗药性突变体的生长情况(表 3)可知,24 h内菌株BD18-9U、BD18-4U和HD7-7U的菌落直径均显著小于各自亲本菌株,而菌株HD14-2U和XT14-4U与亲本菌株差异不明显;随着时间的延长,各突变体的菌落直径与各自亲本菌株间差异均不显著(P=0.05)。5株抗药性突变体的菌丝干重均明显低于各自亲本菌株,各突变体菌丝干重减少量在0.06~0.09 g/瓶之间。与各自亲本菌株相比,所有抗药性突变体的菌核生成数量和菌核干重均明显降低,其中HD14-2U菌核数量和干重降幅最大,分别减少13.0 个/皿和8.7 mg/皿,其次是BD18-9U,菌核数量和干重分别减少11.3 个/皿和7.8 mg/皿,HD7-7U的降幅最小。
| 表 3 小麦纹枯病菌抗噻呋酰胺突变体生长情况Table 3 Growth of the resistant mutants of R. cerealis to trifluzamide |
2.4.2 致病力
致病力测定结果(图 2)表明,与亲本菌株相比,仅有突变体HD7-7U对石新828的致病力没有明显降低,其余所得抗药性突变体对石新828和良星99的致病力均明显下降,2品种的病情指数下降范围分别在2.9~18.9和4.5~10.5之间。
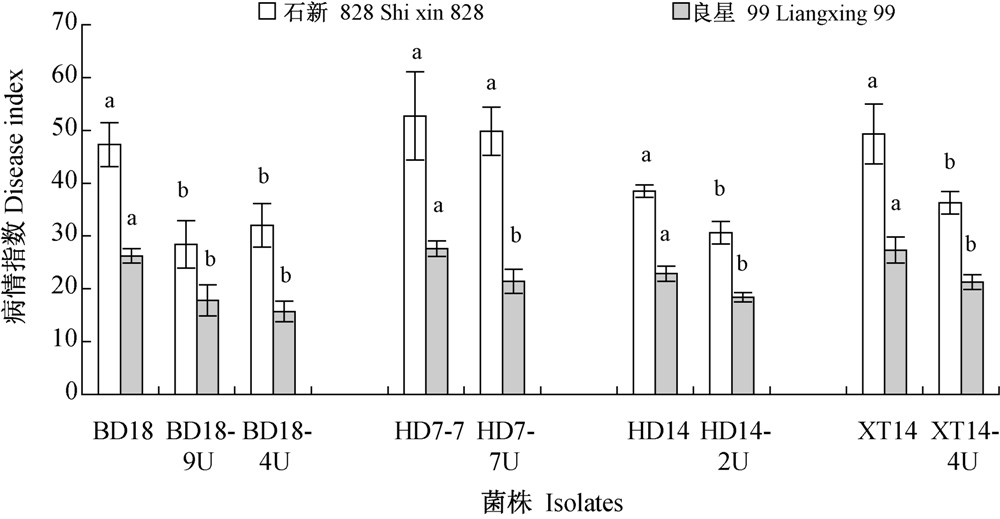 | 注:BD18、HD7-7、HD14和XT14为亲本菌株,其余为抗药性突变体。图中不同字母表示菌株亲本及其突变体对同一小麦品种的致病力经Duncan氏新复极差法检验在P=0.05水平差异显著。 Note: BD18,HD7-7,HD14 and XT14 are parent isolates; others are resistant mutants to trifluzamide. The different letters in the figure show the virulence of parent isolates and its resistant mutants to the same wheat cultivar was significant difference at P=0.05 level by Duncan′s new multiple range tests.图 2 小麦纹枯病菌抗噻呋酰胺突变体及亲本菌株对2个品种小麦苗期的致病力Fig. 2 Virulence of resistant mutants and parent isolates on two wheat cultivars at seedling stage |
2.5 小麦纹枯病菌抗噻呋酰胺突变体的抗药性遗传稳定性
在不含噻呋酰胺的PSA培养基上连续继代培养16代后,5株抗药性突变体对噻呋酰胺的敏感性均呈明显上升趋势(表 4)。其中,突变体BD18-9U、HD7-7U 和XT14-4U的F16代 EC50值均接近于各自亲本菌株(F0),BD18-4U和HD14-2U的F16代 EC50值分别为0.316和0.169 μg/mL,均明显低于各自亲本菌株。表明经紫外线照射诱导获得的5株抗噻呋酰胺突变体的抗药性均不能稳定遗传。
| 表 4 小麦纹枯病菌抗噻呋酰胺突变体的抗药性遗传稳定性Table 4 Resistance stability of the resistant mutants of R. cerealis to trifluzamide |
2.6 噻呋酰胺与其他杀菌剂之间的交互抗性
试验测得抗噻呋酰胺突变体及其亲本菌株对其他6种供试杀菌剂的敏感性由强到弱依次为咯菌腈>戊唑醇>丙环唑>三唑酮>井冈霉素>多菌灵,其平均EC50值依次为0.010、0.028、0.081、0.250、0.508和1.147 μg/mL(表 5)。交互抗性分析结果(表 6)显示:噻呋酰胺EC50值与该6种杀菌剂的EC50值之间的决定系数(R2)分别为0.006 8、0.013 1、0.006 2、0.035 3、0.040 7和0.086 1,相应的F检验P值均大于0.001,表明噻呋酰胺与三唑酮、井冈霉素、戊唑醇、咯菌腈、丙环唑和多菌灵之间均无交互抗性。
| 表 5 小麦纹枯病菌抗噻呋酰胺突变体及亲本对不同杀菌剂的敏感性Table 5 Sensitivity of the trifluzamide-resistant mutants of R. cerealis to different fungicides |
| 表 6 小麦纹枯病菌对噻呋酰胺及其他6种杀菌剂的交互抗性Table 6 Cross-resistance between trifluzamide and other six fungicides in R. cerealis |
3 结论与讨论
本研究采用菌丝生长速率法测定了166株小麦纹枯病菌对噻呋酰胺的敏感性。结果表明,供试小麦纹枯病菌对噻呋酰胺具有较高的敏感性,该群体的敏感性频率分布呈连续单峰曲线,平均EC50值为(0.072±0.022)μg/mL,可作为小麦纹枯病菌对噻呋酰胺的敏感基线。该基线略高于Chen等[ 20 ]建立的水稻纹枯病菌(立枯丝核菌)对噻呋酰胺的敏感基线[(0.058±0.012)μg/mL],这可能是不同病原菌之间的自然差异。不同地区间小麦纹枯病菌菌株的EC50最大值和最小值相差4.68倍,其原因可能是来自于不同地区菌株间的自然差异。
在一定的选择压力或者逆境中,病原菌对不同杀菌剂均可能会产生抗药性。刘英华[ 21 ]通过室内药剂连续抗药性选育,获得了小麦纹枯病菌抗戊唑醇、井冈霉素、丙环唑、 NFDA1 醚唑和咯菌腈的突变菌系。夏晓明[ 24 ]通过药剂筛选和紫外诱导获得了3株对戊唑醇具有不同抗药性水平的小麦纹枯病菌突变体。张骞等[ 25 ]利用紫外线诱变获得了40个抗甲基立枯磷的小麦纹枯病菌突变菌株。本研究通过紫外诱导获得了5株小麦纹枯病菌对噻呋酰胺的抗药性突变体;但通过药剂连续选择未获得抗噻呋酰胺突变体,可能与药剂自身的特性和诱导菌丝块的数量有关。
目前,杀菌剂抗性行动委员会(FRAC)已将琥珀酸脱氢酶抑制剂类(SDHIs)杀菌剂归为中度抗性风险杀菌剂。Keon等[ 26 ]和Shima等[ 27 ]分别检测到了玉米瘤黑粉菌Ustilago maydis和米曲霉Aspergillus oryzae抗萎锈灵的抗性菌株。Roland等[ 28 ]、Wharton等[ 29 ]和陈风平等[ 30 ]分别采集到了抗啶酰菌胺的灰霉病菌Botrytis cinerea、马铃薯早疫病菌Alternaria solani和桃褐腐病菌Monilinia fructicola菌株。李良孔[ 31 ]通过室内药剂筛选,获得了3株抗氟吡菌酰胺的黄瓜白粉病菌Podosphaera xanthii突变体,并发现其抗药性均能稳定遗传,且致病力与敏感菌株无显著差异,最终评估认为黄瓜白粉病菌对氟吡菌酰胺具有中等抗药性风险。Avenot等[ 32 ]发现不同抗啶酰菌胺的梨黑斑病菌Alternaria alternate突变体对吡噻菌胺均表现出了不同程度的抗药性。本研究发现,小麦纹枯病菌抗噻呋酰胺突变体的菌丝干重、菌核生成数量、菌核干重和致病力均明显低于亲本菌株,且其抗药性均不能稳定遗传。交互抗性研究表明,噻呋酰胺对生产上常用药剂三唑酮、井冈霉素、戊唑醇、咯菌腈、丙环唑和多菌灵之间均无交互抗性。据此推测小麦纹枯病菌对噻呋酰胺的抗药性风险属于低至中等。
夏晓明[ 24 ] 研究发现,与敏感菌株相比,小麦纹枯病菌对戊唑醇高抗和中抗菌株的CYP51 基因片段在 8、593、670、673位的核苷酸分别由 T、A、T、A 突变为了 C、G、C、T,同时高抗菌株和敏感、中抗菌株之间在核苷酸上有数十个碱基存在明显不同,且不是连续的。刘西莉等[ 33 ]发现,水稻纹枯病菌抗噻呋酰胺突变体的琥珀酸脱氢酶(Sdh)基因核苷酸位点与敏感菌株存在差异。本研究所得抗药性菌株的核苷酸片段序列与亲本或敏感菌株的差异需要作进一步研究。
鉴于小麦纹枯病菌对噻呋酰胺的室内抗药性风险属于低至中等水平,为延长噻呋酰胺的使用寿命,建议在生产中应与现有杀菌剂交替使用,同时应加强田间小麦纹枯病菌对噻呋酰胺的抗药性监测,以及时了解田间病原菌对该药剂的敏感性变化。
| [1] | BOEREMA G H, VERHOEVEN A A. Check-list for scientific names of common parasitic fungi. Series 2b: Fungi on field crops: Cereals and grasses[J]. Neth J Plant Pathol, 1977, 83(5): 165-204. |
| [2] | 贾廷祥, 吴桂本, 刘传德. 我国小麦根腐性病害研究现状及防治对策[J]. 中国农业科学, 1995, 28(3): 41-48. JIA Tingxiang, WU Guiben, LIU Chuande. The present research situation and control countermeasure of root rots in wheat[J]. Scientia Agric Sinica, 1995, 28(3): 41-48. (in Chinese) |
| [3] | 檀根甲, 季伯衡. 小麦纹枯病的研究进展[J]. 安徽农业大学学报, 1998, 25(1): 70-75. TAN Genjia, JI Boheng. Research progress of wheat sharp eyespot[J]. J Anhui Agric Univ, 1998, 25(1): 70-75. (in Chinese) |
| [4] | 陈健华, 张炽昌, 徐东方, 等. 小麦纹枯病的研究进展[J]. 现代农业科技, 2011(1): 169-170. CHEN Jianhua, ZHANG Chichang, XU Dongfang, et al. Research progress of wheat sharp eyespot[J]. Modern Agric Sci Tech, 2011(1): 169-170. (in Chinese) |
| [5] | 王金凤, 杜丽璞, 李钊, 等. 抗纹枯病、根腐病的转SN1基因小麦的获得与鉴定[J]. 作物学报, 2012, 38(5): 773-779. WANG Jinfeng, DU Lipu, LI Zhao, et al. Development and characterization of SN1 transgenic wheat plants with enhanced resistance to Rhizoctonia cerealis and Bipolaris sorokiniana[J]. Acta Agronomica Sinica, 2012, 38(5): 773-779. (in Chinese) |
| [6] | 刘朝晖, 张旭, 陆维忠. 小麦纹枯病的研究进展和对策[J]. 江苏农业学报, 2000, 16(3): 185-190. LIU Chaohui, ZHANG Xu, LU Weizhong. Research advances in wheat sharp eyespot and further control strategies[J]. Jiangsu J Agric Sci, 2000, 16(3): 185-190. (in Chinese) |
| [7] | 王怀训, 王开运, 蔡春菊, 等. 立克秀防治小麦纹枯病的药效评价[J]. 农药, 2000, 39(12): 31-32. WANG Huaixun, WANG Kaiyun, CAI Chunju, et al. The evaluation of tebuconazole control wheat sharp eyespot[J]. Pesticides, 2000, 39(12): 31-32. (in Chinese) |
| [8] | 李山东, 于金凤, 彭迪, 等. 枯草芽孢杆菌NJ18和氟酰胺联合拌种防治小麦纹枯病研究[J]. 农药学学报, 2013, 15(4): 427-433. LI Shandong, YU Jinfeng, PENG Di, et al. Co-utilization of Bacillus subtilis and flutolanil in controlling sharp eyespot of wheat by seed dressing[J]. Chin J Pestic Sci, 2013, 15(4): 427-433. (in Chinese) |
| [9] | 胡燕, 王怀训, 夏晓明, 等. 四地区小麦纹枯病菌对6种杀菌剂的抗性比较[J]. 植物保护学报, 2006, 33(4): 423-427. HU Yan, WANG Huaixun, XIA Xiaoming, et al. Susceptibility of Rhizoctonia cerealis to six fungicides in four wheat areas[J]. Acta Phytophylacica Sinica, 2006, 33(4): 423-427. (in Chinese) |
| [10] | PRASANNA KUMAR M K, SIDDE GOWDA D K, PANDURANGE GOWDA K T, et al. A new carboxynilide group fungicide against paddy sheath blight[J]. Res J Agric Sci, 2012, 3(2): 500-505. |
| [11] | 吉沐祥, 陈宏州, 吴祥, 等. 噻呋酰胺与氟环唑及其混配对水稻纹枯病菌抑菌作用[J]. 农学学报, 2014, 4(1): 15-18. JI Muxiang, CHEN Hongzhou, WU Xiang, et al. The bacteriostatic action of thifluzamide, epoxiconazole and their mixtures on rice sheath blight[J]. J Agric, 2014, 4(1): 15-18. (in Chinese) |
| [12] | 孙春来, 陈怀谷, 吉用铨, 等. 噻呋酰胺等杀菌剂防治小麦纹枯病田间试验[J]. 现代农药, 2012, 11(6): 42-44. SUN Chunlai, CHEN Huaigu, JI Yongquan, et al. Field trials of seven fungicides including thifluzamide against wheat sharp eyespot[J]. Modern Agrochem, 2012, 11(6): 42-44. (in Chinese) |
| [13] | 陈香华, 赵桂东, 李茹, 等. 不同药剂处理对小麦纹枯病防治效果的研究[J]. 金陵科技学院学报, 2012, 28(4): 50-52. CHEN Xianghua, ZHAO Guidong, LI Ru, et al. The control effect of different medicament treatment on wheat sharp eyespot[J]. J Jinling Inst Technol, 2012, 28(4): 50-52. (in Chinese) |
| [14] | 关立松. 240 g/L满穗悬浮剂防治小麦纹枯病药效研究[J]. 现代农业科技, 2013(8): 94, 99. GUAN Lisong. Study on the control effect of 240 g/L thifluzamide SC on wheat sharp eyespot[J]. Modern Agric Sci Tech, 2013(8): 94, 99. (in Chinese) |
| [15] | GORGOLOUS S G, DEKKER J. Detection and measurement of fungicide resistance general principles[J]. FAO Plant Prot Bull, 1982, 30(2): 39-71. |
| [16] | MENG Qingxiao, CUI Xiaolan, BI Yang, et al. Study on the resistance risk and resistance inheritance of Phytophthora capsici to flumorph[J]. Phytopathology, 2008, 98(Suppl.): 128. |
| [17] | 赵卫松, 韩秀英, 齐永志, 等. 辣椒疫霉对双炔酰菌胺的敏感性测定及其抗药突变体生物学性状研究[J]. 农药学学报, 2011, 13(1): 21-27. ZHAO Weisong, HAN Xiuying, QI Yongzhi, et al. Study on the sensitivity of Phytophthora capsici to mandipropamid and biological characteristics of resistant mutants[J]. Chin J Pestic Sci, 2011, 13(1): 21-27. (in Chinese) |
| [18] | 崔晓岚, 孟庆晓, 毕扬, 等. 辣椒疫霉对烯酰吗啉的敏感性基线及室内抗药突变体研究[J]. 植物病理学报, 2009, 39(6): 630-637. CUI Xiaolan, MENG Qingxiao, BI Yang, et al. Baseline sensitivity and laboratory mutants of Phytophthora capsici resistant to dimethomorph[J]. Acta Phytopathologica Sinica, 2009, 39(6): 630-637. (in Chinese) |
| [19] | 王育水. 环境因素对禾谷丝核菌菌核形成的影响[J]. 麦类作物学报, 2008, 28(1): 160-164. WANG Yushui. Influences of environmental factors on the Sclerotium formation of Rhizoctonia cerealis Vander Hoeven[J]. J Triticeae Crops, 2008, 28(1): 160-164. (in Chinese) |
| [20] | CHEN Y, ZHANG A F, WANG W X, et al. Baseline sensitivity and efficacy of thifluzamide in Rhizoctonia solani[J]. Ann Appl Bio, 2012, 161(3): 247-254. |
| [21] | 刘英华. 小麦纹枯病菌抗戊唑醇菌系生物学特性及其抗性机理研究 [D]. 泰安: 山东农业大学, 2003. LIU Yinghua. Studies on biological characters and resistance mechanism of Rhizoctonia cerrealis to tebuconazole [D]. Tai'an: Shangdong Agricultural University, 2003. (in Chinese) |
| [22] | 汪敏, 吕柏林, 邢小萍, 等. 河南省小麦纹枯病菌的群体组成及其致病力分化研究[J]. 植物病理学报, 2011, 41(5): 556-560. WANG Min, LV Bolin, XING Xiaoping, et al. Composition and virulence variation of the pathogen of wheat sharp eyespot from Henan province[J]. Acta Phytopathologica Sinica, 2011, 41(5): 556-560. (in Chinese) |
| [23] | WONG F P, WILCOX W F. Sensitivity to azoxystrobin among isolates of Uncinula necator: baseline distribution and relationship to myclobutanil sensitivity[J]. Plant Dis, 2002, 86(4): 394-404. |
| [24] | 夏晓明. 禾谷丝核菌(Rhizoctonia cerrealis)对戊唑醇的抗性机制研究 [D]. 泰安: 山东农业大学, 2006. XIA Xiaoming. Studies on the resistance mechnaism of Rhizoctonia cerrealis to tebuconazole [D]. Tai'an: Shangdong Agricultural University, 2006. (in Chinese) |
| [25] | 张骞, 周明国, 叶钟音. 植物病原真菌对甲基立枯磷的抗药性及风险研究[J]. 农药学学报, 2000, 2(2): 22-28. ZHANG Qian, ZHOU Mingguo, YE Zhongyin. Resistance risk of plant pathogenous fungi to tolclofos-methyl[J]. Chin J Pestic Sci, 2000, 2(2): 22-28. (in Chinese) |
| [26] | KEON J P R, WHITE G A, HARGREAVES J A. Isolation, characterization and sequence of a gene conferring resistance to the systemic fungicide carboxin from the maize smut pathogen, Ustilago maydis[J]. Curr Genet, 1991, 19(6): 475-481. |
| [27] | SHIMA Y, ITO Y, KANEKO S, et al. Identification of three mutant loci conferring carboxin-resistance and development of a novel transformation system in Aspergillus oryzae[J]. Fungal Genet Biol, 2009, 46(1): 67-76. |
| [28] | WEBER R W S. Resistance of Botrytis cinerea to multiple fungicides in northern German small-fruit production[J]. Plant Dis, 2011, 95(10): 1263-1269. |
| [29] | WHARTON P, FAIRCHILD K, BELCHER A, et al. First report of in-vitro boscalid-resistant isolates of Alternaria solani causing early blight of potato in Idaho[J]. Plant Dis, 2012, 96(3): 454. |
| [30] | CHEN F, LIU X, CHEN S, et al. Characterization of Monilinia fructicola strains resistant to both propiconazole and boscalid[J]. Plant Dis, 2013, 97(5): 645-651. |
| [31] | 李良孔. 黄瓜白粉病菌对氟吡菌酰胺敏感基线的建立及其抗药性风险评估 [D]. 长春: 吉林大学, 2011. LI Liangkong. Baseline sensitivity of Podosphaera xanthii to fluopyram and its resistance risk assessment [D]. Changchun: Jilin University, 2011. (in Chinese) |
| [32] | AVENOT H F, MICHAILIDES I T J. Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi[J]. Crop Prot, 2010, 29: 643-651. |
| [33] | 刘西莉, 牟文君, 李波涛, 等. 一种鉴定水稻纹枯病菌Sdh基因核苷酸点突变及其对噻呋酰胺抗药性的方法: 中国,201210281520.5 [P]. 2013-01-09. LIU Xili, MOU Wenjun, LI Botao, et al. A method for identification on Sdh nucleotide point mutation of Rhizoctonia solani and its resistance to trifluzamide: China,201210281520.5 [P]. 2013-01-09. (in Chinese) |
 2014, Vol. 16
2014, Vol. 16


