近年来,以合成的生物可降解材料为壁材的微囊化技术,已成为开发农药缓控释制剂、提高农药有效利用率研究的热点[1]。以聚乳酸(PLA)及其共聚物[2]为壁材的农药微囊具有较高的农药累积释放量,并且通过对壁材降解速率的控制,可以实现对药物的控制释放。如:聚乳酸-辣椒素微胶囊[3]和毒死蜱-聚乳酸微球[4]均有较好的成球性和缓释性能。壳聚糖(chitosan,CS)及其衍生物具有良好的降解性和生物相容性,以其为原料与DL-丙交酯聚合制备的壳聚糖-聚乳酸两亲性接枝聚合物(CS-co-PLA)具有良好的降解性,且降解产物无毒,可作为良好的药物控制释放壁材[5]。目前已有将其用于农药缓释领域的研究报道[6, 7]。虽然所制备的载药微囊粒形规则,大小较均一,并表现出良好的缓释性能,但由于其大多采用纳米沉淀法或超声波破碎法制备,粒径均集中在纳米水平,且存在制备条件较苛刻、包封率及载药量低、成本高等问题[8]。
嘧菌酯属甲氧基丙烯酸酯类杀菌剂,具有高效、广谱及内吸性的杀菌活性,与目前已有的其他类别杀菌剂无交互抗性,应用广泛[9],但其有效成分在水中易光解[10]。目前其主要剂型为水悬浮剂和水分散粒剂,有效利用率低,持效期短[11, 12]。笔者以CS-co-PLA为壁材,以嘧菌酯为芯材,以聚乙烯醇(PVA)为连续相稳定剂,采用乳化溶剂挥发法制备了粒径不同的嘧菌酯微囊,并分别研究了芯壁材质量比、PVA质量分数、剪切方式(速率和时间)和油水相比例对微囊性能的影响,从中筛选出了较优的配方及制备条件。 1 材料与方法 1.1 仪器与试剂
Mastersizer Micro激光粒度分析仪(英国马尔文仪器有限公司);IKA T25型高速分散机(德国IKA 集团);FD-1-50型真空冷冻干燥机(北京博医康实验仪器有限公司);TG20-WS高速离心机(长沙湘智离心机仪器有限公司);光学显微镜(重庆奥特光学仪器有限公司);EM-200CX型透射电子显微镜(日本电子JEOL公司); Agilent 1260型高效液相色谱仪(美国安捷伦科技有限公司)。
壳聚糖(CS,上海卡博工贸有限公司);DL-丙交酯(美国Alfa Aesar公司);嘧菌酯(azoxystrobin)原药(纯度97%,中国农科院植保所农药质量与全分析实验室提供);聚乙烯醇和二氯甲烷(分析纯);甲醇(色谱纯)。 1.2 CS-co-PLA的合成及表征
参照文献方法[5,6],采用开环聚合法合成了CS-co-PLA,并对其结构进行了表征。 1.3 嘧菌酯微囊的制备
采用O/W(油相/水相) 乳化溶剂挥发法[13, 14]制备。分别准确称取一定量的嘧菌酯原药和CS-co-PLA,以二氯甲烷为溶剂配制成各化合物质量浓度为50 mg/mL的溶液,将二者按照一定比例混合得到油相;准确称取PVA于去离子水中,加热搅拌溶解配制成一定质量浓度的水溶液,即水相;按比例将油相转移到水相中,高速剪切一定时间,在35 ℃下旋转蒸发除去溶剂,在室温下高速离心 10 min;所得固体用去离子水洗涤3次,过滤,真空冷冻干燥得到嘧菌酯微囊干粉,于干燥器内贮存备用。 1.4 嘧菌酯微囊制备中各因素对其主要性能的影响
按照1.3节制备方法,分别考察不同PVA质量分数、不同芯壁材质量比、不同剪切速率、不同剪切时间以及不同油水相比例对嘧菌酯微囊外观形态、粒径及分布、载药量和包封率等主要性能的影响。 1.5 微囊的主要性能测定 1.5.1 形态观察 1.5.1.1 光学显微镜观察
用去离子水将一定量的微囊粉末配制成微囊悬浮液后,滴于载玻片上,用光学显微镜观察微囊形态、粒径大小及分布,并选取有代表性的区域进行拍照。 1.5.1.2 透射电镜观察
将微囊水悬浮液滴在镀碳膜铜网上,烘干,采用醋酸双氧铀负染法染色后,通过EM-200CX透射电镜观察。 1.5.2 粒径测定
以去离子水为分散介质,在高速(2 000 r/min)搅拌下滴加微囊水悬浮液,当遮光率达到10%~20%时,用激光粒度分析仪测定微囊粒径大小及分布,由(1)式计算跨距。

准确称取0.05 g(精确至0.000 1 g)嘧菌酯微囊干粉,用甲醇溶解并定容至25 mL,经 0.22 μm滤膜过滤,用高效液相色谱(HPLC)外标法测定滤液中嘧菌酯的含量。
HPLC测定条件:Eclipse XDB-C18色谱柱(250 mm×4.6 mm(i.d),5 μm;流动相为V(甲醇)∶V(水)=65∶35;流速1.0 mL/min;柱温30 ℃;检测波长230 nm;进样量5 μL。
分别由(2)、(3)式计算微囊的载药量和包封率。


采用透析袋法[15]。室温下,准确称取0.05 g(精确至0.000 1 g)嘧菌酯微囊干粉,用10 mL去离子水使其分散成微囊悬浮液,置于透析小袋中,将其浸入盛有200 mL缓释介质(含10%甲醇的去离子水)的烧杯中,分别于1、4、7、18、24 h及以后每间隔24 h,取缓释介质1 mL(在每次取样后立即补充1 mL缓释介质),采用1.5.3节的色谱条件测定嘧菌酯含量,绘制其累积释放曲线。 2 结果与分析 2.1 微囊制备中各因素对微囊性能的影响 2.1.1 不同PVA质量分数对微囊性能的影响
由表 1可以看出,改变PVA的质量分数,对嘧菌酯微囊的包封率和载药量影响较大,虽然对粒径影响很小,但对粒径分布影响较大。在PVA质量分数[ω(PVA)]<1%时,跨距较大,粒径分布不均匀;而当ω(PVA)>1%时,跨距明显变小,粒径较均一。随着PVA加入量的增多,微囊的包封率和载药量呈现先升高后降低的趋势。当ω(PVA)=1%时,其包封率和载药量达最高值,分别为89.25%和18.76%。这主要是因为PVA水溶液的黏度与其质量分数成正相关,而具有适当黏度的PVA水溶液有利于微囊保持一定的稳定性,防止芯材流失。当ω(PVA)<1% 时,微囊的包封率与载药量相对较低。这主要是由于当PVA质量分数较低时,界面膜强度较低,在连续的剪切乳化过程中易发生破乳,致使药剂分散在连续相中,从而导致其较低的包封率和载药量。而当ω(PVA)>1%时,其载药量和包封率也有下降的趋势。这主要是由于PVA是表面活性剂,与嘧菌酯之间具有一定的亲和作用,增加PVA的浓度,也会增加嘧菌酯在PVA水溶液中的溶解[16],从而造成包封率下降;而其载药量降低是由于PVA具有良好的成膜性,在载药微囊固化、离心时其外壁会引入部分PVA[17]。
| 表 1 PVA质量分数对嘧菌酯微囊性能的影响 Table 1 Effect of PVA mass fraction on the performance of azoxystrobin microcapsules |
由此可见,PVA的用量是微囊粒径分布、包封率和载药量的主要影响因素,但对微囊粒径的大小影响不大。综合考虑,确定最适宜的PVA质量分数为1%。 2.1.2 不同芯壁材质量比对微囊性能的影响
由表 2可以看出,随着嘧菌酯用量的增加,微囊的包封率呈先升高后降低的趋势,而载药量则显著升高,其粒径及分布变化不大。这主要是由于最初增加的嘧菌酯均能有效地被CS-co-PLA包裹,从而导致包封率增大;而当嘧菌酯被包裹达到饱和时,继续增大嘧菌酯的比例,其包封率就会迅速降低;而微囊的载药量显著增大则主要是由于芯壁材质量比的成倍提高所致。
| 表 2 芯壁材质量比对嘧菌酯微囊性能的影响 Table 2 Effect of mass ratio of core materials and wall materials on the performance of azoxystrobin microcapsules |
可见,在芯壁材质量比为1∶4~1∶1的条件下制备嘧菌酯微囊,既能保证微囊具有较高的包封率和载药量,又能获得较均一的粒径。 2.1.3 油水相比例对微囊性能的影响
结果(见表 3)表明,不同的油水相比例对嘧菌酯微囊的粒径影响很小(粒径均在2 μm左右),但随着油相比例的提高,跨距增大,这符合文献报道的粒径变化规律[18]。其主要原因是:乳液的黏度与乳液中有机相的含量有关,有机相的相对用量越大,乳液的黏度越大,乳化分散所需的剪切力越大,在相同的剪切速率及乳化时间下,形成的乳液粒径会增大,其跨距也会增大;同时,有机相在连续相稳定剂的作用下,分散为细小的乳滴,如果乳液在分散介质水中的浓度越小,那么乳滴间团聚的机会就越少,微囊粒子大小分布更均匀,则其跨距会更小。
| 表 3 油水相比例对嘧菌酯微囊性能的影响 >Table 3 The effect of volume ratio of oil phase and aqueous phase on the performance of azoxystrobin microcapsules |
当V(油相)∶V(水相)=1∶2、1∶5和1∶10时,所制备嘧菌酯微囊的包封率和载药量均未产生显著变化,且皆优于V(油相)∶V(水相)=1∶20条件下制备的微囊。这与体系的黏度有关:随着水相比例的增加,一方面嘧菌酯在溶液中溶解的量增大,另一方面由于体系黏度很小,嘧菌酯向连续相扩散的阻力减小,加快了其扩散速率,从而使其包封率和载药量降低;随着有机相比例的增大,嘧菌酯和壁材分子之间排列较为紧密,使嘧菌酯易于被包裹,而且溶液体系黏度的增大也会使嘧菌酯分子在体系中运动困难而被壁材包裹。
综上可得,当V(油相)∶V(水相)=1∶10时,制备的微囊粒子大小较均一,其包封率和载药量较高,故选择该油水相比作为其制备条件。 2.1.4 剪切乳化时间和速率对微囊性能的影响
由表 4可以看出,剪切乳化时间对微囊平均粒径的影响很小,但却会显著影响粒径的跨距、包封率和载药量。随着剪切乳化时间的增加,在同样的剪切速率下,制备的微囊粒子粒径会更加均一,跨距减小并趋于稳定。在剪切乳化时间达到 5 min 以后,微囊粒径的跨距变化不大,但其包封率和载药量会显著降低。其主要原因是:随着剪切乳化时间的增加,有机溶剂挥发量会增加,这将导致部分药剂扩散到连续相中,从而造成其包封率和载药量减小。
| 表 4 剪切乳化时间对嘧菌酯微囊性能的影响 Table 4 Effect of shear emulsification time on the performance of azoxystrobin microcapsules |
综上可得,当剪切乳化时间为5 min时所制备的微囊粒子粒径较均一,其包封率和载药量均较高。
由表 5可以看出,随着剪切速率的增大,载药微囊粒子的粒径有显著变小的趋势,其跨距略有增大,但其包封率和载药量变化不大,均呈先增大后减小的趋势。其主要原因是:在一定条件下,剪切速率增大,乳液液滴变小,微囊粒径减小,比表面积增大,同时芯材在高剪切力作用下易向外水相扩散,从而导致包封率和载药量降低[19];但是当剪切速率很小时,剪切速率增加可使微囊的包封率和载药量增加[20]。不同剪切速率下所制备的从300 nm到4.5 μm 不同粒径的嘧菌酯微囊,其跨距最大的也在3以下,粒径分布相对较均匀,并且其包封率和载药量均较高(包封率均在71%以上,载药量在14.5%以上)。
| 表 5 剪切速率对嘧菌酯微囊性能的影响 Table 5 Effect of shear rate on the performance of azoxystrobin microcapsules |
因此,通过调节剪切速率可以制备280 nm~4.5 μm不同粒径大小的嘧菌酯微囊,其粒径大小较均一,且包封率和载药量较高。 2.2 嘧菌酯微囊的性能表征
通过对各影响因素的研究,最终筛选出嘧菌酯微囊的适宜制备条件: PVA质量分数为1%、m(嘧菌酯)∶m(CS-co-PLA)=1∶4~1∶1,V(油相)∶ V(水相)=1∶10,剪切乳化时间5 min,剪切速率 3 000~18 000 r/min。通过光学显微镜、透射电镜、激光粒度仪和HPLC对其进行性能表征。 2.2.1 嘧菌酯微囊的外观形态
光学显微镜观察结果(图 1)显示,获得了稳定分散的、具有良好球形、且粒径分布较均一的嘧菌酯微囊。透射电镜图片(图 2)也显示,该微囊具有良好的成球性和分散性。
 | 图 1 光学显微镜图片 Fig.1 Optical microscope photo |
 | 图 2 透射电镜图片 Fig. 2 SEM photo |
由图 3可知,所制备的嘧菌酯微囊的粒径大小呈正态分布,大部分粒径集中在0.6~2.5 μm之间,平均粒径为1.09 μm,跨距为1.79。
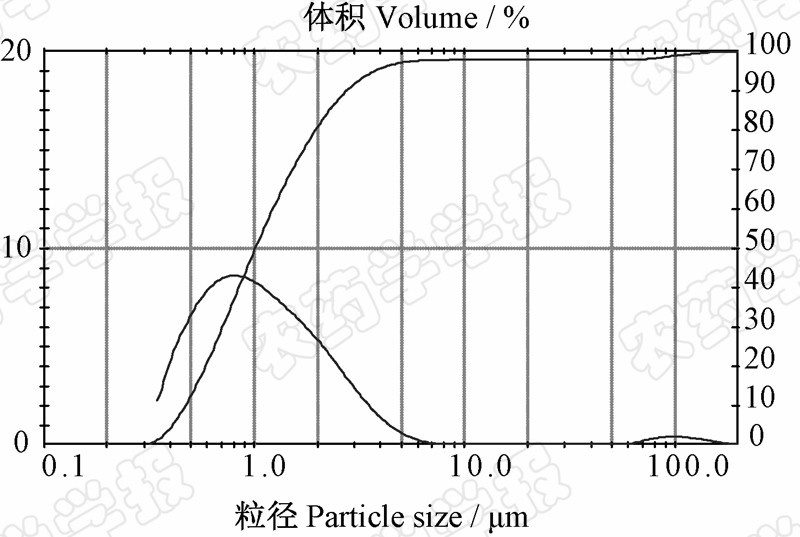 | 图 3 嘧菌酯微囊粒径分布曲线图 Fig. 3 Particle size distribution of azoxystrobin microcapsules |
由嘧菌酯微囊及悬浮剂的累积释放曲线(图 4)可知,嘧菌酯悬浮剂的累积释放率在第4天(96 h)即达到97.54%,与其相比,嘧菌酯微囊则具有明显的缓释效果,其释放可分为突释和缓释2个阶段。由于在微囊表层及浅层附着部分嘧菌酯,导致第1阶段(初期)药剂释放量较大,这与文献报道的 “突释效应”相符[21];第2阶段释放出的药剂主要是来自微囊内部,嘧菌酯被包裹在共聚物的疏水内核中,释放速率较慢,在408 h 时累积释放率为 84.97%。
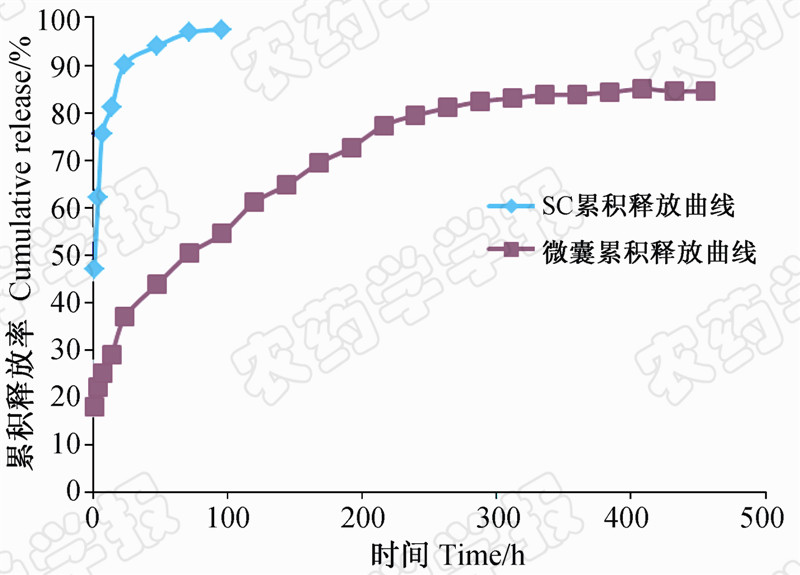 | 图 4 嘧菌酯微囊累积释放曲线 Fig. 4Fig.4 Cumulative release curve of azoxystrobin microcapsules |
采用开环聚合法合成了两亲性接枝聚合物CS-co-PLA,并以其为壁材,以嘧菌酯为芯材,通过乳化溶剂挥发法成功制备了具有较好缓释性能的嘧菌酯微囊。通过对微囊性能的测定,筛选出了较为适宜的制备条件:在PVA质量分数为1%、芯壁材质量比为1∶4~1∶1、V(油相): V(水相)=1∶10、剪切速率介于3000~18 000 r/min 之间、剪切乳化时间为5 min时,可以制备出280 nm~4.5 μm不同粒径大小的微囊,且载药微囊有较高的包封率和载药量,其包封率均在71%以上,载药量在14.5%以上。其中,剪切速率是影响微囊粒径的主要因素。
| [1] | POLJANŠEK I, KUCHARCYZK P, SEDLAŘIK V, et al. Biodegradable polymers from renewable resources: effect of proteinic impurity on polycondensation products of 2-hydroxy-propanoic acid[J]. Mater Technol, 2011, 45: 265-268. |
| [2] | 梁晓飞, 王汉杰, 罗浩, 等. 生物降解多功能缓释微球的制备与表征[J]. 化学学报, 2008, 66(19): 2178-2183. LIANG Xiaofei, WANG Hanjie, LUO Hao, et al. Preparation and characterization of novel biodegradable multifunctional microspheres[J]. Acta Chimica Sinica, 2008, 66(19): 2178-2183.(in Chinese) |
| [3] | 王锦成, 陈思浩, 徐子成, 等. 聚乳酸-辣椒素微胶囊的制备及性能[J]. 农药, 2011, 50(2): 646-648. WANG Jincheng, CHENG Sihao, XU Zicheng, et al. Preparation and properties research on the microcapsules of PLA coated capsaicin [J]. Agrochemicals, 2011, 50(2): 646-648.(in Chinese) |
| [4] | 郭瑞峰, 黄彬彬, 杨晓伟, 等. 毒死蜱-聚乳酸微球的制备及其性能评价[J]. 农药学学报, 2011, 13(4): 409-414. GUO Ruifeng, HUANG Shanshan, YANG Xiaowei, et al. Preparation and characteristics analysis of microspheres of chlorpyrifos and polylactic acid[J]. Chin J Pestic Sci, 2011, 13(4): 409-414.(in Chinese) |
| [5] | WU Y, ZHENG Y L, YANG W L, et al. Synthesis and characterization of a novel amphiphilic chitosan-polylactide graft copolymer[J]. Carbohyd Polym, 2005, 59(2): 165-171. |
| [6] | LI M, HUANG Q L, WU Y. A novel chitosan-poly (lactide) copolymer and its submicron particles as imidacloprid carriers[J]. Pest Manag Sci, 2011, 67(7): 831-836. |
| [7] | 徐蕾, 曹立冬, 李凤敏, 等. 多杀菌素-壳聚糖共聚物微球的制备及性能评价[J]. 农药科学与管理, 2013, 34(5): 23-26. XU lei, CAO Lidong, LI Fengmin, et al. Preparation and characteristics analysis of microsphere of spinosad-chitosan copolymer[J]. Pestic Sci Admin, 2013, 34(5): 23-26.(in Chinese) |
| [8] | BARIK T K, SAHU B, SWAIN V. Nanosilica-from medicine to pest control[J]. Parasitol Res, 2008, 103: 253-258. |
| [9] | 孙天山, 沈志洵. 嘧菌酯市场现状及发展分析[J]. 广东化工,2013, 40(2), 60-61. SUN Tianshan, SHEN Zhenxun. The market status and development analysis of azoxystrobin[J]. Guangdong Chem Ind, 2013, 40(2), 60-61.(in Chinese) |
| [10] | 刘长令, 关爱莹, 张明星. 广谱高效杀菌剂嘧菌酯[J]. 世界农药, 2002, 24(1): 46-49. LIU Changling, GUAN Aiying, ZHANG Mingxing. Broad spectrum high-effect fungicide azoxystrobin[J]. World Pestic, 2002, 24(1): 46-49.(in Chinese) |
| [11] | TSUJI K. Microencapsulation of pesticide and their improved safety[J]. J Microencapsul, 2001, 18 (2): 137-147. |
| [12] | 宋倩, 黄啟良, 袁会珠,等. 可控缓释纳米农药制剂及其研究进展[C]//植物保护科技创新与发展.北京:中国植物保护学会,2008:182-185. SONG Qian, HUANG Qiliang, YUAN Huizhu, et al. Preparation of controllable slow-release pesticide nanoparticles and their research progress[C]//Innovation Develop Plant Prot Sci Tech. Beijing: China Society of Plant Protection, 2008:182-185.(in Chinese) |
| [13] | PARK S J, KIM S H. Preparation and characterization of biodegradable poly(l-lactide)/poly (ethylene glycol) microcapsules containing erythromycin by emulsion solvent evaporation technique[J]. J Colloid Interf Sci, 2004, 271(2): 336-341. |
| [14] | DOWLER C C, DAILEY O D, MULLINIX B G. Polymeric microcapsules of alachlor and metolachlor: preparation and evaluation of controlled-release properties[J]. J Agric Food Chem, 1999, 47(7): 2908-2913. |
| [15] | ASRAR J, DING Y, MONICA R E, et al. Controlled release of tebuconazole from a polymer matrix microparticle: release kinetics and length of efficacy[J]. J Agric Food Chem, 2004, 52(15): 4814-4820. |
| [16] | 李良, 李国明, 黎茂荣, 等. 福利平/聚乳酸微球的制备研究[J]. 华南师范大学学报:自然科学版, 2003(3):102-106. LI Liang, LI Guoming, LI Maorong, et al. Study on the preparation of RFP/PLA microspheres[J]. J South Normal Univ: Nat Sci, 2003(3):102-106.(in Chinese) |
| [17] | 卢凌彬, 黄可龙. 可生物降解聚碳酸亚丙酯丁内酯微囊的制备[J]. 应用化学, 2005, 22(3): 250-254. LU Lingshan, HUANG Kelong. Preparation of biodegradable polymer and propylene carbonate butyrolactone microcapsules [J]. Chinese J Appl Chem, 2005, 22(3): 250-254.(in Chinese) |
| [18] | 刘明星, 马丽, 刘燕群, 等. 可生物降解聚乳酸纳米粒的制备及表征[J]. 化学世界, 2003,44(2): 78-80. LIU Mingxing, MA Li, LIU Yanqun, et al. Preparation and characterization of biodeg radable poly (lactic acid) nanoparticles [J]. Chemical World, 2003,44(2): 78-80.(in Chinese) |
| [19] | 杨亚楠, 娄玲, 梁奇志, 等. 生物降解聚酯包埋利福平缓释微球的制备及释放行为[J]. 高等学校化学学报, 2004,25(1): 162-165. YANG Yan'an, LOU Ling, LIANG Qizhi, et al. Preparation and in vitro release of rifampin microspheres encapsulated in biodegradable polyesters[J]. Chem J Chinese Univ, 2004,25(1): 162-165.(in Chinese) |
| [20] | ZHU K J, JIANG H L, DU X Y, et al. Preparation and characterization of hCG-loaded polylactide or poly (lactide-co-glycolide) microspheres using a modified water-in-oil-in-water (W/O/W) emulsion solvent evaporation technique [J]. J Microencapsul, 2001, 18(2): 247-260. |
| [21] | JÉGAT C, TAVERDET L J. Stirring speed influence study on the microencapsulation process and on the drug release from microcapsules[J]. Polym Bull, 2000, 44(3): 345-351. |
 2014, Vol.16
2014, Vol.16 


