自1973年Ueno 等[1]首次报道单端孢霉烯在真核细胞中能够抑制蛋白质合成以来,目前已知的单端孢霉烯毒素结构类似物已超过148种,其中,木霉菌素(trichodermin)是较早被发现的该类化合物,CAS号为 4682-50-2,结构式见Scheme 1。后来在多种哈茨木霉菌代谢产物中也发现了木霉菌素,其通过与60S-核糖体亚基结合位点结合而抑制肽转移酶活性,进而影响蛋白质合成的起始、延伸和终止阶段,最终阻止蛋白质的合成[2, 3, 4]。构效关系研究发现,在单端孢霉烯毒素结构类似物中,C-3位置的乙酰基对抑制蛋白质合成具有增强作用,而C-12,13-环氧基团和C-9,10-双键是单端孢霉烯毒素抑制蛋白质合成的必需基团,如果该部分结构被破坏其活性将会大幅降低甚至失活[5, 6]。
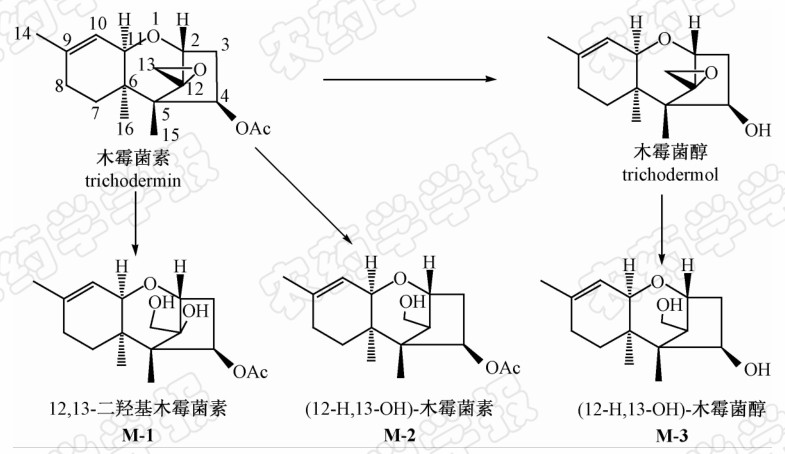 | Scheme 1 |
木霉菌素对多种植物病原真菌具有很强的抑制作用,在酸性至弱碱性和低于100 ℃条件下稳定,而在强碱性或高温条件下容易降解或转化为抑菌活性较低的化合物[7, 8, 9, 10]。已有研究表明,利用新型材料通过光催化降解残留农药,具有使用简便和降解能力强的优点[11, 12, 13]。
纳米氧化钛(TiO2)是一种n型半导体,其禁带宽度为3.2 eV,当受到能量大于3.2 eV的光照射时,可将其价带上的电子激发至导带上,形成光生电子,价带上则形成带正电荷的空穴,光生电子和光生空穴可与水和氧气分别发生反应,产生强氧化性的活性超氧离子自由基和羟基自由基[14]。纳米TiO2是近几年来发展起来的新型光催化剂,在紫外光下能光解水产生过氧化氢。利用TiO2催化降解有毒及生物难降解的有机物已成为近年来水体和土壤污染控制的热点,其可将表面活性剂、有机染料、农药、油类和氰化物等在紫外光下有效地降解、脱色和氧化[15]。
目前尚未见关于木霉菌素光稳定性方面的研究报道。笔者就可见光和紫外光对木霉菌素稳定性的影响进行了测试,重点研究了纳米氧化钛加紫外光(TiO2-UV)对其的催化降解作用,并采用高效液相色谱-质谱联用(HPLC-MS)方法对降解产物进行了解析。由于HPLC-MS并不能准确分析木霉菌素降解产物的结构,且从降解液中回收、分离及提纯降解产物也非常困难,为了准确判断木霉菌素的降解产物及分析其降解后活性降低甚至失活的原因,笔者参照文献方法合成了木霉菌素及其部分衍生物——木霉菌醇、12,13-二羟基木霉菌素(M-1)、(12-H,13-OH)-木霉菌素(M-2)及(12-H,13-OH)-木霉菌醇(M-3),结构式见Scheme 1,并通过HPLC-MS方法将降解产物与所合成的衍生物进行了对比分析。 1 材料与方法 1.1 试剂及主要仪器
锐钛型酸性纳米TiO2,由浙江大洋生物科技集团股份有限公司提供;乙腈为色谱纯,其他试剂均为国产分析纯。
Waters Quattro高效液相色谱-质谱联用仪(HPLC-MS),美国Waters公司;ZF-7三用紫外分析仪,上海分析仪器厂;R-86C人工气候培养箱,杭州雪中碳恒温技术有限公司;SPECORD 200紫外分光光度计,德国耶拿(蔡司)公司;JEM-200cx透射电镜,日本JEOL公司。 1.2 纳米氧化钛的物理特性
用去离子水将锐钛型酸性纳米TiO2配制成质量分数为15%的水乳液,呈乳白色透明状,乳态分布均匀,无沉淀。通过透射电镜观察,其晶体表面粗糙,颗粒均匀,粒径主要分布在 10~20 nm之间(图 1)。
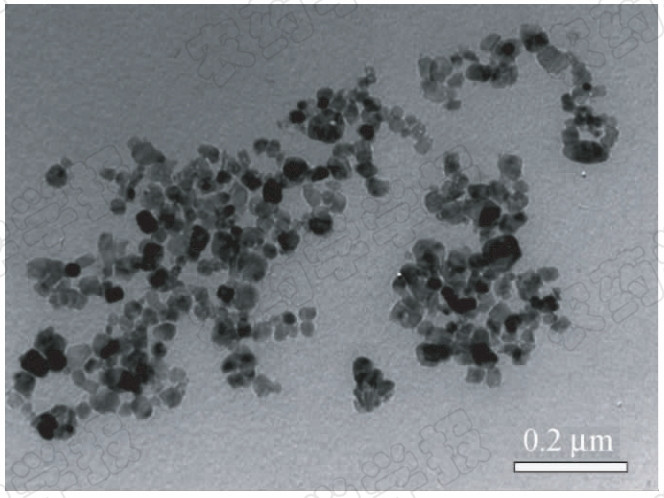 | 图 1 纳米氧化钛的透射电镜图 Fig. 1 Transmission electron microscope photos of nano-size titanium dioxide |
参照文献[9]的方法制备得到木霉菌素(trichodermin)粗品,采用30倍质量的石油醚重结晶,通过HPLC归一化法分析确定其纯度≥99%。
木霉菌醇(trichodermol)和M-1的制备参照文献[16]方法。
参照文献[17]方法制备M-2和M-3,但对反应体系及条件进行了改进:分别称取木霉菌素或木霉菌醇500 mg,置于250 mL具塞梨形瓶中,加入500 mg 三氯化铝和10 mL四氢呋喃,置冰水浴中预冷至0 ℃,加入70 mg 四氢铝锂,在0 ℃下反应3~5 h,薄层层析(TLC)[以V(石油醚)∶V(乙酸乙酯)= 4∶1为展开剂]监测至反应完全。加入20 mL 0.1 mol/L 的盐酸,用等体积的乙酸乙酯萃取3次,60 ℃下真空浓缩至近干。所得粗品先用石油醚溶解,过滤,滤渣再用氯仿溶解,通过硅胶柱层析纯化,采用V(石油醚)∶V(乙酸乙酯)=1∶2 的混合溶剂洗脱,分别得到白色晶体 M-2和M-3。
纯化后的木霉菌醇、M-1、M-2和M-3分别通过TLC、MS及核磁共振氢谱(1H NMR) 分析确认其结构。 1.4 木霉菌素降解试验方案
处理1:木霉菌素样品溶液在避光条件下室温放置30 d。
处理2:于木霉菌素样品溶液中添加质量分数为0.05%的纳米TiO2,避光条件下室温放置30 d。
处理3:将木霉菌素样品溶液置于30 W普通照明灯下30 cm处,25 ℃下光催化降解30 d。
处理4:向木霉菌素样品溶液中添加质量分数为0.05%的纳米TiO2,25 ℃下搅拌(100 mL样品溶液置于直径15 cm的培养皿中,余同)并于30 W普通照明灯下30 cm处光催化降解24 h。
处理5:木霉菌素样品溶液于25 ℃下搅拌并于30 W紫外灯下30 cm处光催化降解24 h。
处理6:于木霉菌素样品溶液中添加质量分数为0.05%的纳米TiO2,25 ℃下搅拌并于30 W紫外灯下30 cm处光催化降解24 h。
处理7:在木霉菌素样品溶液中添加质量分数为0.05%的纳米TiO2,分别用盐酸和氢氧化钠调节溶液的pH至2.5和9.5,25 ℃下搅拌并于30 W紫外灯下30 cm处光催化降解24 h。
每处理均设3个平行试验,取平均值计算降解率。 1.5 高效液相色谱检测条件 Waters Sunfire C18色谱柱(4.6 mm×250 mm,5 μm);Waters二元高压梯度泵(1525 binary HPLC pump);流动相为V(乙腈)∶V(水)=3∶2,流速1.0 mL/min;进样量20 μL。Waters 2487 2-channel uv/vis detector 紫外-可见光检测器,检测波长193 nm,温度为室温。 2 结果与分析 2.1 木霉菌素及其衍生物的理化性质及结构鉴定
木霉菌素、木霉菌醇、M-1、M-2和M-3的相关理化特性、质谱及核磁共振氢谱数据如下:
1) 木霉菌素为白色晶体,熔点45.7~46.3 ℃(文献值45~46 ℃[18]);ESI-MS:292[M-H]+;1H NMR (500 MHz,CDCl3),δ: 5.57~5.56 (m,1H,C4-H),5.40~5.39 (m,1H,C10-H),3.82 (d,J=6.0 Hz,1H,C2-H),3.60 (d,J=6.5 Hz,1H,C11-H),3.12 (d,J=4.0 Hz,1H,C13-Ha),2.83 (d,J=3.0 Hz,1H,C13-Hb),2.54 (dd,J=7.0、13.0 Hz,1H,C3-Ha),2.09 (s,3H,CH3COO-),1.98~1.96 (m,2H,C8-H),1.94~1.92 (dd,J=3.0、6.5 Hz,1H,C7-Ha),1.91 (d,J=7.0 Hz,1H,C3-Hb),1.71 (s,3H,C14-H),1.42~1.40 (m,1H,C7-Hb),0.93 (s,3H,C15-H),0.72 (s,3H,C16-H)。
2)木霉菌醇为白色晶体,熔点117.6~118.1 ℃(文献值117~119 ℃[19]);ESI-MS:250[M-H]+;其1H NMR与文献[19]中报道的一致。
3) M-1为白色晶体,熔点137.8~138.2 ℃;ESI-MS:310[M-H]+;1H NMR (500 MHz,CDCl3),δ: 5.51 (d,J=4.0 Hz,1H,C10-H),5.15~5.12 (m,1H,C4-H),4.16 (d,J=12.0 Hz,1H,C2-H),3.89 (s,2H,13-H),3.76 (d,J=5.0 Hz,1H,C11-H),2.60 (dd,J=6.0、12.0 Hz,1H,C3-Ha),2.06 (s,3H,CH3COO-),2.02~1.98 (m,2H,C8-H),1.95 (d,J=6.0 Hz,1H,C3-Hb),1.74 (s,3H,C14-H),1.72~1.70 (m,1H,C7-Ha),1.25~1.23 (m,1H,C7-Hb),1.17 (s,3H,C15-H),0.72 (s,3H,C16-H)。
4) M-2为白色晶体,熔点152.4~153.0 ℃;ESI-MS:294[M-H]+;1H NMR (500 MHz,CDCl3),δ: 5.52~5.51 (m,1H,C10-H),5.15~5.11 (m,1H,C4-H),4.18~4.15 (m,1H,C2-H),3.90~3.88 (m,2H,C13-H),3.76 (d,J=5.5 Hz,1H,C11-H),2.60~2.50(dd,J=7.0、13.0 Hz,1H,C3-Ha),2.17~2.14 (m,1H,C12-H),2.07 (s,3H,CH3COO-),2.02~1.98 (m,2H,C8-H),1.96~1.90 (m,1H,C7-Ha),1.75 (d,J=7.0 Hz,1H,C3-Hb),1.74 (s,3H,C14-H),1.31~1.27 (m,1H,C7-Hb),1.17 (s,3H,C15-H),0.77 (s,3H,C16-H)。
5)M-3为白色晶体,熔点168.5~169.2 ℃;ESI-MS:252[M-H]+;1H NMR (500 MHz,CDCl3),δ: 5.52~5.51 (m,1H,C10-H),4.21 (t,J=7.0 Hz,1H,C4-H),4.16~4.13 (m,1H,C2-H),3.88~3.87(m,2H,C13-H),3.72 (d,J=5.0 Hz,1H,C11-H),2.43 (dd,J=7.0、13.5 Hz,1H,C3-Ha),2.16~2.13 (m,1H,C12-H),2.08~2.03 (m,2H,C8-H),2.02~2.00 (m,1H,C7-Ha),1.94 (d,J=7.0 Hz,1H,C3-Hb),1.72 (s,3H,C14-H),1.33~1.30 (m,1H,C7-Hb),1.24 (s,3H,C15-H),0.91 (s,3H,C16-H)。
在本研究的HPLC检测条件下,木霉菌素、木霉菌醇、M-1、M-2和M-3的保留时间分别为8.65、3.96、4.36、10.18和4.20 min。 2.2 影响木霉菌素降解的因素 2.2.1 不同光源对木霉菌素降解的影响
在无纳米TiO2催化下,木霉菌素在避光条件下放置30 d、普通照明灯照射30 d和紫外灯下照射24 h后均未发生降解,表明其在光照下具有较强的稳定性,适合在野外喷洒施用。
在纳米TiO2催化下,当溶液为中性时,木霉菌素在避光条件下放置30 d未发生降解,在普通照明灯下照射24 h的降解率仅为2.8%,而在紫外光下照射24 h的降解率可达56.4%。表明纳米TiO2发挥催化降解作用需要一定强度的紫外光激发,可见光的能量不能较好地激发其催化降解作用。 2.2.2 不同pH下纳米TiO2的光催化降解效率
结果见图 2。在纳米TiO2催化下,当溶液的pH值分别为2.5、7.0和9.5时,距30 W紫外灯下30 cm 处照射,随照射时间延长,木霉菌素的降解 率均 逐步升高,24 h后的降解率分别为99.6%、56.4%和76.3%。表明酸性条件下纳米TiO2的光催化降解效果最佳,碱性条件下则比中性条件的降解效果好。
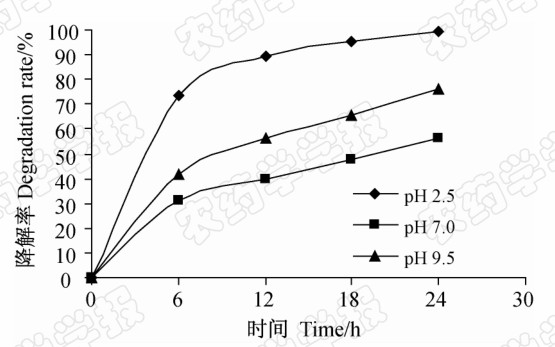 | 图 2 不同pH对纳米TiO2光催化降解木霉菌素的影响 Fig.2 Effects of different pH on the degradation rates |
木霉菌素经TiO2-UV光催化降解24 h后,其降解产物用等体积的乙酸乙酯萃取,萃取液浓缩后用色谱纯乙腈溶解并定容,HPLC检测。从图 3中可看出,经TiO2-UV光催化降解24 h后,木霉菌素的降解率达99.6%。通过与所合成的木霉菌素衍生物比较,确定其主要降解产物2号峰为木霉菌醇(HPLC保留时间3.96 min),3号峰为M-3(保留时间4.20 min),4号峰为M-1(保留时间4.36 min),5号峰 为M-2(保留时间 10.18 min)。以V(石油醚)∶V(乙酸乙酯)=4∶1为展开剂进行薄层层析,各化合物的Rf 值分别为0.29、0.34、0.38及0.45,木霉菌素的Rf 值为0.55。试验中还发现,木霉菌素降解产物的累积量与其分解量不成比例,分析可能是由于TiO2-UV催化光解时将部分木霉菌素深度氧化成了其他更小分子的有机物或二氧化碳和水,而在本研究的检测条件下无法有效地检测到全部降解产物。
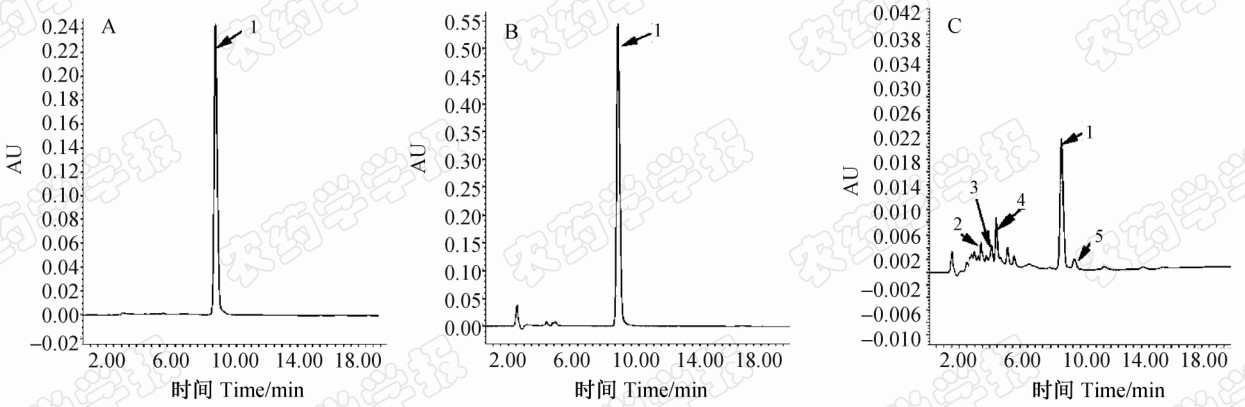 | 图 3 木霉菌素光催化降解24 h后产物的高效液相色谱图
Fig.3 HPLC of trichodermin photocatalytic degradation products were detected after 24 h reactionA. 木霉菌素+紫外光; B. 木霉菌素+ 0.05%TiO2+普通光; C. 木霉菌素+0.05%TiO2+紫外光,其中 1、2、3、4和5号峰的保留时间分别为8.71、3.96、4.20、4.36及10.18 min
A. trichodermin+UV-light; B. trichodermin+ 0.05%TiO2+ordinary light; C. trichodermin+ 0.05%TiO2+ UV-light,the relative retention time of the peaks of No.1,2,3,4 and 5 were 8.71,3.96,4.20,4.36 and 10.18 min,respectively |
农药在使用、贮存及流通等各个环节都会不同程度地受到光照的影响,因此农药的光稳定性决定着其实际应用效果。木霉菌素的光稳定性较好,一方面可确保其药效长久,另一方面却会降低其在作物、土壤及水体中的降解速度。而能否有效地降低或消除其在农产品和土壤中的残留,将成为今后新农药获准推广应用的必要条件。纳米TiO2具有良好的化学、生物及光稳定性,其作为性能优异的光催化剂已得到广泛应用[20, 21],其中锐钛型TiO2薄膜已被证明对有机物的光降解具有催化作用[22, 23]。本研究表明,在可见光(λ>480 nm)照射下,纳米TiO2对木霉菌素的降解无催化作用,而在紫外光下照射24 h,木霉菌素的降解率可达99.6%,表明紫外光能较好地激发纳米TiO2的催化活性。
本研究表明,溶液的pH值也会影响光催化降解的效率,酸性条件下催化降解效果最好,降解率达99.6%,而碱性和中性条件下降解率较低。分析其酸性条件下的紫外光催化氧化降解,其原理可能是纳米TiO\-2受光照后产生空穴,OH-俘获空穴后生成OH自由基,H+俘获电子后生成H自由基,它们分别发生了氧化和还原反应[24],随着pH值升高,[H+]含量逐渐降低,生成的H自由基含量也随之降低,催化活性因此减弱。
本研究通过将降解产物与木霉菌素衍生物进行结构比对,明确了木霉菌素的主要降解产物为木霉菌醇、M-1、M-2及M-3,同时发现光催化降解木霉菌素的量与检测到的降解产物的累积量不成比例关系,推测可能是在TiO2-UV催化降解木霉菌素的过程中,由于紫外光能够将半导体TiO2价带上的电子激发至导带上,产生具有高还原活性的光生电子,同时在价带上留下高氧化性能的光生空穴[25],这些光生空穴能进一步还原或氧化木霉菌素的降解中间产物,从而将木霉菌素深度氧化或还原成了更小分子的有机物、二氧化碳和水。通过对降解产物结构的分析,初步确定木霉菌素降解产物活性大幅降低甚至失活的原因可能是由于其降解过程中C-3位乙酰基被水解(如木霉菌醇)、C-12,13-环氧基团被破坏(如M-1、M-2)以及上述2个基团同时被破坏(如M-3)等原因所致。
| [1] | UENO Y, SATO N, ISHII K, et al. Biological and chemical detection of trichothecene mycotoxins of Fusarium species [J]. Appl Microbiol, 1973, 25(4): 699-704. |
| [2] | CUNDLIFFE E, DAVIES J E. Inhibition of initiation, elongation, and termination of eukaryotic protein synthesis by Trichothecene fungal toxins [J]. Antimicrob Agents Chemother, 1977, 11(3): 491-499. |
| [3] | 陈列忠, 陈建明, 郑许松, 等. 枸骨内生真菌抗菌代谢产物的鉴定及活性研究 [J]. 农药学学报, 2007, 9(2): 143-148. CHEN Liezhong, CHEN Jianming, ZHENG Xusong, et al. Identification and antifungal activity of the metabolite of endophytic fungi isolated from Llex cornuta [J]. Chin J Pesticide Sci, 2007, 9(2): 143-148.(in Chinese) |
| [4] | WEI C M, HANSEN B S, VAUGHAN M H, et al. Mechanism of action of the mycotoxin trichodermin, a 12,13-epoxy-trichothecene [J]. Proc Natl Acad Sci USA, 1974, 71(3): 713-717. |
| [5] | OKUBARA P A, BLECHL A E, MC CORMICK S P, et al. Engineering deoxynivalenol metabolism in wheat through the expression of a fungal trichothecene acetyltransferase gene [J]. Theor Appl Genet, 2002, 106(1): 74-83. |
| [6] | CARTER C J, CANNON M. Structural requirements for the inhibitory action of 12,13-epoxytrichothecenes on protein synthesis in eukaryotes [J]. Biochem J, 1977, 166(3): 399-409. |
| [7] | 牛芳胜, 马志强, 毕秋艳, 等. 哈茨木霉菌与5种杀菌剂对番茄灰霉病菌的协同作用 [J]. 农药学学报, 2013, 15(2): 165-170. NIU Fangsheng, MA Zhiqiang, BI Qiuyan, et al. Synergism of trichoderma harzianum and five fungicides to botrytis cinerea [J]. Chin J Pestic Sci, 2013, 15(2): 165-170. (in Chinese) |
| [8] | 王国平, 郑必强, 章初龙, 等. 内生真菌ZJUF0986代谢的抗菌活性物质特性 [J]. 植物保护学报, 2008, 35(2): 127-131. WANG Guoping, ZHENG Biqiang, ZHANG Chulong, et al. The antifungal activity of the bioactive compound produced by endophytic fungus ZJUF0986 [J]. Acta Phytophylacica Sinica, 2008, 35(2): 127-131. (in Chinese) |
| [9] | 章初龙, 王国平, 郑必强, 等. 紫杉木霉ZJUF0986抗真菌活性代谢产物分离提取及其活性研究[J]. 菌物学报, 2008, 27(3): 439-446. ZHANG Chulong, WANG Guoping, ZHENG Biqiang, et al. Separation and bioactive of antifungal metabolites of Trichoderma taxi ZJUF0986 [J]. Mycosystema, 2008, 27(3): 439-446. (in Chinese) |
| [10] | 刘小红, 张福生, 王国平, 等. ZJUF0986活性代谢产物对稻瘟病菌致病性的影响 [J]. 植物保护学报, 2008, 35(6): 481-485. LIU Xiaohong, ZHANG Fusheng, WANG Guoping, et al. The effect of ZJUF0986 bioactive metabolite on the pathogenicity of Magnaporthe oryzae [J]. Acta Phytophylacica Sinica, 2008, 35(6): 481-485.(in Chinese) |
| [11] | KONSTANTINOU I K, ALBANIS T A. Photocatalytic transformation of pesticides in aqueous titanium dioxide suspensions using artificial and solar light: intermediates and degradation pathways [J]. Appl Cataly B: Environ, 2003, 42(4): 319-335. |
| [12] | SHIMIZU K, MURAYAMA H, NAGAI A, et al. Degradation of hydrophobic organic pollutants by titania pillared fluorine mica as a substrate specific photocatalyst [J]. Appl Catal B: Environ, 2005, 55(2): 141-148. |
| [13] | JARDIM W F, MORAES S G, TAKIYAMA M M. Photocatalytic degradation of aromatic chlorinated compounds using TiO2: toxicity of intermediates [J]. Water Res, 1997, 31(7): 1728-1732. |
| [14] | 蒲丽, 蒋家珍, 李效禹, 等. 纳米TiO2悬浮液对烟草青枯菌杀菌活性的研究 [J]. 农药学学报, 2005, 7(4): 339-342. PU Li, JIANG Jiazhen, LI Xiaoyu, et al. The fatal activity of titanium dioxide on Pseudomonas solanacearum [J]. Chin J Pestic Sci, 2005, 7(4): 339-342. (in Chinese) |
| [15] | MOHAMED M M, AL-ESAIMI M M. Characterization, adsorption and photocatalytic activity of vanadium-doped TiO2 and sulfated TiO2 (rutile) catalysts: degradation of methylene blue dye [J]. J Molecul Catal A: Chem, 2006, 255(1-2): 53-61. |
| [16] | CHENG Jingli, ZHOU Yong, ZHAO Jinhao, et al. Synthesis and antifungal activity of trichodermin derivatives[J]. Chin Chem Lett, 2010, 21: 1037-1040. |
| [17] | BROWN H C, YOON N M. The borohydride-catalyzed reaction of diborane with epoxides, the anti-markovnikov opening of trisubstituted epoxides [J]. J Amer Chem Soc, 1968, 90(10): 2686-2688. |
| [18] | GODTFREDSEN W O,VANGEDAL S. Trichodermin, a new antibiotic related to trichothecin[J]. Proc Chem Soc, London, 1964: 188-189. |
| [19] | XU Xiaojun, CHENG Jingli, ZHOU Yong, et al. Synthesis and antifungal activities of trichodermin derivatives as fungicides on rice[J]. Chem Biodivers, 2013, 10(4): 600-611. |
| [20] | ALBERICI R M, JARDIM W F. Photocatalytic degradation of phenol and chlorinated phenols using Ag-TiO2 in a slurry reactor [J]. Water Res, 1994, 28(3): 1845-1849. |
| [21] | Al-EKABI H, SERPONE N. Kinetics studies in heterogeneous photocatalysis. I. Photocatalytic degradation of chlorinated phenols in aerated aqueous solutions over titania supported on a glass matrix [J]. J Phys Chem, 1988, 92(20): 5726-5731. |
| [22] | ZHENG S K, WANG T M, XIANG G, et al. Photocatalytic activity of nanostructured TiO2 thin films prepared by dc magnetron sputtering method [J]. Vacuum, 2001, 62(4): 361-366. |
| [23] | DUMITRIU D, BALLY A R, BALLIF C, et al. Photocatalytic degradation of phenol by TiO2 thin films prepared by sputtering [J]. Appl Catal B: Environ, 2000, 25(2-3): 83-92. |
| [24] | 张金龙, 徐华胜, 安保正一. 可见光照射下丙炔光催化水解反应的研究Ⅰ.纳米二氧化钛光催化剂的性能[J]. 催化学报, 2003, 24(11): 845-848. ZHANG Jinlong, XU Huasheng, Masakazu A. Study on the photocatalytic hydrolysis of methylacetylene under UV light irradiation Ⅰ. Performance of nano-titania photocatalyst[J]. Chin J Catal, 2003, 24(11): 845-848.(in Chinese) |
| [25] | GUILLERMO M, VICENTE R A, ANTONIO S. Photo-adsorption and photo-desorption of oxygen on highly hydroxylated TiO2 surfaces. Part 1.-Role of hydroxyl groups in photo-adsorption[J]. J Chem Soc, Faraday Trans 1, 1979, 75: 736-747. |
 2014, Vol.16
2014, Vol.16 


