丁虫腈(flufiprole),又名丁烯氟虫腈,化学名称为3-氰基-5-甲代烯丙基氨基-1-(2,6-二氯-4-三氟甲基苯基)-4-三氟甲基亚磺酰基吡唑。由于氟虫腈的环境危害性大,自2009年起其在水稻上已被禁用。为防治水稻上的二化螟等害虫,大连瑞泽农药有限公司在氟虫腈结构基础上,研发了一种新的苯基吡唑类杀虫剂——丁虫腈[1, 2],由于其具有高效、广谱及对鱼、蚕类低毒等特点,已成为氟虫腈的替代品[3, 4, 5],目前已在水稻及甘蓝中登记使用,但在谷物中并未得到推广应用。
玉米作为我国北方主要粮食作物,其种植面积非常广,但目前尚未见有关丁虫腈在玉米中残留特性的研究报道。为了考察丁虫腈在玉米中推广应用的可能性及制定相关的安全使用标准,笔者研究了丁虫腈在玉米及其土壤中的残留特性。
目前,有关丁虫腈在多种蔬菜、大米、乳品及土壤中的残留检测方法主要为液相色谱-串联质谱法(LC-MS/MS)[3, 6]、气相色谱-质谱法(GC-MS)[4, 7]、气相色谱-ECD法(GC-ECD)[5, 8, 9]等,其中LC-MS/MS和GC-MS法虽然操作简单、灵敏度高,但仪器成本高,不易普及;而GC-ECD法具有样品前处理简单、分析速度快及灵敏度高等优点,近年来在丁虫腈残留分析方面得到了广泛的应用。
笔者建立了丁虫腈在玉米及土壤中残留的GC-ECD分析方法,以期为玉米中丁虫腈的合理使用及MRL值的制定提供基础数据。 1 材料与方法 1.1 仪器与药剂
Agilent 6890气相色谱仪,配有ECD检测器及自动进样器(美国Agilent公司);Oasis HLB固相萃取柱(200 mg/3 mL,Waters公司)。
丁虫腈(flufiprole)标准品(纯度96.0%)和 5%的丁虫腈乳油,均由大连瑞泽农药股份有限公司提供;石油醚和正己烷(色谱纯),Sigma-Aldrich公司产品;实验用水为“娃哈哈”纯净水;其他试剂均为分析纯,其中无水硫酸钠用前经550 ℃烘 2 h。 1.2 分析方法 1.2.1 样品的提取与净化
土壤:准确称取 20 g 土壤样品(精确到0.001 g)于250 mL具塞锥形瓶中,加入30 mL丙酮,振荡1 min后超声提取30 min,过滤到100 mL具塞锥形瓶中;向滤渣中再加入20 mL丙酮提取20 min,过滤;合并滤液,在45 ℃下脱溶,所得固体先用20 mL水溶解,再用20 mL乙酸乙酯萃取2次;合并萃取液,在45 ℃下脱溶,用石油醚溶解并定容至5 mL,供GC-ECD测定。
玉米植株和玉米籽粒:将玉米植株或籽粒样品切碎或粉碎后混匀,于-20 ℃冰柜内贮存。准确称取10.0 g样品(精确到0.001 g)于250 mL具塞锥形瓶中,加入40 mL乙腈和10 g 无水硫酸钠,漩涡1 min后超声提取30 min,过滤;滤渣再用30 mL乙腈提取30 min,过滤;合并滤液,加入2 g氯化钠,剧烈振荡后,静止5 min;将有机相转移到蒸发瓶中,在45 ℃下蒸发至近干,残渣用6 mL V(甲醇)∶V(二氯甲烷)=90∶10溶解,待净化。
采用Oasis HLB固相萃取柱净化。 依次用 6 mL甲醇和6 mL水活化萃取柱;加入上述提取液,分别用3 mL水和3 mLV(甲醇)∶V(水)=3∶7的混合溶剂淋洗,吹干;用6 mLV(甲醇)∶V(二氯甲烷)=90∶10 洗脱;收集洗脱液,在45 ℃下旋转蒸发至近干,加入2 mL石油醚溶解,过0.45 μm滤膜,待色谱分析。 1.2.2 GC-ECD检测条件
HP-5 气相色谱柱(30 m×0.25 mm×0.25 μm);升温程序: 柱温100 ℃,保持2 min,再以10 ℃/min的速度升温至290 ℃,保持5 min;进样口温度250 ℃;载气为高纯氮气,流速1.0 mL/min;检测器320 ℃;进样量1μL;不分流进样。在此条件下,丁虫腈的保留时间为12.56 min。 1.2.3 标准曲线绘制
采用外标法定量。先用正己烷将丁虫腈标准品配制成1.0 mg/mL的母液,再用正己烷稀释成100、10、1、0.1、0.01、0.001 μg/mL 的丁虫腈系列标准工作溶液,在1.2.2节色谱条件下测定。以样品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。 1.2.4 添加回收率试验
在未施药的空白土壤、玉米植株及籽粒中,添加一定量丁虫腈标准溶液,添加水平为0.01、0.05和0.5 mg/kg,每个水平5 次重复,按照本研究所建方法进行提取、净化及气相色谱测定,计算平均回收率和相对标准偏差(RSD)。 1.3 田间试验
时间为2013年,试验地为沈阳农业大学。试验期间平均气温为17.5 ℃,年均降水量600 mm。试验地土壤类型为棕壤土,pH 7.5,有机质含量2.0%。各小区种植条件一致。 1.3.1 消解动态试验
选择未施用过丁虫腈的玉米田,小区面积为30 m2,每小区设3 个重复,小区间设保护行,同时设置空白对照区。将5% 的丁虫腈乳油用水稀释100倍后,于玉米苗后茎叶初期(15 cm 株高)定向喷雾施药1 次。其中玉米植株施药量(有效成分) 为56.25 g/hm2(1.5倍推荐高剂量,乳油1 125 g/hm2),土壤施药量(有效成分)为75 g/hm2 (2 倍推荐高剂量,乳油1 500 g/hm2)。分别于施药后2 h 及1、3、5、7、10、14、21、30、45、60 d 采集玉米植株和土壤样品。土壤样品随机取0~15 cm 深土样1 kg 以上,四分法混匀; 植株样品取整棵,切碎混匀后粉碎。样品直接分析或于-20 ℃冰箱中贮存待测。 1.3.2 最终残留试验
试验设计及小区面积同1.3.1节,但对玉米植株及其土壤分别设高、低2个施药剂量。高剂量同1.3.1 节,低剂量为有效成分37.5 g/hm2(推荐剂量,乳油750 g/hm2),于玉米苗后茎叶初期施药1次。每处理重复3次。分别于玉米乳熟期和成熟期,采集处理组和对照组的土壤、玉米植株及玉米籽粒(将乳熟期玉米和成熟玉米脱粒后混匀缩分),样品直接分析或于-20 ℃ 冰箱中贮存,待测。 2 结果与讨论 2.1 样品的提取和净化
以丙酮为溶剂对土壤样品进行提取,无需净化即可有效去除杂质干扰,色谱图见图 1B。由于玉米植株和籽粒样品的基质成分相对复杂,尤其是植株样品中色素较多,所以在用乙腈提取后,采用Oasis HLB固相萃取柱进行净化,有效地去除了基质及杂质成分的干扰(见图 1D,1F)。
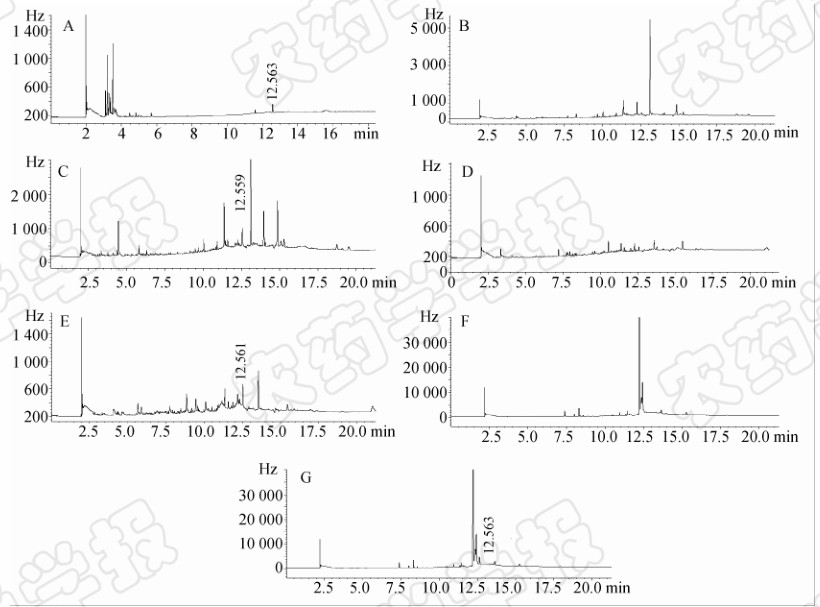 | 图 1 丁虫腈标准品和土壤、玉米植株、玉米样品的色谱图
Fig. 1 Chromatogram of flufiprole standard and difference sample of soil,corn plant and corn
A.丁虫腈标样(0.01 μg/mL);B. 土壤空白样品;C. 土壤添加样品(0.05 mg/kg);D. 玉米植株空白样品;E. 玉米植株添加样品(0.05 mg/kg);F. 玉米籽粒空白样品;G. 玉米籽粒添加样品(0.05 mg/kg)
A. Standard of flufiprole(0.01 μg/mL);B. Blank of soil;C. Soil sample fortified with 0.05 mg/kg flufiprole;D. Blank of corn plant;E. Corn plant sample fortified with 0.05 mg/kg flufiprole;F. Blank of corn;G. Corn sample fortified with 0.05 mg/kg flufiprole |
在0.01~10 mg/kg范围内,丁虫腈的质量浓度与其峰面积呈良好的线性关系,其回归方程为y=14 755x + 216.17,相关系数r=0.999 2。
采用本文所建立的方法进行分析测定,当丁虫腈在土壤、玉米植株及籽粒中的最低添加水平为0.01 mg/kg时,其信噪比为5,可准确进行定量分析,由此可确定该方法的定量限为0.01 mg/kg。
添加回收试验结果见表 1。在0.01、0.05和0.5 mg/kg 3 个添加水平下,丁虫腈的平均回收率为80%~86%,RSD为5.1%~8.0%。准确度和精密度均符合农药残留分析的要求。相关谱图见图 1A~1G。
| 表 1 丁虫腈在土壤、玉米植株、玉米籽粒中的添加回收率(n=5) Table 1 Recoveries of flufiprole spiked in soil,corn plant and corn (n=5) |
由表 2数据可以看出,丁虫腈在土壤和玉米植株中的残留量均随施药后时间的延长而降低,且其在植株中的消解速率快于土壤。施药后7 d,植株中丁虫腈的消解率即可达90%以上,而施药21 d后土壤中的消解率才达90%以上。消解曲线皆符合一级动力学方程,其在玉米植株和土壤中的半衰期分别为2.44和6.77 d。于建垒等[10]报道:丁虫腈在土壤中的半衰期为2.89~4.41 d,土壤中施药后14 d 其消解率可达91%以上;在甘蓝中的半衰期为1.18~1.28 d,施药后3 d消解率达95%以上。目前尚未见有关丁虫腈在其他作物中的消解动态及半衰期的报道。
| 表 2 丁虫腈在土壤、玉米植株中的消解动态方程、半衰期及相关系数 Table 2 The decline dynamics equation,correlation coefficient and half-life of flufiprole in corn plant and soil |
5%的丁虫腈乳油按有效成分37.5 g/hm2(推荐高剂量)和56.25 g/hm2(1.5倍推荐高剂量)分别于玉米苗后茎叶初期施药1 次,距施药后90 d(采样间隔期)时采样,分析结果表明,丁虫腈在供试土壤、玉米植株、玉米乳熟期和收获期籽粒中的最终残留均低于0.01 mg/kg。 3 结 论
本文首次报道了丁虫腈在玉米和土壤中的残留及消解动态。采用有机溶剂提取,经液-液萃取或固相萃取柱净化后,用GC-ECD检测。该方法具有操作简单、重现性好、检测灵敏度高等优势,准确度及精密度均符合农药残留分析要求。
本研究结果表明,丁虫腈在玉米植株和土壤中的消解动态规律均符合一级反应动力学方程,其在玉米植株及土壤中的半衰期分别为2.44和6.77 d,属易降解农药(t1/2 ≤ 30 d)[11]。
我国目前尚未制定丁虫腈在玉米中的最大残留限量(MRL)标准,若参考氟虫腈在蔬菜及谷物中的MRL值(0.02 mg/kg),则可认为采用5%丁虫腈乳油按有效成分37.5 g/hm2或56.25 g/hm2防治玉米田害虫,于玉米苗后茎叶初期施药1次,无论在玉米乳熟期还是收获期,丁虫腈的最终残留量均低于现有的参考限量值。
| [1] | 牛洪涛. 丁烯氟虫腈对小菜蛾的生物活性及抗性风险评估[D]. 泰安:山东农业大学, 2008. NIU Hongtao. Biological activities of butene-fipronil to the diamondbck moth, Plutella xylostella (L.) and its resistance risk assessment[D]. Tai'an:Shandong Agricultural University, 2008.(in Chinese) |
| [2] | 薛超文. 丁烯氟虫腈等新颖杀虫剂对蔬菜害虫的生物活性和田间应用研究[D]. 泰安:山东农业大学, 2007. XUE Chaowen. Bioactivities and field application of butenyl-fipronil etc.on vegetable pests[D]. Tai'an:Shandong Agricultural University, 2007.(in Chinese) |
| [3] | 丁明, 钟冬莲, 汤富彬, 等. 固相萃取/液质联用测定竹笋中丁烯氟虫腈农药残留研究[J]. 分析测试学报, 2013, 32(3): 372-376. DING Ming, ZHONG Donglian, TANG Fubin, et al. Determination of butylene fipronil residue in bamboo shoots by liquid chromatography-tandem mass spectrometry [J]. J Instrum Anal, 2013, 32(3): 372-376.(in Chinese) |
| [4] | 曹维强, 赵海田, 佘永新, 等. 气相色谱-质谱联用对菠菜中丁烯氟虫腈残留的检测[J].分析测试学报, 2009, 28(9):1096-1099. CAO Weiqiang, ZHAO Haitian, SHE Yongxin, et al. Study on determination of butylene fipronil residue in spinach by gas chromatography-mass spectrometry [J]. J Instrum Anal, 2009, 28(9): 1096-1099.(in Chinese) |
| [5] | 何健, 孔德洋, 吴文铸, 等. 稻田样品中丁虫腈及其代谢产物的残留分析方法[J]. 生态与农村环境学报, 2012, 28(4): 451-455. HE Jian, KONG Deyang, WU Wenzhu, et al. Determination of flufiprole and its metabolites in samples from paddy field [J]. J Ecology Rural Environ, 2012, 28(4):451-455.(in Chinese) |
| [6] | TIAN Hongzhe. Determination of chloramphenicol, enrofloxacin and 29 pesticides residuesin bovine milk by liquid chromatography-tandem mass spectrometry [J]. Chemosphere, 2011, 83(3): 349-355. |
| [7] | 曹维强. 丁烯氟虫腈在水、土壤和菠菜中降解动态及机理的研究[D]. 北京: 中国农业科学院, 2010. CAO Weiqiang. Studies on degradation dynamics and mechanism of butylene fipronil in water, soil and spinach[D]. Beijing:Chinese Academy of Agricultural Sciences, 2010.(in Chinese) |
| [8] | 刘郁, 纪明山, 胡睿, 等. 丁烯氟虫腈在油菜中残留分析方法的研究[J]. 安徽农业科学, 2007, 35(18): 5344-5345. LIU Yu, JI Mingshan, HU Rui, et al. Studies on analysis method of butylene fipronil residues in rape [J]. J Anhui Agric Sci, 2007, 35(18): 5344-5345.(in Chinese) |
| [9] | 刘郁, 于亚辉, 边应权, 等. 丁烯氟虫腈在大米中残留分析方法的研究[J]. 世界农药, 2008, 30(5): 35-37. LIU Yu, YU Yahui, BIAN Yingquan, et al. Study on analytical method on butene-fipronil residue in rice [J]. World Pestic, 2008, 30(5): 35-37.(in Chinese) |
| [10] | 于建垒, 宋国春, 李瑞娟, 等. 丁虫腈在甘蓝中的残留特性及安全使用[J]. 中国蔬菜, 2011(20): 79-83. YU Jianlei, SONG Guochun, LI Ruijuan, et al. Residue studies and safe application of flufiprole in cabbage [J]. China Vegetables, 2011(20): 79-83.(in Chinese) |
| [11] | 国家环境保护总局. 化学农药环境安全评价试验准则 [Z]. 北京: 国家环境保护总局,2003. SEPA. Guidelines on environmental safety assessment for chemical pesticides[Z]. Beijing: SEPA,2003.(in Chinese) |
 2014, Vol.16
2014, Vol.16 


