杀虫单(monosultap)属于沙蚕毒素类杀虫剂,作为一种弱的胆碱酯酶抑制剂,其主要通过竞争性抑制胆碱与烟碱型胆碱酯酶的结合而阻断神经节胆碱在突触问的正常传递,具有较强的触杀、胃毒及内吸传导作用,对鳞翅目害虫幼虫有较好的防治效果,在我国应用广泛[1,2,3]。杀虫单化学名称为2-二甲氨基-1-硫代磺酸钠基-3-硫代磺酸基丙烷,相对分子质量为333.4。其纯品为针状结晶,易溶于水、工业酒精及热的无水乙醇,微溶于甲醇,不溶于丙酮、乙醚、氯仿等溶剂,常温及在pH 5~9条件下稳定,遇铁可降解,在强碱及强酸条件下易分解。
我国迄今尚未颁布过有关杀虫单在食品中残留量检测方法的国家标准或行业标准。为了满足进出口贸易的需要,同时为控制食品中农药残留量提供可靠的检测方法,开展杀虫单残留量检测方法及前处理技术的研究是非常必要的。
目前关于杀虫单检测方法的研究报道较多。牟兰等[4,5]采用薄层色谱分离库仑滴定法和钙黄绿素-钯荧光光度测定法等检测了杀虫单原药和制剂中有效成分的含量;李小燕等[6]及吕波等[7]分别采用荧光共振能量转移法和示波电位滴定法测定了原药中杀虫单的含量。有关其残留分析方法的报道多集中在经衍生化后采用气相色谱(GC)和气相色谱-质谱联用(GC-MS)检测方面。由于杀虫单进入昆虫体内可迅速转化为沙蚕毒素或二氢沙蚕毒素,其在强酸或强碱条件下也能水解为沙蚕毒素(杀虫单及沙蚕毒素结构式见 Scheme 1),因此可将杀虫单衍生化为沙蚕毒素后进行检测。郑尊涛等[8]及程欢等[9]分别于衍生化后采用气相色谱-火焰光度检测器 (GC-FPD)和气相色谱-电子捕获检测器(GC-ECD)测定了水稻和土壤中残留的杀虫单;孙惠青等[10]及TAO等[11]分别建立了衍生化后番茄和烟草中杀虫单残留量的GC-FPD分析方法;Zhang等[12]采用衍生化GC-MS方法检测了稻壳及土壤中的杀虫单残留。
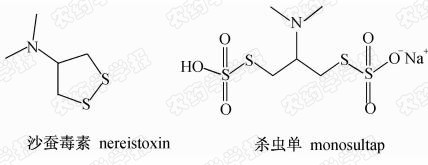 | Scheme 1 |
已报道的杀虫单残留分析方法均存在灵敏度较低及检测对象单一等问题,其中大部分是针对土壤、稻米等基质的检测,而对于富含色素、糖类等成分,基质干扰大的水果、蔬菜等样品仍存在检测灵敏度不高、检测速度慢等问题。为提高水果、蔬菜等作物中杀虫单残留检测的灵敏度,笔者研究建立了快速检测黄瓜、番茄和土壤中杀虫单残留量的衍生化超高效液相色谱-串联质谱(UPLC-MS/MS)方法,该方法不仅灵敏度高,且仪器检测过程只需3~5 min,显著提高了检测效率。 1 材料与方法 1.1 仪器与试剂 1.1.1 主要仪器
高效液相色谱-质谱系统:UPLC(Waters ACQuityTM)-MS/MS(AB Siex TRIPLE QUADTM 5500);色谱柱:1)Waters ACQUITY UPLC R BEH C18柱(100 mm×2.1 mm, 粒径1.7 μm),2)资生堂 CAPCELL PAK C18柱(100 mm×2.0 mm,粒径2.0 μm);BSA124S电子天平(精确至0.1 mg,塞多利斯科学仪器公司);0.22 μm有机滤膜 (天津美瑞泰克公司)。 1.1.2 药剂及试剂
杀虫单(monosultap)标准品(纯度为96.0%)及沙蚕毒素草酸盐(nereistoxin oxalate)标准品(纯度> 99.0%),均购自浙江锐特化工科技有限公司;试剂为色谱纯或分析纯,无水硫酸钠用前经650 ℃灼烧4 h。 1.2 杀虫单及沙蚕毒素标准储备液配制
分别称取10 mg(精确至0.000 1 g)杀虫单标准品和16 mg(精确至0.000 1 g)沙蚕毒素草酸盐标准品于10 mL容量瓶中,用V (甲醇)∶V (水)=1∶9 的混合溶液稀释并定容,分别配制成杀虫单或沙蚕毒素质量浓度为1 000 mg/L的标准储备液,于0~4 ℃条件下贮存,备用。 1.3 样品预处理
土壤样品:于番茄和黄瓜实验基地随机取6~12个点,环刀钻土采集0~15 cm深土壤1~2 kg,过1 mm筛除去碎石、杂草及根茎等杂物后,按四分法留样约250 g,于-18~-20 ℃下贮存,待提取及衍生化。
黄瓜及番茄样品:将黄瓜或番茄全果以四分法缩分,高速捣碎后,留250 g样品,于-18~-20 ℃密封保存,待提取及衍生化。 1.4 样品中杀虫单的提取及衍生化 1.4.1 杀虫单的提取
称取预处理好的样品20 g于250 mL离心瓶中,加入50 mL 0.02 mol/L的盐酸溶液,摇匀后静置10 min,振荡提取30 min(对于黄瓜及番茄样品,振荡提取前先于10 000 r/min匀浆2 min),经布氏漏斗抽滤,用20 mL 0.02 mol/L的盐酸分数次洗涤滤渣,合并滤液于250 mL具塞三角瓶中。 1.4.2 杀虫单的衍生化
用1 mol/L的氢氧化钠调节上述提取液pH至8.5~9.0,振荡5 min后,加入2 mL 0.2 mol/L的硫化钠溶液,置于70 ℃水浴中加热反应2 h后,自然冷却至室温。 1.4.3 沙蚕毒素的萃取
向衍生化后的溶液中加入2 g氯化钠,转移至500 mL分液漏斗中,依次用60、40和30 mL乙醚萃取;合并有机相,经无水硫酸钠干燥,于40 ℃水浴下减压浓缩至近干,氮气吹干,用色谱纯甲醇定容至5 mL,过0.22 μm滤膜,待测。 1.5 UPLC-MS/MS 检测条件 1.5.1 液相色谱条件
Waters ACQUITY UPLC R BEH C18色谱柱(100 mm×2.1 mm, 1.7 μm);柱温25 ℃;流速0.2 mL/min;流动相A:水(含体积分数为0.1%的甲酸),B: 甲醇;梯度洗脱程序见表 1。
| 表 1 超高效液相色谱梯度洗脱程序 Table 1 Gradient elution of UPLC |
采用ESI+离子源,MRM模式进行检测。以m/z 105.0作为沙蚕毒素的准分子离子,以m/z 150.0/105.0作为定量离子对,以m/z 150.0/60.8作为定性离子对。各优化参数设置:锥孔电压30 V;碰撞能量,定量离子为18 V,定性离子为 22 V;毛细管电压3 kV;反吹气流量50 L/h;脱溶剂气流量750 L/h;脱溶剂气温度400 ℃;碰撞气流量0.17 mL/min;离子能量0.4 eV。 1.5.3 杀虫单残留量计算
采用外标法定量。试样中杀虫单质量分数以 ω 计(单位为 μg/kg),计算公式见式(1)[8]。
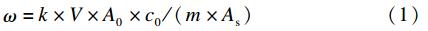
式中:A0 — 标样峰面积值;As —试样峰面积值;c0— 标样中沙蚕毒素质量浓度(μg/L);V — 样品溶液最终定容体积(mL);m — 样品质量(kg);k — 将沙蚕毒素换算成杀虫单时的系数(k=2.238)[由杀虫单相对分子质量(333.4)/沙蚕毒素相对分子质量(149.3)得到]。 2 结果与分析 2.1 萃取溶剂选择
杀虫单易溶于水,20 ℃时其在水中的溶解度为1.335 g/mL,但几乎不溶于有机溶剂,在强酸或强碱条件下能水解为沙蚕毒素;而沙蚕毒素易溶于亲脂性有机溶剂,但不溶于水[13]。利用此特点,本研究按常规方法,采用0.02 mol/L的盐酸水溶液作为提取液,并比较了萃取剂三氯甲烷、乙酸乙酯、石油醚和乙醚对黄瓜、番茄及土壤样品提取液中沙蚕毒素的萃取效果。结果发现:对土壤基质而言,4种萃取剂均能取得理想的回收率;对于番茄和黄瓜基质,采用乙醚作萃取剂时,添加回收率为98%~105%,用石油醚作萃取剂时,添加回收率仅为60%~70%,而采用三氯甲烷和乙酸乙酯萃取时乳化现象严重,且难以消除,操作十分不便。故最后确定以乙醚作为萃取剂。 2.2 质谱条件确定
沙蚕毒素的相对分子质量为149.3,在ESI+模式下,其母离子的分子离子峰(M+H)为150。经全扫描方式观察,确定m/z 150.0/105.0和 m/z 150.0/60.8分别为其定量和定性离子对;通过总离子扫描,确定其最佳碰撞电压为25 eV(图 1)。
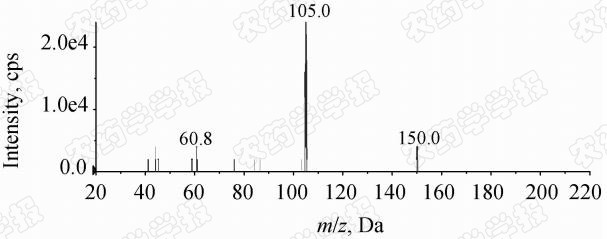 | 图 1 沙蚕毒素(50 μg/L)在25 eV碰撞电压下的 质谱总离子扫描图Fig.1 MS chromatogram of nereistoxin (50 μg/L) at collision energy of 25 eV |
比较了Waters ACQUITY UPLC R BEH C18色谱柱(图 2A)和Thermo Syncronis C18色谱柱(图 2B)对番茄基质中沙蚕毒素的检测结果,发现后者峰形宽且有分叉,故最终选择粒径为1.7 μm的Waters ACQUITY UPLC R BEH C18色谱柱。在所选定的UPLC条件下,沙蚕毒素的保留时间为1.2 min,整个分析时间仅需5 min。
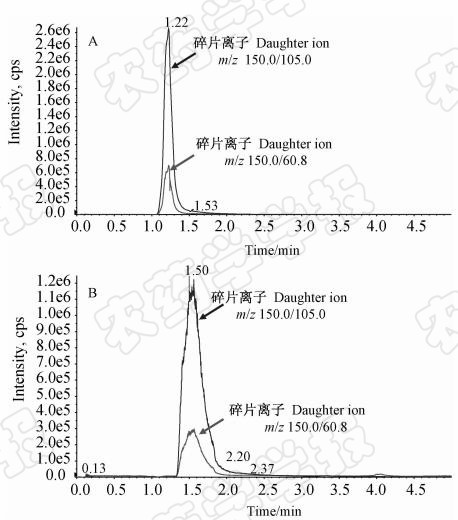 | 图 2 不同色谱柱下沙蚕毒素标样的超高效液相色谱-串联质谱总离子流图Fig. 2 UPLC-MS/MS chromatograms of nereistoxin standards by different columnA. Waters ACQUITY UPLC R BEH C18; B. Thermo Syncronis C18
注:多离子反应模式;番茄基质,添加水平为10 μg/L。 Note: TIC, MRM mode; tomato matrix, spiked level was 10 μg/L. |
采用空白黄瓜、番茄及土壤样品提取液,分别将沙蚕毒素质量浓度为1 000 mg/L的标准储备液逐级稀释成500、200、100、50、20、10、5及1 μg/L的基质匹配标准工作溶液,在选定的仪器条件下进样检测,重复3次。以沙蚕毒素进样质量浓度为横坐标、仪器响应值为纵坐标绘制标准曲线。结果表明,在1~500 μg/L范围内,沙蚕毒素质量浓度与色谱峰面积呈良好的线性关系。其中,番茄:y=45.16x+128.2,R2=0.997 9;黄瓜:y=41.18x+45.11,R2=0.999 3;土壤:y=40.74x+60.90,R2=0.999 6。在该测定条件下,沙蚕毒素的保留时间约为1.25 min。 2.5 仪器检出限及定量限
用空白番茄、黄瓜及土壤基质提取液将沙蚕毒素标准储备液稀释至0.5 μg/L,分别进样测定,计算得到沙蚕毒素的仪器响应信噪比(S/N)分别为15.7、15.8、19.5和12.2。以S/N≥3为检出限(LOD),折算得基质匹配标准溶液中杀虫单的LOD值分别为0.213 μg/kg(番茄)、0.212 μg/kg(黄瓜)及0.172 μg/kg(土壤);以S/N≥10为定量限(LOQ),折算得杀虫单的LOQ值分别为0.710 μg/kg(番茄)、0.707 μg/kg(黄瓜)和0.573 μg/kg(土壤)。 2.6 添加回收率
在空白黄瓜、番茄及其土壤样品中添加10~500 μg/kg水平的杀虫单标准溶液,每个添加水平重复5次,按所确定的方法提取、衍生化、萃取及检测。结果见表3,杀虫单的平均回收率在79%~101%之间,相对标准偏差(RSD)为6.6%~16%,均符合NY/T 788—2004《农药残留试验准则》[14]要求,表明所建立方法可用于黄瓜、番茄及土壤中杀虫单残留量检测。
| 表3 方法添加回收率试验结果(n=5) Table 3 Results of method recovery(n=5) |
3 结论及讨论
本 研究建立了一种UPLC-MS/MS(ESI) 联用分析方法,可用于测定番茄、黄瓜及土壤中杀虫单的残留量。先将杀虫单在碱性条件下水解成沙蚕毒素,经乙醚液-液分配后用甲醇定容,通过UPLC-MS/MS法测定沙蚕毒素的浓度,最后再折算成杀虫单的残留量。
分别比较了三氯甲烷、乙酸乙酯、石油醚和乙醚对黄瓜、番茄及土壤样品中沙蚕毒素的提取效果,发现乙醚更适宜用作黄瓜、番茄等色素及糖类含量多的果蔬样品中杀虫单残留测定的萃取剂。所建立方法对番茄、黄瓜及土壤样品中杀虫单的检出限(LOD)为0.172~0.213 μg/kg,远低于郑尊涛等[8]报道的GC-FPD方法测定土壤及水稻中杀虫单时的检出限(2.0 ~10.0 μg/kg),程欢等[9]报道的GC-ECD方法测定稻田土壤、水稻植株、谷壳和糙米中杀虫单时的检出限(2.5 μg/kg)以及TAO等[11]采用GC-FPD测定番茄中杀虫单时的检出限(1 μg/kg)。本方法中沙蚕毒素的出峰时间为1.25 min,整个检测过程仅需3~5 min,相比程欢等[9]报道的检测时间9 min、郑尊涛等[8]的14 min 以及TAO等[11]的25 min,本方法大大缩短了检测时间,检测效率显著提高,同时可减少溶剂的使用量,更有利于大批量样品的检测。
根据GB/T 2763—2012《食品中农药最大残留限量》标准[15]的规定,对杀虫单最终残留物的定义即是沙蚕毒素。而本研究所建立的方法,实际上检测的是样品中杀虫单和沙蚕毒素的总残留量。此外,由于沙蚕毒素类系列杀虫剂,如杀虫单、杀虫双、杀螟丹、杀虫磺、杀虫环等农药母体均可在碱性条件下水解成沙蚕毒素,因此,对于未知的沙蚕毒素类农药样品,本研究提供了一种简便、可靠、准确的残留量检测方法。
| [1] | 杨学慧,陈宗化,邢华.探讨提高杀虫单出粉率的工艺改进[J].现代农药,2005, 4(6):7-9. YANG Xuehui, CHEN Zonghua, XING Hua. Process innovation on raising flour yield of monosultap[J]. Modem Agrochemicals,2005, 4(6):7-9.(in Chinese) |
| [2] | 吴应琴.高含量杀虫单原粉及色粉的制备[J].贵州化工,2006,31(6):1-4. WU Yingqin. Preparation of high purity of monosultap wet powder and color powder[J].Guizhou Chem Ind, 2006, 31(6):1-4.(in Chinese) |
| [3] | 赵献兵.农药:杀虫单(双)有望迎来结构性机遇[J].中国农资,2006(8):27-29. ZHAO Xianbing. Pesticide: monosultap is expected to usher in structural opportunities [J]. China Agriculture Means of Production, 2006(8):27-29.(in Chinese) |
| [4] | 牟兰,卢玉振,张长庚.薄层色谱分离库仑滴定法测定杀虫单[J].分析化学,1996,24(11):1334-1338. MOU Lan, LU Yuzhen, ZHANG Changgeng. Determination of shachongdan by thin layer chromatographic separation-coulometric titration [J]. Chin J Anal Chem, l996, 24(11):1334-1338.(in Chinese) |
| [5] | 牟兰,卢玉振,张长庚.钙黄绿素-钯荧光光度法测定微量杀虫单[J].光谱学与光谱分析,l997,17(2): 41-44. MOU Lan, LU Yuzhen, ZHANG Changgeng. Fluorometric determination of trace shachongdan with calcein-Pd2+ [J]. Spectroscopy and Spectral Analysis,l997,17(2): 41-44.(in Chinese) |
| [6] | 李小燕,李树伟,曾铭,等.荧光共振能量转移测定杀虫单[J].分析化学,2006,34(9): 1358. LI Xiaoyan, LI Shuwei, ZENG Ming, et al. Determination of shachongdan by fluorescence resonance energy transfer [J]. Chinese J Anal Chem, 2006, 34(9): 1358.(in Chinese) |
| [7] | 吕波,王静,郑秀文,等.示波电位滴定法测定杀虫单含量[J].南京农业大学学报,1999,22(1):99-100. LV Bo, WANG Jing, ZHEN Xiuwen, et al. Determination of shachongdan by oscillographic potentiometric titration [J].J Nanjing Agric Univ,1999,22(1):99-100.(in Chinese) |
| [8] | 郑尊涛,吴慧明,施海燕,等.杀虫单在土壤及水稻中的残留分析方法研究[J].浙江农业学报,2004,16(2):92-95. ZHENG Zuntao, WU Huiming, SHI Haiyan, et al. Method study on residue analysis of monosultap in paddy soil and rice plant[J].Acta Agriculturae Zhejiangensi, 2004, 16(2):92-95.(in Chinese) |
| [9] | 程欢,龚道新.杀虫单在水稻和稻田土壤、水中的残留分析方法研究[J].农药科学与管理,2009,30(12):39-42. CHENG Huan, GONG Daoxin. Study on monosultap residues in rice plants, soil and water[J]. Pestic Sci Admin, 2009, 30(12):39-42.(in Chinese) |
| [10] | 孙惠青,徐光军,李义强,等.烟草中杀虫单残留分析方法研究[J].中国烟草科学,2009,30(1):35-37. SUN Huiqing, XU Guangjun, LI Yiqiang, et al. Analysis method of monosultap residue in tobacco leaves [J]. Chinese Tobacco Science, 2009, 30(1):35-37.(in Chinese) |
| [11] | TAO Chuanjiang, HU Jiye, LI Jianzhong. Determination of insecticide monosultap residues in tomato and soil by capillary gas chromatography with flame photometric detection [J]. Can J Anal Sci Spect, 2007, 52(5): 295-304. |
| [12] | ZHANG Fengzu, WANG Lei, ZHOU Li, et al. Dissipation and residues of monosultap in rice plant and environment [J]. Bull Environ Contam Tox, 2012, 88(3): 362-367. |
| [13] | HASHIMOTO Y, OKAICHI T. Some chemical properties of nereistoxin[J]. Annals of the New York Academy of Sciences, 2006, 90(3):667-673. |
| [14] | NY/T 788-2004,农药残留试验准则[S]. 2004:5. NY/T 788-2004, Guideline on pesticide residue trials [S]. 2004:5.(in Chinese) |
| [15] | GB/T 2763-2012,食品中农药最大残留限量[S].2012: 96. GB/T 2763-2012, Maximum residue limits for pesticides in food [S]. 2012:96.(in Chinese) |
 2014, Vol. 16
2014, Vol. 16


