2,4-二氯苯氧乙酸(2,4-D)是一种高效、内吸、且具有高度选择性的除草剂和植物生长调节剂,广泛应用于田间除去阔叶杂草和水果保鲜[1, 2, 3],但如果使用不当,对人和牲畜会有一定的毒副作用[4, 5]。目前测定苯氧乙酸类除草剂含量的方法主要有气相色谱法和薄层色谱法。前者需要先将其进行酯化反应才能进样测定,操作繁琐、费时;而后者重现性较差[6]。
分子印迹技术(molecular imprinting technique,MIT)是制备对目标分子具有特异性识别能力的聚合物的新技术。它是将功能单体在交联剂的存在下围绕着模板分子先进行聚合反应,然后除去以共价键或非共价键结合的模板分子,从而得到具有特异性识别孔穴的三维网状结构的聚合物,称为分子印迹聚合物(molecular imprinting polymers,MIPs)。目前,MIPs已成功应用于多个领域复杂基质中目标化合物的分离、净化和富集[7, 8, 9],将其用作固相萃取剂,能够克服生物或环境样品体系所需的复杂预处理等不利因素的影响,为样品的采集和分析提供了极大的方便。分子印迹聚合物的制备方式主要有本体聚合、悬浮聚合、沉淀聚合、乳液聚合和种子溶胀聚合等传统方法,但这些方法制备的印迹聚合物,其识别位点多存在于聚合物内部,印迹分子向聚合物内部扩散阻力较大,再结合动力学缓慢,导致印迹分子在洗脱时会有一定的残留[10]。表面引发原子转移自由基聚合 (surface-initiated atom transfer radical polymerization,SI-ATRP) 技术是一种在固相基质表面发生的活性可控的自由基聚合技术,具有修饰密度高、高聚物链端可控、单体选择范围广、条件温和及操作简单等优点[11],能有效克服传统聚合方法中的不足[12, 13, 14]。
SI-ATRP能控制目标分子质量及分子质量分布,进而控制基体表面聚合物膜的结构,可同时聚合多种单体、聚合反应可用水作为介质、不受杂质的影响且可以合成多嵌段聚合物等。采用SI-ATRP技术制备MIPs,分子印迹识别位点分布在MIPs的表面,既可以提高识别速率和识别效果,还可避免印迹分子的泄露,具有较好的应用前景:如Chang等[15]以石墨烯为基底,采用ATRP技术制备的 2,4-二氯苯酚分子印迹膜对模板分子具有良好的特异识别性能;Wei等[16]利用ATRP技术在金的表面合成了赖氨酸分子印迹材料;Wang等[17]以氧化铝为模板,采用ATRP技术制备了β-雌二醇的纳米管膜。
本研究采用SI-ATRP技术,首次以氯甲基化交联聚苯乙烯树脂为载体和大分子引发剂,制备了 2,4-D分子印迹聚合物(2,4-D MIPs),考察了该印迹聚合物对 2,4-D的结合性能,通过对实际样品的富集和分离测定,验证了其识别性能。 2,4-D MIPs的制备流程见图 1。首先在交联聚苯乙烯树脂表面引入苄基氯,得到大分子引发剂CMCPS,同时作为载体;再选取丙烯酰胺(AM)作为功能单体与易于洗脱的模板分子 2,4-D进行预聚合反应,通过静电作用力形成预聚合复合物;继而以乙二醇二甲基丙烯酸酯(EDMA)为交联剂,溴化铜/2,2′-联吡啶(CuBr/Bpy)为催化剂,将复合物接枝到CMCPS表面,最后洗去模板分子后,在CMCPS表面的聚合物薄层中留下了大量与 2,4-D结构类似的孔穴,形成了 2,4-D MIPs。
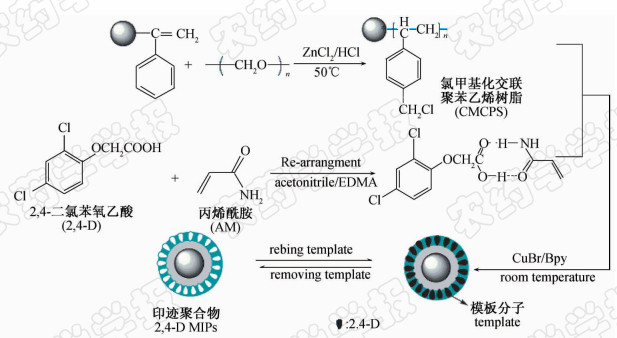 | 图 1 2,4-D表面分子印迹聚合物(2,4-D MIPs)的制备流程Fig. 1 Schematic diagram for preparation of the 2,4-D MIPs |
1 材料与方法 1.1 试剂与仪器
AB-8大孔吸附树脂,18~30目(550~880 μm)(河北沧州保恩化工有限公司);溴化亚铜、2,2′-联吡啶(Bpy)、丙烯酰胺(AM)、 2,4-二氯苯氧乙酸(2,4-D)、 2,4-二氯苯酚(2,4-DCP)、 2,4-二氯苯甲醛(2,4-DCAD)、乙二醇二甲基丙烯酸酯(EDMA),均为分析纯(上海晶纯试剂有限公司);甲醇,色谱纯(Tedia Company Fairfield,USA);其余试剂均为分析纯(天津市大茂化学试剂厂)。
KQ-3200E型超声波清洗器(昆山市超声仪器有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);BS 224S型电子天平(赛多利斯科学仪器有限公司);SHZ-C型水浴恒温振荡器(上海浦东物理光学仪器厂);TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);TGL-20M高速台式离心机(长沙湘仪离心机有限公司);JSM-7500F型电子扫描显微镜(日本JEOL公司);VarioEL III型元素分析仪(德国艾乐曼元素分析系统公司);LC-20AT高效液相色谱仪(日本岛津公司);C18反相色谱柱(4.6 mm×150 mm,5 μm美国安捷伦公司),C18固相萃取柱(500 mg,天津博纳艾杰尔科技有限公司)。
色谱条件:C18反相色谱柱(4.6 mm×150 mm,5 μm,美国安捷伦公司),流动相:V(甲醇)∶V(水)=9∶1,pH 3.0,流速1.0 mL/min,柱温 40 ℃,波长 282 nm。
1.2 氯甲基化交联聚苯乙烯树脂(CMCPS)的制备
参照文献[18]的方法制备CMCPS。在250 mL三颈圆底烧瓶中,加入15.4 g干燥的AB-8树脂、9.09 g多聚甲醛、20.44 g无水氯化锌、80 mL冰乙酸和40 mL 体积分数为80%的浓硫酸,于50 ℃及磁力搅拌下,通入自制的氯化氢气体,反应12 h。用去离子水洗至中性,再用丙酮洗涤,于60 ℃条件下真空干燥24 h,备用。
1.3 2,4-D表面分子印迹聚合物( 2,4-D MIPs)的制备及表征 1.3.1 2,4-D MIPs的制备
分别准确称取(量取)2.2 g 2,4-D、2.8 g AM、8 mL EDMA和16 mL乙腈于100 mL圆底烧瓶,预聚合2 h;再分别准确称取2.2 g CMCPS(作为大分子引发剂)、0.114 g溴化亚铜和0.335 g Bpy于另一100 mL圆底烧瓶中;密封后两个烧瓶分别通氮气(除氧)30 min。在氮气保护下迅速将第1个烧瓶中的液体完全转入第2个烧瓶中,室温反应18 h后,依次用去离子水、0.1 mol/L的乙二胺四乙酸二钠(EDTA)水溶液和丙酮洗涤。于60 ℃下真空干燥24 h。用V(甲醇)∶V(冰乙酸)=8∶2 的混合溶液反复洗涤,并用索氏提取器提取24 h,以除去模板分子 2,4-D 和未反应的交联剂EDMA。于60 ℃下真空干燥,即得 2,4-D MIPs。制备非印迹聚合物(2,4-D NIPs)时,除不加模板分子外,其余操作步骤同上。
1.3.2 2,4-D MIPs的表征
分别采用元素分析法和扫描电镜(SEM)观察法,对CMCPS、 2,4-D MIPs和 2,4-D NIPs进行表征。根据公式(1)计算接枝量(GR)[19]:
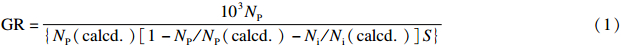
(1)式中,NP表示N元素在氯甲基化交联聚苯乙烯微球上增加的质量分数,NP(calcd.)为AM单体中氮元素的质量分数,Ni为引发剂上增加的氮元素的质量分数,Ni(calcd.)是引发剂单元分子中N元素的理论质量分数,S是聚合物固定相的比表面积(492.31 m2/g)
1.4 2,4-D MIPs对 2,4-D的结合特性 1.4.1 吸附动力学曲线的绘制
分别准确称取0.1 g 2,4-D MIPs和 0.1 g 2,4-D NIPs各10份于两组50 mL的锥形瓶中,加入10 mL 8 mmol/L的 2,4-D甲醇溶液,于室温下振荡不同时间后,移取上清液1 mL,用甲醇定容至10 mL,用紫外分光光度法(测定波长为231 nm)测定上清液中 2,4-D的浓度,根据公式(2)[20]分别计算不同时间段内 2,4-D MIPs和 2,4-D NIPs对2,4-D的吸附量,以吸附量Q对时间t作图,得到吸附动力学曲线。
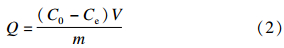
(2)式中,Q为吸附量(mmol/g),C0和Ce分别为 2,4-D的初始浓度和吸附平衡时的浓度(mmol/L),V为溶液体积(mL),m为 2,4-D MIPs的质量(g)。
1.4.2 2,4-D浓度对 2,4-D MIPs吸附量的影响
在室温下,分别准确量取10 mL系列浓度的 2,4-D甲醇溶液置于若干锥形瓶中,加入约0.1 g 2,4-D MIPs,在水浴恒温振荡器中振荡24 h,待结合平衡后取上清液,采用紫外分光光度法测定 2,4-D的浓度。 2,4-D NIPs的 测定方法同上。分别计算单位质量的 2,4-D MIPs和 2,4-D NIPs对 2,4-D的吸附量。
1.4.3 吸附的选择性
为了进一步考察 2,4-D MIPs 对 2,4-D的吸附是否具有专一性,选取与 2,4-D结构类似的 2,4-DCP和 2,4-DCAD(见Scheme 1)作为底物竞争吸附物质,进行吸附试验。
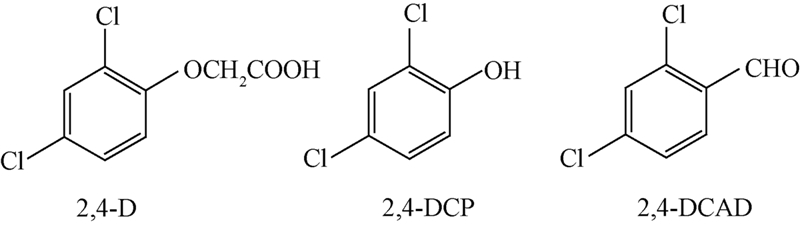 | Scheme 1 |
准确称取3份 2,4-D MIPs,每份0.1 g,分别加入到10 mL 8 mmol/L的 2,4-D、 2,4-DCP和 2,4-DCAD甲醇溶液中,待结合平衡后用紫外分光光度法测定各化合物的浓度。按公式(3)和(4)分别计算各物质的分配系数Kd和 2,4-D MIPs对 2,4-D(相对于 2,4-DCP、 2,4-DCAD)的选择性系数k[21]。 2,4-D NIPs的操作步骤和计算方法同上。
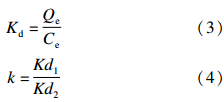
(3)~(4)式中,Kd(mL/g)是某物质的分配系数;Ce(mg/mL)是上清液中该物质的平衡浓度;Qe(mg/g)是该物质的平衡结合量。相对选择性系数k′可由公式(5)确定,它代表相对于非印迹聚合物而言,印迹聚合物 2,4-D MIPs对 2,4-D的吸附选择性的提高程度。

(5)式中,kMIP是 2,4-D MIPs对 2,4-D的选择性系数;kNIP是 2,4-D NIPs对 2,4-D的选择性系数。
采用Scatchard[22]模型分析印迹聚合物的吸附特性。Scatchard方程可表示为:
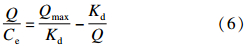
(6)式中,Qmax是印迹聚合物的最大表观吸附量(mg/g),Kd是印迹聚合物的平衡离解常数(mg/L),Q是印迹聚合物在吸附溶液中的吸附量(mg/g),Ce是吸附后模板分子的平衡质量浓度(mg/L)。
1.4.4 动态法测定解吸附性能
称取一定量的 2,4-D MIPs于玻璃填充柱内,使柱床体积(VB)为2 mL,加入一定浓度的 2,4-D溶液并使其达到饱和吸附。以V(甲醇)∶V(乙酸)=8∶2为洗脱液,按2 mL/min 的流速通过 2,4-D MIPs填充柱进行解吸,收集洗脱液并测定 2,4-D 的浓度。以柱床体积(VB)为横坐标,2,4-D 的浓度为纵坐标绘制解吸附曲线。
1.5 2,4-D MIPs吸附性能的验证 1.5.1 2,4-D MIPs-SPE固相萃取柱的制备
取5 mL聚丙烯固相萃取空柱和两片聚乙烯筛板,先用一块筛板将固相萃取柱的一端堵住,向其中均匀填入0.5 g 2,4-D MIPs粉末,再放入另一块筛板压实。用2倍柱体积的V(甲醇)∶V(乙酸)=8∶2 洗脱液洗脱,收集流出液,进行HPLC检测。若未检测出 2,4-D,说明印迹聚合物中的模板分子已被清洗干净。最后用甲醇洗脱除去残留溶剂,于60 ℃下烘干,备用。
1.5.2 实际样品分析
取市售新鲜豆芽60 g于组织捣碎匀浆机中高速匀浆2 min,称取5 g于50 mL试管中,加入一定量的 2,4-D和20 mL蒸馏水,用1.0 mol/L的氢氧化钠溶液调pH至11,室温振荡5 min,静置 30 min,在4 ℃、6 000 r/min下离心10 min,过滤后将滤液转移至50 mL具塞试管中,用1.0 mol/L的盐酸溶液调节pH至3.0,静置 30 min,在4 ℃、8 000 r/min下离心5 min,将滤液转移至 50 mL锥形瓶,备用。
将1.5.1节制备的 2,4-D MIPs-SPE固相萃取柱用2倍体积的甲醇和水活化,加入上述滤液,用V(甲醇)∶V(乙酸)=8∶2 的洗脱液洗脱,收集洗脱液6 mL,过0.45 μm有机滤膜,取20 μL进行HPLC分析,计算回收率。
2 结果与讨论 2.1 2,4-D MIPs的制备
本研究采用SI-ATRP技术制备的 2,4-D MIPs,模板分子 2,4-D易于洗脱,提高了模板分子与识别位点的结合效率。另外,由于CMCPS既可作为载体又可以作为大分子引发剂,故无需再加入其他引发剂,该特征优于文献报道的方法[23]。
2.2 2,4-D MIPs的表征 2.2.1 元素组成分析
结果(表 1)表明:与 2,4-D NIPs 和CMCPS相比,2,4-D MIPs中N、C和H元素的质量分数均升高,接枝量为1.11 mg/m2,表明该印迹聚合物已成功接枝到树脂表面上。
| 表 1 2,4-D MIPs的元素分析数据Table 1 Element analysis results of the 2,4-D MIPs |
2.2.2 电镜分析
由图 2可以看出:印迹前CMCPS表面比较光滑平整,而印迹后的聚合物 2,4-D MIPs颗粒表面多孔、较为粗糙,质地疏松。印迹聚合物上分布的空穴可能是模板分子被洗脱后留下的,该空穴为模板分子的特异性吸附提供了条件。这进一步表明该印迹聚合物已成功制备。
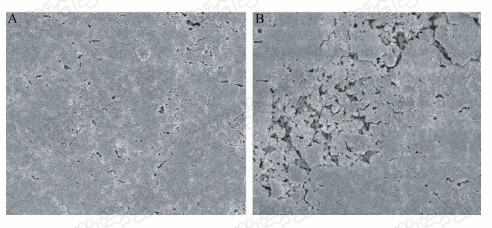 | 图 2 氯甲基化聚苯乙烯树脂和 2,4-D印迹聚合物的扫描电镜图(×10 000)Fig. 2 Scanning electron micrographs of CMCPS and 2,4-D MIPs(×10 000) |
2.3 吸附量的影响因素 2.3.1 模板分子与功能单体的配比对 2,4-D MIPs吸附量的影响
在分子印迹聚合物中,模板分子与功能单体的物质的量之比直接影响印迹聚合物的吸附量。由表 2可以看出:当n(模板)∶n(单体)=1∶4 时,2,4-D MIPs对 2,4-D 的吸附量最大。这可能是由于随着功能单体分子比例的增加,相互之间可形成有效的静电作用力,从而使吸附量增加;但当单体比例进一步增加(n(模板)∶n(单体)=1∶6),吸附量反而降低了,这可能是因为功能单体的量太多时,2,4-D MIPs的非特异性吸附能力也随之增加,会增加其对非模板的底物吸附能力,而相应的选择性吸附能力则降低了[24]。
| 表 2 模板与单体比例对 2,4-D MIPs吸附量的影响Table 2 The influence of ratio of template and monomer on the adsorbing capacity of 2,4-D MIPs |
2.3.2 吸附时间对 2,4-D MIPs吸附量的影响
如图 3所示,随着吸附时间增加,2,4-D MIPs和 2,4-D NIPs对 2,4-D的吸附量逐渐增加,4 h后达到吸附平衡,这与传统的分子印迹方法相比吸附时间大大缩短[25]。这是由于采用SI-ATRP技术,分子印迹识别位点分布在 2,4-D MIPs表面,使结合位点较容易获得,结合动力学加快。在吸附初期,印迹聚合物薄层中有大量的印迹位点,使模板分子容易结合到印迹位点上。随着印迹位点被占用,吸附速率降低,吸附过程达到平衡。从图 3还可看出: 2,4-D MIPs 对 2,4-D的吸附量大于 2,4-D NIPs的,表明在 2,4-D MIPs中形成了有效识别 2,4-D的特异性结合位点,同时也说明 2,4-D MIPs作为固相萃取吸附剂潜力很大。
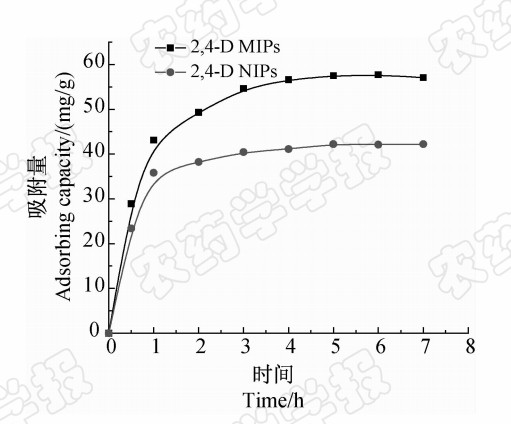 | 图 3 2,4-D MIPs和 2,4-D NIPs的吸附动力学曲线Fig. 3 Adsorption kinetics curve of 2,4-D MIPs and 2,4-D NIPs |
2.3.3 2,4-D浓度对 2,4-D MIPs吸附量的影响
采用静态吸附法测定了 2,4-D MIPs和 2,4-D NIPs对 2,4-D的吸附能力。由吸附等温线(图 4)可以看出:随着 2,4-D浓度的增加,2,4-D MIPs和 2,4-D NIPs 对 2,4-D的吸附能力均增强,但 2,4-D NIPs 的吸附能力相对较弱。这是因为 2,4-D NIPs 对 2,4-D的吸附主要是非特异性吸附,没有选择性和特异性,而 2,4-D MIPs中存在固定排列的功能基的空穴,其大小和固定排列的功能基与 2,4-D互补,这种空穴对 2,4-D分子具有“记忆”功能,因而选择性高,吸附能力强。 2,4-D MIPs和 2,4-D NIPs的吸附量的差值主要源于这种空穴的特异性吸附,这是印迹聚合物突出的结构特征[6],所以,与 2,4-D NIPs相比,2,4-D MIPs对模板分子的亲和能力较强,有更高的吸附量。
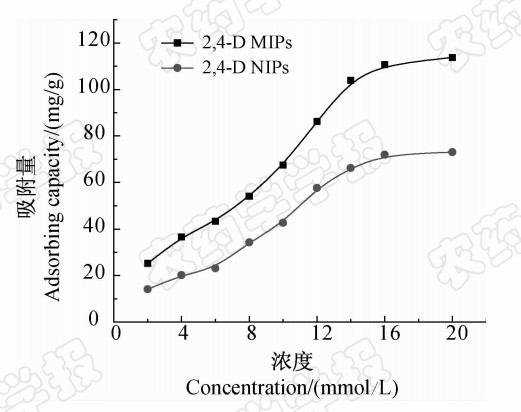 | 图 4 2,4-D MIPs和 2,4-D NIPs的吸附等温线Fig. 4 Binding isotherms of 2,4-D on 2,4-D MIPs and 2,4-D NIPs |
2.4 吸附性能的研究 2.4.1 Scatchard模型分析
以 Q/C\-e对Q作图得到 Scatchard图(见图 5)。由图 5可以看出:Q/C\-e对Q的线性关系由两条直线组成,这说明 2,4-D MIPs 对 2,4-D的吸附有两类不同的结合位点。其线性拟合方程分别为:y=-0.001 58x+0.121 5,回归系数R=0.974 9;y=-0.000 43x+0.061 88,回归系数R=0.998 9,计算得到两类结合位点最大表观吸附量分别为76.92和 142.91 mg/g,高于文献报道值115.93 μmol/g[25],离解常数Kd分别为632.91 和2 309.47 mg/L。
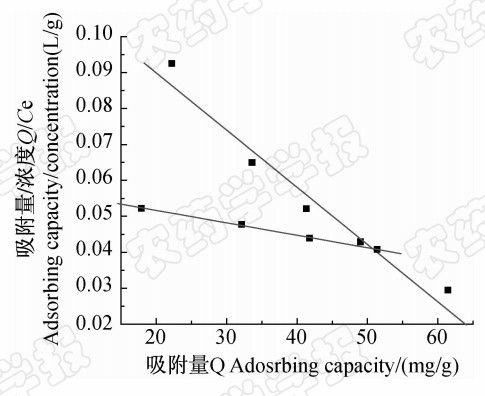 | 图 5 2,4-D MIPs的Scatchard曲线 Fig. 5 Scatchard’s plot for 2,4-D MIPs |
2.4.2 吸附选择性
分子印迹聚合物能够高选择性的识别复杂样品中的印迹分子,这为复杂基体的分离与富集提供了强有力的手段[26]。由图 6可以看出: 2,4-D MIPs对 2,4-D的吸附量是 2,4-DCP和 2,4-DCAD的2倍以上。与 2,4-DCP印迹聚合物和非印迹聚合物比,2,4-D MIPs对 2,4-D的选择性系数分别为2.84和1.23;与 2,4-DCAD相比,2,4-D MIPs对 2,4-D的选择性系数分别为3.75和1.64,相对选择性系数分别为和2.31和2.29。这说明本研究制备的印迹聚合物对 2,4-D具有良好的选择性吸附能力。
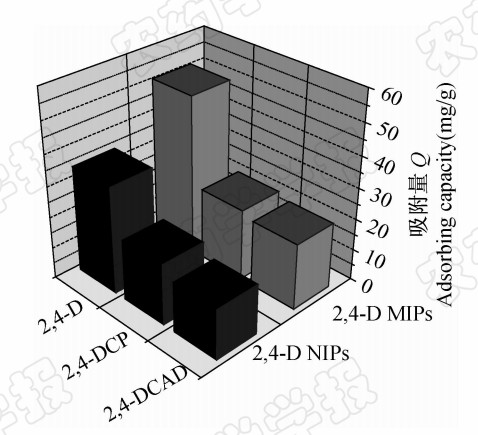 | 图 6 2,4-D MIPs和 2,4-D NIPs分别对于 2,4-D、2,4-DCP和 2,4-DCAD的选择性吸附Fig. 6 Selective bindings of 2,4-D MIPs and 2,4-D NIPs towards 2,4-D,2,4-DCP and 2,4-DCAD |
2.4.3 动态解吸附性能
图 7为 2,4-D MIPs的动态解吸曲线。实验表明,26个柱床体积内解吸率达到93.33%,28个柱床体积内解吸率达到 99.77%。表明该印迹聚合物具有良好的再生性能。
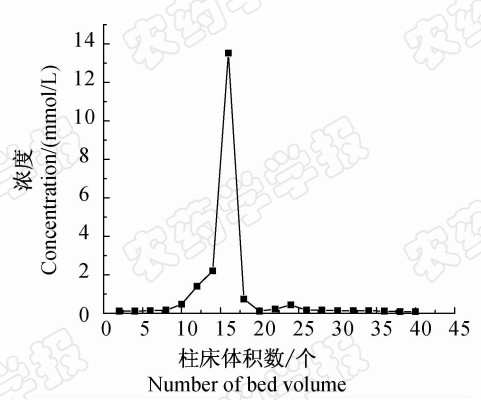 | 图 7 吸附在 2,4-D MIPs上 2,4-D的解吸曲线Fig. 7 Elution curve of 2,4-D on 2,4-D MIPs |
2.5 实际样品的测定
在豆芽 (空白)样品中添加一定量的 2,4-D,按样品处理方法,以 2,4-D MIPs为固相萃取小柱进行添加回收试验,每个水平重复3次。结果(表 3)表明,在0.04~0.25 mg/kg添加水平下,回收率为86%~104%,相对标准偏差(RSD)为1.9%~10%;以3倍信噪比(S/N)计算,方法的检出限为20 ng/g,低于文献报道值(105 ng/g)[27]。说明该 2,4-D MIPs-SPE 可用于豆芽中的痕量 2,4-D的富集和分离测定。该印迹聚合物重复使用10次以后其回收率仍在85%以上,表明该印迹聚合物比较稳定,有良好的再生性能。
| 表 3 豆芽中 2,4-D添加回收试验结果Table 3 Recovery of spiked 2,4-D in bean sample(n=3) |
图 8是添加0.04 mg/kg 2,4-D 的豆芽样品分别经过分子印迹固相萃取小柱(2,4-D MIPs-SPE)、非印迹固相萃取小柱(2,4-D NIPs-SPE)和商品化的C18固相萃取小柱处理的液相色谱图。可以看出:经过商品化的C18小柱处理后几乎检测不到 2,4-D 的色谱峰,而 2,4-D MIPs-SPE小柱因可以富集痕量的 2,4-D而被检出,说明该印迹固相萃取小柱对目标分子具有良好的富集效果。
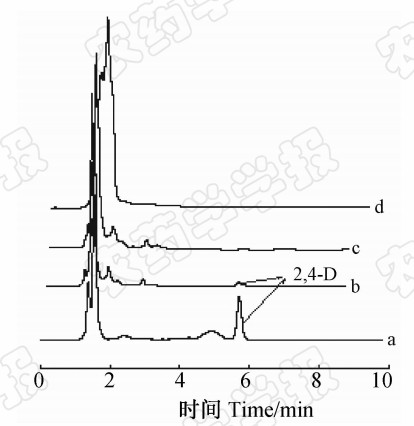 | 图 8 添加 2,4-D(0.04 mg/kg)的豆芽样品经不同固相萃取柱处理的色谱图Fig. 8 The chromatograms of bean sprout samples
with spiked 2,4-D (0.04 mg/kg)a: 2,4-D MIPs-SPE小柱;b: 2,4-D NIPs-SPE小柱;c:C18小柱;d: 空白样品 a: 2,4-D MIPs-SPE cartridge; b: 2,4-D NIPs-SPE cartridge; c: C18 cartridge; d: black sample |
3 结论
本研究采用表面引发原子转移自由基聚合(SI-ATRP)技术,首次以氯甲基化交联聚苯乙烯树脂作为载体和大分子引发剂,以 2,4-二氯苯氧乙酸(2,4-D)为模板分子,丙烯酰胺为单体,乙二醇二甲基丙烯酸酯为交联剂,制备了 2,4-二氯苯氧乙酸分子印迹聚合物(2,4-D MIPs),通过动态、静态实验以及对底物选择性考察,表明该印迹聚合物对 2,4-D 具有特异性好、结合速度快等吸附特点。将该印迹聚合物制成固相萃取小柱 2,4-D MIPs-SPE,对豆芽样品中痕量 2,4-D进行富集分离测定,其回收率在86%~104%之间,将其重复使用10次以后,其回收率仍在85%以上,表明该印迹聚合物具有稳定性好、成本低和重现性好等优点,作为固相萃取吸附功能材料具有较强的优势。
| [1] | 夏慧,陆自强,杨益众.高效液相色谱法测定豆芽中 2,4-二氯苯氧乙酸残留[J].扬州大学学报, 2011, 32(4):86-89. XIA Hui, LU Ziqiang, YANG Yizhong. Determination of 2,4-dichlorophenoxyacetic acid residues in bean sprout samples by high performance liquid chromatography [J]. J Yangzhou Univ, 2011, 32(4): 86-89. (in Chinese) |
| [2] | 段留生,潘瑞炽.植物生长调节剂在经济作物上的应用[M].北京:化学工业出版社,2002:13-19. DUAN Liusheng, PAN Ruizhi. Application of Plant Regulator in the Economic Crops [M]. Beijing: Chemical Industry Press, 2002: 13-19. (in Chinese) |
| [3] | SALMAN J M, HAMEED B H. Adsorption of 2,4-dichlorophenoxyacetic acid and carbofuran pesticides onto granular activated carbon [J]. Desalination, 2010, 256: 129-135. |
| [4] | DENG S B, MA R, YU Q, et al. Enhanced removal of pentachlorophenol and 2,4-D from aqueous solution by an aminated biosorbent [J]. Hazard Mater J, 2009, 165: 408-414. |
| [5] | MOMCIlLOVIC M Z, RANDELOVIC M S, ZARUBICA A R, et al. SBA-15 Templated mesoporous carbons for 2,4-dichlorophenoxyacetic acid removal [J]. Chem Eng J, 2013, 220: 276-283. |
| [6] | 康敬万,刘小育,王志华,等. 2,4-二氯苯氧乙酸分子印迹聚合物的制备及识别特性[J]. 西北师范大学学报: 自然科学版, 2006, 42(3): 59-61. KANG Jingwan, LIU Xiaoyu, WANG Zhihua, et al. Study on preparation and characterizat ion of 2,4-D molecularly imprinted polymer [J]. Northwest Normal J Univ: Nat Sci, 2006, 42(3): 59-61. (in Chinese) |
| [7] | 李金昶, 王璐, 韩明友, 等.固相萃取富集高效液相色谱法测定苯氧乙酸和 2,4-二氯苯氧乙酸[J]. 分析化学, 2011, 29 (5): 580-582. LI Jinchang, WANG Lu, HAN Mingyou, et al. Determination of phenoxyacetic acid and 2,4-dichlorophenoxyacetic acid using solid-phase extraction and high performance liquid chromatography [J]. Chin Anal J Chem, 2011, 29 (5): 580-582. (in Chinese) |
| [8] | 闫宏远,杨更亮.分子印迹固相萃取技术在动物源食品中药物残留检测中的应用进展[J].色谱, 2011, 29(7): 572-579. YAN Hongyuan, YANG Gengliang. Application of molecularly imprinted solid-phase extraction on drug residues in animal source foods [J]. Chin J Chromatogr, 2011, 29(7): 572-579. (in Chinese) |
| [9] | 黄怡,张青杰,刘 敏,等.分子印迹固相萃取-高效液相色谱法测定饲料中莱克多巴胺[J].色谱, 2012, 30(1): 56-61. HUANG Yi, ZHANG Qingjie, LIU Min, et al. Molecularly-imprinted solid phase extraction coupled with higher performance liquid chromatography for the determination of ractopamine in feed samples [J]. Chin J Chromatogr, 2012, 30(1): 56-61. (in Chinese) |
| [10] | SHEN X T, ZHU L H, LIU G X, et al. Enhanced photocatalytic degradation and selective removal of nitrophenols by using surface molecular imprinted titania [J]. Environ Sci Technol, 2008, 42(5): 1687-1692. |
| [11] | PATTEN T E, MATYJASZEWSKISHI K. Atom transfer radical polymerization and the synthesis of polymeric materials [J]. Advanced Materials, 1998, 10 (12): 901-915. |
| [12] | TURNE N W, JEANS C W, BRAIN K R, et al. From 3D to 2D: A review of the molecular imprinting of proteins [J]. Biotechnol Prog, 2006, 22 (6):1474-1489. |
| [13] | 尹晓斐,汤水粉,刘玮,等.表面分子印迹技术研究进展[J]. 福州大学学报:自然科学版, 2011, 39 (5):1-10. YIN Xiaofei, TANG Shuifen, LIU Wei, et al. Recent advances in research of surface molecular imprinting technique [J].J Fuzhou Univ: Nat Sci Ed, 2011, 39(5): 1-10. (in Chinese) |
| [14] | 张卫英,李晓,朱兰兰,等. 表面分子印迹材料制备研究进展[J].现代化工, 2005, 25 (12): 20-23. ZHANG Weiying, LI Xiao, ZHU Lanlan, et al. Advances in preparation of surface molecularly imprinted materials [J]. Modern Chem Ind, 2005, 25 (12): 20-23. (in Chinese) |
| [15] | CHANG L M, WU S, CHEN S N, et al. Preparation of graphene oxide-molecularly imprinted polymer composites via atom transfer radical polymerization [J]. J Mat Sci, 2010, 46(7): 2024-2029. |
| [16] | WEI X L LI X, HUSSON S M. Surface molecular imprinting by atom transfer radical polymerization [J]. Biomacro-molecules, 2005, 6(2): 1113-1121. |
| [17] | WANG H J, ZHOU W H, YIN X F, et al. Template synthesized molecular imprinted polymer nanotube membranes for chemical separation [J]. J Am Chem Soc, 2006, 128(50): 15954-15955. |
| [18] | 董佳斌,吴建波,杨 静,等.高容量亚胺基二乙酸型螯合树脂的制备及吸附性能[J].高等学校化学学报, 2013, 34(3): 714-719. DONG Jiabin, WU Jianbo, YANG Jing, et al. Preparation of high-capacity IDA chelating resin and its adsorption properties [J]. Chem J Chinese Univ, 2013, 34(3): 714-719.(in Chinese) |
| [19] | MIZUTANI A, NAGASE K, KIKUCHI A, et al. Thermo-responsive polymer brush-grafted porous polystyrene beads for all-aqueous chromatography [J]. Chromatogr A, 2010, 1217(4): 522-529. |
| [20] | BYUN H S, YANG D S, CHO S H. Synthesis and characterization of high selective molecularly imprinted polymers for bisphenol A and 2,4-dichlorophenoxyacetic acid by using supercritical uid technology [J]. Polymer, 2013, 54: 589-595. |
| [21] | 牛庆媛,高保娇,刘苏宇,等.新型表面分子印迹法制备苦参碱印迹材料及其分子识别特性[J].化学学报, 2010, 24(68): 2600-2608. NIU Qingyuan, GAO Baojiao, LIU Suyu, et al. Preparation of matrine-imprinted material using novel surface-molecular imprinting method and its molecule recognition character [J]. Chin J Chem, 2010, 24(68): 2600-2608.(in Chinese) |
| [22] | HIRATSUKA Y, FUNAYA N, MATSUNAGA H, et al. Preparation of magnetic molecularly imprinted polymers for bisphenol A and its analogues and their application to the assay of bisphenol A in river water [J]. J Pharmaceut Biomed, 2013, 75: 180-185. |
| [23] | ZHANG H, SONG T, ZONG F, et al. Synthesis and characterization of molecularly imprinted polymers for phenoxyacetic acids [J]. Int J Mol Sci, 2008, 9(1): 98-106. |
| [24] | 银珍红,陈小明. 2,4-二氯苯氧乙酸分子印迹整体柱的制备、表征及色谱性能研究[J].分析测试学报, 2009, 28(8): 949-953. YIN Zhenhong, CHEN Xiaoming. Synthesis and characterization of 2,4-dichlorophenoxyacetic acid molecularly imprinted monolithic column and its chromatographic property [J]. J Instrum Anal, 2009, 28(8): 949-953. (in Chinese) |
| [25] | 顾旭东,蒋培华.除草剂 2,4-二氯苯氧乙酸分子印迹聚合物微球的合成及性能研究[J]. 浙江农业学报, 2011, 23(3): 559-563. GU Xudong, JIANG Peihua. Synthesis and property of molecular imprinted polymeric microspheres of 2,4-dichlorophe-noxyacetic acid [J]. Acta Agriculturae Zhejiangensis, 2011, 23(3): 559-563. (in Chinese) |
| [26] | LI X X, PAN J M, DAI J D, et al. Surface molecular imprinting onto magnetic yeast composites via atom transfer radical polymerization for selective recognition of cefalexina [J]. Chem Eng J, 2012, 198/199: 503-511. |
| [27] | 陆益民,易国斌,陈创彬,等. 西瓜中4种植物生长调节剂残留的分析方法研究[J].分析测试学报, 2011, 30(2): 186-189. LU Yimin, YI Guobin, CHEN Chuangbin, et al. Study on method of determination of four plant growth regulator residues in water melons [J]. J Instrum Anal, 2011, 30(2): 186-189. (in Chinese) |
 2014, Vol.16
2014, Vol.16 


