2. 浙江省桐乡市凤鸣街道农业经济服务中心, 浙江 嘉兴 314505
2. The Agricultural Economy Service Center of Fengming Street, Jiaxing 314505, Zhejiang Province, China
杭白菊Chrysanthemum morifolium 是我国传统的栽培药用植物,其胎菊具有多种药用价值[1,2,3]。毒死蜱(chlorpyrifos)是一种高效、广谱的有机磷杀虫剂,是防治杭白菊蚜虫及一些鳞翅目幼虫的常用农药之一。其通过抑制并“老化”神经病靶酯酶,造成害虫迟发性神经病和免疫功能缺陷[4,5],还可引发新生儿缺陷和癌症[6,7],因此毒死蜱在农业生产中的使用备受关注。国内已有关于毒死蜱在大棚西芹、白菜、苹果、梨等蔬菜和水果中残留消解的研究报道[8,9,10,11],但尚未见有关其在杭白菊及其生长环境中残留消解的报道。本研究通过田间试验和室内色谱仪器分析相结合,研究了毒死蜱在杭白菊胎菊及土壤中的残留及消解动态规律,以及胎菊加工过程对其残留量的影响,同时探讨了干胎菊中毒死蜱在不同温度下的消解动态,以期为杭白菊质量管理和毒死蜱的安全使用提供理论依据。
杭白菊Chrysanthemum morifolium 是我国传统的栽培药用植物,其胎菊具有多种药用价值[1,2,3]。毒死蜱(chlorpyrifos)是一种高效、广谱的有机磷杀虫剂,是防治杭白菊蚜虫及一些鳞翅目幼虫的常用农药之一。其通过抑制并“老化”神经病靶酯酶,造成害虫迟发性神经病和免疫功能缺陷[4,5],还可引发新生儿缺陷和癌症[6,7],因此毒死蜱在农业生产中的使用备受关注。国内已有关于毒死蜱在大棚西芹、白菜、苹果、梨等蔬菜和水果中残留消解的研究报道[8,9,10,11],但尚未见有关其在杭白菊及其生长环境中残留消解的报道。本研究通过田间试验和室内色谱仪器分析相结合,研究了毒死蜱在杭白菊胎菊及土壤中的残留及消解动态规律,以及胎菊加工过程对其残留量的影响,同时探讨了干胎菊中毒死蜱在不同温度下的消解动态,以期为杭白菊质量管理和毒死蜱的安全使用提供理论依据。 1 材料与方法 1.1 供试材料 1.1.1 杭白菊和土壤
供试杭白菊品种为大洋菊,取自浙江省嘉兴市凤鸣街道杭白菊种植基地。土壤类型为轻壤土,有机质含量为1.09%。 1.1.2 药剂及主要仪器
99.0%毒死蜱(chlorpyrifos)标准品,购于德国Dr. Ehrenstorfer 公司;48%毒死蜱乳油,购于江苏佳辉化工有限公司。正己烷为色谱纯,其余试剂均为分析纯;丙酮、二氯甲烷、乙酸乙酯经全玻璃蒸馏装置重蒸;无水硫酸钠、活性炭,杭州高晶化工有限公司;助滤剂Celite 545(硅藻土载体),国药集团化学试剂有限公司;弗罗里硅土(粒径150~250 μm)经600 ℃灼烧4 h后于干燥器中贮存,用前再于130℃烘2 h,并用超纯水脱活。
GC9790气相色谱仪(配FPD检测器,GC-FPD)。 1.2 试验方法 1.2.1 田间试验设计
试验于2011和2012年的9—10月在浙江省桐乡市凤鸣街道杭白菊种植基地进行。按照《农药残留试验准则》[12]要求,采用随机区组设计,分别设推荐高剂量(有效成分0.48 kg/hm2)和1.5倍推荐高剂量(有效成分0.72 kg/hm2),分2次施药,第1次于杭白菊蚜虫危害初期(距采收前45 d)施药,第2次于杭白菊现蕾期(距采收前30 d)施药;分别于末次施药后2 h及1、3、7、14、21、30 d采集样品。每小区面积约 20 m2,小区间设保护行,同时设不施药空白对照区。所有处理和对照均3次重复。
胎菊采样时小区边行和每行距离两端0.5 m内不采样,部分加工成干胎菊,其余随机取样2 kg,混匀,备用。土壤随机取5~10个点,用土钻采集0~10 cm的土壤1~2 kg,去杂质、过830 μm筛、混匀后采用四分法留样500 g。土壤、鲜胎菊及干胎菊均于-20 ℃保存,备用。 1.2.2 加工过程对胎菊中毒死蜱残留量的影响
干胎菊加工过程参照文献[13]方法进行。分别取施药后2 h及1、3、7、14、21、30 d的鲜胎菊各10.0 g,经高压蒸汽杀青后置于50~60 ℃烘房中烘6~8 h,置于通风房中晾干。分别考察鲜胎菊以及杀青、烘干和晾干后样品中毒死蜱残留量的变化情况。重复 3次,结果取平均值。 1.2.3 不同温度对干胎菊中毒死蜱消解的影响
将毒死蜱残留量较高的同批次鲜胎菊按1.2.2节的方法制成干胎菊,分别置于10、20和30 ℃的恒温培养箱中(避光),于2 h及1、3、7、14、21、30、45、60、90 d 时分别取出部分样品,检测毒死蜱含量。 1.3 分析方法 1.3.1 样品前处理
1.3.1.1 土壤
准确称取20.0 g土壤样品于250 mL样品瓶中,加入50 mL丙酮和5 g助滤剂,超声提取30 min;抽滤,用30 mL丙酮洗涤残渣,合并滤液,于60 ℃下旋蒸浓缩至5 mL;将浓缩液转移至加有50 mL质量分数为10%氯化钠溶液的250 mL分液漏斗中,依次用40、30和30 mL二氯甲烷萃取;取下层有机相经无水硫酸钠脱水,减压浓缩、氮气吹干后用正己烷定容至2 mL,待测。同时测定各批次土壤样品含水量,用于校正干土中的残留量。 1.3.1.2 干、鲜胎菊
提取:准确称取10 g胎菊样品于250 mL样品瓶中,加入50 mL丙酮,于5 000 r/min下匀浆1 min,超声提取30 min;抽滤,用30 mL丙酮洗涤残渣,合并滤液,于60 ℃下旋蒸浓缩至约5 mL;将滤液转移至加有50 mL质量分数为10%氯化钠溶液的250 mL分液漏斗中,依次用40、30和30 mL二氯甲烷萃取;取下层有机相经无水硫酸钠脱水,减压浓缩至5 mL,待净化。
净化:玻璃柱长25 cm,内径2 cm,由下至上依次填装2 cm无水硫酸钠、11 g弗罗里硅土-活性炭[m(弗罗里硅土)∶m(活性炭)=7∶4]和2 cm无水硫酸钠;用30 mL乙酸乙酯预淋洗,弃去淋洗液;加入待净化样品,用100 mL乙酸乙酯洗脱;收集洗脱液,减压浓缩至近干,氮气吹干,用正己烷定容至2 mL,待测。 1.3.2 色谱条件
DB-1301色谱柱(30 m×0.32 mm,0.25 μm,安捷伦公司);进样口温度230 ℃;检测器温度250 ℃;不分流进样,进样量1 μL;气体流速:高纯氮气(纯度99.999 9%)90 mL/min,尾吹35 mL/min,氢气10 mL/min,空气100 mL/min。升温程序:初始温度110 ℃保持0 min;以20 ℃/min升到210 ℃,保持5 min;以20 ℃/min升到250 ℃,保持5 min。在此条件下,毒死蜱的保留时间为10.5 min。 1.3.3 标准曲线的绘制
准确称取毒死蜱标准品0.1 g(精确到0.000 1 g),用正己烷配制成1 000 mg/L的标准储备液,再逐级稀释为10、5、1、0.1、0.05和0.005 mg/L的系列标准工作溶液,由低浓度至高浓度依次检测,每个浓度重复6次。以毒死蜱质量浓度为横坐标(x),峰面积为纵坐标(y)绘制标准曲线。 1.3.4 添加回收试验
选取空白土壤、鲜胎菊和干胎菊样品,分别进行毒死蜱的添加回收率试验。土壤中的添加水平分别为0.5、0.005和 0.001 mg/kg,胎菊中的添加水平为0.5、0.05和0.005 mg/kg。分别按1.3.1和1.3.2节的方法进行样品前处理和仪器分析,测定毒死蜱的添加回收率和相对标准偏差(RSD)。每个添加水平重复 6次。 2 结果与分析 2.1 方法的灵敏度、准确度和精密度
结果表明:在0.005~10 mg/L范围内,毒死蜱峰面积与质量浓度间呈良好的线性关系,回归方程y=423 719x+12 212,决定系数(R2)为0.999 6。
在0.001~0.5 mg/kg添加水平下,毒死蜱在土壤中的平均回收率为93%~96%,RSD为2.0%~4.9%;在0.005~0.5 mg/kg添加水平下,毒死蜱在鲜胎菊中的平均回收率为85%~92%,RSD为4.1%~9.1%,在干胎菊中的平均回收率为88%~93%,RSD为3.7%~9.4%;分别以3倍和10倍信噪比(S/N)确定得毒死蜱的最小检出量(LOD)为0.001 ng,在鲜/干胎菊中的最低检测浓度(LOQ)为0.005 mg/kg,在土壤中的LOQ为0.001 mg/kg。 2.2 毒死蜱在胎菊和土壤中的消解动态分析 2.2.1 毒死蜱在胎菊中的消解动态
结果(图 1)显示:施药随时间延长,毒死蜱在鲜胎菊中的残留量逐渐减少,符合一级反应动力学方程ct=c0e-kt。半衰期分别为4.21 d(0.48 kg/hm2,2011年)、2.94 d(0.72 kg/hm2,2011年),4.22 d(0.48 kg/hm2,2012年)和3.43 d(0.72 kg/hm2,2012年),且不同年份间差异不显著(P<0.05)。2011和2012年2年试验结果的共同特点是:在30 d时胎菊中毒死蜱均消解了98%以上;同一年份高低2种剂量毒死蜱处理间差异不显著(P<0.05)。蔡恩兴等[14]的研究也表明,在不同施药次数和剂量以及不同年份同一季节中,毒死蜱在菜用大豆上的残留消解速率基本一致。
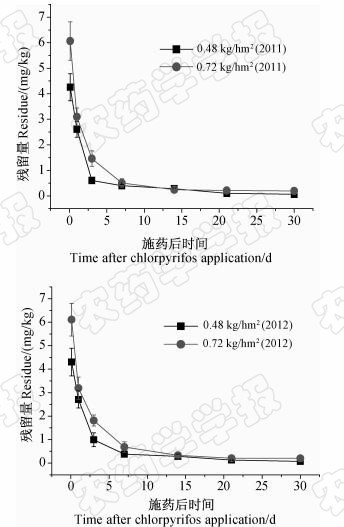 | 图 1 毒死蜱在胎菊中的消解动态曲线Fig. 1 Decline dynamics curves of chlorpyrifos in chrysanthemum bud |
结果(图 2)表明:毒死蜱在杭白菊土壤中的消解动态也符合一级动力学方程。其半衰期分别为9.24 d(0.48 kg/hm2,2011年)、10.25 d(0.72 kg/hm2,2011年)、9.32 d(0.48 kg/hm2,2012年)和10.82 d(0.72 kg/hm2,2012年),且不同年份间差异不显著(P<0.05)。黄素芳等[15]和毛应明等[16]关于毒死蜱在蕹菜、小麦及土壤中的残留消解动态研究表明,毒死蜱在土壤中的半衰期均长于在作物中的;本研究结果也表明,毒死蜱在杭白菊土壤中的消解比在杭白菊中的缓慢。程燕[17]报道,毒死蜱在土壤中的半衰期一般为60~120 d, 但在潮湿的土壤中,毒死蜱的有效半衰期为45~163 h;由于毒死蜱的高吸附系数使其易被土壤颗粒吸附,而其在土壤中的消解半衰期同土壤对其的吸附作用密切相关,所以毒死蜱在不同条件土壤中的半衰期相差较大。李界秋等[18]研究表明,毒死蜱在壤土、沙土和黏土中的消解半衰期分别为23.9、12.6 和9.8 d。吴祥为等[19]和田芹等[20]研究表明,在一定范围内,温度越高、pH值越高,越有利于毒死蜱的降解,高能量、短波长的紫外光也有利于其降解。
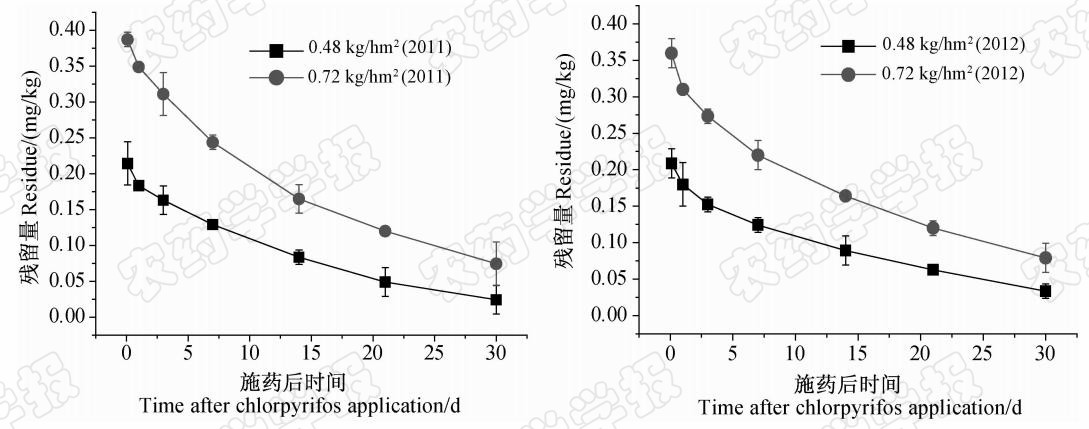 | 图 2 毒死蜱在杭白菊土壤中的消解动态曲线Fig. 2 Decline dynamics curves of chlorpyrifos in soil |
结果(表 1,图 3)表明:不同温度下毒死蜱在室内干胎菊中的残留消解符合一级动力学方程,半衰期分别为27.39 d(10 ℃)、19.74 d(20 ℃)和12.64 d(30 ℃),即温度越高,胎菊中的毒死蜱消解越快。与鲜胎菊相比,干胎菊中毒死蜱消解缓慢,半衰期较长。这可能是因为鲜胎菊中的水分高达80%以上,而干胎菊中的水分则低于13%,微生物可利用的水分较少,从而限制了微生物对毒死蜱的降解。
| 表 1 不同温度下干胎菊中毒死蜱的消解动力学方程及其相关参数 Table 1 Dissipation kinetic and correlation parameters of chlorpyrifos in dry chrysanthemum bud at different temperature |
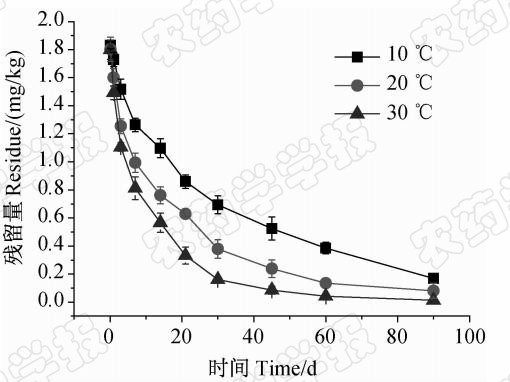 | 图 3 不同温度下毒死蜱在干胎菊中的消解动态曲线Fig. 3 Decline dynamics curve of chlorpyrifos in dry chrysanthemum bud at different temperature |
将鲜胎菊加工为干胎菊后,浓缩量约为 5.25倍,理论上,胎菊中毒死蜱的浓度也应相应提高5.25倍,但本研究结果(表 2)表明:加工后干胎菊中毒死蜱的浓度仅约为对应鲜胎菊的2.15~4.31倍,明显低于5.25倍,这表明加工过程导致了毒死蜱残留量的减少。表 3结果也表明,3道加工工序均造成了胎菊中毒死蜱残留量的减少。
| 表 2 毒死蜱在胎菊中的残留量(±SE, n=3) Table 2 Chlorpyrifos residue in chrysanthemum bud |
| 表 3 加工过程对胎菊中毒死蜱残留量的影响(±SE, n=3) Table 3 Impact of process on chlorpyrifos residue |
2011—2012两年的田间消解试验结果表明:毒死蜱在杭白菊土壤中的半衰期为9.24~10.82 d,在鲜胎菊中的半衰期为2.94~4.22 d;加工过程可使毒死蜱残留量减少,由操作和机械带来的误差使其减少量差异较大。使用48%毒死蜱乳油在田间以有效成分0.48和0.72 kg/hm2的剂量喷施2次,距第2次施药后21 d时,毒死蜱在干胎菊中残留量分别为0.58和0.89 mg/kg,均低于我国制定的毒死蜱在茶叶中的MRL值(1 mg/kg)。表明每年若以有效成分0.48和0.72 kg/hm2的剂量喷施2次,安全间隔期定为21 d就可确保毒死蜱在商品杭白菊胎菊中的残留量不超过1 mg/kg。
在室内条件下,毒死蜱在干胎菊中的消解半衰期在12 d以上,且其消解速率与温度成正相关。
| [1] | SASSI A B, HARZALLAH-SKHIRI F, BOURGOUGNON N, et al. Antimicrobial activities of four tunisian chrysanthemum species[J]. Indian J Med Res, 2008, 127(2): 183-192. |
| [2] | HU Changqi, CHEN Ke, SHI Qian, et al. Anti-AIDS agents,10.Acacetin-7-O-β -D-galactopyranoside, an anti-HIV principle from Chrysanthemum morifolium and a structure-activity correlation with some related flavonoids[J]. J Nat Prod, 1994, 57(1): 42-51. |
| [3] | WANG Huikang, XIA Yi, YANG Zhenyu, et al. Recent advances in the discovery and development of flavonoids and their analogues as antitumor and anti-HIV agents[J]. Adv Exp Med Biol, 1998, 439: 191-225. |
| [4] | JACK D T, GUNNAR H, ALAN B. Immunological abnormalities in human chronically exposed to chlorpyrifos[J]. Arch Environ Health, 2002, 57(3): 181-187. |
| [5] | GALLOWAY T, HANDY R. Immunotoxicity of organo-phosphorous pesticides[J]. Ecotoxicology, 2003, 12(1/4): 345-363. |
| [6] | SHERMAN J D. Chlorpyrifos (Dursban)-Associated birth defects: Report of four cases[J]. Arch Environ Health, 1996, 51(1): 5-8. |
| [7] | WON J L, AARON B, JANE A H, et al. Cancer incidence among pesticide applicators exposed to chlorpyrifos in the agricultural health study[J]. J Natl Cancer Inst, 2004, 96(23): 1781-1789. |
| [8] | 周世萍, 段昌群, 余泽芬, 等. 毒死蜱在大棚西芹中的残留降解动态[J]. 中国蔬菜, 2007(7): 23-25. ZHOU Shiping, DUAN Changqun, YU Zefen, et al. Residual dynamics of chlorpyrifos in celery under greenhouse conditions[J]. China Veget, 2007(7): 23-25.(in Chinese) |
| [9] | 赵学平,袁玉伟,胡秀卿,等. 茚虫威和毒死蜱在小白菜中的残留及其膳食暴露评估[J].浙江农业学报,2010, 22(6): 784-789. ZHAO Xueping, YUAN Yuwei, HU Xiuqing, et al. Residues and its dietary exposure estimation of indoxacarb and chlorpyrifos in pakchoi cabbage[J]. J Zhejiang Agric Sci, 2010, 22(6): 784-789. (in Chinese) |
| [10] | 梁俊,赵政阳,李海飞,等. 苹果中毒死蜱残留降解动态研究[J]. 农业环境科学学报,2008, 27(6): 2461-2466. LIANG Jun, ZHAO Zhengyang, LI Haifei, et al. Residual degradation behaviors of chlorpyrifos in apple[J]. J Agro-environ Sci, 2008, 27(6): 2461-2466. (in Chinese) |
| [11] | 赵丽娟,张洪,秦曙,等. 毒死蜱在梨和土壤中的残留研究[J]. 农药科学与管理,2010,31(2): 42-46. ZHAO Lijuan, ZHANG Hong, QIN Shu, et al. Study on the chlorpyrifos residues in pear and soil[J]. Pestic Sci Admin, 2010, 31(2): 42-46. (in Chinese) |
| [12] | NY/T 788—2004, 农药残留试验准则[S]. 北京:中国农业出版社,2004. NY/T 788—2004, Guide-lines for pesticide residue testing[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [13] | 赵静,崔旭,吴加伦,等. 多菌灵在杭白菊及其土壤中的残留消解动态[J]. 农药学学报,2013, 15(4): 457-463. ZHAO Jing, CUI Xu, WU Jialun, et al. Residue and decline dynamics of carbendazim in chrysanthemum flower and soil[J]. Chin J Pestic Sci, 2013, 15(4): 457-463. (in Chinese) |
| [14] | 蔡恩兴,郭建辉,陈丽萍,等. 毒死蜱在菜用大豆上残留动态及安全使用技术[J]. 大豆科学, 2008, 27(5): 823-827. CAI Enxing, GUO Jianhui, CHEN Liping, et al. Dynamics of chlorpyrifos residue in vegetable soybean and techniques for its safe use[J]. Soybean Sci, 2008, 27(5): 823-827. (in Chinese) |
| [15] | 黄素芳,朱育菁,林抗美,等. 毒死蜱在蕹菜及土壤中的残留和消解动态研究[J]. 农业环境科学学报,2006, 25(增刊): 269-271. HUANG Sufang, ZHU Yujing, LIN Kangmei, et al. Study on the residue of chlorpyrifos in Ipomoea aquatica forsk and the soil[J]. J Agro-environ Sci, 2006, 25(S1): 269-271. (in Chinese) |
| [16] | 毛应明,王学松,沈伟健,等. 毒死蜱在小麦植株及土壤环境中的残留特性[J]. 环境科学研究,2007, 20(5): 105-109. MAO Yingming, WANG Xuesong, SHEN Weijian, et al. The residual property of chlorpyrifos in wheat seedling and soil[J]. Res Environ Sci, 2007, 20(5): 105-109. (in Chinese) |
| [17] | 程燕. 毒死蜱的环境行为研究进展[J]. 安徽农学通报,2008, 14(8): 75-76. CHENG Yan. The progress of chlorpyrifos environmental behavior study[J]. Anhui Agric Sci Bull, 2008, 14(8): 75-76. (in Chinese) |
| [18] | 李界秋,黎晓峰,沈方科,等. 毒死蜱在环境中的降解研究[J]. 安徽农业科学,2007, 35(11): 3334-3336. LI Jieqiu, LI Xiaofeng, SHEN Fangke, et al. Study on chlorpyrifos degradation in environment[J]. Anhui Agric Sci, 2007, 35(11): 3334-3336. (in Chinese) |
| [19] | 吴祥为,花日茂,锋汤,等. 毒死蜱在水溶液中的光化学降解[J]. 应用生态学报,2006,17(7): 1301-1304. WU Xiangwei, HUA Rimao, FENG Tang, et al. Photochemical degradation of chlorpyrifosin water[J]. Appl Ecol Sci, 2006, 17(7): 1301-1304. (in Chinese) |
| [20] | 田芹,周志强,江树人,等. 毒死蜱在环境水体中降解的研究[J]. 农业环境科学学报,2005, 24(2): 289-293. TIAN Qin, ZHOU Zhiqiang, JIANG Shuren, et al. Degradation of chlorpyrifos in environmental water[J]. J Agro-environ Sci, 2005, 24(2): 289-293. (in Chinese) |
 2014, Vol. 16
2014, Vol. 16


