乙基多杀菌素(spinetoram)是由美国陶氏益农公司研发的一种新型多杀菌素[1],原药的有效成分为乙基多杀菌素-J(XDE-175-J)和乙基多杀菌素-L(XDE-175-L)的混合物(质量比约为3∶1),其主要作用于昆虫神经中烟碱型乙酰胆碱受体和γ-氨基丁酸受体,致使虫体对兴奋性或抑制性的信号传递反应不敏感,影响其正常的神经活动,直至死亡[2]。乙基多杀菌素具有胃毒和触杀作用,主要用于防治鳞翅目害虫(小菜蛾、甜菜夜蛾)及缨翅目害虫(蓟马)等,该药目前在我国已在甘蓝、茄子和水稻上获准登记使用,主要用于防治小菜蛾、蓟马和稻纵卷叶螟,其对稻纵卷叶螟具有杀虫速度快和持效期长的特点[3],推荐施药剂量(有效成分)为18~27 g/hm2。
目前关于乙基多杀菌素在环境中残留分析方法及消解动态的研究报道均较少[4,5,6,7]。已报道的残留分析方法主要有液相色谱 (LC)法及液相色谱-串联质谱(LC-MS/MS)法,检测限(LOD)均为0.01 mg/kg[4,5,6,7]。所涉及的样品净化方法主要有液-液萃取[4,6]、固相萃取[4]和分散固相萃取[5, 7]等。其中液-液萃取法所需溶剂量较大,如赵瑶瑶等[6]建立的甘蓝样品净化方法中单个样品即需要100 mL石油醚进行净化,而固相萃取法耗费时间较长,分散固相萃取法则相对比较简便。此外,已报道的这些残留分析方法所涉及的基质主要是蔬菜和水果,关于水稻植株中乙基多杀菌素残留分析方法的研究目前尚未见报道。赵瑶瑶等[6]研究了乙基多杀菌素在甘蓝和土壤中的消解动态,发现其 在甘蓝和土壤中的平均半衰期分别为3.11和2.39 d。Malhat等[7]采用高效液相色谱(HPLC)法研究了乙基多杀菌素在番茄中的消解动态,发现其在番茄中的消解半衰期为2.60 d。目前尚未见有关乙基多杀菌素在水稻及稻田生态系统中消解动态的研究报道。
笔者研究建立了采用吸附剂乙二胺-N-丙基硅烷(PSA)净化,超高效液相色谱-串联质谱(UPLC-MS/MS)测定田水、土壤及水稻植株样品中乙基多杀菌素残留量的方法,并采用该方法研究了6%乙基多杀菌素悬浮剂(SC)以1.5倍推荐高剂量(有效成分40.5 g/hm2)使用后在稻田水、土壤和水稻植株中的消解动态,以期为乙基多杀菌素在稻田环境样品和水稻植株中的残留检测研究及其在水稻上的安全合理使用提供参考。
1 材料与方法 1.1 药剂及试剂
XDE-175-J和XDE-175-L标准品(纯度≥96.0%),6%乙基多杀菌素悬浮剂(SC),均购自陶氏益农公司。乙腈为色谱纯及分析纯,甲酸为色谱纯,其余乙二胺-N-丙基硅烷(PSA)、硫酸镁和氯化钠等试剂均为市售分析纯。
1.2 主要仪器设备
Waters UPLC-Xevo TQ MS 超高效液相色谱-串联质谱仪(UPLC-MS/MS)及Waters ACQUITY UPLC BEH C18 色谱柱(2.1 mm×100 mm,1.7 μm),美国Waters公司;N-EVAP 24位氮吹仪,美国Organomation公司;BSA124S-CW分析天平(精度0.1 mg)及BSA2202S电子天平(精度 0.01 g),德国Sartorius公司;GF-04-01型背负式手动喷雾器,台州广丰塑业有限公司。
1.3 田间试验方法
参照《农药登记残留试验准则》[8],采用1次施药多次采样的方法。在供试水稻田内设置3个面积分别为30 m2的消解动态试验小区,小区之间设保护带。于水稻苗期手动喷施1.5倍推荐高剂量 (有效成分40.5 g/hm2) 的6%乙基多杀菌素SC,于施药后2 h 及1、3、5、7、10、14、21 d,分别随机采集水稻植株和稻田表层土壤(0~10 cm)样品,于2、8 h 及1、3、5、7、10、14 d分别采集田水样品。水稻植株去除残叶后剪碎,土壤除去碎石、杂草和植物根茎等杂物,风干后过40目(孔径 0.63 mm)筛。水稻植株留样不少于1 000 g,土壤样品不少于2 000 g,田水样品不少于500 mL,于-20 ℃下冷冻保存,待测。同时在距离试验区30 m 以外选取相同条件地块作为空白对照试验小区,取田水、土壤和水稻植株空白样品,样品处理及保存方法同施药处理。
1.4 分析方法 1.4.1 样品提取及净化
1.4.1.1 土壤样品
称取5 g预处理好的土样于50 mL聚四氟乙烯离心管中,加入20 mL乙腈,用力振摇1 min后超声提取30 min,5 000 r/min下离心3 min,取上清液;上清液中加入5mL去离子水、1.5 g 氯化钠和4.0 g 硫酸镁,涡旋2 min,于5 000 r/min 离心2 min;取2 mL上清液于5 mL离心管中,加入50 mg PSA和150 mg硫酸镁,涡旋30 s,于10 000 r/min离心2 min;取0.4 mL上清液,加入0.6 mL 0.1%甲酸溶液,混合均匀,过0.22 μm 滤膜,待分析。
1.4.1.2 植株样品
称取5 g预处理好的水稻植株样品于100 mL聚四氟乙烯离心管中,加入40 mL乙腈;其余操作步骤同土壤样品。
1.4.1.3 田水样品
吸取0.2 mL已抽滤去除固体杂质的水样,加入0.6 mL 0.1%甲酸溶液及0.2 mL乙腈,混合均匀,过0.22 μm滤膜,待分析。
1.4.2 仪器检测条件
UPLC条件:流动相A为0.1%的甲酸溶液,流动相B为色谱纯乙腈;流速0.30 mL/min;柱温30 ℃;进样体积10 μL。梯度洗脱程序:初始流动相为A相80%,B相20%,保持0.5 min;在1.5 min内B相线性升至90%,保持1.5 min;之后在0.1 min 内B相线性降至20%,保持1.4 min。在此条件下,XDE-175-L和XDE-175-J的保留时间分别约为2.77和2.73 min。
MS条件:多离子反应监测(MRM)模式扫描;电喷雾正离子源(ESI+);毛细管电压1.5 kV;锥孔电压20 V;离子源温度150 ℃; 锥孔反吹气流量50 L/h;脱溶剂气温度500 ℃;脱溶剂气流量1 000 L/h;碰撞气流量0.2 mL/min。确定XDE-175-J的 定量离子对为 m/z 748.6/142.1,定性离子对为m/z 748.6/203.1;XDE-175-L的定量离子对为m/z 760.6/142.1,定性离子对为m/z 760.6/203.1。m/z 748.6/142.1和m/z 760.6/142.1的碰撞能量均为30 eV;m/z 748.6/203.1和m/z 760.6/203.1的碰撞能量均为28 eV。
1.4.3 标准曲线绘制
分别准确称取10 mg XDE-175-J和XDE-175-L标准品,用色谱纯乙腈溶解并定容至10 mL,配制成1 000 mg/L的标准母液,再用色谱纯乙腈稀释成10 mg/L的中间液,最后用流动相分别稀释配制成0.125、0.5、2.5、5、20和100 μg/L的系列标准工作溶液,按1.4.2节条件进行测定。以进样质量浓度为横坐标,定量离子对峰面积为纵坐标,绘制标准曲线。试验重复3次。
1.4.4 添加回收试验
取制备好的空白对照样品,加入一定量的XDE-175-J和XDE-175-L标准品,按1.4.1节方法进行提取、净化,按1.4.2节条件测定回收率及相对标准偏差。XDE-175-J和XDE-175-L在田水样品中的添加水平为0.001~0.5 mg/L,在土壤中的添加水平为0.002~0.5 mg/kg,在水稻植株中的添加水平为0.005~0.5 mg/kg。每浓度重复5次。
2 结果与讨论 2.1 标准曲线
XDE-175-J和XDE-175-L的标准曲线方程分别为y=26 784x+4 685和y=26 087x+5 107,绝对系数(R2)分别为0.999 8和0.999 9,表明进样质量浓度与相应的峰面积之间线性关系良好。此外,与采用空白基质样品净化液稀释配制的基质匹配标准工作溶液比较,得基质标准曲线与标准工作溶液曲线的斜率比在0.91~1.05之间,表明各样品的基质效应不明显,因此本试验中在进行实际样品检测时均直接采用标准工作溶液曲线进行分析。
2.2 方法的准确度、精密度和灵敏度
添加回收率试验结果(表 1)表明:当XDE-175-L和XDE-175-J在空白田水、土壤和水稻植株样品中的添加水平为0.001~0.5 mg/kg (L)时,其平均回收率在83%~102% 之间,相对标准偏差(RSD) 为1.9%~ 6.2%,均符合农药残留分析方法的技术标准要求[8]。同时可看出,田水添加样品的RSD明显较小,这主要是由于田水样品几乎无前处理步骤,其误差基本上是由进样分析造成的。样品空白图谱及添加图谱见图 1。通过添加回收试验,确定田水样品中方法的定量限(LOQ)为 0.001 mg/L,土壤样品中LOQ为0.002 mg/kg,水稻植株中LOQ为0.005 mg/kg;按S/N =3计算得XDE-175-L和XDE-175-J在各样品中的检测限(LOD)分别为5.0×10-4 mg/kg(土壤)、2.5×10-4 mg/L(田水)和 0.001 mg/kg(植株)。各样品中2种化合物的最小检出量均为5.0 × 10-4 ng。
| 表 1 乙基多杀菌素在 田水、土壤和水稻植株样品中的添加回收率 (%,n=5)Table 1 Recovery of spinetoram in rice straw,soil and paddy water (%,n=5) |
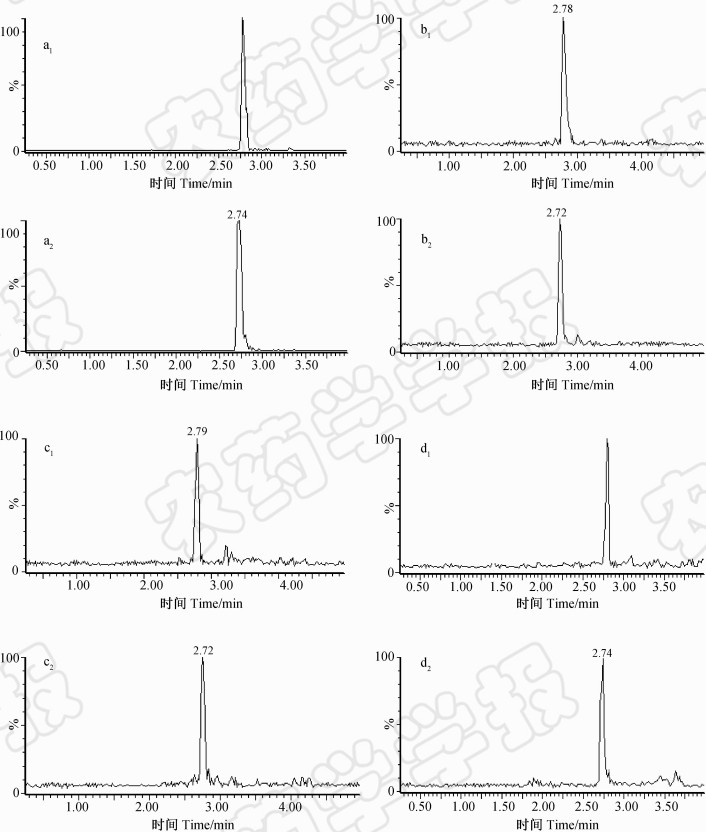 | 图 1 乙基多杀菌素标准溶液(a,0.002 5 mg/L)、田水(b,0.001 mg/L)、土壤(c,0.002 mg/kg)和水稻植株(d,0.005 mg/kg)添加样品的多反应监测色谱图Fig. 1 The MRM chromatograms of spinetoram in standard solution (a,0.002 5 mg/L),fortified paddy water sample (b,0.001 mg/L),fortified soil sample (c,0.002 mg/kg) and fortified rice straw sample (d,0.005 mg/kg)注:a1、b1、c1和d1为XDE-175-L,a2、b2、c2和d2为XDE-175-J。 Note: a1,b1,c1and d1 was XDE-175-L,a2,b2,c2 and d2 was XDE-175-J. |
本研究所建立方法的平均回收率(83%~102%)与相关文献中XDE-175-L和XDE-175-J的回收率范围(77%~101%)[4, 6, 7]相比无明显差异,但明显好于Park等建立的LC-MS/MS方法的回收率(71%~115%)[5];RSD (1.9%~6.2%)与Liu等所建立方法的RSD (1.2%~6.4%)相比亦无明显差异[4],但明显好于其他文献方法的RSD (3.4%~9.1%[6]、5.3%~12%[7]和3.3%~15%[5])。灵敏度测定结果表明,本方法的LOD值明显低于文献方法的LOD值(均为0.01 mg/kg) [4, 5, 6, 7]。表明所建立方法具有较好的精密度和灵敏度。
2.3 乙基多杀菌素在田水、土壤和水稻植株中的消解动态
消解动态过程中乙基多杀菌素的含量用样品中XDE-175-L和XDE-175-J的含量之和来表示。试验结果表明,乙基多杀菌素在田水,土壤和水稻植株中的消解过程均符合一级动力学方程。
结果(图 2)表明:乙基多杀菌素在田水、土壤和水稻植株中的消解半衰期分别为0.35、6.8和1.1 d,消解动力学方程分别为ct =0.013 2e-1.968 5t(田水),ct=0.030 8e-0.101 8t(土壤)和ct = 0.853 0e-0.622 3t(植株),R2分别为0.918 1(田水),0.895 1(土壤) 和0.961 8(植株)。
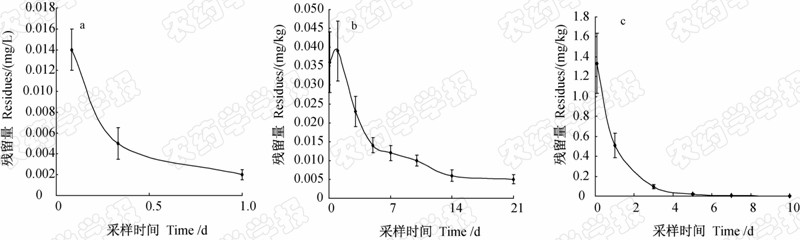 | 图 2 乙基多杀菌素在田水(a)、稻田土壤(b)和水稻植株(c)中的消解动态曲线Fig. 2 Degradation dynamics of spinetoram residues in paddy water (a),soil (b) and rice straw (c) |
从图 2a中可知,乙基多杀菌素在田水中解非常迅速,1 d内消解率即达到85.7%,3 d时在田水中已不能检出。李文明等[9]报道了与乙基多杀菌素同属刺糖菌素类杀虫剂的多杀霉素(spinosad,多杀菌素)在田水中的消解动态,发现多杀霉素在田水中消解也非常迅速,半衰期仅为1.1~1.2 d。本研究结果与之相似。同时从图 2b中可知,乙基多杀菌素在稻田土壤中消解相对较慢,21 d时消解率仅86.1%。与赵瑶瑶等[6]报道的乙基多杀菌素在菜地土壤中的消解动态(半衰期为2.39 d)相比,其在稻田土壤中消解相对较慢,这可能与土壤性质、气候因素以及田水使得乙基多杀菌素在稻田土壤中的光消解变弱均有一定的关系。从图 2c中可知,在水稻植株上,3 d内乙基多杀菌素的消解率已超过90.0%,7 d时已达到99.4%,表明乙基多杀菌素在水稻植株中消解非常迅速。与赵瑶瑶等[6]报道的乙基多杀菌素在甘蓝中的消解动态(半衰期为3.11 d)相比,其在水稻植株中消解更加迅速,这可能与供试水稻植株正处在分蘖期,其生物量增加较快有一定的关系。
根据《化学农药环境安全评价试验准则》[10]规定,土壤中农药的消解半衰期<30 d时,则将该农药归为易消解农药。本研究中乙基多杀菌素在稻田土壤中的半衰期仅为6.8 d,因此其属于易消解型农药。
3 结论
与赵瑶瑶等[6]所报道的方法相比,本研究建立的UPLC-MS/MS分析方法具有简单、快速、灵敏度高、重复性好等特点,可用于水稻植株及稻田生态系统中乙基多杀菌素的残留分析,同时,所建立的仪器分析方法还可为糙米中乙基多杀菌素残留分析方法的建立提供参考。
消解动态试验结果表明,乙基多杀菌素在 田水、稻田土壤和水稻植株中的残留量均随时间的延长而逐渐降低,其消解动态曲线符合一级动力学方程,在水稻植株中的消解半衰期为1.1 d,施药后7 d 的残留量为原始沉积量的0.6%,土壤中的消解半衰期为6.8 d,施药后21 d 的残留量为原始沉积量的13.9%,田水中的消解半衰期为0.35 d,施药后1 d 的残留量为原始沉积量的14.3%,属易消解型农药。
| [1] | 朱秦. 陶氏益农公司获得杀虫剂spinetoram的第一个全球登记[J]. 农药市场信息, 2007, 21: 25. ZHU Qin. Dow Agrosciences receives first global registration for spinetoram insecticide [J]. Pesticide Market News, 2007, 21: 25. (in Chinese) |
| [2] | ORR N, SHAFFNER A J, RICHEY K, et al. Novel mode of action of spinosad: receptor binding studies demonstrating lack of interaction with known insecticidal target sites [J]. Pestic Biochem Physioli, 2009, 95(1): 1-5. |
| [3] | 夏华兴, 陈明亮, 刘维新, 等. 氟啶虫胺腈与乙基多杀菌素混用防治水稻迁飞性害虫田间药效试验[J]. 现代农药, 2013, 12(3): 52-54. XIA Huaxing, CHEN Mingliang, LIU Weixin, et al. Field effect trials on the mixture of sulfoxaflor and spinetoram against rice migratory pests [J]. Modern Agrochemicals, 2013, 12(3): 52-54. (in Chinese) |
| [4] | LIU X, ABD EL-ATY A M, PARK J Y, et al. Determination of spinetoram in leafy vegetable crops using liquid chromatography and confirmation via tandem mass spectrometry [J]. Biomed Chromatogr, 2011, 25(10): 1099-1106. |
| [5] | PARK K H, CHOI J H, EI-ATY A M A, et al. Determination of spinetoram and its metabolites in amaranth and parsley using QuEChERS-based extraction and liquid chromatograpy-tandem mass spectrometry [J]. Food Chem, 2012, 134(4): 2552-2559. |
| [6] | 赵瑶瑶, 秦旭, 秦冬梅, 等. XDE-175及其代谢物在甘蓝和土壤中的残留动态研究[J]. 农业环境科学学报, 2009, 28(5): 1032-1036. ZHAO Yaoyao, QIN Xu, QIN Dongmei, et al. Residue dynamics of XDE-175 and its metabolites in cabbage and soil[J]. J Agro-Environ Sci, 2009, 28(5): 1032-1036. (in Chinese) |
| [7] | MALHAT F M. Simultaneous determination of spinetoram residues in tomato by high performance liquid chromatography combined with QuEChERS method [J]. Bull Environ Contam Toxicol, 2013, 90: 222-226. |
| [8] | NY/T 788—2004,农药残留试验准则[S]. 北京:中国农业出版社,2004. NY/T 788—2004, Pesticides guidelines for residual tests [S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [9] | 李文明, 乔成奎, 陈晓旭, 等. 高效液相色谱-串联质谱法测定水稻中多杀霉素的残留及消解动态[J]. 农药学学报, 2012, 14(3):298-304. LI Wenming, QIAO Chengkui, CHEN Xiaoxu, et al. Study on decline and residue of spinosad in paddy using high performance liquid chromatography-tandem mass spectrometry [J]. Chin J Pestic Sci, 2012, 14(3): 298-304. (in Chinese) |
| [10] | 中国国家环境保护局. 化学农药环境安全评价试验准则[J]. 农药科学与管理, 1990, 11(4):4-9. State Enviromental Protection Administration of China. Experimental criterion of chemical pesticides environment safety evaluation [J]. Pestic Sci Admin, 1990, (2):1-5. (in Chinese) |
 2014, Vol.16
2014, Vol.16 


