2. 北京农业质量标准与 检测技术研究中心, 北京 100097;
3. 沈阳化工研究院有限公司, 新农药创制与开发国家重点实验室, 沈阳 110021;
4. 北京市平谷植保站, 北京 101200;
5. 中国农业大学 植物病理学系, 北京 100193
2. Beijing Research Center for Agricultural Standards and Testing, Beijing 100097, China;
3. Stay Key Laboratory of the Discovery and Development of Novel Pesticide, Shenyang Research Institute of Chemical Industry, Shenyang 110021, China;
4. Plant Protection Station of Pinggu, Beijing 101200, China;
5. Department of Plant Pathology, College of Agronomy and Biotechnology, China Agricultural University, Beijing 100193, China
啶菌噁唑(SYP-Z048)是由原沈阳化工研究院创制的新型杀菌剂,其化学名称为5-(4-氯苯基)-2,3-二甲基-3-(吡啶-3-基)-异噁唑啉[1],结构式见Scheme 1,是一种高效、低毒、广谱的麦角甾醇合成抑制剂(EBIs)[2]。啶菌噁唑在田间对番茄灰霉病、黄瓜灰霉病和番茄叶霉病均具有优异的防治效果[3,4,5],对植物真菌病害防治具有很好的应用前景[6]。但目前尚未见关于啶菌噁唑作用方式、药理学行为及环境毒理学的研究报道。
 | Scheme 1 |
1 材料与方法 1.1 供试材料及主要仪器
84%啶菌噁唑(SYP-Z048)原药(沈阳化工研究院有限责任公司);94.48%啶菌噁唑标准品(国家农药产品质量监督检验中心);95%甲霜灵(metalaxyl)原药(江苏利农有限责任公司);95%福美双(thiram)原粉(上海长江化工厂)。表面活性剂Silwet L77(简称L77,通用电气东芝有机硅有限公司);羰基氰-间-氯苯腙(CCCP)(Sigma公司);葡萄糖、色氨酸(市售);甲醇、丙酮(色谱纯和分析纯);水(重蒸水)。
“保利1号”番茄种子(北京北方大丰种籽销售中心)。
HP1100高效液相色谱仪、UV200紫外可变波长检测仪、P200 高压泵及色谱数据处理工作站(均为Agilent公司产品)。 1.2 试验方法 1.2.1 啶菌噁唑在番茄幼苗中的吸收与传导性测定 1.2.1.1 药剂配制
啶菌噁唑标准品和甲霜灵原药用色谱纯甲醇、福美双原粉用色谱纯丙酮配成10 mg/μL 的母液,并用相应基质溶液稀释成工作浓度,用于确定HPLC检测条件。根据啶菌噁唑商品化制剂菌思奇的田间使用剂量(啶菌噁唑质量分数为25%,推荐使用剂量为250~ 320 mg/L),确定本研究中番茄植株处理时的药剂浓度。先将啶菌噁唑和甲霜灵原药用分析纯甲醇、福美双用分析纯丙酮配成10 mg/μL的母液, 试验时再用纯水稀释,用于根部或叶部处理;处理番茄植株叶片时,药液中再加入0.01%的表面活性剂 L77,以利于药液在叶片表面的分散。 1.2.1.2 根部的吸收及向顶传导性
参考朱书生等[8]报道的方法并略加改进。番茄种子播种于中国农业大学科学园温室内,常规管理。于3~4叶期时整株取样,室内用自来水清洗根部。将番茄幼苗根部分别浸泡在50、100及200 mg/L的啶菌噁唑药液中,分别以100 mg/L内吸性杀菌剂甲霜灵和100 mg/L 非内吸性杀菌剂福美双药液处理作为吸收传导活性测定的阳性和阴性对照。将处理后植株置于人工气候培养箱中,于(24±2) ℃、相对湿度70%~80%、照度10 000 lx、12 h/12 h光暗交替条件下培养。分别在培养2、4、8、16、32和48 h后取样,每处理取样5株,3次重复。
依次用自来水、甲醇(福美双处理组用丙酮,以下同)和去离子水清洗植株,用吸水纸吸干。将植株根、茎和叶分开,分别称取鲜重。样品用液氮研磨后置于 50 mL 离心管中,加入20 mL甲醇(或丙酮)超声处理20 min,于4 000 r/min下离心 20 min; 将上清液转入100 mL平底烧瓶,浓缩蒸干,用甲醇(或丙酮)定容至10 mL;取 1 mL 样品溶液,经 0.45 μm 微孔过滤器过滤后移入Eppendorf管中,于 4 ℃ 冰箱中保存,待测。若浓度超出线性范围,则稀释后再进样检测。 1.2.1.3 叶部的吸收及向基传导性
待温室培养的番茄幼苗长至4叶期时,分别于倒二叶滴加60 μL 含0.01% L77的500、1 000及2 000 mg/L的啶菌噁唑药液,并摘除少许叶尖以作标记。每处理3次重复,每重复10株幼苗。分别于处理后48、72、96及124 h取样,将样品分为施药叶、施药上部叶、施药下部叶、茎和根5组。样品浓缩后用液氮吹干,然后用1 mL 甲醇(或丙酮)溶解。其他同1.2.1.2节。 1.2.2 不同因子对番茄植株吸收和传导啶菌噁唑的影响
试验共设5个处理,分为14组,每组3次重复,每重复5株番茄幼苗,啶菌噁唑药液浓度均为50 mg/L。处理①(低温的影响,1组):将番茄植株根部浸泡在啶菌噁唑药液中,于4 ℃冰箱中培养;处理②(能量抑制剂的影响,2组):将番茄植株根部分别浸泡在含有1.0×10-3和1.0×10-4 mmol/L CCCP的啶菌噁唑药液中;处理③(pH的影响,5组):将番茄植株根部分别浸泡在pH值为2.3、4.8、6.3、8.3和9.5的啶菌噁唑药液中;处理④(葡萄糖和色氨酸的影响,5组):将番茄植株根部分别浸泡在含有0、1.0和2.0 mmol/mL葡萄糖和L-色氨酸的啶菌噁唑药液中;处理⑤(对照,1组):将番茄植株根部浸泡在啶菌噁唑药液中,于室温下培养。除处理①外,其余处理均置于(24±2) ℃、相对湿度70%~80%、照度10 000 lx、12 h/12 h 光暗交替条件人工气候培养箱中培养。均于24 h后取样,洗净植株,将植株分为根部和地上部分。样品提取及净化处理同1.2.1.2节。 1.2.3 高效液相色谱检测条件及添加回收率试验
1.2.3.1 HPLC条件
啶菌噁唑测定选用VP-ODS C18 不锈钢色谱柱(250 mm×4.6 mm,5 μm);甲霜灵和福美双测定选用HYPERSILBDS C18 不锈钢色谱柱(250 mm×4.6 mm,5 μm)。流动相为甲醇-水,流速1.0 mL/min。外标法定量。 1.2.3.2 基质效应测定
采用按1.2.1.2节方法提取得到的不同组织样品溶液,分别配制啶菌噁唑(0.5~200 mg/L)和甲霜灵(1~200 mg/L)的基质匹配标准工作溶液,经变换流动相比例,确定合适的分离条件,在该条件下确定标准曲线和线性范围。分别测定1.2.1和1.2.2节各处理样品中啶菌噁唑和对照药剂甲霜灵、福美双的含量,以消除基质效应对分析结果的影响。 1.2.3.3 添加回收率试验
分别在磨碎的番茄根(1 g)、茎(10 g)、叶(5 g)样品中添加啶菌噁唑标准溶液,根据药剂处理浓度以及植株不同部位可能的累积吸收量确定添加水平。其中,根中的添加水平分别为10和400 μg/g,茎中分别为50和150 μg/g,叶中分别为40和100 μg/g,每浓度重复3次。样品处理及药剂提取、净化方法同1.2.1.2节。 2 结果与分析 2.1 高效液相色谱分析方法的确定 2.1.1 分离条件与线性关系
经变换流动相比例,选择适宜的色谱分离条件。最终确定,啶菌噁唑的分离条件:流动相为V(甲醇)∶V(水)=75∶25,检测波长λ=220 nm;甲霜灵的分离条件:流动相为V(甲醇)∶V(水)=60∶40,检测波长λ=230 nm;福美双的分离条件:流动相为V(甲醇)∶V(水)=60∶40,检测波长λ=254 nm;流速均为1.0 mL/min。在上述色谱条件下,各供试药剂可与番茄组织内其他成分得到很好的分离。根据啶菌噁唑的光学异构体目标峰a和b的出峰时间分别为8和9 min,则11 min之内即可完成1个样品的测定(图 1)。HPLC测定结果表明,在0.5~200 mg/L 质量浓度范围内,啶菌噁唑吸收峰面积与质量浓度之间具有很好的线性关系,其标准曲线方程为y=27.362x+37.662,相关系数r为0.999 7,最低检出浓度为0.2 μg/g;在1~200 mg/L质量浓度范围内,内吸性杀菌剂甲霜灵的吸收峰面积与进样浓度之间也呈良好的线性关系,其标准曲线方程为y=3.834 8x+2.087 2,相关系数r为 0.999 9,最低检出浓度为0.1 μg/g;而非内吸性杀菌剂福美双的最低检出浓度为0.1 μg/g,由于其根部施药后在番茄植株中不能检测到,因此未测定其线性范围和标准曲线。
 | 图 1 啶菌噁唑处理番茄幼苗48 h后样品及空白样品色谱图Fig.1 The chromatogram of extracts from tomato seedling after SYP-Z048 application for 48 h
and from non-fungicide treatment注:a和b 分别为啶菌噁唑的异构体;A、B、C分别为啶菌噁唑(200 mg/L)处理48 h后的番茄叶、茎及根部样品提取液;
A1、B1、C1分别为空白处理番茄叶、茎及根部样品提取液。 Note: a and b was the isomers of SYP-Z048, respectively; A, B, and C was extracts from leave, stem and root after SYP-Z048 (200 mg/L) application for 48 h, respectively; A1, B1 and C1 was the extracts from blank of leave, stem and root, respectively. |
表 1结果显示,添加不同水平的啶菌噁唑后,其在番茄植株不同部位样品中的回收率均大于75%,相对标准偏差(RSD)<10%,表明番茄植株组织对啶菌噁唑检测的影响很小,且提取方法简便可行。
| 表 1 啶菌噁唑在番茄植株不同部位样品中的添加回收率 Table 1 Recovery of SYP-Z048 in different tissue of tomato plant |
结果如图 2所示,根部施药后,啶菌噁唑和阳性对照药剂甲霜灵向顶部传导的速度均很快。50、100和200 mg/L 啶菌噁唑处理番茄根部2h后,即可分别在根部和茎部检测到目标药剂,其中根部啶菌噁唑的含量分别为:(78.82±18.86)、(207.99±45.59)和(283.71±84.90) μg/(g FW)(每g植物组织中药剂的含量),茎部中啶菌噁唑含量分别为:0、(6.86±0.91)和(10.26±3.86) μg/(g FW);100和200 mg/L啶菌噁唑处理根部16 h后,在叶部可以检测到少量的目标药剂。
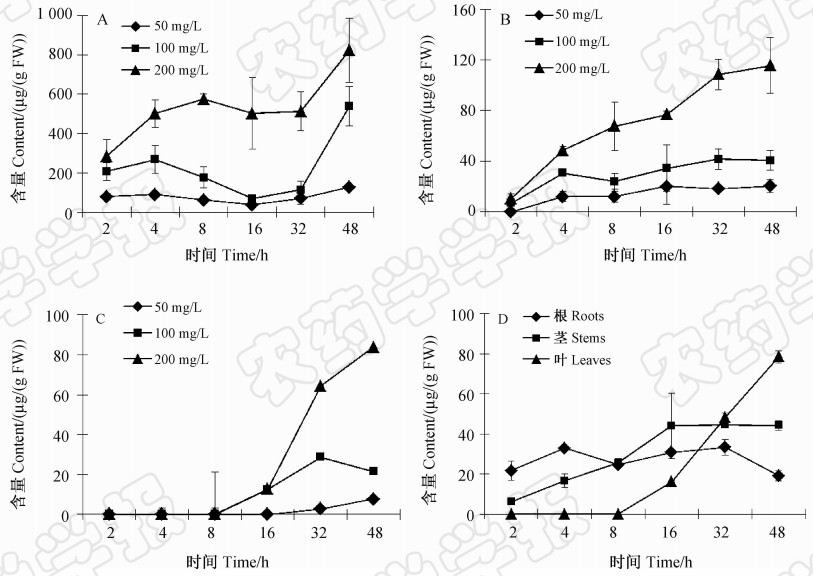 | 图2 啶菌噁唑和甲霜灵根部处理后在番茄幼苗中的分布动态Fig.2 Distribution of SYP-Z048 and metalaxyl in tomato seedling after fungicide application in roots注:A、B和C分别表示啶菌噁唑在根、茎和叶部的分布;D表示甲霜灵在植株不同部位的分布。 Note: A, B and C was the distribution of SYP-Z048 in roots,stems and leaves, respectively; D was the distribution of metalaxyl in different plant tissue. |
50、100和200 mg/L啶菌噁唑处理根部48 h后,药剂在整个植株内均有分布,且根部中药剂的含量>茎部>叶部。啶菌噁唑在植株体内的传导速度与甲霜灵相当,但其在根部和茎部的积累量明显高于甲霜灵,在叶部的积累量与甲霜灵无明显差别。 2.2.2 啶菌噁唑在番茄植株中的分布特征
结果见图2。根部中啶菌噁唑含量在2~4 h内呈上升趋势,8~32 h内处于平衡状态,并有不同程度的下降波动趋势。推测这是因为在该时间段内,通过根部吸收的药剂迅速向茎部和叶部输导所致。处理48 h后,药剂在根部的累积达到最大量。2~48 h内,茎部啶菌噁唑的含量总体上处于上升趋势,且药剂在茎部的积累量明显高于叶部。施药16 h后在叶部可检测到啶菌噁唑的分布,16~48 h内叶部中啶菌噁唑的积累量上升较快。研究表明,啶菌噁唑在番茄植株中的分布与积累趋势及特点与阳性对照药剂甲霜灵相似。
2.3 叶部施药后啶菌噁唑在番茄植株中的向基性传导及在叶片间的转运
表 2结果表明,2 000 mg/L的啶菌噁唑施于中部叶片48 h后,即可在根部检测到药剂,其含量为(1.16±0.05) μg/(g FW);500、1 000、2 000 mg/L啶菌噁唑于叶片施药72 h后,在根部均可检测到药剂。施药72~124 h内,在茎部均未检测到药剂,可能是由于茎部作为运输通道,其药剂的积累量较低。总体而言,啶菌噁唑可从中部施药叶片向上、向下传导至整个植株,其中根部的药剂积累量随着培养时间的延长表现为逐渐升高的趋势,表明啶菌噁唑具有向基传导能力,并可在叶间传导运输。试验还显示,于中部叶片施药后,除根部以外,啶菌噁唑在植株其他部位的分布并未随时间的延长而呈现规律性的上升或下降趋势,推测可能是由于药剂在检测部位被向下或向上转运的同时也从其他部位吸收、积累,从而导致检测结果与药剂的转运量、吸收量与降解能力三者之间的动态变化相关。
结果(表 3)表明,从积累量看,4 ℃低温条件下番茄幼苗对啶菌噁唑的吸收和传导能力稍低于24 ℃常温条件下,但差异不显著。
结果(表 4)表明,用含有1.0×10-3和1.0×10-4 mmol/L CCCP的50 mg/L啶菌噁唑药液处理植株根部后24 h内,番茄幼苗根部和地上部分中啶菌噁唑的积累量与对照相比无显著差异,表明CCCP对番茄幼苗吸收和传导啶菌噁唑没有明显的抑制作用。
表5结果表明,pH为 2.3~9.5 系列梯度范围时,番茄植株根部和地上部分对5种不同pH值药液的吸收及积累量均无显著差异。
表6结果显示,不同浓度的葡萄糖和色氨酸对番茄幼苗根部和地上部分吸收啶菌噁唑均没有显著的抑制作用。
3 结论与讨论
高效液相色谱(HPLC)方法在杀菌剂检测研究中应用极为广泛。张龙等[9]和曲田丽等[10]采用HPLC法分别研究了杀菌剂拟邻烯丙基苯酚在小麦中的向基和向顶传导特性;朱书生等[8]利用HPLC法研究了氟吗啉的传导性。本研究采用HPLC法,通过于番茄幼苗根部和特定叶位施药,分别研究了啶菌噁唑的向顶和向基传导能力。结果表明:啶菌噁唑属内吸性杀菌剂,于番茄幼苗根部施药后,可被根部快速吸收并向地上部分传导,具有很强的向上传导能力,16 h后即可到达植株叶部;同时其还具有一定的向基传导能力,于中部叶片施用 500 μg/mL 的啶菌噁唑,72 h后在根部可检测到该药剂;这与内吸性杀菌剂甲霜灵[11]的特性相似。番茄幼苗根部对啶菌噁唑的吸收不受低温、羰基氰-间-氯苯腙(CCCP)、pH值、葡萄糖和色氨酸等因素的影响。
植物对药剂的吸收机制涉及诸多因素,是一个比较复杂的过程。植物的根在从外部吸收溶质时,首先有一个快速吸收的阶段,称为第一阶段,之后吸收速度变慢并趋于平稳,称为第二阶段。其中第一阶段是由于扩散作用因而不需要能量代谢的被动吸收过程,第二阶段则是需要通过呼吸作用释放能量的主动吸收过程[12]。通常无论是在低温条件下,或是呼吸作用被抑制剂抑制的情况下,第一阶段的被动吸收均基本不受影响,而第二阶段的主动吸收过程则会被抑制[12]。本研究表明,番茄植株对啶菌噁唑的吸收不受低温影响,因此推测番茄根部对啶菌噁唑的吸收是以第一阶段为主的被动吸收过程。
CCCP是一种解偶联剂,其是否影响了植株对某种化合物的吸收,是判断该吸收过程需要能量与否的标志[13-15]。Hetherington等[15]的研究表明,玉米和大豆悬浮细胞对外界低浓度除草剂草甘膦的吸收属于主动吸收,该吸收过程受CCCP所抑制。本研究结果表明,番茄植株对啶菌噁唑的吸收不受CCCP的影响,由此判断其吸收过程为不需要消耗能量的被动吸收。这与低温试验的结果一致。
植物根部对溶质的主动吸收需要质膜ATPase利用ATP水解产生的能量,把细胞质内的H+向膜外“泵”出,从而形成H+电化学势差,以此作为驱动力而进行离子转运[12]。Michelet等[16]研究发现,植物质膜ATPase活性存在一个最适pH值。本研究结果表明,番茄植株不论根部还是地上部分对啶菌噁唑的吸收均不受pH值的影响,从而进一步验证了其吸收过程为被动吸收。
植物根部对溶质的主动吸收过程除依赖H+电化学势差外,还需通过传递体(transporter)才能完成,它们是具有转运功能的蛋白质[12]。而糖、氨基酸等进入植物体活细胞也需要借助于质膜上的这些蛋白载体。因此当植株对药剂为主动吸收时,添加糖和氨基酸等物质可以竞争这些传递体,从而影响植株对药剂的吸收。本研究结果表明,糖和色氨酸对番茄植株吸收啶菌噁唑均不存在竞争效应,进而证明了番茄根部对啶菌噁唑的吸收不需要依赖传递体,即该吸收过程是被动的物理过程。
已有研究表明,桃褐腐病菌 Monilinia fructicola对啶菌噁唑的抗性风险为低到中等,且推测其属于典型的14α
-脱甲基酶抑制剂[17],即DMI类药剂。DMI类杀菌剂是20世纪70~80年代开发的,具有广谱、活性高、内吸性强及品种多等特点,包括三唑类、咪唑类、嘧啶类、哌嗪类和吡啶类等。其作用机理是通过杂环上的氮原子与羊毛甾醇14α-脱甲基酶的血红素-铁活性中心结合,从而抑制酶的活性,阻碍麦角甾醇的合成,最终起到杀菌的作用[18]。该类药剂是农用杀菌剂中品种最多的一类,在多种病害防治中起着不可替代的作用,可用于产前及产后病害的防治[19-21]。迄今为止,虽然啶菌噁唑仅在灰霉病害防治上获准登记使用,但其作为DMI类杀菌剂中的一员,具有抑菌谱广、高效、低毒的特性,因此预计啶菌噁唑同样也具有很好的开发应用潜力。
综上所述,啶菌噁唑是一种内吸性杀菌剂,具有很强的向上传导及一定的向基传导能力,且番茄幼苗根部对药剂的吸收及地上部分对药剂的积累量均不受低温、羰基氰-间-氯苯腙(CCCP)、pH值、葡萄糖和色氨酸等因素的影响,说明该药剂的内吸传导是一种被动吸收的过程。所得研究结果可为新型杀菌剂啶菌噁唑通过种子处理或根部施药预防种苗病害和土传病害,或利用其向顶部快速传导的特性防治植物新生叶片及植株顶部的病害提供依据,有助于指导其田间科学合理用药。
![]()
表 2 啶菌噁唑处理中部叶片后其在番茄幼苗中的吸收和分布
Table 2 Uptake and distribution of SYP-Z048 in tomato seedling when the fungicide was applied onto a middle leaf
![]()
表 3 低温对番茄幼苗吸收和传导啶菌噁唑的影响
Table 3 Effect of low temperature on the uptake and transportation of SYP-Z048 in tomato seedlings
![]()
表 4 羰基氰-间-氯苯腙对番茄幼苗吸收和传导啶菌噁唑的影响
Table 4 Effect of CCCP on the uptake and
transportation of SYP-Z048 in tomato seedlings ![]()
表5 不同pH值对番茄幼苗吸收和传导啶菌噁唑的影响
Table 5 Effect of pH values on the uptake and transportation of SYP-Z048 in tomato seedlings ![]()
表6 葡萄糖和色氨酸对番茄幼苗吸收和传导啶菌噁唑的影响
Table 6 Effect of tryptophan and glucose on the
uptake and transportation of SYP-Z048 in tomato seedlings
| [1] | 张立新,史蒂芬H.塞伯,爱德华M.斯采佩斯,等. 用作杀菌剂的杂环取代的异噁唑啉类化合物:CN 1280767A[P]. 2001-01-24. ZHANG Lixin, SEIBER S H, STSEIPAIS E M, et al. Heterocycle substituted isoxazole quinolines compounds as fungicide: CN 1280767A[P]. 2001-01-24. (in Chinese) |
| [2] | 韩平, 刘西莉, 刘鹏飞, 等. 高效液相色谱法研究啶菌噁唑对番茄灰霉病菌麦角甾醇生物合成的影响[J]. 分析化学, 2006, 34(10): 1467-1470. HAN Ping, LIU Xili, LIU Pengfei, et al. Effect of novel fungicide 5-(4-chloro phenyl)-2,3-dimethyl-3-(pyridine-3)-oxazoline on ergosterol biosynthesis in Botrytis cinerea by high performance liquid chromatography[J].s1 Chin J Analy Chem, 2006, 34(10): 1467-1470. (in Chinese) |
| [3] | 司乃国, 张宗俭, 刘君丽, 等. 创制杀菌剂啶菌恶唑生物活性及应用研究(Ⅰ):番茄灰霉病[J]. 农药, 2004, 43(1): 16-18. SI Naiguo, ZHANG Zongjian, LIU Junli, et al. Biological activity and application of a novel fungicide: SYP-Z048[J]. Chin J Pestic, 2004, 43(1): 16-18. (in Chinese) |
| [4] | 司乃国, 张宗俭, 刘君丽, 等. 创制杀菌剂啶菌恶唑的生物活性及应用研究(Ⅱ):黄瓜灰霉病[J]. 农药, 2004, 43(2): 61-63. SI Naiguo, ZHANG Zongjian, LIU Junli, et al. Biological activity and application of a novel fungicide, SYP-Z048(Ⅱ)[J]. Chin J Pestic, 2004, 43(2): 61-63. (in Chinese) |
| [5] | 刘君丽, 司乃国, 陈亮, 等. 创制杀菌剂啶菌恶唑的生物活性及应用研究(Ⅲ):番茄叶霉病[J]. 农药, 2004, 43(3): 103-105. LIU Junli, SI Naiguo, CHEN Liang, et al. Biological activity against tomato leaf mold and application of a novel fungicide, SYP-Z048(Ⅲ)[J]. Chin J Pestic, 2004, 43(3): 103-105. (in Chinese) |
| [6] | ALEXANDRINE L D F, DANIELE D, JOCELYNE B, et al. Mechanisms of resistance to fenpropimorph and terbinafine, two sterol biosynthesis inhibitors, in Nectria haematococca, a phytopathogenic fungus[J]. Pestic Biochem Physiol, 1999, 64(3): 167-184. |
| [7] | 唐除痴, 李煜旭, 陈 彬, 等. 农药化学[M]. 天津: 南开大学出版社, 1998: 295-297. TANG Chuchi, LI Yuxu, CHEN Bin, et al. Pesticide Chemistry[M]. Tianjin: Nankai University Press, 1998: 295-297. (in Chinese) |
| [8] | 朱书生, 刘西莉, 李健强, 等. 新型杀菌剂氟吗啉在黄瓜植株体内的吸收传导行为[J]. 高等学校化学学报, 2006, 27(10): 1887-1890. ZHU Shusheng, LIU Xili, LI Jianqiang, et al. Uptake and translocation behavior of new fungicide flumorph in cucumber plant[J]. Chem J Chin Univ, 2006, 27(10): 1887-1890. (in Chinese) |
| [9] | 张龙, 刘西莉, 李健强, 等. 拟银杏杀菌剂邻烯丙基苯酚的内吸传导作用[J]. 高等学校化学学报, 2004, 25(4): 654-658. ZHANG Long, LIU Xili, LI Jianqiang, et al. Intake transportation function of ginkgo-imitated fungicide of 2-allyl phenol[J]. Chem J Chin Univ, 2004, 25(4): 654-658. (in Chinese) |
| [10] | 曲田丽, 孟昭礼, 李健强. 高效液相色谱法研究邻烯丙基苯酚在小麦植株中的向基传导和分布[J]. 分析化学, 2006, 34(7): 1023-1026. QU Tianli, MENG Zhaoli, LI Jianqiang. Study on transportation and distribution of fungicide 2-allyl phenol from the leave to root in wheat seedling by high performance liquid chromatography-photodiode array detection[J]. Chin J Anal Chem, 2006, 34(7): 1023-1026. (in Chinese) |
| [11] | WILSON P C, WHITWELL T, KLAINE S J. Metalaxyl toxicity, uptake, and distribution in several ornamental plant species[J]. J Environ Qual, 2001, 30(2): 411-417. |
| [12] | 王 忠. 植物生理学[M]. 北京: 中国农业出版社, 2000: 92-99. WANG Zhong. Plant Physioloy[M]. Beijing: China Agriculture Press, 2000: 92-99. (in Chinese) |
| [13] | 邱全胜, 苏雪峰. 大豆下胚轴质膜H+-ATPase质子转运的测定[J]. 生物化学与生物物理进展, 1999, 26(1): 79-83. QIU Quansheng, SU Xuefeng. The determination of proton transport by the plasma membrane ATPase from soybean hypocotyls[J].. Prog Biochem Biophys, 1999, 26(1): 79-83 (in Chinese) |
| [14] | HONDA M, ITO K, HARA T. Effect of physiological activities on aluminum uptake in carrot (Daucus carota L.) cells in suspension culture[J]. Soil Sci Plant Nutr, 1997, 43(2): 361-368. |
| [15] | HETHERINGTON P R, MARSHALL G, KIRKWOOD R C, et al. Absorption and efflux of glyphosate by cell suspensions[J]. J Exp Bot, 1998, 49(320): 527-533. |
| [16] | MICHELET B, BOUTRY M. The plasma membrane H+-ATPase: a highly regulated enzyme with multiple physiological functions[J]. Plant Physiol, 1995, 108(1): 1-6. |
| [17] | CHEN F P, FAN J R, ZHOU T, et al. Baseline sensitivity of Monilinia fructicola from China to the DMI fungicide SYP-Z048 and analysis of DMI-resistant mutants[J]. Plant Dis, 2012, 96(3): 416-422. |
| [18] | SIEGEL M R. Sterol inhibiting fungicides effects on sterol biosynthesis and sites of action[J]. Plant Dis, 1981, 65(12): 986-989. |
| [19] | KARAOGLANIDISA G S, KARADIMOS D A. Efficacy of strobilurins and mixtures with DMI fungicides in controlling powdery mildew in field-grown sugar beet[J]. Crop Protection, 2006, 25(9): 977-983. |
| [20] | KEMMITT G M, DEBOER G, OUIMETTE D, et al. Systemic properties of myclobutanil in soybean plants, affecting control of Asian soybean rust (Phakopsora pachyrhizi) [J]. Pest Management Sci, 2008, 64(12): 1285-1293. |
| [21] | MCKAY A H, FÖRSTER H, ADASKAVEG J E. Efficacy and application strategies for propiconazole as a new postharvest fungicide for managing sour rot and green mold of citrus fruit[J]. Plant Dis, 2012, 96: 235-242. |
 2014, Vol. 16
2014, Vol. 16


